Method Article
無細胞再構成のための組換えセプチン複合体の精製と品質管理
要約
細胞骨格タンパク質のin vitro再構成は、これらのタンパク質の基本的な機能特性を理解するための重要なツールです。本論文は、細胞分裂と遊走において中心的な役割を果たす組換えセプチン複合体の品質を精製および評価するためのプロトコルを記載する。
要約
セプチンは、ヘテロオリゴマー複合体から細胞骨格フィラメントおよび高次構造を形成することができる保存された真核生物GTP結合タンパク質のファミリーです。それらは他の細胞骨格成分および細胞膜と相互作用して、遊走および細胞分裂などの重要な細胞機能に関与する。セプチンの多くの相互作用の複雑さ、多数のセプチン遺伝子(ヒトでは13個)、およびセプチンが異なるサブユニット組成を持つヘテロオリゴマー複合体を形成する能力のために、無細胞再構成はセプチン生物学の基礎を理解するための重要な戦略です。本論文では、まず、2段階アフィニティークロマトグラフィーアプローチを使用して、ヘテロオリゴマー形態の組換えセプチンを精製する方法について説明します。次に、セプチン複合体の純度と完全性をチェックするために使用される品質管理のプロセスが詳細に説明されています。このプロセスは、ネイティブおよび変性ゲル電気泳動、負染色電子顕微鏡、および干渉散乱顕微鏡を組み合わせたものです。最後に、ネガ染色電子顕微鏡および蛍光顕微鏡を用いてセプチン錯体の重合能を確認するプロセスについて説明する。これは、ショ ウジョウバエ セプチン六量体と同様に、高品質のヒトセプチン六量体および異なるseptin_9アイソフォームを含む八量体を製造することが可能であることを示している。
概要
細胞骨格は、古典的にはアクチンフィラメント、微小管、中間フィラメント1からなる3成分系と記載されてきたが、最近では細胞骨格1の第4成分としてセプチンが認められている。セプチンは、真核生物に保存されているGTP結合タンパク質のファミリーです2。セプチンは、細胞分裂3、細胞間接着4、細胞運動性5、形態形成6、細胞感染7、細胞極性の確立と維持8など、多くの細胞機能に関与しています。それらの重要な機能にもかかわらず、セプチンがそのようなプロセスにどのように関与しているかはよく理解されていません。
セプチンファミリーのタンパク質は、タンパク質配列の類似性に基づいていくつかのサブグループ(分類に応じて4つまたは7つ)に細分されます2。異なるサブファミリーのメンバーは、フィラメントの構成要素であり、次にバンドル、リング、メッシュワークなどの高次構造に集合する回文ヘテロオリゴマー複合体を形成することができます1,9,10,11,12。さらなる分子の複雑さは、異なるスプライス変異体の存在から生じ、その一例はヒトSEPT9であり、そこでは異なるスプライス変異体の特定の機能の証拠がある13、14、15。さらに、ヘテロオリゴマーの長さは、種および細胞型に依存する。例えば、カエノラブディティス・エレガンス・セプチンは四量体16を形成し、ショウジョウバエ・メラノガスター・セプチンは六量体17を形成し(図1A)、サッカロミセス・セレビシエ・セプチンは八量体18を形成し、ヒトセプチンは六量体と八量体19の両方を形成します(図1A)。同じサブファミリー由来のセプチンアイソフォーム、スプライスバリアント、および翻訳後修飾セプチンが複合体内で互いに置換する能力、および異なるサイズのヘテロオリゴマーの(共)存在により、異なるヘテロオリゴマー複合体の細胞機能を描写することが困難になっています12。
セプチンのもう一つの興味深い能力は、細胞内の多くの結合パートナーと相互作用する能力です。セプチンは、間期および細胞分裂中に原形質膜および膜細胞小器官に結合する20,21,22。細胞分裂において、セプチンは細胞質分裂中にアニリン23,24,25ならびにアクチンおよびミオシンと協力する26,27。細胞質分裂の後期段階では、セプチンは中体離脱のための輸送(ESCRT)システムに必要なエンドソーム選別複合体を調節するようである28。さらに、間期細胞のアクチン皮質およびアクチンストレス線維に位置するセプチンの証拠もあります29、30、31。特定の細胞型では、セプチンは微小管細胞骨格にも結合して調節する32,33。
これらすべての特徴により、セプチンは研究するのに非常に興味深いタンパク質システムになりますが、挑戦的なタンパク質システムでもあります。多数のセプチンサブユニット(スプライスバリアント2を数えずにヒトでは13遺伝子)と、同じサブファミリーのセプチンサブユニットが互いに置換し、異なるサイズのヘテロオリゴマーを形成する可能性の組み合わせにより、遺伝子操作によって特定のセプチンの細胞機能について結論を出すことは困難です。さらに、セプチンの複数の相互作用により、細胞骨格または膜成分に向けられた薬物34 などの一般的な研究ツールの効果を解釈することは困難な作業になります。
この状況を克服する方法は、セプチンのin vitro(無細胞)再構成で細胞内の研究を補完することです。インビトロ再構成は、特定のサブユニット組成および長さ18、35、36、37を有する単一タイプのセプチンヘテロオリゴマーの単離を可能にする。この複合体は、セプチン38,39,40の基本的な構造的および物理化学的特性を発見するために単独で、またはモデル生体膜11,41,42、アクチンフィラメント10,27、または微小管32,36などの所望のパートナーと組み合わせて、それらの性質を解読するために、制御された環境で研究することができる。相互 作用。
したがって、さまざまなセプチン複合体を効率的に精製するための信頼性の高い方法は、セプチン研究にとって不可欠です。ただし、同じプロトコルを使用しても、精製が異なれば、活性/機能、さらには完全性が異なるタンパク質が得られる可能性があります。酵素などの市販のタンパク質については、機能性および酵素活性が注意深く検証される43。セプチンなどの細胞骨格タンパク質や構造タンパク質の慎重な品質管理を実施することは困難な場合がありますが、ラボ間での実験を比較可能にすることが不可欠です。
この論文では、大腸菌細胞におけるモノまたはバイシストロン構築物を含む2つのベクター(表1)の同時発現に基づいて、ヘテロオリゴマー形態の高品質の組換えセプチンを精製する堅牢な方法について説明します。この方法は、his6タグセプチンとStrep-IIタグセプチンの両方を含むセプチンヘテロオリゴマーを捕捉するための2段階アフィニティークロマトグラフィーアプローチで構成されています(図1B、C)。Ivら10で最初に記載されたこのプロトコルは、ショウジョウバエセプチン六量体11、27、35、ヒトセプチン六量体10、および異なる天然(アイソフォーム1、3、および5)10,32または変異したSEPT9アイソフォーム32を含むいくつかのヒトセプチン八量体を精製するために使用されています。.さらに、精製されたセプチンの品質を評価するための一連の技術の説明が与えられる。まず、セプチンサブユニットの完全性と正しい化学量論を変性電気泳動と透過型電子顕微鏡(TEM)を使用してチェックします。次に、正しい分子量のヘテロオリゴマーの存在、および複雑な不安定性を示すモノマーまたはより小さなオリゴマーの存在を、ネイティブ電気泳動および干渉散乱顕微鏡(iSCAT)を介した質量測光によって調べます。最後に、最後のステップは、蛍光顕微鏡とTEMを使用したセプチンの重合活性の評価で構成されます。
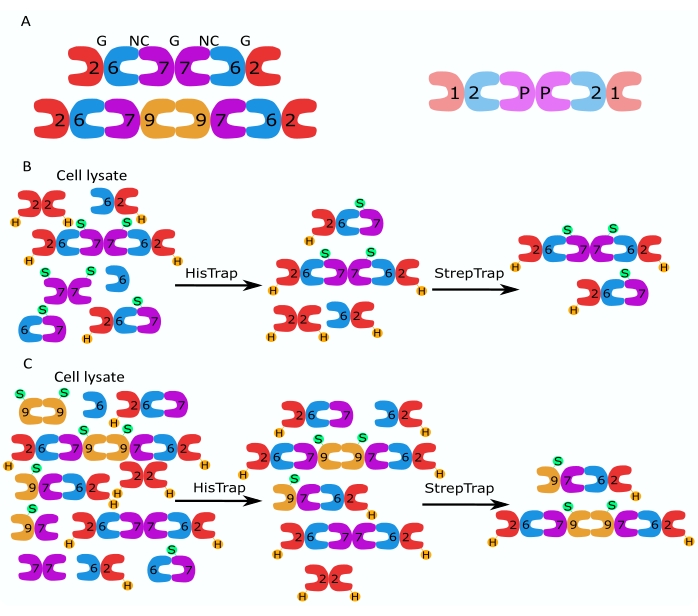
図1:精製戦略 。 (A)ヒト(左)と ショウジョウバエ (右)の細胞に存在するセプチンヘテロオリゴマーの模式図。数字は示されたグループのセプチンサブユニットを示し、Pはピーナッツを示します。ヒトSEPT9は、そのアイソフォームのいずれかであり得る。セプチンサブユニットは非対称形状を有し、ヒト六量体の上にそれぞれNCおよびGで示されるように、2つの異なる界面、NC:NCおよびG:G界面に縦方向に関連付けられる。(B,C)二段階クロマトグラフィー戦略の概略図を、(B)ヒトセプチン六量体および(C)八量体について示す。Hはヒスタグを示し、SはストレプIIタグを示します。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1. セプチンヘテロオリゴマーの精製
- 細菌細胞と発現ベクターとの共形質転換
- 発現に使用する1つのpnEAと1つのpnCSプラスミド44の組み合わせを選択します。セプチンヘテロオリゴマー10、35の所望のサブユニット組成、および蛍光タグ付けが必要かどうかに応じて組み合わせを選択する。
注:ここでは、C末端タグ付きモノマースーパーフォルダーGFP(msfGFP)タグ付きSEPT2(ヒトセプチンの場合)またはmsfGFPまたはモノマー増強GFP(mEGFP)-DSep2( ショウジョウバエ セプチンの場合)が使用されます(表1)。 - 各プラスミド 1 μL (~1 ng/μL) を 100 μL の有能な BL21 大腸菌 細胞にピペットで移し、氷上で 20 分間インキュベートします。
- 細胞を42°Cの水浴に40秒間置き、すぐに氷上で3分間インキュベートします。
- 細胞懸濁液に0.9 mLのリソゲンブロス(LB)培地を加え、細胞を37°Cで1時間増殖させます。 100 μg/mLのアンピシリンと100 μg/mLのスペクチノマイシンを含む温かいLB寒天プレートに100 μLの細胞をプレート化し、37°Cで一晩インキュベートします。
- 発現に使用する1つのpnEAと1つのpnCSプラスミド44の組み合わせを選択します。セプチンヘテロオリゴマー10、35の所望のサブユニット組成、および蛍光タグ付けが必要かどうかに応じて組み合わせを選択する。
- 細菌の前培養を成長させる
- 250 mLの三角フラスコに、100 μg/mLのアンピシリンと100 μg/mLのスペクチノマイシンを含む100 mLのテリフィックブロス(TB)またはLB培地を充填します。
- 滅菌接種ループを有するLB-寒天プレートから単一のコロニーを取り出し、ステップ1.2.1から新鮮な培地に移します。
- ロータリーシェーカーインキュベーターで37°Cで一晩または少なくとも6時間インキュベートします。
注:この培養から、細菌懸濁液をグリセロールと1:1で混合し、-80°Cで保存することにより、グリセロールストックを調製できます。 このストックは、ステップ1.2.2で使用できます。新しく変換されたコロニーの代わりに。
- 細菌培養とタンパク質発現誘導
- 100 mLの増殖した細菌を、50 μg/mLのアンピシリンと50 μg/mLのスペクチノマイシンを含む5 LのTBまたはLBに移します。
- この培養液をシェーカーインキュベーター内で37°Cで、非標識セプチンの場合は2〜3、msfGFP/mEGFP標識セプチンの場合は0.6〜0.8の範囲で波長600 nmで測定された光学密度(OD)に達するまで増殖させ、最終濃度0.5 mM IPTGを添加してタンパク質発現を誘導します。標識されたセプチンのODが低いのは、次のステップで詳述するように、より長い発現時間で死期に達することを回避するためです。
- 非標識セプチンヘテロオリゴマーを発現する細胞を37°Cで3時間インキュベートするか、msfGFP標識ヘテロオリゴマーを発現する細胞を17°Cで一晩インキュベートします。
注:非標識複合体の短いタンパク質発現時間は、より豊富なTB培地の使用によって促進され、タンパク質分解を防ぐために選択されます。標識複合体のより長い発現時間とより低い温度を組み合わせることで、msfGFPタグの正しい折り畳みが可能になります。
- 細菌溶解とライセートの清澄化
注:精製手順のこの時点から、タンパク質分解タンパク質の分解または活性の損失を防ぐために、タンパク質含有溶液を氷上または4°Cに常に保ってください。- 4,000 x g で4°Cで20分間遠心分離することにより、培養細胞を回収します。 上澄み液を捨てる。
- オプションで、このステップでペレットを急速凍結し、-80°Cで最大6か月間保管します。このオプションを選択した場合は、続行する前に必ずペレットを氷上で解凍してください。
- ペレットを100 mLの溶解バッファー(表2)に溶解し、細胞を溶解します。以下の2つのオプションのいずれかを選択してください
- 30%の振幅を使用してチップ超音波処理器で30秒オンと59秒オフの7サイクルで超音波処理します(設定は超音波処理器に依存することに注意してください)。
- フレンチプレスのセルを少なくとも3回渡して分解します。
- 20,000 x g で4°Cで30分間遠心分離して細胞ライセートを清澄化し、上清を保持します。ステップ1.5.1から始めることをお勧めします。この遠心ステップの間。
- 必要に応じて、セクション2で説明したように、変性電気泳動用のサンプルを採取します。
- 4,000 x g で4°Cで20分間遠心分離することにより、培養細胞を回収します。 上澄み液を捨てる。
- Hisタグ付きタンパク質のアフィニティークロマトグラフィー
注:このステップでは、ニッケルカラムを使用してヒトSEPT2または ショウジョウバエ Sep1を含む複合体を生成します(図1B)。- 予め充填したニッケルセファロース高速クロマトグラフィーカラムをセプチンバッファーで平衡化します(表2)。
- 清澄化した上清を1 mL/minでカラムにロードし、結合したタンパク質を少なくとも3カラム容量のセプチンバッファーで洗浄します。
- セプチン複合体を50%HisTrap溶出バッファー(表2)で1 mL/minで溶出し、0.5 mL画分を収集して、250 mMのイミダゾール濃度を得ました。
- 高速タンパク質液体クロマトグラフィー(FPLC)システムでオンラインでモニターするか、マイクロボリューム分光光度計で精製した後の280 nmでの溶出液の光吸光度で示されるように、セプチン複合体を含む画分を選択します。
注:イミダゾールは280nmの光を吸収します。これはおそらく、セプチン溶出後にタンパク質ピークがゼロ吸光度に戻らない理由を説明しています(図2A)。
- Strep-IIタグタンパク質のアフィニティークロマトグラフィー
注:このステップでは、ストレプタクチンカラムを使用して、ヒトSEPT7(六量体)、ヒトSEPT9(八量体)、または ショウジョウバエ ピーナッツのいずれかを含む複合体を生成します(図1B)。クロマトグラフィーカラムは、修飾ビオチン-ストレプトアビジン系に基づいています。タンパク質は修飾ビオチン(Strep-II-tag)でタグ付けされており、カラムには操作されたストレプトアビジン(Strep-Tactin)が含まれています。ビオチン-ストレプトアビジン系から修飾されているにもかかわらず、ストレプ-タクチン-ストレプトアビジン-II-タグ系とビオチン-ストレプトアビジン系との間に干渉はありません。記載されたシステムは、ビオチンおよびストレプトアビジンを用いた再構成アッセイとの干渉を回避するために使用される。- プレパックしたStrepTactinセファロース高速クロマトグラフィーカラムをセプチンバッファーで平衡化します(表2)。ニッケルカラムから回収したセプチン含有画分を1 mL/minでロードし、結合したタンパク質を少なくとも3カラム容量のセプチンバッファーで洗浄します。
- セプチン複合体を100%StrepTrap溶出バッファー(表2)で1 mL/minで溶出し、0.5 mLの画分を収集して、2.5mMの濃度のデスチオビオチンを得ました。
注:StrepTrap溶出バッファー中のデスチオビオチンは、新鮮に溶解する必要があります。 - FPLCシステムでオンラインでモニターした280 nmでの溶出液の光吸光度によって示されるように、またはマイクロボリューム分光光度計で精製した後、セプチン複合体を含む画分を選択します。
注:変性電気泳動は通常、この時点でカラム洗浄とセプチン画分のサンプルを使用して行われます。カラムの順序は、区別できない結果、すなわちステップ1.4の後に清澄化されたライセートで反転することができます。は、ストレプ・タクチンアフィニティークロマトグラフィーに続いてニッケルアフィニティークロマトグラフィーに供することができる。
- 透析と保管
- 最終保存溶液からデスチオビオチンを除去するには、30 kDaのMWCO透析膜を用いて、1 mM DTTを添加したセプチンバッファー(表2)に対して、サンプルとバッファーの容量比を~1:300で一晩、または少なくとも4時間、4°Cで透析します。
- 必要に応じて、30 kDa MWCO遠心濃縮カラムを使用してセプチンを所望の濃度まで濃縮します。280 nmでの溶液の吸光度を介して測定され、ProtParamを介して計算された理論的な吸光係数を使用して、5〜7 μMの濃度を目指します(表3)。
- タンパク質複合体を目的のアリコートサイズに分注し、アリコートをスナップフリーズして、-80°Cで保存します。
注:タンパク質を6か月以上保存しないことをお勧めします。さらに、特にタンパク質が推奨時間より長く保存される場合は、定期的な品質管理実験を実施することをお勧めします。
2.セプチンヘテロオリゴマーの純度と完全性の品質管理
注:ヘテロオリゴマーの品質管理は、溶液中に存在するセプチン複合体の質量と完全性の検出を可能にする一連の生化学的およびイメージング技術で構成されています。
- 正しい成分を含むセプチンヘテロオリゴマーの形成をチェックするための変性電気泳動
- 選択した画分10 μLを10 μLの2x SDSサンプルバッファーと混合し、プレキャスト4%-15%TGXゲルにロードし、システムにトリス/グリシン/SDSランニングバッファーを充填します。
- 電気泳動を200 Vで35分間実行し、ゲルを染色して結果を視覚化します(材料表)。個々のセプチンタンパク質およびセプチンヘテロオリゴマー複合体の分子量を 表3に見出すことができる。
- 精製セプチンを含む各レーン内の各バンドの相対強度をコントラスト反転画像で測定します。これを行うには、各バンドの周りの同じサイズの長方形の平均強度と、同じレーンにバンドがない領域の同じサイズの長方形の平均強度を計算します。次に、各バンドの強度をバンドのない領域の強度で割って値を正規化します。
メモ: 強度が飽和している場合(たとえば、コントラスト反転イメージの 8 ビットイメージの場合は 255 の値)、レーンをスキップします。
- ネイティブ電気泳動 による アンサンブル平均ネイティブサイズ分布
- 前日にアノードバッファー800 mL、ライトブルーカソードバッファー200 mLを準備し、冷蔵庫で保存します。アノードバッファーを調製するには、40 mLの20xランニングバッファーを760 mLのタイプI脱イオン水(I-水)で希釈します。水色のカソードバッファーを調製するには、10 mLの20xランニングバッファーと1 mLの20xカソード添加剤を189 mLのI-水で希釈します。ランニングバッファーとカソード添加剤には、キット(材料表)が付属しています。
- ~500 ngのセプチンを必要量のサンプルバッファー(この場合は4xサンプルバッファーを使用するため2.5 μL、 材料表を参照)と10 μLの容量に達するのに十分なI-水を混合して、10 μLのサンプルを調製します。
- サンプルをゲルにロードし、氷冷したアノードバッファーとカソードバッファーをシステムに適合させます。
- 低電流で止まらない電源で150Vで約115分間電気泳動を行い、ゲルを染色して結果を可視化します。配列に基づいて計算された単一タンパク質および複合体の分子量を 表3に見出すことができる。
- 干渉散乱顕微鏡による質量測光法による1分子質量分布
- #1.5スライドガラスを超音波洗浄機で超音波処理して、I-水中で5分間、イソプロパノールで5分間、最後にI-水で5分間洗浄します。
- 2つのスライドガラスを穏やかな窒素ガスの流れで乾燥させ、スライドの1つの中央に0.01%ポリ-L-リジン(PLL)溶液7 μL滴を置きます。次に、もう一方のスライドの中心をPLLドロップの上に置き、2つのスライドを直交させて簡単に分離できるようにします。30秒間インキュベートします。
- I-水1xを入れたビーカーに浸し、I-水2xの流れを直接適用して洗ってください。次に、2つのスライドを窒素ガスの流れで乾燥させます。これらのスライドは、その後、乾燥した状態で室温で約6週間保存できます。
注: 実験を正しく実行するために、PLL で処理されているスライドの側面にラベルを付けます。
- I-水1xを入れたビーカーに浸し、I-水2xの流れを直接適用して洗ってください。次に、2つのスライドを窒素ガスの流れで乾燥させます。これらのスライドは、その後、乾燥した状態で室温で約6週間保存できます。
- 実験の直前に、2 x 2、3 x 2、または3 x 3ガスケット(それぞれ4、6、または9のイメージングチャンバー/スライドを生成する)を切り取り、スライドガラスとガスケットが汚れた表面に接触しないようにしながら、スライドガラスのPLL処理部分に貼り付けます。スライドを軽量のワイパーティッシュの上に置き、ピペットチップでガスケットを押して、ガスケットに保護プラスチックを貼り付けたまま貼り付けます。
- セプチンバッファー(表2)を室温に温め、手持ちのタンパク質を解凍します(その後、氷上に保管してください)。
注:iSCATは、タンパク質シグナル45に似たいくつかの界面活性剤および低分子のシグナルを示します。DTTはそれらの小分子の1つであり、それがこの実験に使用されていない理由です。保存されたセプチンからのDTTの痕跡しかありません。 - ガスケット付きのスライドを19 μLのセプチンバッファーを含む市販の質量測光システムに置き、オートフォーカスオプションを使用して顕微鏡に焦点を合わせます。製造元の指示に従って、見つかったフォーカスが正しいかどうかを確認してください。ここでは、セットアップの一部である標準の100倍の対物レンズを使用します。
- [ファイル > 新しいプロジェクト] または [ファイル > プロジェクトの読み込み] を使用して、データを格納するプロジェクト フォルダーを作成または読み込みます。
- 1 μLのサンプルを19 μLのセプチンバッファードロップ(ステップ2.3.5)にピペットで入れ、何も触れないようにすることでスライドの動きを最小限に抑えながら、焦点を合わせて混合します。次に、[録画]をクリックして6,000フレームのビデオを 録画します。
- 正しい分析のために、次のサンプルを記録します:セプチンバッファー、シグナル対質量比のキャリブレーション用のタンパク質質量標準(最近のキャリブレーションが利用可能で、環境条件が変更されていない場合、このサンプルはスキップできます)、およびDTTなしでセプチンバッファーで希釈した250 nMのセプチン複合体(これにより、最終濃度は~12.5 nMになります)。
- メーカーのソフトウェアを使用してビデオを分析して、タンパク質の質量分布を取得します。次のように、良質のデータを確認してください。
- 異なるセプチンヘテロオリゴマーサイズのピークが重なりすぎているか、検出されたイベントが多すぎる場合(128ピクセルx 34ピクセルの通常の視野が10.8 μm x 2.9 μmに及ぶ6,000フレームのビデオで>3,500イベント)、最終セプチン濃度を下げて再度測定します。
- 測定された単一分子の数が十分でない場合(通常の視野を持つ6,000フレームのビデオでは少なくとも2,500〜3,500)、セプチン濃度を上げて再度測定します。
- 負の染色透過型電子顕微鏡によるセプチン複合体の直接イメージング
- サンプルをセプチン緩衝液で約50 nMの濃度に希釈し、染色液を調製します(I水中の2%ギ酸ウラニルまたは酢酸ウラニル)。
注:ギ酸ウラニルは新鮮に準備する必要があります。 - 希釈したセプチン4 μLをグロー放電電子顕微鏡グリッド上にピペットで移し、30秒間インキュベートします。
- ろ紙を使用してほとんどのタンパク質溶液を除去し、グリッドをセプチンバッファーで2倍、I-水で1倍洗浄して、緩く吸着したセプチンを除去します。
- I-水中の2%酢酸ウラニルまたはギ酸ウラニル溶液で1分間染色し、染色溶液をろ紙で吸収し、グリッドを数分間風乾します。
- 適切に位置合わせされた透過型電子顕微鏡を使用してグリッドをスクリーニングし、汚れが強化された領域を検索し、これらの選択された領域内で約100枚の画像を収集します。
- 少なくとも50,000倍の倍率で画像を収集し、約2 Å/ピクセルのピクセルサイズを取得し、焦点ぼけを-1 μmから-2 μmまで変化させます。加速電圧200kVを使用してください。好ましくは、自動化された手順を使用してデータを収集しますが、これは利用可能な取得ソフトウェアによって異なります。
- 専用ソフトウェアによる2D画像処理の実行
- 専用ソフトウェア46を用いて少なくとも2,000個の粒子をボックスアウトする。
- 2次元の整列と分類を、クラスが取得されるまで繰り返し実行しますが、それ以上の改善はありません。最初の配置と分類のステップは、分類の偏りを避けるために参照フリーにする必要があります。
- 最初の参照のない分類から得られた平均を新しい参照として使用して、追加の分類を実行します。それ以上の改善が達成されなくなるまで、このプロセスを繰り返します。各クラスが50〜100個の選択されたパーティクルに基づいており、個々のサブユニットがはっきりと見えることを確認します。さまざまなソフトウェアツールを使用できます(スパイダー、エマン、またはリリオン)46,47,48。
- サンプルをセプチン緩衝液で約50 nMの濃度に希釈し、染色液を調製します(I水中の2%ギ酸ウラニルまたは酢酸ウラニル)。
3. 重合分析によるセプチンの機能的品質管理
注:機能性品質管理は、重合セプチン複合体の検出を可能にする一連のイメージング技術で構成されています。以下では、非標識セプチンを「暗」セプチンと称し、非標識セプチンを重合するために使用される緩衝液を「暗」セプチン重合緩衝液(SPB)と呼ぶ。
- 蛍光顕微鏡によるセプチンバンドルイメージング
- 5x fluoSPB(表2)と、90%ダークセプチンと10%msfGFP-セプチンからなるセプチンミックスを、セプチンバッファー+ 1 mM DTT中の所望の最終濃度の6倍の濃度で調製します。このアッセイの典型的な濃度は300 nMであるため、この混合物の濃度は1,800 nMです。
- この特定の順序で、I-水(最終的な目的量まで補充するのに十分)、20%5xfluoSPB(最終希釈1:5)、0.05 μM PCD、および16.67%セプチン混合物(最終希釈1:6)を混合することにより、セプチンを重合します。10 μLの場合、6.23 μLのI-水、2 μLの5xfluoSPB、0.1 μLのPCD(ストック5 μM)、および1.67 μLのセプチンミックスを混合します。この混合物を室温で少なくとも30分間インキュベートします。
- サンプルをfluoSPBで洗浄したイメージングチャンバー(表2)に追加し、セプチンバンドルを画像化します。以前の研究10,32で説明したように、PLL-PEGパッシベーション流路は、この実験でうまく機能します。
- 負の染色透過電子顕微鏡によるセプチンバンドルの想像
- 5x darkSPB(表2)と、セプチンバッファー+ 1 mM DTT中の所望の最終濃度の6倍の濃度で100%ダークセプチンからなるセプチン混合物を調製します。このアッセイの典型的な濃度は300 nMであるため、この混合物の濃度は1,800 nMです。
- この特定の順序で、I-水(最終的な所望の量まで補充するのに十分)、20%5xdarkSPB、および16.67%セプチン混合物を混合することにより、セプチン複合体を重合します。5 μLの場合、3.16 μLのI-水、1 μLの5x darkSPB、および0.83 μLのセプチン混合物を混合します。この混合物を室温で少なくとも30分間インキュベートします。
- 3〜5 μLのサンプルをグロー放電電子顕微鏡グリッドに加え、1分間インキュベートします。次に、ろ紙で液体を吸収し、darkSPBバッファーを一滴加えてグリッド2xをdarkSPB(表2)で洗浄し、I水で1x洗浄し、2%酢酸ウラニルで~30秒間インキュベートし、汚れを吸い取り、サンプルを数分間風乾します。
- セプチンバンドルを120 kV、倍率5,000倍から60,000倍の倍率で、1〜2 μmの焦点を合わせた画像化します。
結果
プロトコルで述べたように、2つのセプチン発現プラスミドと共形質転換した5Lの 大腸菌 細胞を増殖させ、IPTGを添加することによってセプチンの発現を誘導した。3時間後、細胞を遠心分離により回収し、溶解緩衝液に再懸濁し、超音波処理により溶解した。次に、ライセートを遠心分離によって清澄化し、清澄化した溶液をHisTrapカラムに適用しました(図2A)。最初の精製後、セプチン含有画分をプールし、StrepTrapカラムに適用した(図2B)。これにより、通常、約3〜5 mLの~1 μMセプチン複合体が得られます。セプチン含有画分をプールする前に、変性ゲル電気泳動を使用して、セプチンサブユニットの完全性および複合体を形成する異なるセプチンサブユニット間の等モル化学量論比を検査することができる。(図3A)。ゲルがセプチンサブユニットの分子量(表3)に対応する同様に強いバンドを示す場合、プロトコルを継続できます。そうでない場合は、プロトコルを再起動することをお勧めします。SEPT9_i1を有するヒトセプチン八量体について示した例では、 図3A は、同様の強度を有するSEPT9_i1、SEPT6、SEPT7、およびSEPT2に対応するバンド(上から下の順)を明確に示しています。正規化強度の99%信頼区間は、SEPT2±1.128 0.048、SEPT6±1.092 0.034、SEPT7±1.108 0.040、SEPT9±0.029で1.067でした。SEPT2 が msfGFP でタグ付けされている場合、SEPT9_i1 のすぐ下にシフトします。使用する電気泳動システムと、SEPT7のC末端TEV-Strepタグの存在(タグなしSEPT7よりも移動が遅くなる)によっては、SEPT7バンドとSEPT6バンドは分子量が等しいため、融合することがあります。次のステップは、フラクションをプールし、DTTでセプチンバッファーに対して透析することです。透析後、濃度が低すぎる(<2 μM)場合、または実験に高濃度が必要な場合は、プロトコルに記載されているように、濃縮ステップを含めることができます。1μM未満の濃度は通常、セプチンの機能品質が悪いことを示しています。3.5 μMから7 μMの間の最終セプチン複合体濃度は、ほとんどの in vitro アッセイに適しています。これらの濃度は、通常、濃縮後の容量が0.5〜1mLに達したときに得られる。
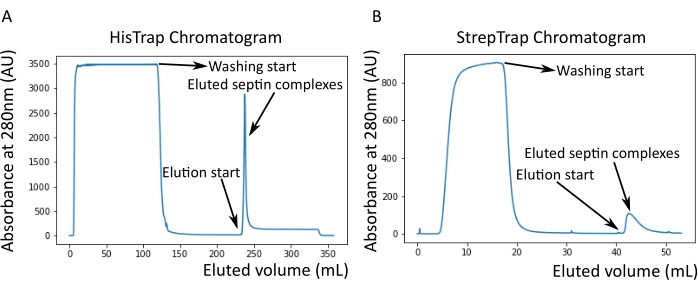
図2:暗黒ヒトセプチンoctamers_9i1の精製に対応するクロマトグラムの例 。 (A)HisTrapカラムクロマトグラム。セプチン溶出ピークの後、おそらくバッファー中にイミダゾールが存在するため、吸光度はゼロに戻りません。プールされた画分は、溶出ピークの開始から吸光度が約250mLで安定するまで行った。(B)ストレプトラップカラムクロマトグラム。プールされた画分は、溶出ピークの開始から吸光度が50mLで約0に戻るまで行った。 この図の拡大版を表示するには、ここをクリックしてください。
品質管理を継続するために、プロトコルに記載されているように、ネイティブ電気泳動を実施しました(図3B)。ゲル中には、無傷のヘテロオリゴマーに対応するメジャーバンド、および通常、ダイマーに対応するマイナーバンドが観察され得る。ヒト六量体は242 kDaマーカーバンドより少し上に見られ、八量体は計算された分子量より上の480 kDaバンドの上に見られます。これらのバンドの位置を、真核細胞抽出物32のウェスタンブロット分析によって確認した。msfGFPによるタグ付けは、各SEPT2をmsfGFPタンパク質と結合させる。これにより、セプチン複合体の分子量が53.4 kDa(26.7 kDa/msGFP分子)増加します。それにもかかわらず、天然の電気泳動ゲルでは、msfGFPタグ付き複合体の見かけの分子量は、タグなし複合体の見かけの分子量と区別がつかない。
セプチン複合体が無傷であるかどうかをテストするための補完的な技術は、iSCAT顕微鏡による質量測光です。iSCATは、参照光との干渉によって増幅されたスライドガラスに着弾する分子の光散乱、典型的にはスライドガラス底部でのレーザーの反射を監視する。次に、バックグラウンド減算アプローチを使用して、粒子にコントラストを与えます。この補正により、信号は、粒子がガラスに着地するか、ガラスから離れるかに応じて正の値と負の値を示します49。検出されたシグナルは、タンパク質50の分子量に正比例する。したがって、質量標準によるシグナル対質量キャリブレーションは、サンプルタンパク質の質量を決定することができます。 図3C は、SEPT9_i1を含有するヒトセプチン八量体の一例を示す。検出された単一粒子のほとんど(~50%)は、SEPT9_i1(423 kDa)を含む完全な八量体で予想される分子量です(図3C)。150〜300 kDaの質量を持つ粒子もありますが、明確なピークは観察されず、他のセプチン種が低存在量で存在する可能性があることを示しています。同様に、mEGFPタグ付き ショウジョウバエ 六量体について検出された単一粒子のほとんどは、無傷の六量体(361 kDa)について予想される分子量のものである(図3D)。241 kDaの追加の明確なピークは、2つのピーナッツタンパク質、1つのDSep1と1つのmEGFP-DSep2を含む安定な四量体の存在を示しています。最後に、ヒトおよびフライセプチン複合体の両方が、モノマーおよび二量体の混合物である可能性のある80kDa付近のピークを示し、おそらく微量のDTTまたは凝集する他の小分子によって増幅され、プロット45の正側にピークを示す。
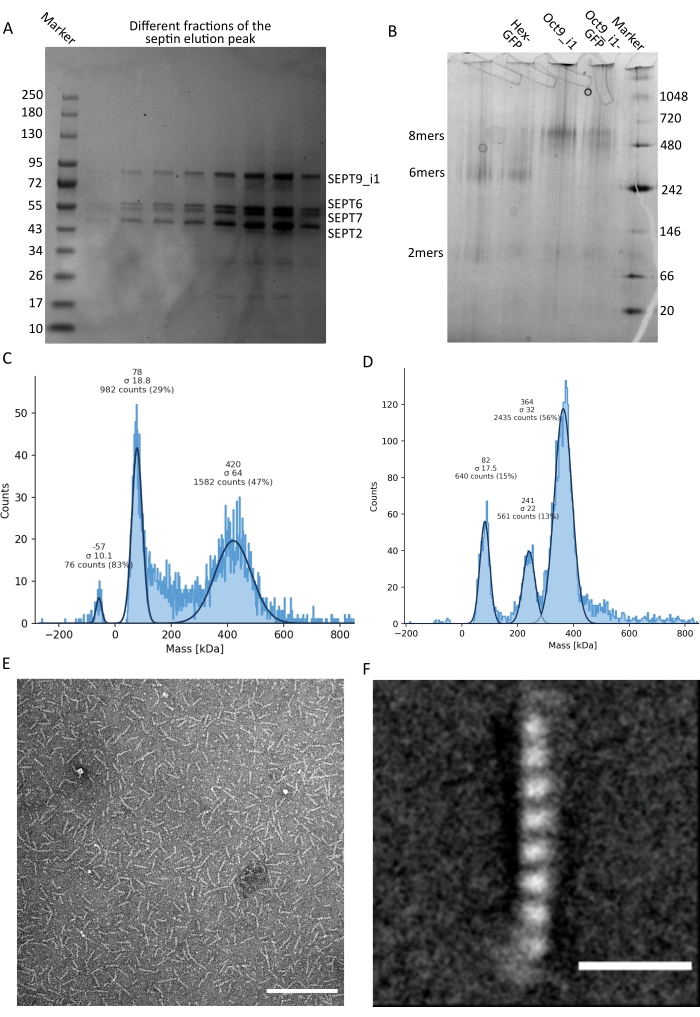
図3:オリゴマーの品質管理の結果の例 。 (a)暗黒ヒトセプチンoctamers_9i1の精製とは異なる画分の溶出ピークを示す変性ゲルの例。(B)異なるセプチン複合体の天然電気泳動の例。(C,D)セプチン複合体の12.5nMでの質量測光のヒストグラム結果の異なる例:(C)暗黒ヒトセプチンoctamers_9i1および(D)DSep1-msfGFP ショウジョウバエ セプチン六量体。線はガウス適合です。(E)セプチン緩衝液中の25nM暗黒ヒトセプチンoctamers_9i1のTEM像。スケールバー= 200 nm。(F)SEPT2-msfGFPヒトセプチンoctamers_9i1のクラス平均画像。msfGFP タグは、両端のファジー密度として表示されます。スケールバー= 10 nm。パネル(E)および(F)は、生物学者の会社の著作権であり、許可を得てIv et al.10 から適応されています。 この図の拡大版を表示するには、ここをクリックしてください。
ネイティブゲルとiSCATの両方がアンサンブル平均情報のみを提供することを考慮して、単一のセプチンオリゴマーの透過型電子顕微鏡画像のクラス平均化を使用して、直接可視化によって複合体の完全性と純度を確認しました。セプチンバッファー中のセプチン複合体のTEM画像では、長さ24 nm(六量体)または32 nm(八量体)のロッドが観察されます。SEPT9_i1を含有するヒトセプチン八量体の一例を 図3Eに見ることができる。それらをクラス平均化すると、 図3FのSEPT9_i1を有するmsfGFPタグ付きヒト八量体について見られるように、各サブユニットを観察し、カウントすることができる。オリゴマーが蛍光標識されている場合、ロッドの端にSEPT2-msfGFPに対応する余分な密度が観察されます(図3F)。
上記の技術の組み合わせは、正しい化学量論比および高純度を有する八量体(または六量体)が、記載されたプロトコールを使用して精製され得ることを証明する。最後に、最後の品質管理チェックは、重合能力の観点からセプチン複合体の機能性についてです。低塩濃度(記載された緩衝液9を有する<150mM KCl)の存在下で、セプチンが他のタンパク質または負に帯電した脂質膜の存在下でない場合、それらはバンドル9に自己集合する。セプチンは、高い(300 mM)KCl濃度を有する貯蔵バッファーにそれらを保持することによって重合を防止する。次に、セプチンヘテロオリゴマーを同じ組成のバッファーで1:6の容量比で希釈しますが、KClは含まれていませんが、最終的なKCl濃度は50 mMになります。蛍光イメージングを行うために、このバッファーは、光退色から保護するための酸素消去システムと点滅抑制剤で補完されます。TIRF顕微鏡では、浅いTIRFフィールド(~100 nm;図4A,B)。共焦点顕微鏡では、糸状構造の大きなクラスターが溶液中でより高い位置に浮かんでいるのを見ることができます(図4C)。最後に、TEMを使用すると、TIRFで観察されたクラスターに対応するセプチンの小さなバンドル(図4D)と、共焦点顕微鏡で観察された構造に対応する大きなバンドル(図4E)を観察できます。図4D,Eの挿入図は、両方のタイプの構造が平行に走る長くて細いフィラメントで構成され、先細端の束を形成していることを示しています。蛍光画像とTEM画像を組み合わせることで、精製されたセプチン複合体がフィラメントに重合し、フィラメントが自己組織化して束になることを証明しています。
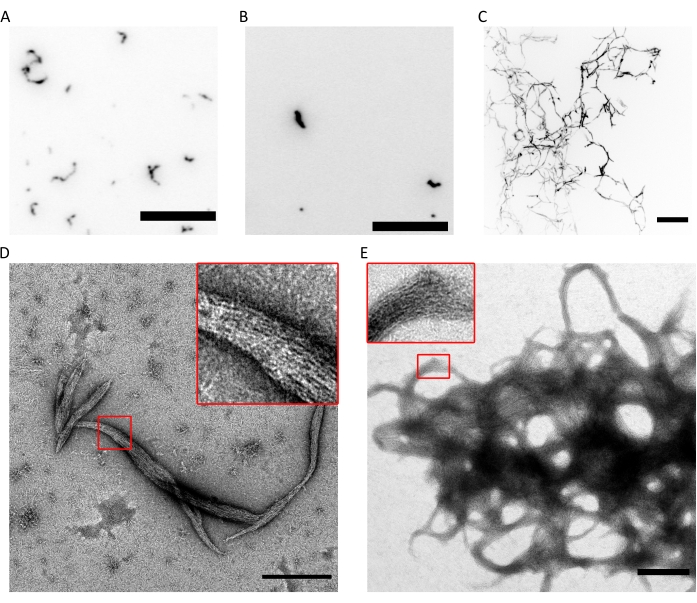
図4:重合能精度管理の結果の例。 (A)フルオSPB中の300 nMヒトセプチン六量体(10%msfGFP標識六量体)のTIRF画像。(B)fluoSPB中のSEPT9_i1(10%msfGFP標識octamers9_i1)を含む300nMヒトセプチン八量体のTIRF画像。(C)fluoSPB中の300 nMヒトセプチンoctamers_9i3の0.5 μm間隔で~30 μmにわたるZスタックの共焦点最大強度投影。(A-C)スケールバー= 10 μm、反転グレースケール。(D,E)darkSPB中のヒトセプチンoctamers_9i1の(D)小さな束と(E)大きな束のTEM画像の例。挿入図は、バンドル内で平行に走る透明なフィラメントが観察される領域を示します。スケールバー= 500 nm。パネル(C-E)は生物学者の著作権であり、許可を得てIv et al.10から翻案されています。この図の拡大版を表示するには、ここをクリックしてください。
表1:プラスミドのリスト。 このプロトコールに従ってセプチンオリゴマーを精製するためのプラスミド。全てのプラスミドはAddgene(第1カラム)に寄託されている。 この表をダウンロードするには、ここをクリックしてください。
表 2: バッファーの一覧。 セプチンオリゴマーの精製および品質管理に使用される緩衝組成物。 この表をダウンロードするには、ここをクリックしてください。
表3:分子量と吸光係数。 セプチンサブユニット、異なるセプチン複合体、および 表1にリストされているプラスミドで精製できるユニークなセプチンサブユニット(MWのみ)の線形融合を想定して、複合体の配列に基づいてProtParamで計算された波長280nmでの分子量(MW)および光吸光係数(ε)のリスト。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明する方法は、予め形成されたセプチンヘテロオリゴマーの堅牢な精製および品質管理を可能にする。この方法を正しく適用するために考慮すべき重要な問題のいくつかは次のとおりです。クロマトグラフィー分離の溶出ステップでは、セプチン複合体の希釈を最小限に抑えるために、推奨される(またはそれより低い)流速を使用することが重要です。さらに、最終濃縮ステップ中のタンパク質の回収率を最大化するために、濃縮カラムは、溶液がフィルターに押し付けられないように配向されています(片側にフィルターしかない場合)。溶液がフィルターに直接送られると、タンパク質はフィルターにはるかに付着し、最終収量が大幅に減少します。濃縮ステップが必ずしも必要ではないことを考慮することも重要です。クロマトグラムのピーク付近の狭い範囲からのみフラクションをピックすると、通常、多くの再構成アプリケーション(通常は10〜300 nM)に十分な高いストック濃度(>3,000 nM)が得られます。最後に、蛍光顕微鏡によるセプチン複合体の機能性の品質管理のためには、セプチン複合体がガラスに熱心に付着するため、顕微鏡スライドの表面を正しく不動態化することが重要です。スライドガラスの不動態化は、PLL−PEG機能化を介して、または中性(100%DOPC)支持脂質二重層の形成のいずれかによって行うことができる11,32。
Ivら10で最初に記載された元の精製プロトコルと比較して、緩衝液組成に変化がある(表2)。MgCl2の濃度は5mMから2mMに減少し、トリス塩酸塩の濃度およびpHはそれぞれ50mMから20mMにおよび8.0から7.4に減少した。これらの変更は、緩衝条件をヒトセプチンと脂質二重層、アクチンフィラメント、および微小管との相互作用の研究に適合させるために行われました10,11,32。これは、著者らがFバッファー中に支持された脂質二重層を形成し、Fバッファー中にATPが存在することを除けば、その組成がdarkSPBの組成と同じであるためである。バッファーの変更は、元のバッファーと比較して精製セプチンの品質または寿命に変化をもたらさなかった。
この精製方法にはまだいくつかの制限があります。第一に、精製の異なる試みは、精製されたセプチン複合体のバンドル形成能力によって確認されるように、収率(0.5〜1mLの2〜5μMセプチン複合体)および機能品質において異なる可能性がある。そのため、このホワイトペーパーで説明されている品質チェックを一貫して実行することが非常に重要です。発現時間と細菌培養物の光学密度を非常によく制御することで、収量の差を軽減することができます。第二に、この精製パイプラインは三量体と六量体、または四量体と八量体を区別できません(図1B)。しかしながら、品質管理実験は、セプチン複合体の大部分がそれらの長いオリゴマー形態であることを証明するために使用することができる。さらに狭いオリゴマーサイズ分布が必要な場合は、ステップ1.6の間にサイズ排除クロマトグラフィーを挿入できます。およびステップ1.7。精製プロトコルの。ただし、このオプションのステップは歩留まりを劇的に低下させるため、厳密に必要な場合を除いて推奨されません。最後の、より根本的な制限は、組換えセプチン複合体の発現系としての大腸菌の使用から来ています。当然のことながら、このシステムは、リン酸化、アセチル化、およびスモイル化などの動物細胞で報告されている翻訳後修飾(PTM)を許可しません6,51,52,53。これらの翻訳後修飾は、昆虫またはヒト細胞において同様の精製戦略を実施することによって追加することができる。さらに、この論文ではセプチンの再構成についてのみ議論しましたが、細胞での研究では、Borgファミリー54,55やアニリン24,25,56のタンパク質などの調節タンパク質は、セプチンの組み立てと機能に実質的でありながら十分に理解されていない影響を与える可能性があるため、最終的にin vitroに組み込むことが重要です。 勉強。Borgタンパク質およびアニリンの精製のためのプロトコールが報告されている54,57。
ここで報告されているセプチン精製プロトコルは、正しいサブユニット化学量論でオリゴマー形態のセプチンを精製するための標準化された方法を提供し、単一のセプチンサブユニットに依存する多くの以前のin vitro研究よりも重要な進歩を提供します。特定の状況におけるいくつかのセプチンは単一のサブユニット2として作用することができるが、現在の文献は、動物細胞において、セプチンが主に複合体9,58で機能することを強く示唆している。したがって、この論文や他の論文10、11、18、32、35、36、37に記載されているような事前に形成されたヘテロオリゴマーの使用は、in vitroを介してセプチンの構造的および生物物理学的特性を研究するために非常に重要です。 細胞内のそれらの機能を解剖するための再構成。さらに、セプチンは、膜や細胞骨格を含む多くの相互作用パートナーを持つ自己組織化タンパク質であり、ボトムアップ合成生物学59,60,61や、湾曲42,62,63などの膜生物物理学的特性におけるタンパク質誘発性変化の研究にとって非常に興味深いものとなっています。
開示事項
著者らは、競合する利益や金銭的利益を宣言していません。
謝辞
我々は、質量測光(iSCAT)実験への協力について、セシリア・デ・アグレラ・ピント氏、トマス・デ・ガライ氏、カタリーナ・ホイサーマン氏に感謝する。アリエン・ヤコビとヴィエル・エヴァースがTEMを手伝ってくれた。TIRFへの支援に対するルシア・バルダウフ。パスカル・ヴェルディエ・ピナール ネイティブ電気泳動に関するアドバイス。ショウジョウバエセプチン精製の取り組みの立ち上げを支援してくれたAgata SzubaとMarjolein Vinkenoog、およびフランス国立研究インフラストラクチャフランスバイオイメージング(ANR10-INBS-04)のメンバーであるキュリー研究所の細胞および組織イメージング(PICT-IBiSA)。この研究は、オランダ科学研究機構(NWO / OCW)から「BaSyC-合成細胞の構築」重力助成金(024.003.019)および国立研究開発庁(ANR助成金ANR-17-CE13-0014:「セプティモルフ」;ANR-13-JSV8-0002-01: "SEPTIME";およびANR-20-CE11-0014-01:「セプツコート」)。
資料
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
参考文献
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802(2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349(2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76(2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203(2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226(2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190(2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, Pt 3 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420(2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166(2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315(2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved