Method Article
Purification et contrôle de qualité de complexes de septine recombinante pour reconstitution sans cellules
Dans cet article
Résumé
La reconstitution in vitro des protéines du cytosquelette est un outil essentiel pour comprendre les propriétés fonctionnelles de base de ces protéines. Le présent article décrit un protocole pour purifier et évaluer la qualité des complexes septiniques recombinants, qui jouent un rôle central dans la division cellulaire et la migration.
Résumé
Les septines sont une famille de protéines eucaryotes conservées liant le GTP qui peuvent former des filaments cytosquelettiques et des structures d’ordre supérieur à partir de complexes hétéro-oligomères. Ils interagissent avec d’autres composants du cytosquelette et la membrane cellulaire pour participer à des fonctions cellulaires importantes telles que la migration et la division cellulaire. En raison de la complexité des nombreuses interactions des septines, du grand nombre de gènes de septine (13 chez l’homme) et de la capacité des septines à former des complexes hétéro-oligomères avec différentes compositions de sous-unités, la reconstitution cellulaire est une stratégie essentielle pour comprendre les bases de la biologie des septines. Le présent article décrit d’abord une méthode de purification des septines recombinantes sous leur forme hétéro-oligomère en utilisant une approche de chromatographie d’affinité en deux étapes. Ensuite, le processus de contrôle de la qualité utilisé pour vérifier la pureté et l’intégrité des complexes septine est détaillé. Ce procédé combine l’électrophorèse sur gel natif et dénaturant, la microscopie électronique à coloration négative et la microscopie à diffusion interférométrique. Enfin, une description du procédé de vérification de la capacité de polymérisation des complexes septiniques par microscopie électronique à coloration négative et microscopie fluorescente est donnée. Cela démontre qu’il est possible de produire des hexamères et des octamères de septine humaine de haute qualité contenant différentes isoformes de septin_9, ainsi que des hexamères de septine de drosophile .
Introduction
Le cytosquelette a été classiquement décrit comme un système à trois composants composé de filaments d’actine, de microtubules et de filaments intermédiaires 1, mais récemment, les septines ont été reconnues comme un quatrième composant du cytosquelette1. Les septines sont une famille de protéines de liaison au GTP qui sont conservées chez les eucaryotes2. Les septines sont impliquées dans de nombreuses fonctions cellulaires telles que la division cellulaire3, l’adhésion cellule-cellule4, la motilité cellulaire5, la morphogenèse6, l’infection cellulaire7, et l’établissement et le maintien de la polarité cellulaire8. Malgré leurs fonctions importantes, la façon dont les septines sont impliquées dans de tels processus est mal comprise.
La famille des protéines septines est subdivisée en plusieurs sous-groupes (quatre ou sept, selon la classification) en fonction de la similitude de séquence protéique2. Les membres de différentes sous-familles peuvent former des complexes hétéro-oligomères palindromiques, qui sont les éléments constitutifs des filaments et qui, à leur tour, s’assemblent en structures d’ordre supérieur telles que des faisceaux, des anneaux et des maillages 1,9,10,11,12. Une complexité moléculaire supplémentaire découle de la présence de différentes variantes d’épissures, un exemple étant SEPT9 humain, où il existe des preuves de fonctions spécifiques de différentes variantes d’épissage13,14,15. De plus, la longueur des hétéro-oligomères dépend de l’espèce et du type de cellule. Par exemple, les septines de Caenorhabditis elegans forment les tétramères 16, les septines de Drosophila melanogaster forment les hexamères 17 (Figure 1A), les septines de Saccharomyces cerevisiae forment les octamères 18 et les septines humaines forment à la fois les hexamères et les octamères19 (Figure 1A). La capacité des isoformes de septines, des variantes d’épissage et des septines post-traductionnellement modifiées de la même sous-famille à se substituer dans le complexe et la (co-)existence d’hétéro-oligomères de tailles différentes ont rendu difficile la délimitation des fonctions cellulaires de différents complexes hétéro-oligomères12.
Une autre capacité intéressante des septines est leur capacité à interagir avec de nombreux partenaires de liaison dans la cellule. Les septines lient la membrane plasmique et les organites membraneux pendant l’interphase et la division cellulaire20,21,22. En divisant les cellules, les septines coopèrent avec l’anilline 23,24,25 et l’actine et la myosine au cours de la cytocinèse 26,27. Aux stades avancés de la cytocinèse, les septines semblent réguler les complexes de tri endosomal nécessaires au système de transport (ESCRT) pour l’abscissionmédiane du corps 28. En outre, il existe également des preuves de septine située sur le cortex d’actine et de fibres de stress d’actine des cellules dans les cellules interphasiques 29,30,31. Dans des types cellulaires spécifiques, les septines se lient et régulent également le cytosquelette des microtubules32,33.
Toutes ces caractéristiques font des septines un système protéique très intéressant à étudier, mais aussi un défi. La combinaison du grand nombre de sous-unités de septine (13 gènes chez l’homme sans compter les variantes d’épissage2) avec le potentiel des sous-unités de septine de la même sous-famille à se substituer mutuellement et à former des hétéro-oligomères de tailles différentes rend difficile de tirer une conclusion sur la fonction cellulaire d’une septine spécifique par manipulation génétique. De plus, les multiples interactions des septines rendent difficile l’interprétation des effets d’outils de recherche courants tels que les médicaments34 destinés aux composants du cytosquelette ou de la membrane.
Un moyen de surmonter cette situation est de compléter la recherche sur les cellules par une reconstitution in vitro (sans cellules) des septines. La reconstitution in vitro permet d’isoler un seul type d’hétéro-oligomères de septine avec une composition sous-unitaire spécifique et une longueur 18,35,36,37. Ce complexe peut ensuite être étudié en milieu contrôlé, soit seul pour découvrir les propriétés structurales et physico-chimiques de base des septines 38,39,40, soit en association avec des partenaires souhaités tels que les biomembranes modèles 11,41,42, les filaments d’actine 10,27, ou les microtubules 32,36 pour déchiffrer la nature de leur Interactions.
Par conséquent, une méthode fiable pour purifier efficacement différents complexes de septine est vitale pour la recherche sur la septine. Cependant, même en utilisant le même protocole, différentes purifications peuvent donner des protéines avec une activité / fonctionnalité différente ou même une intégrité. Pour les protéines disponibles dans le commerce telles que les enzymes, la fonctionnalité et l’activité enzymatique sont soigneusement validées43. La mise en œuvre d’un contrôle de qualité minutieux pour les protéines cytosquelettiques ou structurelles telles que les septines peut être difficile, mais il est essentiel de rendre les expériences comparables entre les laboratoires.
Cet article décrit une méthode robuste pour purifier des septines recombinantes de haute qualité sous leur forme hétéro-oligomère basée sur l’expression simultanée de deux vecteurs contenant des constructions mono- ou bi-cistroniques (Tableau 1) dans des cellules d’Escherichia coli. La méthode consiste en une approche de chromatographie d’affinité en deux étapes pour capturer des hétéro-oligomères de septine contenant à la fois une septine marquée à6 et une septine marquée Strep-II (Figure 1B,C). Ce protocole, décrit pour la première fois dans Iv et al.10, a été utilisé pour purifier les hexamères de septine 11,27,35 de Drosophila, les hexamères de septine humaine 10 et plusieurs octamères de septine humaine contenant différentes isoformes SEPT9 natives (isoformes 1, 3 et 5)10,32 ou mutées 32 . En outre, une description d’un ensemble de techniques permettant d’évaluer la qualité des septines purifiées est donnée. Tout d’abord, l’intégrité et la stœchiométrie correcte des sous-unités de septine sont vérifiées à l’aide de l’électrophorèse dénaturante et de la microscopie électronique à transmission (MET). Ensuite, la présence d’hétéro-oligomères de masse moléculaire correcte et la présence de monomères ou d’oligomères plus petits indiquant une instabilité complexe sont examinées par électrophorèse native et photométrie de masse par microscopie à diffusion interférométrique (iSCAT). Enfin, la dernière étape consiste en l’évaluation de l’activité polymérisante des septines par microscopie à fluorescence et MET.
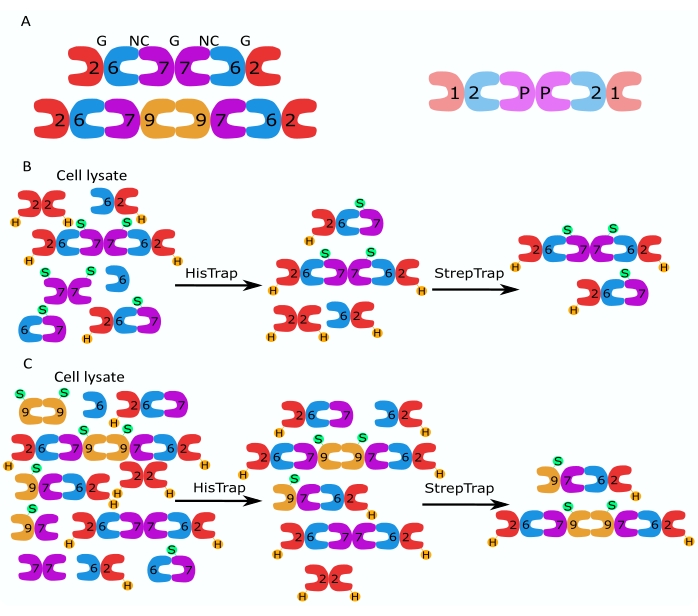
Figure 1 : Stratégie de purification. (A) Schémas des hétéro-oligomères de septine qui existent dans les cellules humaines (à gauche) et de drosophile (à droite). Les nombres désignent les sous-unités de septine des groupes indiqués, et P désigne l’arachide. Le SEPT9 humain peut être n’importe laquelle de ses isoformes. Les sous-unités septines ont une forme asymétrique et sont associées longitudinalement à deux interfaces distinctes, l’interface NC:NC et l’interface G:G, comme indiqué par NC et G, respectivement, au-dessus de l’hexamère humain. (B,C) Illustration schématique de la stratégie chromatographique en deux étapes, montrée pour (B) les hexamères de septine humaine et (C) les octamères. H indique les balises his, tandis que S indique les balises Strep-II. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
1. Purification des hétéro-oligomères de septine
- Co-transformation des cellules bactériennes avec les vecteurs d’expression
- Sélectionnez une combinaison d’un plasmide pnEA et d’un plasmide pnCS44 qui sera utilisé pour l’expression. Choisissez la combinaison en fonction de la composition de sous-unité souhaitée de l’hétéro-oligomère de septine10,35 et de la nécessité ou non d’un marquage fluorescent.
REMARQUE : le superdossier monomère marqué en phase C (msfGFP) marqué SEPT2 (pour les septines humaines) ou msfGFP- ou GFP monomère amélioré (mEGFP)-DSep2 (pour les septines de Drosophila ) est utilisé ici (Tableau 1). - Pipeter 1 μL de chaque plasmide (~1 ng/μL) dans 100 μL de cellules compétentes d’Escherichia coli BL21 et incuber sur de la glace pendant 20 min.
- Placer les cellules dans un bain-marie à 42 °C pendant 40 s puis les incuber immédiatement pendant 3 min sur de la glace.
- Ajouter 0,9 mL de bouillon lysogénique (LB) à la suspension cellulaire et laisser pousser les cellules pendant 1 h à 37 °C. Plaquer 100 μL de cellules sur des plaques chaudes de LB-agar contenant 100 μg/mL d’ampicilline et 100 μg/mL de spectinomycine et incuber pendant une nuit à 37 °C.
- Sélectionnez une combinaison d’un plasmide pnEA et d’un plasmide pnCS44 qui sera utilisé pour l’expression. Choisissez la combinaison en fonction de la composition de sous-unité souhaitée de l’hétéro-oligomère de septine10,35 et de la nécessité ou non d’un marquage fluorescent.
- Cultiver la pré-culture bactérienne
- Remplir une fiole d’erlenmeyer de 250 ml avec 100 mL de bouillon Terrific (TB) ou de milieu LB contenant 100 μg/mL d’ampicilline et 100 μg/mL de spectinomycine.
- Prélever une seule colonie dans la plaque de gélose LB à l’aide d’une boucle d’inoculation stérile et la transférer dans un milieu frais à partir de l’étape 1.2.1.
- Incuber à 37 °C dans un incubateur rotatif, soit pendant une nuit, soit pendant au moins 6 h.
NOTE: À partir de cette culture, un stock de glycérol peut être préparé en mélangeant la suspension bactérienne 1: 1 avec du glycérol et stocké à -80 ° C. Ce stock peut être utilisé à l’étape 1.2.2. au lieu d’une colonie fraîchement transformée.
- Culture bactérienne et induction de l’expression protéique
- Transférer 100 mL de bactéries cultivées dans 5 L de TB ou LB contenant 50 μg/mL d’ampicilline et 50 μg/mL de spectinomycine.
- Cultiver cette culture à 37 °C dans un incubateur agitateur jusqu’à ce qu’elle atteigne une densité optique (DO) mesurée à une longueur d’onde de 600 nm dans la plage de 2-3 pour les septines non marquées ou de 0,6-0,8 pour les septines marquées msfGFP/mEGFP et induire l’expression des protéines en ajoutant une concentration finale de 0,5 mM IPTG. La DO inférieure pour les septines étiquetées est d’éviter d’atteindre la phase de mort dans leur temps d’expression plus long, comme détaillé dans l’étape suivante.
- Incuber les cellules exprimant des hétéro-oligomères de septine non marqués pendant 3 h à 37 °C ou les cellules exprimant des hétéro-oligomères marqués msfGFP pendant une nuit à 17 °C.
REMARQUE: Le court temps d’expression des protéines pour les complexes non marqués, facilité par l’utilisation du milieu TB plus riche, est choisi pour prévenir la dégradation des protéines. Le temps d’expression plus long combiné à une température plus basse pour les complexes marqués est choisi pour permettre un pliage correct de l’étiquette msfGFP.
- Lyse bactérienne et clarification du lysat
NOTE: À partir de ce stade de la procédure de purification, conserver la solution contenant des protéines sur de la glace ou à 4 °C en tout temps pour éviter la dégradation ou la perte d’activité des protéines protéolytiques.- Recueillir les cellules cultivées par centrifugation à 4 000 x g pendant 20 min à 4 °C. Jetez le surnageant.
- En option, congelez la pastille à cette étape et conservez-la à −80 °C pendant 6 mois maximum. Si cette option est choisie, assurez-vous de décongeler la pastille sur la glace avant de continuer.
- Dissoudre la pastille dans 100 mL de tampon de lyse (tableau 2) et lyser les cellules. Choisissez l’une des deux options ci-dessous
- Sonicate en 7 cycles de 30 s ON et 59 s OFF avec un sonicateur à pointe utilisant 30% d’amplitude (notez que les réglages dépendent du sonicateur).
- Décomposez les cellules dans la presse Français en les passant au moins 3x.
- Clarifier le lysat cellulaire par centrifugation à 20 000 x g pendant 30 min à 4 °C et conserver le surnageant. Il est recommandé de commencer par l’étape 1.5.1. au cours de cette étape centrifuge.
- Si vous le souhaitez, prélever un échantillon pour dénaturer l’électrophorèse, comme décrit à la rubrique 2.
- Recueillir les cellules cultivées par centrifugation à 4 000 x g pendant 20 min à 4 °C. Jetez le surnageant.
- Chromatographie d’affinité pour les protéines marquées par His
REMARQUE : Cette étape produit des complexes contenant de la SEPT2 humaine ou de la Drosophila Sep1 à l’aide d’une colonne de nickel (Figure 1B).- Équilibrer une colonne de chromatographie à haute performance en sépharose de nickel préemballée avec un tampon de septine (tableau 2).
- Charger le surnageant clarifié sur la colonne à 1 mL/min et laver la protéine liée avec au moins trois volumes de colonne de tampon septine.
- Éluer les complexes septiniques avec un tampon d’élution HisTrap à 50 % (tableau 2) à 1 mL/min tout en recueillant des fractions de 0,5 mL pour obtenir une concentration d’imidazole de 250 mM.
- Prélever les fractions contenant des complexes septiniques, comme indiqué par l’absorbance optique de l’éluat à 280 nm surveillée en ligne avec un système de chromatographie liquide protéique rapide (FPLC) ou après la purification avec un spectrophotomètre de microvolume.
REMARQUE: L’imidazole absorbe la lumière à 280 nm. Cela explique probablement pourquoi le pic protéique ne revient pas à une absorbance nulle après l’élution de la septine (Figure 2A).
- Chromatographie d’affinité pour les protéines marquées par Strep-II
REMARQUE : Cette étape produit des complexes contenant soit de la SEPT7 humaine (hexamères), de la SEPT9 humaine (octamères) ou de l’arachide de drosophile à l’aide d’une colonne Strep-Tactin (Figure 1B). La colonne de chromatographie est basée sur un système modifié biotine-streptavidine. La protéine est marquée avec de la biotine modifiée (Strep-II-tag), et la colonne contient une streptavidine modifiée (Strep-Tactin). Bien qu’il ait été modifié à partir du système biotine-streptavidine, il n’y a aucune interférence entre le système Strep-Tactin-Strep-II-tag et le système biotine-streptavidine. Le système décrit est utilisé pour éviter toute interférence avec les essais de reconstitution utilisant la biotine et la streptavidine.- Équilibrer une colonne de chromatographie à haute performance de StrepTactin sépharose préemballée avec un tampon de septine (tableau 2). Charger les fractions contenant de la septine récupérées de la colonne de nickel à 1 mL/min et laver la protéine liée avec au moins trois volumes de colonne tampon de septine.
- Éluer les complexes septiniques avec un tampon d’élution StrepTrap à 100 % (tableau 2) à 1 mL/min tout en recueillant des fractions de 0,5 mL pour obtenir une concentration de 2,5 mM de desthiobiotine.
REMARQUE : La desthiobiotine contenue dans le tampon d’élution StrepTrap doit être dissoute à l’état frais. - Prélever les fractions contenant des complexes septiniques, comme indiqué par l’absorbance optique de l’éluat à 280 nm surveillée en ligne avec un système FPLC ou après la purification avec un spectrophotomètre de microvolume.
NOTE: L’électrophorèse dénaturante se fait généralement à ce stade avec des échantillons de lavage de colonne et de fractions de septine. L’ordre des colonnes peut être inversé avec des résultats indiscernables, c’est-à-dire le lysat clarifié après l’étape 1.4. peut être soumis à une chromatographie d’affinité Strep-Tactin suivie d’une chromatographie d’affinité nickel.
- Dialyse et entreposage
- Pour éliminer la desthiobiotine de la solution de stockage finale, dialyser les complexes septine dans un rapport volume échantillon/tampon ~1:300 contre le tampon septine (tableau 2) complété par 1 mM de TNT pendant une nuit, ou pendant au moins 4 h, à 4 °C à l’aide d’une membrane de dialyse MWCO de 30 kDa.
- En option, concentrer les septines à l’aide d’une colonne de concentration centrifuge MWCO de 30 kDa jusqu’à la concentration souhaitée. Viser une concentration de 5-7 μM, mesurée via l’absorbance optique de la solution à 280 nm et en utilisant un coefficient d’extinction théorique calculé via ProtParam (Tableau 3).
- Aliquote les complexes protéiques dans la taille aliquote désirée, surgeler l’aliquote et la conserver à −80 °C.
REMARQUE: Il est recommandé de ne pas stocker la protéine pendant plus de 6 mois. En outre, il est recommandé d’effectuer régulièrement des expériences de contrôle de la qualité, surtout si la protéine est stockée plus longtemps que le temps recommandé.
2. Contrôle de la qualité de la pureté et de l’intégrité de l’hétéro-oligomère de septine
NOTE: Le contrôle de qualité des hétéro-oligomères consiste en un ensemble de techniques biochimiques et d’imagerie qui permettent la détection de la masse et de l’intégrité des complexes septiniques présents dans la solution.
- Dénaturation de l’électrophorèse pour vérifier la formation de l’hétéro-oligomère de septine avec les composants corrects
- Mélanger 10 μL des fractions sélectionnées avec 10 μL de tampon d’échantillon SDS 2x, les charger sur un gel TGX préfabriqué à 4%-15% et remplir le système avec un tampon courant Tris/glycine/SDS.
- Exécutez l’électrophorèse pendant 35 min à 200 V et colorez le gel (Table des matériaux) pour visualiser les résultats. Les poids moléculaires des protéines septines individuelles et des complexes hétéro-oligomères de septine sont présentés dans le tableau 3.
- Mesurez l’intensité relative de chaque bande à l’intérieur de chaque voie contenant des septines purifiées dans une image inversée par contraste. Pour ce faire, calculez l’intensité moyenne de rectangles de taille égale autour de chaque bande et d’un rectangle de taille égale sur une région sans bande dans la même voie. Ensuite, normalisez les valeurs en divisant l’intensité de chaque bande par l’intensité de la région sans bandes.
REMARQUE : Si l’intensité est saturée (par exemple, des valeurs de 255 pour une image 8 bits sur une image à contraste inversé), ignorez la voie.
- Distribution de taille native moyenne d’ensemble par électrophorèse native
- Préparez 800 ml de tampon anodique et 200 ml de tampon cathodique bleu clair la veille et conservez-les au réfrigérateur. Pour préparer le tampon anodique, diluer 40 mL de tampon courant 20x avec 760 mL d’eau désionisée de type I (I-eau). Pour préparer le tampon cathodique bleu clair, diluer 10 mL de tampon courant 20x et 1 mL d’additif cathodique 20x avec 189 mL d’I-eau. Le tampon de fonctionnement et l’additif de cathode sont livrés avec un kit (Table of Materials).
- Préparer 10 μL de l’échantillon en mélangeant ~500 ng de septine avec la quantité nécessaire de tampon d’échantillon (2,5 μL dans ce cas, en raison de l’utilisation d’un tampon d’échantillon 4x; voir Tableau des matériaux) et suffisamment d’I-eau pour atteindre un volume de 10 μL.
- Chargez les échantillons sur le gel et remplissez le système avec les tampons d’anode et de cathode glacés.
- Faites fonctionner l’électrophorèse pendant environ 115 min à 150 V avec une alimentation qui ne s’arrête pas aux faibles courants et tache le gel (Table of Materials) pour visualiser les résultats. Les poids moléculaires des protéines et complexes individuels calculés sur la base de la séquence peuvent être trouvés dans le tableau 3.
- Distribution de masse d’une seule molécule par photométrie de masse par microscopie à diffusion interférométrique
- Lavez les lames de verre #1.5 en les sonicant dans un nettoyeur à ultrasons pendant 5 min dans I-water, 5 min dans de l’isopropanol, et enfin, 5 min dans I-water.
- Sécher deux lames de verre avec un léger jet d’azote gazeux et placer une goutte de 7 μL de solution de poly-L-lysine (PLL) à 0,01% au centre de l’une des lames. Ensuite, placez le centre de l’autre glissière au-dessus de la goutte PLL, en orientant les deux glissières orthogonalement pour faciliter la séparation. Incuber pendant 30 s.
- Laver en plongeant dans un bécher avec I-water 1x et en appliquant directement un jet d’I-eau 2x. Ensuite, séchez les deux lames avec un flux d’azote gazeux. Ces lames peuvent être stockées par la suite pendant environ 6 semaines à température ambiante dans des conditions sèches.
Remarque : étiquetez le côté de la lame qui est traité avec la LPL pour exécuter correctement l’expérience.
- Laver en plongeant dans un bécher avec I-water 1x et en appliquant directement un jet d’I-eau 2x. Ensuite, séchez les deux lames avec un flux d’azote gazeux. Ces lames peuvent être stockées par la suite pendant environ 6 semaines à température ambiante dans des conditions sèches.
- Juste avant l’expérience, coupez un morceau de joints de 2 x 2, 3 x 2 ou 3 x 3 (qui donnent respectivement 4, 6 ou 9 chambres d’imagerie / lame) et collez-le sur la partie traitée PLL d’une lame de verre tout en évitant que la lame de verre et les joints entrent en contact avec toute surface sale. Placez la lame sur un mouchoir d’essuie-glace léger et appuyez sur les joints avec une pointe de pipette pour les coller avec le plastique protecteur encore sur les joints.
- Réchauffer le tampon septine (tableau 2) à température ambiante et décongeler les protéines en main (les garder sur la glace par la suite).
REMARQUE: iSCAT montre le signal de certains détergents et petites molécules qui ressemblent à des signaux protéiques45. Le DTT est l’une de ces petites molécules, et c’est pourquoi il n’est pas utilisé pour cette expérience. Il n’y a qu’une trace de DTT provenant de la septine stockée. - Placez la lame avec des joints sur le système commercial de photométrie de masse contenant 19 μL de tampon septine et faites la mise au point du microscope à l’aide de l’option autofocus. Suivez les instructions du fabricant pour vérifier si le focus trouvé est correct. L’objectif standard 100x qui fait partie de la configuration est utilisé ici.
- Créez ou chargez un dossier de projet pour stocker les données à l’aide de Fichier > Nouveau projet ou Fichier > Charger le projet.
- Pipeter 1 μL d’échantillon sur les 19 μL de goutte tampon de septine (étape 2.3.5) utilisés pour focaliser et mélanger tout en minimisant le mouvement de la lame en ne touchant rien en le faisant. Ensuite, enregistrez une vidéo de 6 000 images en cliquant sur Enregistrer.
- Pour une analyse correcte, enregistrer les échantillons suivants: tampon septine, étalon de masse protéique pour l’étalonnage du rapport signal/masse (si un étalonnage récent est disponible et que les conditions environnementales n’ont pas changé, cet échantillon peut être ignoré), et 250 nM de complexes septine dilués dans un tampon septine sans DTT (cela donne une concentration finale de ~12,5 nM).
- Analysez les vidéos à l’aide du logiciel du fabricant pour obtenir la distribution de la masse protéique. Vérifiez les données de bonne qualité comme suit.
- Si les pics de différentes tailles d’hétéro-oligomères de septine se chevauchent trop ou si trop d’événements sont détectés (>3 500 événements pour une vidéo de 6 000 images avec le champ de vision régulier de 128 pixels x 34 pixels couvrant 10,8 μm x 2,9 μm), diminuez la concentration finale de septine et mesurez à nouveau.
- S’il n’y a pas assez de nombre de molécules individuelles mesurées (au moins 2 500-3 500 pour une vidéo de 6 000 images avec le champ de vision régulier), augmentez la concentration de septine et mesurez à nouveau.
- Imagerie directe des complexes septiniques par microscopie électronique à transmission de coloration négative
- Diluer les échantillons à une concentration d’environ 50 nM dans un tampon septine et préparer la solution de coloration (formate d’uranyle à 2% ou acétate d’uranyle dans de l’eau I).
NOTE: Le formate d’uranyle doit être préparé frais. - Pipeter 4 μL de septines diluées sur une grille de microscopie électronique à décharge luminescente et incuber pendant 30 s.
- Retirez la majeure partie de la solution protéique à l’aide d’un papier filtre et lavez la grille 2x avec un tampon septine et 1x avec de l’eau I pour éliminer les septines faiblement adsorbées.
- Colorer avec de l’acétate d’uranyle à 2% ou une solution de formate d’uranyle dans de l’eau I pendant 1 min, absorber la solution de coloration avec un papier filtre et sécher la grille à l’air pendant quelques minutes.
- Examinez la grille à l’aide d’un microscope électronique à transmission correctement aligné pour rechercher des régions de coloration améliorée et recueillir environ 100 images dans ces zones sélectionnées.
- Collectez des images à un grossissement d’au moins 50 000x pour obtenir une taille de pixel d’environ 2 Å/pixel et avec une défocalisation variant de −1 μm à −2 μm. Utilisez une tension d’accélération de 200 kV. De préférence, utilisez une procédure automatisée pour collecter les données, qui dépendra du logiciel d’acquisition disponible.
- Effectuer un traitement d’image 2D à l’aide d’un logiciel dédié
- Boîte d’au moins 2 000 particules à l’aide d’un logiciel dédié46.
- Effectuez l’alignement et la classification bidimensionnels de manière itérative jusqu’à ce que les classes soient obtenues sans autre amélioration. La première étape d’alignement et de classification devrait être exempte de référence afin d’éviter tout biais dans la classification.
- Utiliser les moyennes obtenues à partir de la première classification sans référence comme nouvelles références pour effectuer un tour supplémentaire de classification. Répétez ce processus de manière itérative jusqu’à ce qu’aucune autre amélioration ne soit obtenue. Assurez-vous que chaque classe est basée sur 50 à 100 particules prélevées et que les sous-unités individuelles sont clairement visibles. Différents outils logiciels peuvent être utilisés (Spider, Eman ou Relion)46,47,48.
- Diluer les échantillons à une concentration d’environ 50 nM dans un tampon septine et préparer la solution de coloration (formate d’uranyle à 2% ou acétate d’uranyle dans de l’eau I).
3. Contrôle de la qualité fonctionnelle de la septine par analyse de polymérisation
REMARQUE: Le contrôle de la qualité de la fonctionnalité consiste en un ensemble de techniques d’imagerie qui permettent la détection de complexes de septine polymérisés. Ci-dessous, les septines non marquées sont appelées septines « foncées » et le tampon utilisé pour polymériser les septines non marquées est appelé tampon de polymérisation de septine « foncée » (SPB).
- Imagerie du faisceau de septine par microscopie à fluorescence
- Préparer le fluoSPB 5x (tableau 2) et un mélange de septine composé de 90% de septine foncée et de 10% de msfGFP-septine à une concentration six fois supérieure à la concentration finale souhaitée dans le tampon septine + 1 mM de TNT. Une concentration typique pour cet essai est de 300 nM et, par conséquent, la concentration est de 1 800 nM pour ce mélange.
- Polymériser la septine en mélangeant, dans cet ordre spécifique, de l’I-eau (suffisante pour compléter jusqu’au volume final souhaité), 20% 5xfluoSPB (une dilution finale de 1:5), 0,05 μM PCD et 16,67% de mélange de septine (une dilution finale de 1:6). Pour 10 μL, mélanger 6,23 μL d’I-eau, 2 μL de 5xfluoSPB, 0,1 μL de PCD (avec un stock de 5 μM) et 1,67 μL de mélange de septine. Incuber ce mélange pendant au moins 30 minutes à température ambiante.
- Ajouter les échantillons dans une chambre d’imagerie lavée avec fluoSPB (tableau 2) et imager les faisceaux de septine. Les canaux d’écoulement passivés PLL-PEG, tels que décrits dans la recherche précédente10,32, fonctionnent bien pour cette expérience.
- Imagerie du faisceau de septine par microscopie électronique à transmission de taches négatives
- Préparer le 5x darkSPB (Tableau 2) et un mélange de septine composé à 100% de septine foncée à une concentration six fois supérieure à la concentration finale souhaitée dans le tampon septine + 1 mM de TNT. Une concentration typique pour cet essai est de 300 nM et, par conséquent, la concentration est de 1 800 nM pour ce mélange.
- Polymériser les complexes septine en mélangeant, dans cet ordre spécifique, de l’I-eau (suffisante pour compléter jusqu’au volume final souhaité), 20% 5xdarkSPB et 16,67% de mélange de septine. Pour 5 μL, mélanger 3,16 μL d’I-eau, 1 μL de 5x darkSPB et 0,83 μL de mélange de septine. Incuber ce mélange pendant au moins 30 minutes à température ambiante.
- Ajouter 3 à 5 μL d’échantillon dans une grille de microscopie électronique à décharge luminescente et incuber pendant 1 min. Ensuite, lavez la grille 2x avec darkSPB (Tableau 2) en absorbant le liquide avec un papier filtre et en ajoutant une goutte de tampon darkSPB, lavez 1x avec de l’I-eau, incuber pendant ~30 s avec 2% d’acétate d’uranyle, éponger la tache et sécher l’échantillon à l’air pendant quelques minutes.
- Image des faisceaux de septine à 120 kV et des grossissements compris entre 5 000x et 60 000x avec une défocalisation comprise entre 1 et 2 μm.
Résultats
Comme mentionné dans le protocole, 5 L de cellules E. coli co-transformées avec les deux plasmides exprimant la septine ont été cultivés, et l’expression des septines a été induite par l’ajout d’IPTG. Après 3 h, les cellules ont été collectées par centrifugation, remises en suspension dans un tampon de lyse et lysées par sonication. Le lysat a ensuite été clarifié par centrifugation et la solution clarifiée a été appliquée sur une colonne HisTrap (Figure 2A). Après la première purification, les fractions contenant de la septine ont été regroupées et appliquées sur une colonne StrepTrap (figure 2B). Cela donne généralement environ 3-5 mL de ~1 μM complexe septine. Avant de regrouper les fractions contenant de la septine, l’électrophorèse sur gel dénaturant peut être utilisée pour vérifier l’intégrité des sous-unités de septine et le rapport stœchiométrique équimolaire entre les différentes sous-unités de septine formant le complexe. (figure 3A). Si le gel présente des bandes d’intensité similaire correspondant aux masses moléculaires (tableau 3) des sous-unités de septine, le protocole peut être poursuivi. Si ce n’est pas le cas, il est recommandé de recommencer le protocole. Dans l’exemple montré pour l’octamère de septine humaine avec SEPT9_i1, la figure 3A montre clairement les bandes correspondant à SEPT9_i1, SEPT6, SEPT7 et SEPT2 (dans l’ordre de haut en bas) avec des intensités similaires; l’intervalle de confiance à 99 % de l’intensité normalisée était de 1,128 ± 0,048 pour SEPT2, 1,092 ± 0,034 pour SEPT6, 1,108 ± 0,040 pour SEPT7 et 1,067 ± 0,029 pour SEPT9. Si SEPT2 est marqué avec msfGFP, il se déplacera très près en dessous de SEPT9_i1. Selon le système d’électrophorèse utilisé et la présence de l’étiquette TEV-Streptococcique C-terminale pour SEPT7 (ce qui le rend migrer plus lentement que SEPT7 non marqué), les bandes SEPT7 et SEPT6 fusionnent parfois en raison de leurs poids moléculaires comparables. L’étape suivante consiste à mettre en commun les fractions et à les dialyser contre un tampon septine avec du DTT. Après la dialyse, si la concentration est trop faible (<2 μM) ou si une concentration plus élevée est nécessaire pour les expériences, une étape de concentration peut être incluse, comme décrit dans le protocole. Des concentrations inférieures à 1 μM indiquent généralement une mauvaise qualité fonctionnelle des septines. Une concentration finale du complexe septine entre 3,5 μM et 7 μM fonctionne bien pour la plupart des tests in vitro . Ces concentrations sont généralement obtenues lorsque le volume après concentration atteint 0,5-1 mL.
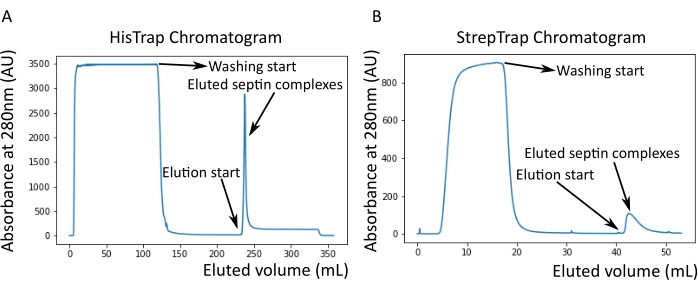
Figure 2 : Exemple de chromatogrammes correspondant à la purification de septine humaine foncée octamers_9i1. (A) chromatogramme sur colonne HisTrap. Après le pic d’élution de septine, l’absorbance ne revient pas à zéro, probablement en raison de la présence d’imidazole dans le tampon. La fraction regroupée est allée du début du pic d’élution jusqu’à ce que l’absorbance se stabilise à environ 250 mL. (B) Chromatogramme sur colonne StrepTrap. La fraction regroupée est allée du début du pic d’élution jusqu’à ce que l’absorbance revienne à environ 0 à 50 mL. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour poursuivre le contrôle de la qualité, une électrophorèse native, telle que décrite dans le protocole, a été effectuée (Figure 3B). Dans les gels, on peut observer une bande majeure correspondant aux hétéro-oligomères intacts et, généralement, une bande mineure correspondant aux dimères. Les hexamères humains se trouvent un peu au-dessus de la bande marqueur de 242 kDa, tandis que les octamères se trouvent au-dessus de la bande de 480 kDa, au-dessus de leur masse moléculaire calculée. L’emplacement de ces bandes a été vérifié par Western blot analysis of eucaryotic cell extraits32. Le marquage avec msfGFP couple chaque SEPT2 avec une protéine msfGFP. Cela provoque une augmentation du poids moléculaire des complexes septine de 53,4 kDa (molécule 26,7 kDa/msGFP). Néanmoins, sur le gel d’électrophorèse natif, le poids moléculaire apparent des complexes marqués MSFGFP est impossible à distinguer de celui des complexes non marqués.
Une technique complémentaire pour tester si les complexes septiniques sont intacts est la photométrie de masse par microscopie iSCAT. iSCAT surveille la diffusion de la lumière des molécules atterrissant sur une lame de verre amplifiée par des interférences avec la lumière de référence, généralement la réflexion du laser sur le fond de la lame de verre. Ensuite, une approche de soustraction de fond est utilisée pour donner un contraste aux particules. En raison de cette correction, le signal affiche des valeurs positives et négatives selon que les particules atterrissent sur le verre ou s’en éloignent49. Le signal détecté est directement proportionnel au poids moléculaire des protéines50. Par conséquent, un étalonnage signal-masse avec un étalon de masse peut déterminer la masse des protéines de l’échantillon. La figure 3C montre un exemple d’octamères de septine humaine contenant SEPT9_i1. La plupart des particules simples détectées (~50%) sont d’un poids moléculaire attendu pour des octamères complets contenant SEPT9_i1 (423 kDa) (Figure 3C). Il existe également des particules de masse comprise entre 150 et 300 kDa, mais aucun pic clair n’est observé, indiquant la présence possible d’autres espèces de septines en faible abondance. De même, la plupart des particules uniques détectées pour les hexamères de drosophile marqués au mEGFP ont un poids moléculaire attendu pour les hexamères intacts (361 kDa) (Figure 3D). Un pic clair supplémentaire à 241 kDa indique la présence de tétramères stables contenant deux protéines d’arachide, une DSep1 et une mEGFP-DSep2. Enfin, les complexes septine humaine et mouche montrent un pic autour de 80 kDa qui pourrait être un mélange de monomères et de dimères, éventuellement amplifié par une trace de DTT ou toute autre petite molécule qui s’agrège, montrant un pic du côté positif de la parcelle45.
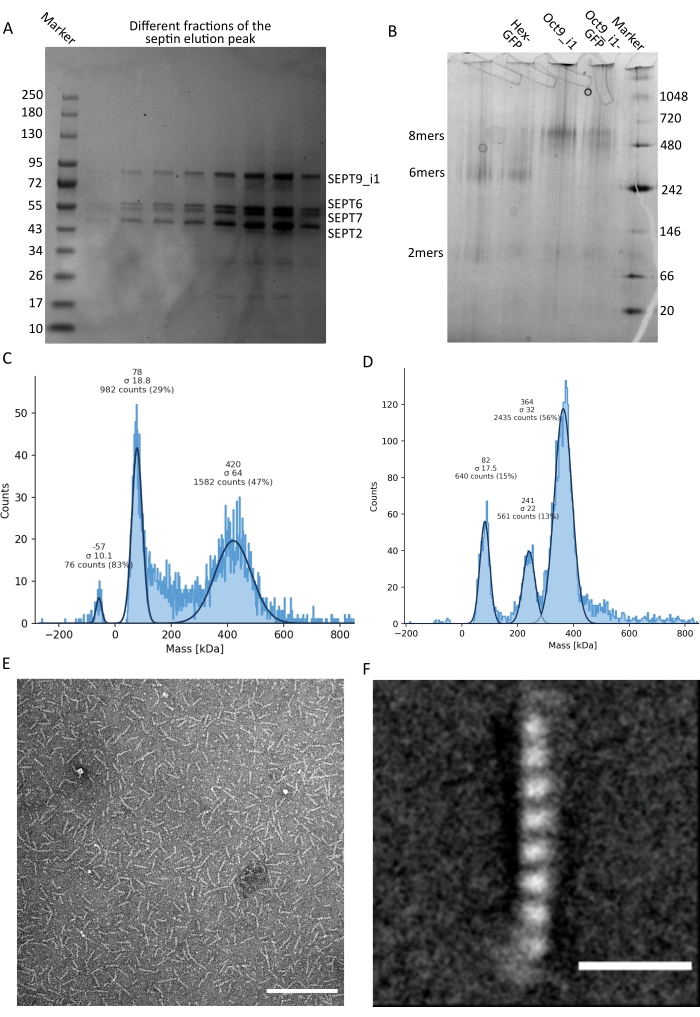
Figure 3 : Exemples de résultats du contrôle qualité des oligomères. (A) Exemple de gel dénaturant montrant différentes fractions du pic d’élution provenant de la purification de septine humaine foncée octamers_9i1. (B) Exemple d’électrophorèse native de différents complexes septiniques. (C, D) Différents exemples de résultats histographiques de photométrie de masse à 12,5 nM de complexes septiniques: (C) septine humaine foncée octamers_9i1 et (D) DSep1-msfGFP Drosophila septine hexamères. Les lignes sont des coupes gaussiennes. E) Image TEM de 25 nM de septine humaine foncée octamers_9i1 dans un tampon de septine. Barre d’échelle = 200 nm. (F) Image moyenne de classe de SEPT2-msfGFP septine humaine octamers_9i1. Les balises msfGFP sont visibles sous forme de densités floues aux deux extrémités. Barre d’échelle = 10 nm. Les panneaux (E) et (F) sont la propriété de The Company of Biologists et ont été adaptés de Iv et al.10 avec permission. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Étant donné que les gels natifs et iSCAT ne fournissent que des informations moyennées par ensemble, la moyenne par classe des images de microscopie électronique à transmission d’oligomères de septine unique a été utilisée pour vérifier l’intégrité et la pureté des complexes par visualisation directe. Dans les images TEM de complexes septiniques dans le tampon de septine, des bâtonnets de 24 nm (hexamères) ou 32 nm (octamères) de longueur peuvent être observés. Un exemple d’octamère de septine humaine contenant SEPT9_i1 peut être vu à la figure 3E. Lorsque la classe les fait la moyenne, chacune des sous-unités peut être observée et comptée, comme on l’a vu pour l’octamère humain marqué msfGFP avec SEPT9_i1 sur la figure 3F. Dans le cas où l’oligomère est marqué par fluorescence, des densités supplémentaires correspondant au SEPT2-msfGFP peuvent être observées à l’extrémité des bâtonnets (Figure 3F).
La combinaison des techniques ci-dessus prouve que les octamères (ou hexamères) avec le rapport stœchiométrique correct et une grande pureté peuvent être purifiés en utilisant le protocole décrit. Enfin, le dernier contrôle de qualité porte sur la fonctionnalité des complexes septine en termes de capacité de polymérisation. En présence d’une faible concentration en sel (<150 mM KCl avec le tampondécrit 9), si les septines ne sont pas en présence d’autres protéines ou de membranes lipidiques chargées négativement, elles s’auto-assemblent en faisceaux9. Les septines sont empêchées de polymérisation en les maintenant dans le tampon de stockage, qui a une concentration élevée (300 mM) de KCl. Les hétéro-oligomères de septine sont ensuite dilués à un rapport volumique de 1:6 dans un tampon de même composition mais sans KCl pour atteindre une concentration finale en KCl de 50 mM. Pour faire de l’imagerie par fluorescence, ce tampon est complété par un système de piégeage de l’oxygène pour protéger du photoblanchiment et par un suppresseur de clignotement. En microscopie TIRF, de petits amas de protéines peuvent être observés dans le champ TIRF peu profond (~100 nm; Figure 4A, B). Sur un microscope confocal, on peut voir de grands amas de structures filamenteuses flottant plus haut dans la solution (Figure 4C). Enfin, avec la MET, on peut observer de petits faisceaux de septine (Figure 4D), correspondant aux grappes observées par TIRF, et de grands faisceaux (Figure 4E), correspondant aux structures observées par microscopie confocale. Les encarts de la figure 4D,E révèlent que les deux types de structures sont constitués de filaments longs et minces qui courent en parallèle, formant des faisceaux aux extrémités effilées. Ensemble, les images de fluorescence et de TEM prouvent que les complexes de septine purifiés peuvent polymériser en filaments, qui à leur tour s’auto-assemblent en faisceaux.
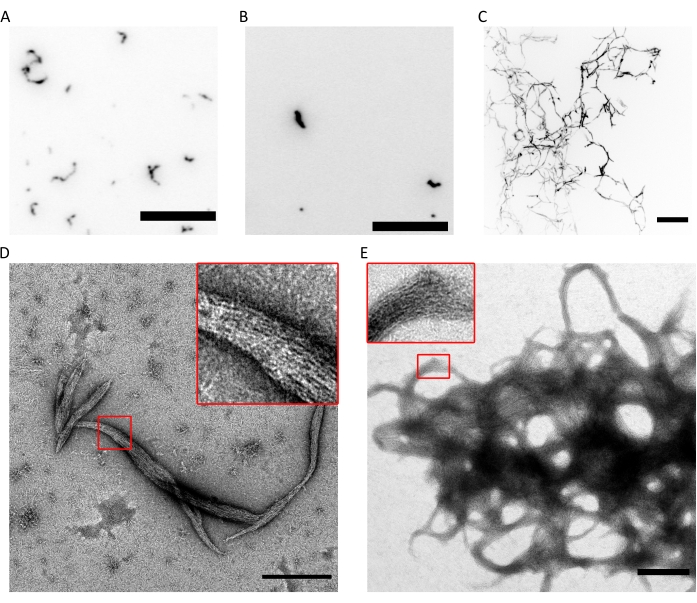
Figure 4 : Exemples de résultats du contrôle de la qualité de la polymérisation. (A) Image TIRF d’hexamères humains de septine de 300 nM (hexamères marqués msfGFP à 10 %) dans fluoSPB. (B) Image TIRF de 300 nM d’octamères de septine humaine contenant SEPT9_i1 (10% msfGFP marqué octamers9_i1) dans fluoSPB. (C) Projections confocales d’intensité maximale des piles Z sur ~30 μm avec un espacement de 0,5 μm de 300 nM de septine humaine octamers_9i3 dans fluoSPB. (A-C) Barre d’échelle = 10 μm et niveaux de gris inversés. (D, E) Exemple d’images TEM de (D) petits et (E) gros faisceaux de septine humaine octamers_9i1 dans darkSPB. Les encarts montrent les régions où des filaments transparents parallèles au sein du faisceau peuvent être observés. Barres d’échelle = 500 nm. Les panneaux (C-E) sont protégés par le droit d’auteur de The Company of Biologists et ont été adaptés de Iv et al.10 avec permission. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Liste des plasmides. Plasmides pour purifier les oligomères de septine suivant ce protocole. Tous les plasmides ont été déposés dans Addgene (première colonne). Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Liste des tampons. Compositions tampons utilisées pour la purification et le contrôle qualité des oligomères de septine. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Masses moléculaires et coefficients d’extinction. Liste des masses moléculaires (MW) et des coefficients d’extinction optique (ε) à une longueur d’onde de 280 nm calculée avec ProtParam sur la base des séquences du complexe, en supposant une fusion linéaire des sous-unités de septine, des différents complexes de septine et des sous-unités uniques de septine (uniquement MW) qui peuvent être purifiées avec les plasmides énumérés dans le tableau 1. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
La méthode décrite ici permet la purification robuste et le contrôle de la qualité des hétéro-oligomères de septine préformés. Certaines des questions clés à prendre en compte pour l’application correcte de la méthode sont les suivantes. Pendant les étapes d’élution dans les séparations chromatographiques, il est important d’utiliser le débit recommandé (ou inférieur) pour minimiser la dilution des complexes septines. De plus, pour maximiser la récupération des protéines lors de l’étape finale de concentration, la colonne concentratrice est orientée de manière à ce que la solution ne soit pas poussée contre le filtre (lorsqu’il n’y a qu’un filtre d’un côté). Si la solution va directement au filtre, la protéine y adhère beaucoup plus, ce qui diminue considérablement le rendement final. Il est également important de considérer que l’étape de concentration n’est pas toujours nécessaire. La cueillette de fractions uniquement dans une plage étroite autour du pic dans le chromatogramme donne généralement une concentration de stock suffisamment élevée (>3 000 nM) pour de nombreuses applications de reconstitution (qui fonctionnent généralement entre 10 et 300 nM). Enfin, pour le contrôle de la qualité de la fonctionnalité des complexes septine par microscopie à fluorescence, il est important de passiver correctement la surface des lames de microscopie, car les complexes de septine adhèrent avidement au verre. La passivation des lames de verre peut se faire soit par fonctionnalisation PLL-PEG, soit par la formation de bicouches lipidiques neutres (100% DOPC)supportées 11,32.
Par rapport au protocole de purification original décrit pour la première fois dans Iv et al.10, il y a un changement dans les compositions tampons (tableau 2). La concentration de MgCl 2 a été réduite de 5 mM à2 mM, et la concentration et le pH de Tris-HCl ont été réduits de 50 mM à 20 mM et de 8,0 à 7,4, respectivement. Ces modifications ont été apportées pour rendre les conditions tampons compatibles avec les études des interactions des septines humaines avec les bicouches lipidiques, les filaments d’actine et les microtubules10,11,32. En effet, les auteurs ont formé des bicouches lipidiques soutenues et de l’actine polymérisée dans le tampon F, dont la composition est identique à celle du darkSPB, à l’exception de la présence d’ATP dans le tampon F. Le changement de tampon n’a produit aucun changement dans la qualité ou la durée de vie des septines purifiées par rapport aux tampons d’origine.
Cette méthode de purification présente encore plusieurs limites. Tout d’abord, différentes tentatives de purification peuvent varier en rendement (0,5-1 mL de complexes septines 2-5 μM) et en qualité fonctionnelle, comme le vérifie la capacité de formation de faisceaux des complexes septines purifiés. C’est pourquoi il est très important d’effectuer systématiquement les contrôles de qualité décrits dans ce document. Contrôler très bien les temps d’expression et la densité optique de la culture bactérienne peut aider à atténuer la différence de rendement. Deuxièmement, ce pipeline de purification ne permet pas de distinguer les trimères et les hexamères ou entre les tétramères et les octamères (Figure 1B). Cependant, les expériences de contrôle de la qualité peuvent être utilisées pour prouver que la majorité des complexes septine sont sous leur forme oligomère longue. Dans le cas où une distribution granulométrique encore plus étroite est nécessaire, une chromatographie d’exclusion de taille peut être insérée entre l’étape 1.6. et étape 1.7. du protocole de purification. Cette étape facultative, cependant, diminue considérablement le rendement, et elle n’est pas recommandée à moins qu’elle ne soit strictement nécessaire. Une dernière limitation, plus fondamentale, provient de l’utilisation d’E. coli comme système d’expression pour les complexes septiniques recombinants. Naturellement, ce système ne permet pas les modifications post-traductionnelles (PTM), qui ont été rapportées dans les cellules animales, telles que la phosphorylation, l’acétylation et la sumoylation 6,51,52,53. Ces modifications post-traductionnelles pourraient être ajoutées en mettant en œuvre une stratégie de purification similaire dans les cellules d’insectes ou d’humains. En outre, cet article n’a discuté que de la reconstitution des septines par elles-mêmes, mais des études dans les cellules indiquent que les protéines régulatrices telles que les protéines de la famille Borg 54,55 et l’anilline24,25,56 peuvent avoir des effets substantiels mais mal compris sur l’assemblage et les fonctions des septines et sont donc importantes à incorporer éventuellement in vitro études. Des protocoles de purification des protéines de Borg et de l’anilline ont été rapportés54,57.
Le protocole de purification de la septine rapporté ici offre un moyen standardisé de purifier les septines sous leur forme oligomère avec la stœchiométrie sous-unitaire correcte, offrant une avancée importante par rapport à de nombreuses études in vitro antérieures reposant sur des sous-unités de septine uniques. Même si certaines septines dans des contextes spécifiques peuvent agir comme une seule sous-unité2, le corpus actuel de littérature suggère fortement que, dans les cellules animales, les septines fonctionnent principalement dans les complexes 9,58. Par conséquent, l’utilisation d’hétéro-oligomères préformés, tels que ceux décrits dans cet article et d’autres 10,11,18,32,35,36,37, est d’une grande importance pour étudier les propriétés structurelles et biophysiques des septines via in vitro reconstitution pour disséquer leurs fonctions dans la cellule. De plus, les septines sont des protéines auto-assemblées avec de nombreux partenaires d’interaction, y compris la membrane et le cytosquelette, ce qui les rend d’un grand intérêt pour la biologie synthétique ascendante 59,60,61 et les études des changements induits par les protéines dans les propriétés biophysiques de la membrane telles que la courbure42,62,63.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent ou financier.
Remerciements
Nous remercions Cecilia de Agrela Pinto, Tomás de Garay et Katharina Häußermann pour leur aide dans les expériences de photométrie de masse (iSCAT); Arjen Jakobi et Wiel Evers pour leur aide dans le cadre de la GDT; Lucia Baldauf pour son aide avec la FRBR; Pascal Verdier-Pinard pour ses conseils concernant l’électrophorèse native; Agata Szuba et Marjolein Vinkenoog pour leur aide dans la mise en place des efforts de purification de la septine de drosophile, et l’Imagerie cellulaire et tissulaire (PICT-IBiSA), Institut Curie, membre de l’Infrastructure Nationale de Recherche Français France-BioImagerie (ANR10-INBS-04). Cette recherche a reçu un financement de l’Organisation néerlandaise pour la recherche scientifique (NWO/OCW) par le biais de la subvention de gravitation « BaSyC-Building a Synthetic Cell » (024.003.019) et de l’Agence Nationale pour la Recherche (subventions ANR ANR-17-CE13-0014: « SEPTIMORF »; ANR-13-JSV8-0002-01: « SEPTIME »; et ANR-20-CE11-0014-01 : « SEPTSCORT »).
matériels
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
Références
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802(2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349(2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76(2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203(2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226(2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190(2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, Pt 3 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420(2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166(2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315(2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon