Method Article
טיהור ובקרת איכות של מתחמי ספטין רקומביננטיים לשחזור ללא תאים
In This Article
Summary
שחזור במבחנה של חלבונים ציטוסקטליים הוא כלי חיוני להבנת התכונות התפקודיות הבסיסיות של חלבונים אלה. המאמר הנוכחי מתאר פרוטוקול לטיהור והערכה של קומפלקסי ספטין רקומביננטיים, הממלאים תפקיד מרכזי בחלוקת תאים ונדידתם.
Abstract
ספטינים הם משפחה של חלבונים קושרי GTP אאוקריוטים משומרים שיכולים ליצור חוטים ציטוסקטליים ומבנים מסדר גבוה יותר מקומפלקסים הטרו-אוליגומריים. הם מתקשרים עם רכיבים ציטוסקטליים אחרים ועם קרום התא כדי להשתתף בתפקודים תאיים חשובים כגון נדידה וחלוקת תאים. בשל המורכבות של האינטראקציות הרבות של ספטינים, המספר הרב של גנים של ספטין (13 בבני אדם), והיכולת של ספטינים ליצור קומפלקסים הטרו-אוליגומריים עם הרכבי תת-יחידות שונים, שחזור ללא תאים הוא אסטרטגיה חיונית להבנת היסודות של הביולוגיה של ספטין. המאמר הנוכחי מתאר לראשונה שיטה לטיהור ספטינים רקומביננטיים בצורתם ההטרו-אוליגומרית באמצעות גישה של כרומטוגרפיית זיקה דו-שלבית. לאחר מכן, תהליך בקרת האיכות המשמש לבדיקת הטוהר והשלמות של מתחמי ספטין מפורט. תהליך זה משלב אלקטרופורזה מקומית של ג'ל דנטורציה, מיקרוסקופיית אלקטרונים של כתמים שליליים ומיקרוסקופיה של פיזור אינטרפרומטרי. לבסוף, ניתן תיאור של התהליך לבדיקת יכולת הפילמור של קומפלקסי ספטין באמצעות מיקרוסקופיית אלקטרונים של כתמים שליליים ומיקרוסקופיה פלואורסצנטית. זה מדגים כי ניתן לייצר באיכות גבוהה hexamers ספטין אנושי octamers המכילים איזופורמים שונים של septin_9, כמו גם Drosophila septin hexamers.
Introduction
השלד של הציטוסקלטון תואר באופן קלאסי כמערכת בעלת שלושה רכיבים המורכבת מסבי אקטין, מיקרוטובולים וחוטי ביניים 1, אך לאחרונה הוכרו ספטינים כמרכיב רביעי של השלד הציטוסקולרי1. ספטינים הם משפחה של חלבונים קושרי GTP הנשמרים באאוקריוטים2. ספטינים מעורבים בתפקודים תאיים רבים כגון חלוקת תאים3, הידבקות תא4, תנועתיות תאים5, מורפוגנזה6, זיהום תאי7, והתבססות ותחזוקה של קוטביות התא8. למרות הפונקציות החשובות שלהם, איך septins מעורבים בתהליכים כאלה הוא הבין היטב.
משפחת החלבונים ספטין מחולקת למספר תת-קבוצות (ארבע או שבע, בהתאם לסיווג) בהתבסס על דמיון ברצף חלבונים2. חברים בתת-קבוצות שונות יכולים ליצור קומפלקסים הטרו-אוליגומריים פלינדרומיים, שהם אבני הבניין של חוטים ואשר, בתורם, מתכנסים למבנים מסדר גבוה יותר כגון צרורות, טבעות ורשתות רשת 1,9,10,11,12. מורכבות מולקולרית נוספת נובעת מנוכחותם של גרסאות שחבור שונות, דוגמה לכך היא SEPT9 אנושי, שם יש ראיות לפונקציות ספציפיות של גרסאות שחבור שונות13,14,15. בנוסף, אורך ההטרו-אוליגומרים תלוי במין ובסוג התא. לדוגמה, ספטינים של Caenorhabditis elegans יוצרים טטרמרים16, ספטינים של Drosophila melanogaster יוצרים הקסמרים 17 (איור 1A), ספטינים של Saccharomyces cerevisiae יוצרים אוקסטארים 18, וספטינים אנושיים יוצרים גם הקסמרים וגם אוקסטמרים19 (איור 1A). יכולתם של איזופורמים של ספטין, גרסאות שחבור וספטינים שעברו שינוי לאחר תרגום מאותה תת-משפחה להחליף זה את זה בקומפלקס והקיום (המשותף) של הטרו-אוליגומרים בגדלים שונים הקשו על תיחום הפונקציות התאיות של קומפלקסים הטרו-אוליגומריים שונים12.
יכולת מעניינת נוספת של ספטינים היא יכולתם לקיים אינטראקציה עם שותפים מקשרים רבים בתא. ספטינים קושרים את קרום הפלזמה ואת האברונים הממברניים במהלך אינטרפאזה וחלוקת תאים20,21,22. בחלוקת תאים, ספטינים משתפים פעולה עם אנילין 23,24,25 ואקטין ומיוזין במהלך ציטוקינזיס 26,27. בשלבים מאוחרים של ציטוקינזיס, נראה כי ספטינים מווסתים את מתחמי המיון האנדוזומליים הדרושים למערכת ההובלה (ESCRT) עבור abscission midbody28. בנוסף, יש גם עדויות לכך שספטין ממוקם על קליפת המוח אקטין וסיבי עקה אקטין של תאים בתאים בין-פאזיים 29,30,31. בסוגי תאים ספציפיים, ספטינים גם קושרים ומווסתים את שלד הציטוסקול של המיקרוטובול32,33.
כל התכונות הללו הופכות את הספטינים למערכת חלבונים מעניינת מאוד למחקר, אך גם למאתגרת. השילוב של המספר הגדול של תת-יחידות ספטין (13 גנים בבני אדם מבלי לספור גרסאות שחבור2) עם הפוטנציאל של תת-יחידות ספטין מאותה תת-משפחה להחליף זו את זו וליצור הטרו-אוליגומרים בגדלים שונים מקשה על הסקת מסקנה על התפקוד התאי של ספטין מסוים על ידי מניפולציה גנטית. יתר על כן, האינטראקציות המרובות של ספטינים הופכות את פענוח ההשפעות של כלי מחקר נפוצים כגון תרופות34 המכוונות לרכיבים ציטוסקטליים או ממברנה למשימה קשה.
דרך להתגבר על מצב זה היא להשלים את המחקר בתאים עם שחזור חוץ גופי (ללא תאים) של ספטינים. שחזור במבחנה מאפשר בידוד של סוג יחיד של הטרו-אוליגומרים ספטין עם הרכב תת-יחידה מסוים ואורך 18,35,36,37. לאחר מכן ניתן לחקור קומפלקס זה בסביבה מבוקרת, לבד כדי לגלות את התכונות המבניות והפיסיקוכימיות הבסיסיות של ספטינים 38,39,40, או בשילוב עם שותפים רצויים כגון מודלים ביולוגיים 11,41,42, חוטי אקטין 10,27, או מיקרוטובולים 32,36 כדי לפענח את טבעם של אינטראקציות.
לכן, שיטה אמינה לטהר מתחמי ספטין שונים ביעילות היא חיונית למחקר ספטין. עם זאת, אפילו באמצעות אותו פרוטוקול, טיהורים שונים יכולים לתת חלבונים עם פעילות / פונקציונליות שונה או אפילו שלמות. עבור חלבונים זמינים מסחרית כגון אנזימים, הפונקציונליות והפעילות האנזימטית מאומתות בקפידה43. יישום בקרת איכות קפדנית עבור חלבונים ציטוסקטליים או מבניים כגון ספטינים יכול להיות מאתגר, אך חיוני להפוך ניסויים במעבדות שונות לדומים.
מאמר זה מתאר שיטה חזקה לטיהור ספטינים רקומביננטיים באיכות גבוהה בצורתם ההטרו-אוליגומרית המבוססת על ביטוי סימולטני של שני וקטורים המכילים מבנים חד-סטריים או דו-ציסטרוניים (טבלה 1) בתאי Escherichia coli. השיטה מורכבת מגישה של כרומטוגרפיית זיקה דו-שלבית ללכידת הטרו-אוליגומרים של ספטין המכילים גם ספטין בעל 6תגים וגם ספטין מתויג Strep-II (איור 1B,C). פרוטוקול זה, שתואר לראשונה ב- Iv et al.10, שימש לטיהור הקסמרים של ספטין דרוזופילה 11,27,35, הקסמרים של ספטין אנושיים 10, ומספר אוקסטמרים של ספטין אנושי המכילים איזופורמים מקומיים שונים (איזופורם 1, 3 ו- 5)10,32 או מוטציה של SEPT9 32 . יתר על כן, תיאור של קבוצה של טכניקות כדי להעריך את האיכות של septins מטוהרים ניתנת. ראשית, השלמות והסטויכיומטריה הנכונה של תת-היחידות של ספטין נבדקת באמצעות אלקטרופורזה דנטורית ומיקרוסקופיית אלקטרונים (TEM). לאחר מכן, נוכחותם של הטרו-אוליגומרים בעלי המסה המולקולרית הנכונה ונוכחותם של מונומרים או אוליגומרים קטנים יותר המעידים על אי-יציבות מורכבת נבחנים על ידי אלקטרופורזה מקומית ופוטומטריית מסה באמצעות מיקרוסקופיית פיזור אינטרפרומטרית (iSCAT). לבסוף, השלב האחרון מורכב מהערכת פעילות הפילמור של המחיצות באמצעות מיקרוסקופיה פלואורסצנטית ו- TEM.
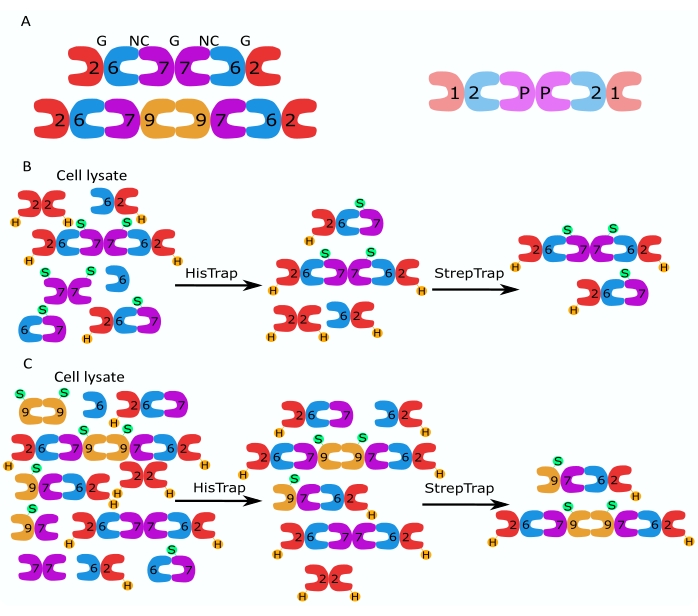
איור 1: אסטרטגיית טיהור. (A) סכמות של הטרו-אוליגומרים של ספטין הקיימות בתאים אנושיים (שמאליים) ודרוזופילה (מימין). מספרים מציינים יחידות משנה של ספטין מהקבוצות המצוינות, ו- P מציין בוטנים. SEPT9 אנושי יכול להיות כל אחד מהאיזופורמים שלו. לתת-היחידות של ספטין יש צורה אסימטרית והן משויכות אורכית לשני ממשקים נפרדים, ממשק NC:NC וממשק G:G, כפי שמצוין על ידי NC ו- G, בהתאמה, על גבי ההקסמר האנושי. (ב,ג) המחשה סכמטית של אסטרטגיית הכרומטוגרפיה הדו-שלבית, המוצגת עבור (B) הקסמרים של ספטין אנושיים ו-(C) אוקסטארים. H מציין את התגים שלו, בעוד S מציין את תגי Strep-II. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
1. טיהור של ספטין הטרו-אוליגומרים
- טרנספורמציה משותפת של תאי חיידקים עם וקטורי הביטוי
- בחר שילוב של pnEA אחד ופלסמיד pnCS44 אחד שישמש לביטוי. בחר את השילוב בהתאם להרכב תת-היחידות הרצוי של ההטרו-אוליגומר10,35 של ספטין והאם נדרש תיוג פלואורסצנטי או לא.
הערה: נעשה שימוש כאן ב-GFP מונומרי מתויג כ-C (msfGFP)-מתויג כ-SEPT2 (עבור ספטינים אנושיים) או MSFGP- או מונומרי משופר GFP (mEGFP)-DSep2 (עבור ספטינים של דרוזופילה ) כאן (טבלה 1). - פיפטה 1 μL של כל פלסמיד (~1 ng/μL) לתוך 100 μL של BL21 Escherichia coli תאים מוכשרים דגירה על קרח במשך 20 דקות.
- מניחים את התאים באמבט מים בטמפרטורה של 42 מעלות צלזיוס למשך 40 שניות ואז מיד מדגרים אותם למשך 3 דקות על קרח.
- הוסיפו 0.9 מ"ל של ציר ליזוגני (LB) בינוני לתרחיף התאים ותנו לתאים לגדול במשך שעה אחת בטמפרטורה של 37 מעלות צלזיוס. צלחת 100 μL של תאים על לוחות LB-agar חמים המכילים 100 מיקרוגרם / מ"ל אמפיצילין ו 100 מיקרוגרם / מ"ל spectinomycin ו דגירה לילה ב 37 מעלות צלזיוס.
- בחר שילוב של pnEA אחד ופלסמיד pnCS44 אחד שישמש לביטוי. בחר את השילוב בהתאם להרכב תת-היחידות הרצוי של ההטרו-אוליגומר10,35 של ספטין והאם נדרש תיוג פלואורסצנטי או לא.
- גידול חיידקים לפני תרבית
- מלאו בקבוק ארלנמאייר בנפח 250 מ"ל ב-100 מ"ל של ציר נהדר (TB) או מדיום LB המכיל 100 מיקרוגרם/מ"ל אמפיצילין ו-100 מיקרוגרם/מ"ל ספקטינומיצין.
- בחר מושבה אחת מצלחת LB-agar עם לולאת חיסון סטרילית והעבר אותה למדיה טרייה משלב 1.2.1.
- לדגור ב 37 מעלות צלזיוס באינקובטור שייקר סיבובי, או לילה או לפחות 6 שעות.
הערה: מתרבית זו, ניתן להכין ציר גליצרול על ידי ערבוב תרחיף החיידקים 1:1 עם גליצרול ואחסון בטמפרטורה של −80 מעלות צלזיוס. ניתן להשתמש במניה זו בשלב 1.2.2. במקום מושבה שזה עתה השתנתה.
- תרבית חיידקים והשראת ביטוי חלבונים
- העבר 100 מ"ל של חיידקים גדלים לתוך 5 ליטר של שחפת או LB המכילים 50 מיקרוגרם / מ"ל אמפיצילין ו 50 מיקרוגרם / מ"ל ספקטינומיצין.
- לגדל תרבית זו בטמפרטורה של 37 מעלות צלזיוס באינקובטור שייקר עד שהיא מגיעה לצפיפות אופטית (OD) הנמדדת באורך גל של 600 ננומטר בטווח של 2-3 עבור ספטינים ללא תווית או 0.6-0.8 עבור מחיצות המסומנות על-ידי msfGFP/mEGFP ולגרום לביטוי חלבונים על-ידי הוספת ריכוז סופי של 0.5 mM IPTG. ה-OD התחתון עבור המחיצות המסומנות הוא להימנע מלהגיע לשלב המוות בזמן הביטוי הארוך יותר שלהם, כפי שמפורט בשלב הבא.
- דגירה של התאים המבטאים הטרו-אוליגומרים של ספטין ללא תווית במשך 3 שעות ב-37 מעלות צלזיוס או את התאים המבטאים הטרו-אוליגומרים המסומנים על-ידי msfGFP למשך הלילה בטמפרטורה של 17 מעלות צלזיוס.
הערה: זמן הביטוי הקצר של חלבונים עבור קומפלקסים ללא תווית, המתאפשר על-ידי שימוש במדיום השחפת העשיר יותר, נבחר כדי למנוע פירוק חלבון. זמן הביטוי הארוך יותר בשילוב עם טמפרטורה נמוכה יותר עבור קומפלקסים מסומנים נבחר כדי לאפשר קיפול נכון של תג msfGFP.
- ליזיס חיידקי והבהרת ליזאט
הערה: מנקודה זו ואילך בהליך הטיהור, יש לשמור את התמיסה המכילה חלבון על קרח או בטמפרטורה של 4 מעלות צלזיוס בכל עת כדי למנוע פירוק של חלבון פרוטאוליטי או אובדן פעילות.- לאסוף את התאים בתרבית על ידי צנטריפוגה ב 4,000 x גרם במשך 20 דקות ב 4 מעלות צלזיוס. השליכו את הסופר-נטנט.
- לחלופין, הקפיא את הכדור בשלב זה ואחסן בטמפרטורה של −80°C למשך 6 חודשים לכל היותר. אם אפשרות זו נבחרה, הקפידו להפשיר את הכדור על הקרח לפני שתמשיכו.
- ממיסים את הכדור ב-100 מ"ל של חיץ ליזה (טבלה 2) ומניחים את התאים. בחר אחת משתי האפשרויות הבאות
- סוניקט ב-7 מחזורים של 30 שניות ON ו-59 שניות כבוי עם סוניקטור קצה המשתמש באמפליטודה של 30% (שימו לב שההגדרות תלויות בסוניקטור).
- לשבור את התאים בעיתונות הצרפתית על ידי העברתם לפחות 3x.
- להבהיר את התא lysate על ידי צנטריפוגה ב 20,000 x גרם במשך 30 דקות ב 4 מעלות צלזיוס ולשמור על supernatant. מומלץ להתחיל בשלב 1.5.1. במהלך שלב צנטריפוגלי זה.
- לחלופין, קח דגימה עבור דנטורינג אלקטרופורזה, כמתואר בסעיף 2.
- לאסוף את התאים בתרבית על ידי צנטריפוגה ב 4,000 x גרם במשך 20 דקות ב 4 מעלות צלזיוס. השליכו את הסופר-נטנט.
- כרומטוגרפיית זיקה לחלבונים המתויגים שלו
הערה: שלב זה מניב קומפלקסים המכילים SEPT2 אנושי או Drosophila Sep1 באמצעות עמודת ניקל (איור 1B).- שיווי משקל עמודת כרומטוגרפיה ארוזה מראש של ניקל ספרוז בעל ביצועים גבוהים עם מאגר ספטין (טבלה 2).
- יש להעמיס את הסופר-נטנט המובהר על העמודה במהירות של 1 מ"ל/דקה ולשטוף את החלבון המאוגד בלפחות שלושה טורים של חיץ ספטין.
- אלוקים את מתחמי הספטין עם 50% מאגר אלוטיון HisTrap (טבלה 2) ב-1 מ"ל/דקה תוך איסוף שברים של 0.5 מ"ל כדי להניב ריכוז אימידזול של 250 מ"מ.
- בחר את השברים המכילים קומפלקסי ספטין, כפי שמצוין על ידי ספיגה אופטית של eluate ב 280 ננומטר מנוטר באינטרנט עם מערכת כרומטוגרפיה נוזלית חלבון מהירה (FPLC) או לאחר טיהור עם ספקטרופוטומטר microvolume.
הערה: אימידזול בולע אור ב-280 ננומטר. זה כנראה מסביר מדוע שיא החלבון לא חוזר לאפס ספיגה אחרי הספיגה של ספטין (איור 2A).
- כרומטוגרפיית זיקה לחלבונים מתויגים Strep-II
הערה: שלב זה מניב קומפלקסים המכילים SEPT7 אנושי (הקסמרים), SEPT9 אנושי (אוקטמרים) או בוטנים Drosophila באמצעות עמודת סטרפ-טקטין (איור 1B). עמודת הכרומטוגרפיה מבוססת על מערכת ביוטין-סטרפטווידין שעברה שינוי. החלבון מתויג עם ביוטין מעובד (Strep-II-tag), והעמודה מכילה סטרפטאבידין מהונדס (Strep-Tactin). למרות היותו שונה ממערכת הביוטין-סטרפטאבידין, אין הפרעה בין מערכת הסטרפ-טקטין-סטרפ-II-טאג לבין מערכת הביוטין-סטרפטאבידין. המערכת המתוארת משמשת כדי למנוע הפרעה במבחני שחזור באמצעות ביוטין וסטרפטאבידין.- שיווי משקל עמודת כרומטוגרפיה של סטרפטקטין ספרוז בעל ביצועים גבוהים ארוזה מראש עם מאגר ספטין (טבלה 2). טען את השברים המכילים ספטין שהתאוששו מעמודת הניקל במהירות של 1 מ"ל/דקה ושטוף את החלבון הקשור בשלושה נפחים של לפחות שלושה טורים של חיץ ספטין.
- שטו את קומפלקסי ספטין עם 100% מאגר אלוטיון StrepTrap (טבלה 2) ב-1 מ"ל/דקה תוך איסוף שברים של 0.5 מ"ל כדי להניב ריכוז של 2.5mM desthiobiotin.
הערה: יש להמיס את הדסטיוביוטין במאגר ה-StrepTrap טרי. - בחר את השברים המכילים קומפלקסי ספטין, כפי שצוין על ידי ספיגה אופטית של eluate ב 280 ננומטר מנוטר באינטרנט עם מערכת FPLC או לאחר טיהור עם ספקטרופוטומטר microvolume.
הערה: האלקטרופורזה הדנטורית נעשית בדרך כלל בשלב זה עם דגימות של שטיפות העמודים ושברי ספטין. ניתן להפוך את סדר העמודות עם תוצאות שאינן ניתנות להבחנה, כלומר, הליזאט המובהר לאחר שלב 1.4. יכול להיות נתון לכרומטוגרפיה של זיקת סטרפ-טקטין ואחריה כרומטוגרפיה של זיקת ניקל.
- דיאליזה ואחסון
- כדי להסיר את הדסטיוביוטין מתמיסת האחסון הסופית, דיאליזה של מתחמי ספטין ביחס נפח דגימה למאגר של ~1:300 כנגד מאגר ספטין (טבלה 2) בתוספת DTT של 1 mM למשך הלילה, או למשך 4 שעות לפחות, בטמפרטורה של 4 מעלות צלזיוס באמצעות ממברנת דיאליזה של 30 kDa MWCO.
- לחלופין, רכז את המחיצות באמצעות עמודת ריכוז צנטריפוגלית של 30 kDa MWCO עד לריכוז הרצוי. יש לשאוף לריכוז של 5-7 מיקרומטר, כפי שנמדד באמצעות ספיגה אופטית של התמיסה ב-280 ננומטר ובאמצעות מקדם הכחדה תיאורטי המחושב באמצעות ProtParam (טבלה 3).
- Aliquot את קומפלקסי החלבון לגודל aliquot הרצוי, הצמד להקפיא את aliquot, ולאחסן אותו ב -80 מעלות צלזיוס.
הערה: מומלץ לא לאחסן את החלבון במשך יותר מ-6 חודשים. בנוסף, מומלץ לבצע ניסויי בקרת איכות קבועים, במיוחד אם החלבון מאוחסן זמן רב יותר מהזמן המומלץ.
2. בקרת איכות של טוהר ויושרה של ספטין הטרו-אוליגומר
הערה: בקרת האיכות ההטרו-אוליגומרית מורכבת ממערכת של טכניקות ביוכימיות והדמיה המאפשרות זיהוי המסה והשלמות של מתחמי ספטין הנמצאים בתמיסה.
- נטרול אלקטרופורזה כדי לבדוק את היווצרותו של הטרו-אוליגומר ספטין עם הרכיבים הנכונים
- ערבבו 10 μL של השברים שנבחרו עם 10 μL של מאגר דגימת SDS של 2x, טענו אותם על ג'ל TGX משודר מראש של 4%-15%, ומלאו את המערכת במאגר פועל של Tris/glycine/SDS.
- הפעל את האלקטרופורזה במשך 35 דקות ב 200 V והכתים את הג'ל (טבלת החומרים) כדי לדמיין את התוצאות. את המשקלים המולקולריים של חלבוני ספטין בודדים וקומפלקסים הטרו-אוליגומריים של ספטין ניתן למצוא בטבלה 3.
- מדוד את העוצמה היחסית של כל רצועה בתוך כל נתיב המכילה ספטינים מטוהרים בתמונה הפוכה עם ניגודיות. עשה זאת על ידי חישוב העוצמה הממוצעת של מלבנים בגודל שווה סביב כל רצועה ושל מלבן בגודל שווה באזור ללא כל פס באותו נתיב. לאחר מכן, נרמל את הערכים על ידי חלוקת העוצמה של כל פס בעוצמת האזור ללא פסים.
הערה: אם העוצמה רוויה (לדוגמה, ערכים של 255 לתמונה של 8 סיביות בתמונה הפוכה עם ניגודיות), דלג על הנתיב.
- התפלגות גודל מקורית ממוצעת באמצעות אלקטרופורזה מקומית
- הכינו 800 מ"ל של חיץ אנודה ו-200 מ"ל של חיץ קתודי כחול בהיר יום קודם לכן ואחסנו אותם במקרר. כדי להכין את חיץ האנודה, לדלל 40 מ"ל של 20x חיץ פועל עם 760 מ"ל של מים deionized סוג I (I-מים). כדי להכין את החיץ הקתודי הכחול בהיר, יש לדלל 10 מ"ל של חיץ ריצה פי 20 ו-1 מ"ל של תוסף קתודי 20x עם 189 מ"ל של I-water. המאגר הפועל והתוסף הקתודה מגיעים עם ערכה (Table of Materials).
- הכן 10 μL של הדגימה על ידי ערבוב ~ 500 ננוגרם של ספטין עם הכמות הדרושה של מאגר דגימה (2.5 μL במקרה זה, עקב השימוש במאגר דגימה 4x; ראה טבלת חומרים) ומספיק I-מים כדי להגיע לנפח של 10 μL.
- העמיסו את הדגימות על הג'ל ומלאו את המערכת באנודה קרה כקרח ובמאגרי קתודה.
- הפעל את האלקטרופורזה במשך כ-115 דקות ב-150 וולט עם ספק כוח שאינו עוצר בזרמים נמוכים ומכתים את הג'ל (Table of Materials) כדי לדמיין את התוצאות. את המשקלים המולקולריים של החלבונים והקומפלקסים הבודדים המחושבים על סמך הרצף ניתן למצוא בטבלה 3.
- התפלגות מסה של מולקולה בודדת באמצעות פוטומטריית מסה באמצעות מיקרוסקופיית פיזור אינטרפרומטרית
- יש לשטוף את מגלשות הזכוכית #1.5 על ידי הונתן בחומר ניקוי על-קולי למשך 5 דקות ב-I-water, 5 דקות באיזופרופנול, ולבסוף, 5 דקות ב-I-water.
- יבשו שתי מגלשות זכוכית עם זרם עדין של גז חנקן והניחו טיפה של 7 μL של תמיסת Poly-L-Lysine (PLL) של 0.01% במרכז אחת השקופיות. לאחר מכן, הנח את מרכז השקופית השנייה על גבי טיפת ה- PLL, כיוון שתי השקופיות בצורה אורתוגונלית להפרדה קלה. דגירה במשך 30 שניות.
- יש לשטוף על ידי טבילה בכוס עם I-water 1x ועל ידי מריחה ישירה של זרם של I-water 2x. לאחר מכן, יבש את שתי השקופיות בזרימה של גז חנקן. ניתן לאחסן מגלשות אלה לאחר מכן במשך כ-6 שבועות בטמפרטורת החדר בתנאי יובש.
הערה: תייג את צד השקופית המטופלת ב- PLL כדי להפעיל את הניסוי כהלכה.
- יש לשטוף על ידי טבילה בכוס עם I-water 1x ועל ידי מריחה ישירה של זרם של I-water 2x. לאחר מכן, יבש את שתי השקופיות בזרימה של גז חנקן. ניתן לאחסן מגלשות אלה לאחר מכן במשך כ-6 שבועות בטמפרטורת החדר בתנאי יובש.
- רגע לפני הניסוי, חתכו חתיכה של 2 x 2, 3 x 2 או 3 x 3 אטמים (המניבים 4, 6 או 9 תאי הדמיה / החלקה, בהתאמה) והדביקו אותה על החלק המטופל ב- PLL של מגלשת זכוכית תוך הימנעות ממגלשת הזכוכית והאטמים הבאים במגע עם משטח מלוכלך כלשהו. הניחו את המגלשה על רקמת מגב קלה ולחצו על האטמים עם קצה פיפטה כדי להדביק אותם עם הפלסטיק המגן שעדיין נמצא על האטמים.
- יש לחמם את חיץ ספטין (טבלה 2) לטמפרטורת החדר ולהפשיר את החלבונים ביד (יש לשמור אותם על הקרח לאחר מכן).
הערה: iSCAT מראה את האות של דטרגנטים מסוימים ומולקולות קטנות הדומות לאותות חלבון45. DTT היא אחת מאותן מולקולות קטנות, ולכן היא אינה משמשת לניסוי זה. יש רק זכר של DTT מגיע ספטין מאוחסן. - הניחו את המגלשה עם האטמים על מערכת פוטומטריית המסה המסחרית המכילה 19 μL של חיץ ספטין ומקדו את המיקרוסקופ באמצעות אפשרות המיקוד האוטומטי. בצע את הוראות היצרן כדי לבדוק אם המוקד שנמצא נכון. המטרה הסטנדרטית של 100x שהיא חלק מההתקנה משמשת כאן.
- צור או טען תיקיית פרוייקט כדי לאחסן את הנתונים באמצעות קובץ > פרוייקט חדש או קובץ > טען פרוייקט.
- פיפטה 1 μL של דגימה על 19 μL של טיפת חיץ ספטין (שלב 2.3.5) המשמש למיקוד וערבוב תוך מזעור תנועת השקופית על ידי אי נגיעה בשום דבר תוך כדי כך. לאחר מכן, הקלט סרטון בן 6,000 פריימים על ידי לחיצה על הקלט.
- לניתוח נכון, רשום את הדגימות הבאות: מאגר ספטין, תקן מסת חלבון לכיול יחס אות למסה (אם קיים כיול עדכני ותנאי הסביבה לא השתנו, ניתן לדלג על דגימה זו), ו -250 ננומטר של קומפלקסי ספטין מדוללים במאגר ספטין ללא DTT (זה נותן ריכוז סופי של ~ 12.5 ננומטר).
- נתח את הסרטונים באמצעות תוכנת היצרן כדי להשיג את התפלגות מסת החלבון. בדוק אם יש נתונים באיכות טובה כדלקמן.
- אם הפסגות של גדלים שונים של הטרו-אוליגומרים של ספטין חופפות יותר מדי או שמזוהים יותר מדי אירועים (>3,500 אירועים לסרטון של 6,000 פריימים עם שדה ראייה רגיל של 128 פיקסלים על 34 פיקסלים המשתרעים על פני 10.8 מיקרומטר x 2.9 מיקרומטר), הפחת את ריכוז המחיצות הסופי ומדוד שוב.
- אם לא נמדדו מספיק ספירות של מולקולות בודדות (לפחות 2,500-3,500 לסרטון של 6,000 פריימים עם שדה הראייה הרגיל), הגדילו את ריכוז הספטין ומדדו שוב.
- הדמיה ישירה של קומפלקסי ספטין באמצעות מיקרוסקופיית אלקטרונים להעברת כתמים שליליים
- לדלל דגימות לריכוז של כ-50 ננומטר במאגר ספטין ולהכין את תמיסת הכתמים (2% אורניל פורמטה או אורניל אצטט ב-I-water).
הערה: יש להכין את פורמט אורניל טרי. - פיפטה 4 μL של ספטינים מדוללים על גבי רשת מיקרוסקופיית אלקטרונים זוהרת משוחררת ודגירה במשך 30 שניות.
- הסר את רוב תמיסת החלבון באמצעות נייר סינון ושטוף את הרשת פי 2 עם חיץ ספטין ופי 1 עם I-water כדי להסיר ספטינים שנספחו באופן רופף.
- להכתים בתמיסת 2% אורניל אצטט או אורניל פורמטה ב-I-water למשך דקה אחת, לספוג את תמיסת הכתמים בנייר סינון ולייבש את הרשת באוויר למשך מספר דקות.
- סנן את הרשת באמצעות מיקרוסקופ אלקטרונים הילוכים מיושר כראוי כדי לחפש אזורים של כתם משופר ולאסוף כ -100 תמונות בתוך אזורים נבחרים אלה.
- אסוף תמונות בהגדלה של לפחות 50,000x כדי לקבל גודל פיקסל של כ- 2 Å/pixel ועם defocus המשתנה בין −1 μm ל- −2 μm. השתמש במתח האצה של 200 kV. רצוי, השתמש בהליך אוטומטי כדי לאסוף את הנתונים, אשר יהיה תלוי בתוכנת הרכישה הזמינה.
- ביצוע עיבוד תמונה דו-ממדי באמצעות תוכנה ייעודית
- ארוז לפחות 2,000 חלקיקים באמצעות תוכנה ייעודית46.
- בצע יישור וסיווג דו-ממדיים באופן איטרטיבי עד לקבלת שיעורים ללא שיפור נוסף. שלב היישור והסיווג הראשון צריך להיות ללא התייחסות כדי למנוע כל הטיה בסיווג.
- השתמש בממוצעים המתקבלים מהסיווג הראשון ללא ייחוס כהפניות חדשות כדי לבצע סבב נוסף של סיווג. חזור על תהליך זה באופן איטרטיבי עד שלא יושג שיפור נוסף. ודא שכל מחלקה מבוססת על 50 עד 100 חלקיקים שנבחרו, ויחידות משנה בודדות נראות בבירור. ניתן להשתמש בכלי תוכנה שונים (ספיידר, אימאן או ריליון)46,47,48.
- לדלל דגימות לריכוז של כ-50 ננומטר במאגר ספטין ולהכין את תמיסת הכתמים (2% אורניל פורמטה או אורניל אצטט ב-I-water).
3. בקרת איכות פונקציונלית ספטין באמצעות ניתוח פילמור
הערה: בקרת איכות הפונקציונליות מורכבת ממערכת של טכניקות הדמיה המאפשרות זיהוי של מתחמי ספטין פולימריים. להלן, ספטינים ללא תווית מכונים ספטינים "כהים", והמאגר המשמש לפולימריזציה של ספטינים ללא תווית מכונה חיץ פילמור ספטין "כהה" (SPB).
- הדמיית צרור ספטין באמצעות מיקרוסקופיה פלואורסצנטית
- הכינו את 5x fluoSPB (טבלה 2) ותערובת ספטין המורכבת מ-90% ספטין כהה ו-10% msfGFP-ספטין בריכוז גבוה פי שישה מהריכוז הסופי הרצוי במאגר ספטין + 1 mM DTT. ריכוז טיפוסי לבדיקה זו הוא 300 ננומטר, ולכן הריכוז הוא 1,800 ננומטר עבור תערובת זו.
- פילמר את המחיצות על ידי ערבוב, בסדר הספציפי הזה, I-water (מספיק כדי למלא עד לנפח הרצוי הסופי), 20% 5xfluoSPB (דילול סופי של 1:5), 0.05 μM PCD, ותערובת ספטין של 16.67% (דילול סופי של 1:6). עבור 10 μL, יש לערבב 6.23 μL של I-water, 2 μL של 5xfluoSPB, 0.1 μL של PCD (עם מלאי של 5 μM), ו 1.67 μL של תערובת septin. דגרו את התערובת הזו למשך 30 דקות לפחות בטמפרטורת החדר.
- הוסף את הדגימות לתא הדמיה שטוף ב- fluoSPB (טבלה 2) וצלם את צרורות המחיצות. ערוצי זרימה שעברו פסיביזציה של PLL-PEG, כפי שתואר במחקר הקודם10,32, פועלים היטב עבור ניסוי זה.
- צרור ספטין מדמיין באמצעות מיקרוסקופיית אלקטרונים של העברת כתמים שליליים
- הכינו את 5x darkSPB (טבלה 2) ותערובת ספטין המורכבת מ-100% ספטין כהה בריכוז גבוה פי שישה מהריכוז הסופי הרצוי במאגר ספטין + 1 mM DTT. ריכוז טיפוסי לבדיקה זו הוא 300 ננומטר, ולכן הריכוז הוא 1,800 ננומטר עבור תערובת זו.
- פולימריזציה של קומפלקסי ספטין על ידי ערבוב, בסדר הספציפי הזה, I-water (מספיק כדי למלא עד לנפח הרצוי הסופי), 20% 5xdarkSPB ותערובת ספטין 16.67%. עבור 5 μL, יש לערבב 3.16 μL של I-water, 1 μL של 5x darkSPB, ו- 0.83 μL של תערובת ספטין. דגרו את התערובת הזו למשך 30 דקות לפחות בטמפרטורת החדר.
- יש להוסיף 3-5 μL של דגימה לרשת מיקרוסקופיית אלקטרונים המוזרמת בזוהר ולדגירה למשך דקה אחת. לאחר מכן, יש לשטוף את הרשת פי 2 עם darkSPB (טבלה 2) על ידי ספיגת הנוזל בנייר סינון והוספת טיפה של חיץ darkSPB, לשטוף פי 1 עם I-water, לדגור במשך ~30 שניות עם 2% אורניל אצטט, להכתים את הכתם ולייבש את הדגימה באוויר למשך מספר דקות.
- דמיינו את חבילות הספטין ב-120 kV והגדלות בין 5,000x ל-60,000x עם רזולוציה של בין 1-2 מיקרומטר.
תוצאות
כפי שצוין בפרוטוקול, 5 L של תאי E. coli שעברו טרנספורמציה משותפת עם שני הפלסמידים המבטאים ספטין גדלו, והביטוי של ספטינים הושרה על ידי הוספת IPTG. לאחר 3 שעות, התאים נאספו על ידי צנטריפוגה, הוחזרו בחיץ תזה, ושוכבו על ידי סוניקציה. לאחר מכן הובהר הליזאט על ידי צנטריפוגה, והפתרון המובהר הוחל על עמוד HisTrap (איור 2A). לאחר הטיהור הראשון, השברים המכילים ספטין אוחדו והושמו על עמוד StrepTrap (איור 2B). זה בדרך כלל מניב סביב 3-5 מ"ל של ~ 1 μM קומפלקס ספטין. לפני איגום השברים המכילים ספטין, ניתן להשתמש באלקטרופורזה של ג'ל דנטורינג כדי לבדוק את שלמות תת-היחידות של ספטין ואת היחס הסטויכיומטרי השווה בין תת-היחידות השונות של ספטין המרכיבות את המרכובת. (איור 3A). אם הג'ל מראה פסים עזים דומים המתאימים למשקלים המולקולריים (טבלה 3) של תת-יחידות הספטין, ניתן להמשיך את הפרוטוקול. אם לא, מומלץ להפעיל את הפרוטוקול שוב. בדוגמה המוצגת עבור ספטין אוקטמר אנושי עם SEPT9_i1, איור 3A מראה בבירור רצועות המתאימות ל-SEPT9_i1, SEPT6, SEPT7 ו-SEPT2 (בסדר מלמעלה למטה) בעוצמות דומות; הרווח בר-סמך של 99% של העוצמה המנורמלת היה 1.128 ± 0.048 עבור SEPT2, 1.092 ± 0.034 עבור SEPT6, 1.108 ± 0.040 עבור SEPT7, ו- 1.067 ± 0.029 עבור SEPT9. אם SEPT2 מתויג עם msfGFP, הוא יזוז קרוב מאוד מתחת SEPT9_i1. בהתאם למערכת האלקטרופורזה המשמשת ולנוכחות של תג TEV-Strep מסוף C עבור SEPT7 (מה שגורם לו לנדוד לאט יותר מאשר SEPT7 לא מתויג), רצועות SEPT7 ו- SEPT6 מתמזגות לעיתים בשל משקלן המולקולרי הדומה. השלב הבא הוא לאגד את השברים ולדייק אותם כנגד מאגר ספטין עם DTT. לאחר הדיאליזה, אם הריכוז נמוך מדי (<2 מיקרומטר) או שיש צורך בריכוז גבוה יותר לניסויים, ניתן לכלול שלב ריכוז, כמתואר בפרוטוקול. ריכוזים מתחת ל-1 μM מצביעים בדרך כלל על איכות תפקודית גרועה של המחיצות. ריכוז קומפלקס ספטין סופי בין 3.5 μM ל-7 μM פועל היטב עבור רוב הבדיקות במבחנה . ריכוזים אלה מתקבלים בדרך כלל כאשר נפח לאחר הריכוז מגיע 0.5-1 מ"ל.
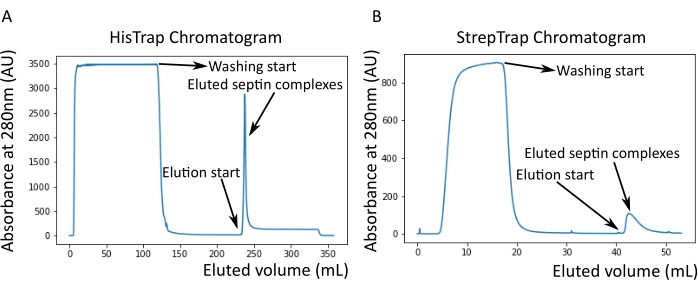
איור 2: כרומטוגרמות לדוגמה המתאימות לטיהור של ספטין אנושי כהה octamers_9i1 . (A) כרומטוגרמה של עמודת HisTrap. לאחר שיא האלוציה של ספטין, הספיגה אינה חוזרת לאפס, ככל הנראה בשל נוכחותו של אימידזול בחיץ. השבר המאוגד עבר מתחילת שיא האלוציה עד שהספיגה התייצבה על כ-250 מ"ל. (B) כרומטוגרמה של עמודת סטרפ-טראפ. החלק המאוגד הלך מתחילת שיא האלוציה עד שהספיגה חזרה לסביבות 0 ב-50 מ"ל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
כדי להמשיך בבקרת האיכות, בוצע אלקטרופורזה טבעית, כמתואר בפרוטוקול (איור 3B). בג'לים ניתן לראות להקה מז'ור המתאימה להטרו-אוליגומרים שלמים, ובדרך כלל להקה מינורית המתאימה לדמרים. הקסמרים אנושיים נמצאים מעט מעל רצועת הסמן של 242 kDa, בעוד שאוקטמרים נמצאים מעל רצועת 480 kDa, מעל המסה המולקולרית המחושבת שלהם. מיקומן של להקות אלה נבדק על ידי ניתוח כתמים מערביים של תמציות תאים אאוקריוטים32. תיוג עם msfGFP זוגות כל SEPT2 עם חלבון msfGFP. זה גורם לעלייה במשקל המולקולרי של קומפלקסי ספטין של 53.4 kDa (מולקולת 26.7 kDa/msGFP). עם זאת, על ג'ל האלקטרופורזה המקורי, המשקל המולקולרי לכאורה של קומפלקסים מתויגים msfGFP אינו ניתן להבחנה מזה של קומפלקסים לא מתויגים.
טכניקה משלימה לבדיקה אם קומפלקסי הספטין שלמים היא פוטומטריית מסה על ידי מיקרוסקופיית iSCAT. iSCAT מנטר את פיזור האור של מולקולות הנוחתות על מגלשת זכוכית המוגברת על ידי הפרעה לאור ייחוס, בדרך כלל השתקפות הלייזר בתחתית שקופית הזכוכית. לאחר מכן, נעשה שימוש בגישת חיסור רקע כדי לתת ניגוד לחלקיקים. בשל תיקון זה, האות מראה ערכים חיוביים ושליליים בהתאם לשאלה אם החלקיקים נוחתים על הזכוכית או מתרחקים ממנה49. האות שזוהה הוא ביחס ישר למשקל המולקולרי של חלבונים50. לכן, כיול אות למסה עם תקן מסה יכול לקבוע את המסה של חלבוני הדגימה. איור 3C מראה דוגמה של אוקטמרים אנושיים המכילים SEPT9_i1. רוב החלקיקים הבודדים שזוהו (~50%) הם בעלי משקל מולקולרי הצפוי עבור אוקטמרים שלמים המכילים SEPT9_i1 (423 kDa) (איור 3C). ישנם גם חלקיקים עם מסות בין 150-300 kDa, אך לא נצפתה פסגה ברורה, מה שמעיד על נוכחות אפשרית של מיני ספטין אחרים בשפע נמוך. באופן דומה, רוב החלקיקים הבודדים שזוהו עבור הקסמרים של Drosophila המתויגים על-ידי mEGFP הם בעלי משקל מולקולרי הצפוי עבור הקסמרים שלמים (361 kDa) (איור 3D). שיא ברור נוסף של 241 kDa מצביע על נוכחות של טטרמרים יציבים המכילים שני חלבוני בוטנים, אחד DSep1 ואחד mEGFP-DSep2. לבסוף, גם מתחמי הספטין האנושיים וגם הזבובים מראים שיא סביב 80 kDa שיכול להיות תערובת של מונומרים ודימרים, אולי מוגבר על ידי עקבות של DTT או כל מולקולה קטנה אחרת שמצטברת, מה שמראה שיא בצד החיובי של העלילה45.
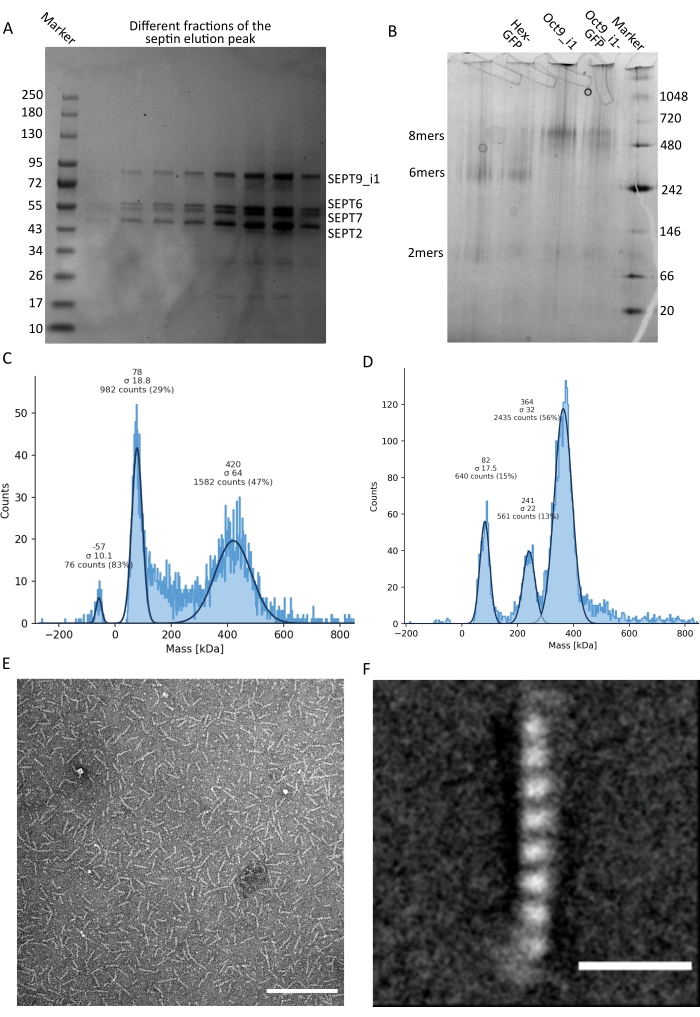
איור 3: דוגמאות לתוצאות של בקרת האיכות של האוליגומר . (A) דוגמה לג'ל דנטורינג המציג שברים שונים של שיא האלוציה מטיהור ספטין אנושי כהה octamers_9i1. (B) דוגמה לאלקטרופורזה מקומית של קומפלקסים שונים של ספטין. (ג,ד) דוגמאות שונות לתוצאות היסטוגרמה של פוטומטריה המונית ב-12.5 ננומטר של קומפלקסי ספטין: (C) ספטין אנושי כהה octamers_9i1 ו-(D) DSep1-msfGFP דרוזופילה ספטין הקסמרים. הקווים הם גזרות גאוס. (E) תמונת TEM של ספטין אנושי כהה בגודל 25 ננומטר octamers_9i1 במאגר ספטין. סרגל קנה מידה = 200 ננומטר. (F) תמונה ממוצעת בכיתה של ספטין אנושי SEPT2-msfGFP octamers_9i1. תגי msfGFP נראים כצפיפויות מטושטשות בשני הקצוות. סרגל קנה מידה = 10 ננומטר. לוחות (E) ו-(F) הם זכויות היוצרים של חברת הביולוגים והותאמו מ-Iv et al.10 באישור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
בהתחשב בכך שגם ג'לים מקוריים וגם iSCAT מספקים מידע ממוצע בלבד, נעשה שימוש בממוצע הסיווג של תמונות מיקרוסקופיית אלקטרונים של אוליגומרים בודדים של ספטין יחיד כדי לבדוק את השלמות והטוהר של הקומפלקסים על ידי הדמיה ישירה. בתמונות TEM של מתחמי ספטין במאגר ספטין, ניתן לראות מוטות באורך של 24 ננומטר (הקסמרים) או 32 ננומטר (אוקטמרים). דוגמה של ספטין אוקטמר אנושי המכיל SEPT9_i1 ניתן לראות באיור 3E. כאשר הכיתה ממוצעת אותם, ניתן לצפות ולספור כל אחת מתת-היחידות, כפי שניתן לראות עבור האוקטמר האנושי המתויג על-ידי msfGFP עם SEPT9_i1 באיור 3F. במקרה שהאוליגומר מסומן באופן פלואורסצנטי, ניתן לראות צפיפויות נוספות המתאימות ל-SEPT2-msfGFP בקצה המוטות (איור 3F).
השילוב של הטכניקות הנ"ל מוכיח כי octamers (או hexamers) עם יחס סטויכיומטרי הנכון טוהר גבוה ניתן לטהר באמצעות הפרוטוקול המתואר. לבסוף, בדיקת בקרת האיכות האחרונה היא עבור הפונקציונליות של מתחמי ספטין במונחים של יכולת פילמור שלהם. בנוכחות ריכוז מלח נמוך (<150 mM KCl עם החיץהמתואר 9), אם ספטינים אינם בנוכחות חלבונים אחרים או ממברנות שומנים טעונות שלילית, הם מרכיבים את עצמם לתוך צרורות9. ספטינים מונעים פילמור על ידי שמירתם במאגר האחסון, בעל ריכוז KCl גבוה (300 mM). לאחר מכן מדוללים ההטרו-אוליגומרים של ספטין ביחס נפח של 1:6 במאגר של אותו הרכב אך ללא KCl כדי להשיג ריכוז KCl סופי של 50 mM. כדי לבצע הדמיה פלואורסצנטית, חיץ זה משלים עם מערכת נטרול חמצן כדי להגן מפני photowhiteaching ועם מדכא מהבהב. במיקרוסקופיית TIRF ניתן לראות צבירים קטנים של חלבונים בתוך שדה TIRF הרדוד (~100 ננומטר; איור 4A,B). במיקרוסקופ קונפוקלי ניתן לראות צבירים גדולים של מבנים נימה מרחפים גבוה יותר בתמיסה (איור 4C). לבסוף, באמצעות TEM, ניתן לראות צרורות קטנים של ספטין (איור 4D), המתאימים לאשכולות שנצפו על-ידי TIRF, וצרורות גדולים (איור 4E), המתאימים למבנים שנצפו על-ידי מיקרוסקופיה קונפוקלית. הסטים של איור 4D,E מגלים ששני סוגי המבנים מורכבים מחוטים ארוכים ודקים הפועלים במקביל ויוצרים צרורות עם קצוות מחודדים. יחד, תמונות הפלואורסצנציה וה- TEM מוכיחות כי קומפלקסי הספטין המטוהרים יכולים להתפלמר לחוטים, אשר בתורם מרכיבים את עצמם לצרורות.
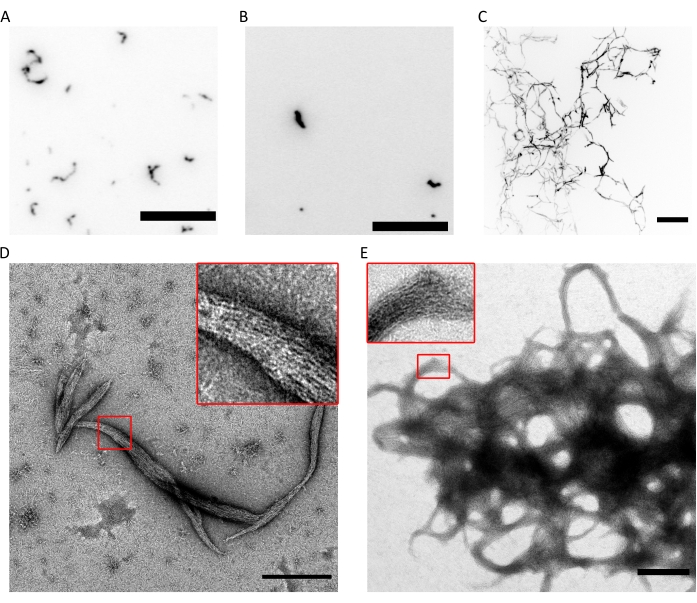
איור 4: דוגמאות לתוצאות של בקרת איכות יכולת הפימור. (A) תמונת TIRF של הקסמרים ספטין אנושיים בגודל 300 ננומטר (10% הקסמרים עם תווית msfGFP) ב-fluoSPB. (B) תמונת TIRF של אוקטמרים של ספטין אנושי בגודל 300 ננומטר המכילים SEPT9_i1 (10% octamers9_i1 עם תווית msfGFP) ב-fluoSPB. (C) הקרנות קונפוקליות בעוצמה מקסימלית של ערימות Z על פני ~30 מיקרומטר עם ריווח של 0.5 מיקרומטר של 300 ננומטר ספטין אנושי octamers_9i3 ב- fluoSPB. (א-ג) סרגל קנה מידה = 10 מיקרומטר וגווני אפור הפוכים. (ד,ה) תמונות TEM לדוגמה של (D) צרורות קטנים ו- (E) גדולים של ספטין אנושי octamers_9i1 ב- darkSPB. כניסות מציגות אזורים שבהם ניתן לראות חוטים שקופים הפועלים במקביל בתוך החבילה. סרגלי קנה מידה = 500 ננומטר. לוחות (C-E) הם זכויות יוצרים של חברת הביולוגים והותאמו מ- Iv et al.10 באישור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
טבלה 1: רשימת פלסמידים. פלסמידים לטיהור אוליגומרים ספטין בעקבות פרוטוקול זה. כל הפלסמידים הופקדו באדג'ין (עמודה ראשונה). אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: רשימת מאגרים. הרכבי חיץ המשמשים לטיהור ובקרת איכות של אוליגומרים ספטין. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: משקלים מולקולריים ומקדמי הכחדה. רשימת משקלים מולקולריים (MW) ומקדמי הכחדה אופטיים (ε) באורך גל של 280 ננומטר המחושבת באמצעות ProtParam בהתבסס על רצפי המרכבך, בהנחה של היתוך ליניארי של תת-יחידות ספטין, מתחמי ספטין השונים ותת-יחידות ספטין ייחודיות (MW בלבד) שניתן לטהר באמצעות הפלסמידים המפורטים בטבלה 1. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
השיטה המתוארת כאן מאפשרת טיהור חזק ובקרת איכות של הטרו-אוליגומרים של ספטין שנוצרו מראש. חלק מהנושאים המרכזיים שיש לקחת בחשבון ליישום הנכון של השיטה הם כדלקמן. במהלך שלבי האלוציה בהפרדות הכרומטוגרפיות, חשוב להשתמש בקצב הזרימה המומלץ (או הנמוך יותר) כדי למזער את הדילול של מתחמי המחיצות. בנוסף, כדי למקסם את התאוששות החלבון בשלב הריכוז הסופי, עמודת הריכוז מכוונת באופן כזה שהתמיסה לא נדחפת כנגד המסנן (כאשר יש רק מסנן בצד אחד). אם הפתרון הולך ישירות למסנן, החלבון נדבק אליו הרבה יותר, ומקטין באופן משמעותי את התשואה הסופית. כמו כן חשוב לקחת בחשבון כי צעד הריכוז לא תמיד הכרחי. בחירת שברים רק מטווח צר סביב השיא בכרומטוגרמה בדרך כלל נותנת ריכוז מלאי גבוה מספיק (>3,000 ננומטר) עבור יישומי שחזור רבים (הפועלים בדרך כלל בין 10-300 ננומטר). לבסוף, עבור בקרת איכות של הפונקציונליות של קומפלקסים septin על ידי מיקרוסקופיה פלואורסצנטית, חשוב להעביר כראוי את פני השטח של שקופיות מיקרוסקופיה, שכן מתחמי septin דבק בשקיקה זכוכית. פסיבציה של שקופיות הזכוכית יכולה להיעשות באמצעות פונקציונליזציה של PLL-PEG או על ידי היווצרות של דו-שכבתי שומנים נתמכים ניטרליים (100% DOPC)11,32.
בהשוואה לפרוטוקול הטיהור המקורי שתואר לראשונה ב- Iv et al.10, חל שינוי בהרכבי החיץ (טבלה 2). הריכוז של MgCl2 הופחת מ-5 mM ל-2mM, והריכוז וה-pH של Tris-HCl הופחתו מ-50 mM ל-20 mM ומ-8.0 ל-7.4, בהתאמה. שינויים אלה נעשו כדי להפוך את תנאי החיץ לתואמים למחקרים על יחסי הגומלין של ספטינים אנושיים עם דו-שכבתיות שומנים, חוטי אקטין ומיקרוטובולים10,11,32. הסיבה לכך היא שהמחברים יצרו דו-שכבתי שומנים נתמכים ואקטין פולימרי במאגר F, שהרכבו זהה לזה של darkSPB, מלבד נוכחות של ATP במאגר F. שינוי החיץ לא גרם לשינויים באיכות או באורך החיים של המחיצות המטוהרות בהשוואה למאגרים המקוריים.
שיטה זו של טיהור עדיין יש כמה מגבלות. ראשית, ניסיונות טיהור שונים יכולים להשתנות בתפוקה (0.5-1 מ"ל של מתחמי ספטין 2-5 מיקרומטר) ובאיכות הפונקציונלית, כפי שנבדק על ידי יכולת היווצרות הצרור של מתחמי ספטין מטוהרים. לכן חשוב מאוד לבצע בעקביות את בדיקות האיכות המתוארות במאמר זה. שליטה טובה מאוד בזמני הביטוי ובצפיפות האופטית של תרבית החיידקים יכולה לעזור למתן את ההבדל בתפוקה. שנית, צינור הטיהור הזה לא יכול להבחין בין גוזמים והקסמרים או בין טטרמרים לאוקטמרים (איור 1B). עם זאת, ניתן להשתמש בניסויי בקרת האיכות כדי להוכיח שרוב מתחמי הספטין הם בצורת אוליגומר ארוך שלהם. במקרה שנדרשת התפלגות גודל אוליגומר צרה עוד יותר, ניתן להכניס כרומטוגרפיה של אי הכללת גודל בין שלב 1.6. ושלב 1.7. של פרוטוקול הטיהור. עם זאת, צעד אופציונלי זה מקטין באופן דרמטי את התשואה, והוא אינו מומלץ אלא אם כן הוא נחוץ בהחלט. מגבלה אחרונה, בסיסית יותר, נובעת מהשימוש ב- E. coli כמערכת ביטוי למתחמי ספטין רקומביננטיים. מטבע הדברים, מערכת זו אינה מאפשרת שינויים לאחר תרגום (PTMs), אשר דווחו בתאי בעלי חיים, כגון זרחון, אצטילציה וסומוילציה 6,51,52,53. ניתן להוסיף שינויים פוסט-טרנסלציוניים אלה על ידי יישום אסטרטגיית טיהור דומה בתאי חרקים או בני אדם. יתר על כן, מאמר זה דן רק בשחזור של ספטינים בפני עצמם, אך מחקרים בתאים מצביעים על כך שלחלבונים רגולטוריים כגון חלבונים ממשפחת הבורג 54,55 ואנילין 24,25,56 יכולה להיות השפעה משמעותית אך לא מובנת היטב על ההרכבה והתפקודים של ספטינים, ולכן חשוב לשלב אותם בסופו של דבר במבחנה לימודים. פרוטוקולים לטיהור חלבוני בורג ואנילין דווחו54,57.
פרוטוקול טיהור המחיצות המדווח כאן מציע דרך סטנדרטית לטהר ספטינים בצורתם האוליגומרית עם הסטויכיומטריה הנכונה של תת-יחידות, ומציע התקדמות חשובה על פני מחקרים קודמים רבים במבחנה המסתמכים על יחידות משנה בודדות של ספטין. אף על פי שחלק מהמחיצות בהקשרים ספציפיים יכולות לפעול כתת-יחידה2 יחידה, גוף הספרות הנוכחי מציע כי בתאי בעלי חיים, ספטינים מתפקדים בעיקר בקומפלקסים 9,58. לכן, השימוש בהטרו-אוליגומרים שנוצרו מראש, כמו אלה המתוארים במאמר זה ואחרים 10,11,18,32,35,36,37, הוא בעל חשיבות רבה לחקר התכונות המבניות והביופיזיות של ספטינים באמצעות מבחנה reconstitution לנתח את הפונקציות שלהם בתא. יתר על כן, ספטינים הם חלבונים המרכיבים את עצמם עם שותפים רבים לאינטראקציה, כולל הממברנה והשלד הציטוסקולרי, מה שהופך אותם לבעלי עניין רב בביולוגיה סינתטית מלמטה למעלה 59,60,61 ומחקרים על שינויים הנגרמים על ידי חלבונים בתכונות הביופיזיות של הממברנה כגון עקמומיות42,62,63.
Disclosures
המחברים מצהירים על היעדר אינטרסים מתחרים או כלכליים.
Acknowledgements
אנו מודים לססיליה דה אגרלה פינטו, תומס דה גאראי וקתרינה האוסרמן על עזרתם בניסויי פוטומטריה המונית (iSCAT); ארג'ן יעקובי ו-וייל אוורס על עזרתם ב-TEM; לוצ'יה בלדוף על עזרתה ב-TIRF; פסקל ורדייה-פינארד על עצתו בנוגע לאלקטרופורזה מקומית; אגטה סובה ומרג'וליין וינקנוג על עזרתן בהקמת מאמצי טיהור ספטין דרוזופילה, והדמיית תאים ורקמות (PICT-IBiSA), מכון קירי, חבר בתשתית המחקר הלאומית הצרפתית צרפת-ביו-דימות (ANR10-INBS-04). מחקר זה קיבל מימון מהארגון ההולנדי למחקר מדעי (NWO/OCW) באמצעות מענק הכבידה 'BaSyC-Building a Synthetic Cell' (024.003.019) ומהסוכנות הלאומית למחקר (ANR מעניקה ANR-17-CE13-0014: "SEPTIMORF"; ANR-13-JSV8-0002-01: "ספטמבר"; ו ANR-20-CE11-0014-01: "SEPTSCORT").
Materials
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
References
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802(2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349(2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76(2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203(2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226(2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190(2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, Pt 3 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420(2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166(2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315(2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved