Method Article
Purificazione e controllo qualità di complessi di septina ricombinanti per la ricostituzione cellula-free
In questo articolo
Riepilogo
La ricostituzione in vitro delle proteine citoscheletriche è uno strumento vitale per comprendere le proprietà funzionali di base di queste proteine. Il presente articolo descrive un protocollo per purificare e valutare la qualità dei complessi di settina ricombinanti, che svolgono un ruolo centrale nella divisione e migrazione cellulare.
Abstract
Le settine sono una famiglia di proteine leganti GTP eucariotiche conservate che possono formare filamenti citoscheletrici e strutture di ordine superiore da complessi etero-oligomerici. Interagiscono con altri componenti citoscheletrici e la membrana cellulare per partecipare a importanti funzioni cellulari come la migrazione e la divisione cellulare. A causa della complessità delle numerose interazioni delle septine, del gran numero di geni della settina (13 nell'uomo) e della capacità delle settine di formare complessi etero-oligomerici con diverse composizioni di subunità, la ricostituzione senza cellule è una strategia vitale per comprendere le basi della biologia della septina. Il presente articolo descrive innanzitutto un metodo per purificare le settine ricombinanti nella loro forma etero-oligomerica utilizzando un approccio cromatografico di affinità in due fasi. Quindi, viene dettagliato il processo di controllo qualità utilizzato per verificare la purezza e l'integrità dei complessi di settina. Questo processo combina elettroforesi su gel nativa e denaturante, microscopia elettronica a colorazione negativa e microscopia a diffusione interferometrica. Infine, viene fornita una descrizione del processo per verificare la capacità di polimerizzazione dei complessi di settina mediante microscopia elettronica a colorazione negativa e microscopia fluorescente. Ciò dimostra che è possibile produrre esameri e ottameri di settina umana di alta qualità contenenti diverse isoforme di septin_9, nonché esameri di settina di Drosophila .
Introduzione
Il citoscheletro è stato classicamente descritto come un sistema a tre componenti costituito da filamenti di actina, microtubuli e filamenti intermedi 1, ma recentemente le settine sono state riconosciute come un quarto componente del citoscheletro1. Le septine sono una famiglia di proteine leganti GTP conservate negli eucarioti2. Le septine sono coinvolte in molte funzioni cellulari come la divisione cellulare3, l'adesione cellula-cellula4, la motilità cellulare5, la morfogenesi6, l'infezione cellulare7 e l'istituzione e il mantenimento della polarità cellulare8. Nonostante le loro importanti funzioni, il modo in cui le settine sono coinvolte in tali processi è poco compreso.
La famiglia di proteine della settina è suddivisa in diversi sottogruppi (quattro o sette, a seconda della classificazione) in base alla somiglianza della sequenza proteica2. I membri di diverse sottofamiglie possono formare complessi etero-oligomerici palindromi, che sono i mattoni dei filamenti e che, a loro volta, si assemblano in strutture di ordine superiore come fasci, anelli e meshworks 1,9,10,11,12. Un'ulteriore complessità molecolare deriva dalla presenza di diverse varianti di splicing, un esempio è SEPT9 umano, dove vi è evidenza di funzioni specifiche di diverse varianti di splicing13,14,15. Inoltre, la lunghezza degli etero-oligomeri dipende dalla specie e dal tipo di cellula. Ad esempio, le settine di Caenorhabditis elegans formano i tetrameri 16, le settine di Drosophila melanogaster formano gli esameri 17 (Figura 1A), le settine di Saccharomyces cerevisiae formano gli ottameri 18 e le settine umane formano sia gli esameri che gli ottameri19 (Figura 1A). La capacità delle isoforme di septina, delle varianti di splicing e delle settine modificate post-traduzionalmente della stessa sottofamiglia di sostituirsi a vicenda nel complesso e la (co-)esistenza di etero-oligomeri di dimensioni diverse hanno reso difficile delineare le funzioni cellulari di diversi complessi etero-oligomerici12.
Un'altra capacità interessante delle settine è la loro capacità di interagire con molti partner leganti nella cellula. Le settine legano la membrana plasmatica e gli organelli membranosi durante l'interfase e la divisione cellulare20,21,22. Nelle cellule in divisione, le settine cooperano con l'anillina 23,24,25 e l'actina e la miosina durante la citochinesi 26,27. Nelle ultime fasi della citochinesi, le settine sembrano regolare i complessi di selezione endosomica necessari per il sistema di trasporto (ESCRT) per l'abscissione del corpo medio28. Inoltre, ci sono anche prove di septina localizzata sulla corteccia di actina e sulle fibre di stress dell'actina delle cellule nelle cellule interfase 29,30,31. In specifici tipi cellulari, le settine legano e regolano anche il citoscheletro dei microtubuli32,33.
Tutte queste caratteristiche rendono le settine un sistema proteico molto interessante da studiare, ma anche impegnativo. La combinazione del gran numero di subunità della settina (13 geni nell'uomo senza contare le varianti di giunzione2) con il potenziale delle subunità della settina della stessa sottofamiglia di sostituirsi a vicenda e formare etero-oligomeri di dimensioni diverse rende difficile trarre una conclusione sulla funzione cellulare di una specifica settina mediante manipolazione genetica. Inoltre, le molteplici interazioni delle settine rendono difficile interpretare gli effetti di strumenti di ricerca comuni come i farmaci34 diretti ai componenti citoscheletrici o di membrana.
Un modo per superare questa situazione è quello di integrare la ricerca sulle cellule con la ricostituzione in vitro (cell-free) delle settine. La ricostituzione in vitro consente l'isolamento di un singolo tipo di etero-oligomeri della settina con una specifica composizione di subunità e lunghezza 18,35,36,37. Questo complesso può quindi essere studiato in un ambiente controllato, sia da solo per scoprire le proprietà strutturali e fisico-chimiche di base delle settine 38,39,40, sia in combinazione con partner desiderati come biomembrane modello 11,41,42, filamenti di actina 10,27 o microtubuli 32,36 per decifrare la natura della loro Interazioni.
Pertanto, un metodo affidabile per purificare in modo efficiente diversi complessi di septina è vitale per la ricerca sulla septina. Tuttavia, anche utilizzando lo stesso protocollo, purificazioni diverse possono dare proteine con diversa attività / funzionalità o addirittura integrità. Per le proteine disponibili in commercio come gli enzimi, la funzionalità e l'attività enzimatica sono accuratamente convalidate43. L'implementazione di un attento controllo di qualità per le proteine citoscheletriche o strutturali come le settine può essere difficile, ma è essenziale rendere comparabili gli esperimenti tra i laboratori.
Questo articolo descrive un metodo robusto per purificare settine ricombinanti di alta qualità nella loro forma etero-oligomerica basato sull'espressione simultanea di due vettori contenenti costrutti mono- o bi-cistronici (Tabella 1) in cellule di Escherichia coli. Il metodo consiste in un approccio cromatografico di affinità in due fasi per catturare etero-oligomeri di settina contenenti sia una settina con6 marcature che una settina marcata con Strep-II (Figura 1B,C). Questo protocollo, descritto per la prima volta in Iv et al.10, è stato usato per purificare gli esameri di settina di Drosophila 11,27,35, gli esameri di settina umana 10 e diversi ottameri di settina umana contenenti diverse isoforme native (isoforme 1, 3 e 5)10,32 o mutate SEPT9 32 . Inoltre, viene fornita una descrizione di una serie di tecniche per valutare la qualità delle settine purificate. In primo luogo, l'integrità e la corretta stechiometria delle subunità della settina vengono controllate utilizzando l'elettroforesi denaturante e la microscopia elettronica a trasmissione (TEM). Quindi, la presenza di etero-oligomeri della massa molecolare corretta e la presenza di monomeri o oligomeri più piccoli indicativi di instabilità complessa vengono esaminati mediante elettroforesi nativa e fotometria di massa tramite microscopia a diffusione interferometrica (iSCAT). Infine, l'ultimo step consiste nella valutazione dell'attività polimerizzante delle settine mediante microscopia a fluorescenza e TEM.
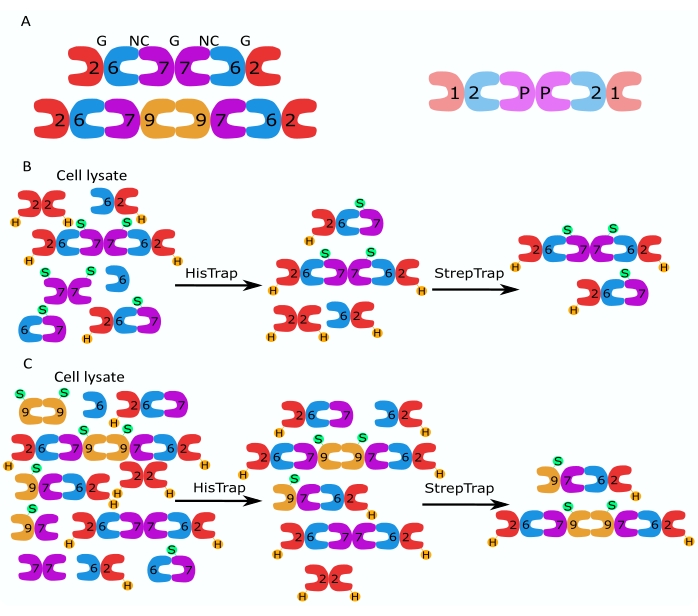
Figura 1: Strategia di purificazione. (A) Schemi degli etero-oligomeri della settina che esistono nelle cellule umane (a sinistra) e Drosophila (a destra). I numeri indicano le subunità settine dei gruppi indicati e P indica l'arachide. Il SEPT9 umano può essere una qualsiasi delle sue isoforme. Le subunità settine hanno una forma asimmetrica e sono associate longitudinalmente a due interfacce distinte, l'interfaccia NC:NC e G:G, come indicato rispettivamente da NC e G, sopra l'esamero umano. (B,C) Illustrazione schematica della strategia cromatografica a due fasi, mostrata per (B) esameri di settina umana e (C) ottameri. H indica i tag his, mentre S indica i tag Strep-II. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocollo
1. Purificazione degli etero-oligomeri della settina
- Co-trasformazione delle cellule batteriche con i vettori di espressione
- Selezionare una combinazione di un pnEA e un plasmide pnCS44 che verrà utilizzato per l'espressione. Scegliere la combinazione in base alla composizione della subunità desiderata dell'etero-oligomero della settina10,35 e se è necessaria o meno la marcatura fluorescente.
NOTA: qui viene utilizzata la supercartella monomerica con tag C GFP (msfGFP)-tagged SEPT2 (per septine umane) o msfGFP- o GFP monomerica potenziata (mEGFP)-DSep2 (per le settine di Drosophila ) (Tabella 1). - Pipettare 1 μL di ciascun plasmide (~1 ng/μL) in 100 μL di cellule competenti di BL21 Escherichia coli e incubare su ghiaccio per 20 minuti.
- Mettere le celle a bagnomaria a 42 °C per 40 s e poi incubarle immediatamente per 3 minuti su ghiaccio.
- Aggiungere 0,9 mL di terreno di brodo lisogenico (LB) alla sospensione cellulare e lasciare crescere le cellule per 1 ora a 37 °C. Piastra 100 μL di cellule su piastre calde di agar LB contenenti 100 μg/mL di ampicillina e 100 μg/mL di spectinomicina e incubare per una notte a 37 °C.
- Selezionare una combinazione di un pnEA e un plasmide pnCS44 che verrà utilizzato per l'espressione. Scegliere la combinazione in base alla composizione della subunità desiderata dell'etero-oligomero della settina10,35 e se è necessaria o meno la marcatura fluorescente.
- Coltiva la pre-coltura batterica
- Riempire un matraccio Erlenmeyer da 250 mL con 100 mL di brodo Terrific (TB) o terreno LB contenente 100 μg/mL di ampicillina e 100 μg/mL di spectinomicina.
- Prelevare una singola colonia dalla piastra LB-agar con un ciclo di inoculazione sterile e trasferirla su terreni freschi dal punto 1.2.1.
- Incubare a 37 °C in un incubatore a scuotitore rotante, durante la notte o per almeno 6 ore.
NOTA: Da questa coltura, uno stock di glicerolo può essere preparato mescolando la sospensione batterica 1:1 con glicerolo e conservato a -80 °C. Questo stock può essere utilizzato nella fase 1.2.2. invece di una colonia appena trasformata.
- Coltura batterica e induzione dell'espressione proteica
- Trasferire 100 ml di batteri cresciuti in 5 L di TB o LB contenenti 50 μg/mL di ampicillina e 50 μg/mL di spectinomicina.
- Coltivare questa coltura a 37 °C in un incubatore shaker fino a raggiungere una densità ottica (OD) misurata a una lunghezza d'onda di 600 nm nell'intervallo 2-3 per le settine non marcate o 0,6-0,8 per le settine marcate con msfGFP / mEGFP e indurre l'espressione proteica aggiungendo una concentrazione finale di 0,5 mM IPTG. L'OD inferiore per le settine marcate è quello di evitare di raggiungere la fase di morte nel loro tempo di espressione più lungo, come dettagliato nel passaggio successivo.
- Incubare le cellule che esprimono etero-oligomeri di settina non marcati per 3 ore a 37 °C o le cellule che esprimono etero-oligomeri marcati con msfGFP per una notte a 17 °C.
NOTA: Il breve tempo di espressione proteica per i complessi non marcati, facilitato dall'uso del mezzo TB più ricco, è scelto per prevenire la degradazione delle proteine. Il tempo di espressione più lungo combinato con la temperatura più bassa per i complessi etichettati viene scelto per consentire il corretto piegamento del tag msfGFP.
- Lisi batterica e chiarificazione del lisato
NOTA: Da questo punto in poi nella procedura di purificazione, mantenere la soluzione contenente proteine su ghiaccio o a 4 °C in ogni momento per prevenire la degradazione proteolitica delle proteine o la perdita di attività.- Raccogliere le cellule coltivate centrifugando a 4.000 x g per 20 minuti a 4 °C. Scartare il surnatante.
- Facoltativamente, congelare il pellet in questa fase e conservare a -80 °C per un massimo di 6 mesi. Se si sceglie questa opzione, assicurarsi di scongelare il pellet sul ghiaccio prima di continuare.
- Sciogliere il pellet in 100 ml di tampone di lisi (Tabella 2) e lisare le cellule. Scegli una delle due opzioni seguenti
- Sonicare in 7 cicli di 30 s ON e 59 s OFF con un sonicatore di punta utilizzando il 30% di ampiezza (notare che le impostazioni dipendono dal sonicatore).
- Abbattere le celle nella stampa francese passandole almeno 3x.
- Chiarire il lisato cellulare centrifugando a 20.000 x g per 30 minuti a 4 °C e mantenere il surnatante. Si consiglia di iniziare con il passaggio 1.5.1. durante questa fase centrifuga.
- Facoltativamente, prelevare un campione per l'elettroforesi denaturante, come descritto nella sezione 2.
- Raccogliere le cellule coltivate centrifugando a 4.000 x g per 20 minuti a 4 °C. Scartare il surnatante.
- Cromatografia di affinità per proteine marcate con His.
NOTA: Questa fase produce complessi contenenti SEPT2 umano o Drosophila Sep1 utilizzando una colonna di nichel (Figura 1B).- Equilibrare una colonna cromatografica ad alte prestazioni di solfosio di nichel preconfezionata con tampone di settina (Tabella 2).
- Caricare il surnatante chiarificato sulla colonna a 1 ml/min e lavare la proteina legata con almeno tre volumi di tampone septino.
- Eluire i complessi di septina con tampone di eluizione HisTrap al 50% (Tabella 2) a 1 mL/min raccogliendo frazioni da 0,5 mL per ottenere una concentrazione di imidazolo di 250 mM.
- Prelevare le frazioni contenenti complessi di setti, come indicato dall'assorbanza ottica dell'eluato a 280 nm monitorata online con un sistema di cromatografia liquida proteica veloce (FPLC) o dopo la purificazione con uno spettrofotometro a microvolume.
NOTA: L'imidazolo assorbe la luce a 280 nm. Questo probabilmente spiega perché il picco proteico non torna all'assorbanza zero dopo l'eluizione della settina (Figura 2A).
- Cromatografia di affinità per proteine marcate con Strep-II
NOTA: Questo passaggio produce complessi contenenti SEPT7 umano (esameri), SEPT9 umano (ottameri) o arachidi Drosophila utilizzando una colonna Strep-Tactin (Figura 1B). La colonna cromatografica si basa su un sistema modificato biotina-streptavidina. La proteina è etichettata con biotina modificata (Strep-II-tag), e la colonna contiene una streptavidina ingegnerizzata (Strep-Tactin). Nonostante sia stato modificato dal sistema biotina-streptavidina, non vi è alcuna interferenza tra il sistema Strep-Tactin-Strep-II-tag e il sistema biotina-streptavidina. Il sistema descritto viene utilizzato per evitare interferenze con i saggi di ricostituzione utilizzando biotina e streptavidina.- Equilibrare una colonna cromatografica ad alte prestazioni di seffatosio StrepTactin preconfezionata con tampone di settina (Tabella 2). Caricare le frazioni contenenti sseptina recuperate dalla colonna di nichel a 1 mL/min e lavare la proteina legata con almeno tre volumi di colonna di tampone septina.
- Eluire i complessi di septina con tampone di eluizione StrepTrap al 100% (Tabella 2) a 1 mL/min raccogliendo frazioni da 0,5 mL per ottenere una concentrazione di 2,5 mM di destiobiotina.
NOTA: La destiobiotina nel tampone di eluizione StrepTrap deve essere sciolta fresca. - Prelevare le frazioni contenenti complessi di septina, come indicato dall'assorbanza ottica dell'eluato a 280 nm monitorata online con un sistema FPLC o dopo la purificazione con uno spettrofotometro a microvolume.
NOTA: L'elettroforesi denaturante viene solitamente eseguita a questo punto con campioni dei lavaggi delle colonne e delle frazioni di settino. L'ordine delle colonne può essere invertito con risultati indistinguibili, cioè il lisato chiarificato dopo il passaggio 1.4. può essere sottoposto a cromatografia di affinità Strep-Tactin seguita da cromatografia di affinità di nichel.
- Dialisi e conservazione
- Per rimuovere la destiobiotina dalla soluzione di conservazione finale, dializzare i complessi di settina in un rapporto di volume campione-tampone ~1:300 contro tampone di settina (Tabella 2) integrato con 1 mM DTT durante la notte, o per almeno 4 ore, a 4 °C utilizzando una membrana di dialisi MWCO da 30 kDa.
- Opzionalmente, concentrare le settine utilizzando una colonna centrifuga di concentrazione MWCO da 30 kDa fino alla concentrazione desiderata. Puntare a una concentrazione di 5-7 μM, misurata tramite l'assorbanza ottica della soluzione a 280 nm e utilizzando un coefficiente di estinzione teorico calcolato tramite ProtParam (Tabella 3).
- Aliquotare i complessi proteici nella dimensione aliquota desiderata, congelare l'aliquota e conservarla a -80 °C.
NOTA: Si raccomanda di non conservare la proteina per più di 6 mesi. Inoltre, si raccomanda di eseguire regolari esperimenti di controllo della qualità, soprattutto se la proteina viene conservata più a lungo del tempo raccomandato.
2. Controllo di qualità della purezza e dell'integrità dell'etero-oligomero della settina
NOTA: Il controllo di qualità degli etero-oligomeri consiste in un insieme di tecniche biochimiche e di imaging che consentono di rilevare la massa e l'integrità dei complessi settonici presenti nella soluzione.
- Elettroforesi denaturante per verificare la formazione dell'etero-oligomero della settina con i componenti corretti
- Miscelare 10 μL delle frazioni selezionate con 10 μL di 2x tampone campione SDS, caricarli su un gel TGX prefabbricato al 4%-15% e riempire il sistema con tampone Tris/glicina/SDS.
- Eseguire l'elettroforesi per 35 minuti a 200 V e colorare il gel (Tabella dei materiali) per visualizzare i risultati. I pesi molecolari delle singole proteine della settina e dei complessi etero-oligomerici della settina possono essere trovati nella Tabella 3.
- Misurare l'intensità relativa di ciascuna banda all'interno di ogni corsia contenente settine purificate in un'immagine invertita a contrasto. A tale scopo, calcola l'intensità media di rettangoli di dimensioni uguali attorno a ciascuna banda e di un rettangolo di dimensioni uguali su una regione senza alcuna banda nella stessa corsia. Quindi, normalizzare i valori dividendo l'intensità di ciascuna banda per l'intensità della regione senza bande.
NOTA: se l'intensità è satura (ad esempio, valori di 255 per un'immagine a 8 bit su un'immagine con contrasto invertito), saltare la corsia.
- Distribuzione dimensionale nativa media dell'ensemble tramite elettroforesi nativa
- Preparare 800 mL di tampone anodico e 200 mL di tampone catodico azzurro il giorno prima e conservarli in frigorifero. Per preparare il tampone anodico, diluire 40 ml di tampone corrente 20x con 760 ml di acqua deionizzata di tipo I (I-acqua). Per preparare il tampone catodico azzurro, diluire 10 ml di tampone corrente 20x e 1 mL di additivo catodico 20x con 189 mL di I-acqua. Il tampone di scorrimento e l'additivo catodico vengono forniti con un kit (Table of Materials).
- Preparare 10 μL del campione mescolando ~500 ng di septina con la quantità necessaria di tampone del campione (2,5 μL in questo caso, a causa dell'uso di un tampone campione 4x; vedere Tabella dei materiali) e abbastanza I-acqua per raggiungere un volume di 10 μL.
- Caricare i campioni sul gel e riempire il sistema con l'anodo ghiacciato e i tamponi catodici.
- Eseguire l'elettroforesi per circa 115 minuti a 150 V con un alimentatore che non si ferma alle basse correnti e colora il gel (Table of Materials) per visualizzare i risultati. I pesi molecolari delle singole proteine e complessi calcolati in base alla sequenza possono essere trovati nella Tabella 3.
- Distribuzione di massa a singola molecola mediante fotometria di massa mediante microscopia a diffusione interferometrica
- Lavare i vetrini #1.5 sonicandoli in un pulitore ad ultrasuoni per 5 minuti in I-water, 5 min in isopropanolo e, infine, 5 min in I-water.
- Asciugare due vetrini con un leggero getto di azoto gassoso e posizionare una goccia di 7 μL di soluzione di poli-L-lisina (PLL) allo 0,01% al centro di uno dei vetrini. Quindi, posizionare il centro dell'altra diapositiva sopra la goccia PLL, orientando le due diapositive ortogonalmente per una facile separazione. Incubare per 30 s.
- Lavare immergendo in un becher con I-water 1x e applicando direttamente un getto di I-water 2x. Quindi, asciugare i due vetrini con un flusso di azoto gassoso. Questi vetrini possono essere conservati successivamente per circa 6 settimane a temperatura ambiente in condizioni asciutte.
NOTA: etichettare il lato della diapositiva trattato con il PLL per eseguire correttamente l'esperimento.
- Lavare immergendo in un becher con I-water 1x e applicando direttamente un getto di I-water 2x. Quindi, asciugare i due vetrini con un flusso di azoto gassoso. Questi vetrini possono essere conservati successivamente per circa 6 settimane a temperatura ambiente in condizioni asciutte.
- Poco prima dell'esperimento, tagliare un pezzo di guarnizioni 2 x 2, 3 x 2 o 3 x 3 (che producono rispettivamente 4, 6 o 9 camere di imaging / vetrino) e incollarlo sulla parte trattata con PLL di un vetrino evitando che il vetrino e le guarnizioni entrino in contatto con qualsiasi superficie sporca. Posizionare la slitta su un tergicristallo leggero e premere sulle guarnizioni con una punta di pipetta per attaccarle con la plastica protettiva ancora sulle guarnizioni.
- Riscaldare il tampone di settina (Tabella 2) a temperatura ambiente e scongelare le proteine in mano (tenerle in ghiaccio in seguito).
NOTA: iSCAT mostra il segnale di alcuni detergenti e piccole molecole che assomigliano a segnali proteici45. Il DTT è una di quelle piccole molecole, ed è per questo che non viene utilizzato per questo esperimento. C'è solo una traccia di DTT proveniente dalla settina immagazzinata. - Posizionare il vetrino con le guarnizioni sul sistema di fotometria di massa commerciale contenente 19 μL di tampone septino e focalizzare il microscopio utilizzando l'opzione di messa a fuoco automatica. Seguire le istruzioni del produttore per verificare se la messa a fuoco trovata è corretta. Qui viene utilizzato l'obiettivo 100x standard che fa parte della configurazione.
- Creare o caricare una cartella di progetto per archiviare i dati utilizzando File > Nuovo progetto o File > Carica progetto.
- Pipettare 1 μL di campione sui 19 μL di goccia tampone septina (fase 2.3.5) utilizzata per mettere a fuoco e miscelare riducendo al minimo il movimento del vetrino senza toccare nulla durante l'operazione. Quindi, registra un video di 6.000 fotogrammi facendo clic su Registra.
- Per una corretta analisi, registrare i seguenti campioni: tampone di settina, standard di massa proteica per la calibrazione del rapporto segnale-massa (se è disponibile una taratura recente e le condizioni ambientali non sono cambiate, questo campione può essere saltato) e 250 nM di complessi di septina diluiti in tampone di settina senza DTT (questo dà una concentrazione finale di ~ 12,5 nM).
- Analizza i video utilizzando il software del produttore per ottenere la distribuzione della massa proteica. Verificare la presenza di dati di buona qualità come segue.
- Se i picchi di diverse dimensioni degli etero-oligomeri della settina si sovrappongono troppo o vengono rilevati troppi eventi (> 3.500 eventi per un video di 6.000 fotogrammi con il campo visivo regolare di 128 pixel x 34 pixel che copre 10,8 μm x 2,9 μm), diminuire la concentrazione finale di septina e misurare nuovamente.
- Se non ci sono abbastanza conteggi di singole molecole misurate (almeno 2.500-3.500 per un video di 6.000 fotogrammi con il campo visivo regolare), aumentare la concentrazione di septina e misurare di nuovo.
- Imaging diretto di complessi di septina tramite microscopia elettronica a trasmissione a macchia negativa
- Diluire i campioni ad una concentrazione di circa 50 nM in tampone di settina e preparare la soluzione colorante (formiato di uranile al 2% o acetato di uranile in I-acqua).
NOTA: Il formiato di uranile deve essere preparato fresco. - Pipettare 4 μL di settine diluite su una griglia di microscopia elettronica scarica a bagliore e incubare per 30 s.
- Rimuovere la maggior parte della soluzione proteica usando una carta da filtro e lavare la griglia 2x con tampone di settina e 1x con I-water per rimuovere le settine adsorbite liberamente.
- Colorare con acetato di uranile al 2% o soluzione di formiato di uranile in I-acqua per 1 minuto, assorbire la soluzione colorante con una carta da filtro e asciugare all'aria la griglia per alcuni minuti.
- Scherma la griglia utilizzando un microscopio elettronico a trasmissione correttamente allineato per cercare le regioni di colorazione migliorata e raccogliere circa 100 immagini all'interno di queste aree selezionate.
- Raccogli immagini con un ingrandimento di almeno 50.000x per ottenere una dimensione dei pixel di circa 2 Å/pixel e con una sfocatura variabile da -1 μm a -2 μm. Utilizzare una tensione di accelerazione di 200 kV. Preferibilmente, utilizzare una procedura automatizzata per raccogliere i dati, che dipenderà dal software di acquisizione disponibile.
- Esegui l'elaborazione delle immagini 2D utilizzando un software dedicato
- Inscatolare almeno 2.000 particelle utilizzando un software dedicato46.
- Eseguire l'allineamento bidimensionale e la classificazione in modo iterativo fino a ottenere le classi senza ulteriori miglioramenti. La prima fase di allineamento e classificazione dovrebbe essere priva di riferimenti per evitare qualsiasi distorsione nella classificazione.
- Utilizzare le medie ottenute dalla prima classificazione senza riferimenti come nuovi riferimenti per effettuare un ulteriore ciclo di classificazione. Ripetere questo processo in modo iterativo fino a quando non si ottengono ulteriori miglioramenti. Assicurati che ogni classe sia basata su 50-100 particelle scelte e che le singole subunità siano chiaramente visibili. È possibile utilizzare diversi strumenti software (Spider, Eman o Relion)46,47,48.
- Diluire i campioni ad una concentrazione di circa 50 nM in tampone di settina e preparare la soluzione colorante (formiato di uranile al 2% o acetato di uranile in I-acqua).
3. Controllo di qualità funzionale della septina tramite analisi di polimerizzazione
NOTA: Il controllo di qualità della funzionalità consiste in un insieme di tecniche di imaging che consentono il rilevamento di complessi di settina polimerizzata. Di seguito, le settine non etichettate sono indicate come settine "scure" e il tampone utilizzato per polimerizzare le settine non marcate è indicato come tampone di polimerizzazione della settina "scura" (SPB).
- Imaging del fascio di settina tramite microscopia a fluorescenza
- Preparare il fluoSPB 5x (Tabella 2) e una miscela di settina composta da settina scura al 90% e settina msfGFP al 10% a una concentrazione sei volte superiore rispetto alla concentrazione finale desiderata in tampone settino + 1 mM DTT. Una concentrazione tipica per questo test è 300 nM e, pertanto, la concentrazione è 1.800 nM per questa miscela.
- Polimerizzare la settina mescolando, in questo ordine specifico, I-acqua (sufficiente per rabboccare fino al volume finale desiderato), 20% 5xfluoSPB (una diluizione finale di 1:5), 0,05 μM PCD e 16,67% settina mix (una diluizione finale di 1:6). Per 10 μL, mescolare 6,23 μL di I-acqua, 2 μL di 5xfluoSPB, 0,1 μL di PCD (con uno stock di 5 μM) e 1,67 μL di miscela di settini. Incubare questa miscela per almeno 30 minuti a temperatura ambiente.
- Aggiungere i campioni in una camera di imaging lavata con fluoSPB (Tabella 2) e visualizzare i fasci di settini. I canali di flusso passivati PLL-PEG, come descritto nella precedente ricerca10,32, funzionano bene per questo esperimento.
- Imaging del fascio di septina tramite microscopia elettronica a trasmissione di macchie negative
- Preparare il darkSPB 5x (Tabella 2) e una miscela di settini composta da settina scura al 100% a una concentrazione sei volte superiore rispetto alla concentrazione finale desiderata in tampone septina + 1 mM DTT. Una concentrazione tipica per questo test è 300 nM e, pertanto, la concentrazione è 1.800 nM per questa miscela.
- Polimerizzare i complessi di septina mescolando, in questo ordine specifico, I-acqua (sufficiente per rabboccare fino al volume finale desiderato), 20% 5xdarkSPB e 16,67% settina miscela. Per 5 μL, mescolare 3,16 μL di I-water, 1 μL di 5x darkSPB e 0,83 μL di mix di settina. Incubare questa miscela per almeno 30 minuti a temperatura ambiente.
- Aggiungere 3-5 μL di campione a una griglia di microscopia elettronica scarica a bagliore e incubare per 1 minuto. Quindi, lavare la griglia 2x con darkSPB (Tabella 2) assorbendo il liquido con una carta da filtro e aggiungendo una goccia di tampone darkSPB, lavare 1x con I-water, incubare per ~ 30 s con acetato di uranile al 2%, asciugare la macchia e asciugare all'aria il campione per alcuni minuti.
- Immagina i fasci di septina a 120 kV e ingrandimenti tra 5.000x e 60.000x con una sfocatura compresa tra 1-2 μm.
Risultati
Come menzionato nel protocollo, sono stati coltivati 5 L di cellule di E. coli co-trasformate con i due plasmidi che esprimono la septina e l'espressione delle settine è stata indotta aggiungendo IPTG. Dopo 3 ore, le cellule sono state raccolte mediante centrifugazione, risospese in tampone di lisi e lisate mediante sonicazione. Il lisato è stato quindi chiarificato mediante centrifugazione e la soluzione chiarificata è stata applicata a una colonna HisTrap (Figura 2A). Dopo la prima purificazione, le frazioni contenenti setti sono state raggruppate e applicate su una colonna StrepTrap (Figura 2B). Questo produce in genere circa 3-5 ml di ~ 1 μM complesso di septina. Prima di raggruppare le frazioni contenenti settina, è possibile utilizzare l'elettroforesi su gel di denaturazione per verificare l'integrità delle subunità della settina e il rapporto stechiometrico equimolare tra le diverse subunità della settina che formano il complesso. (Figura 3A). Se il gel mostra bande altrettanto intense corrispondenti ai pesi molecolari (Tabella 3) delle subunità della settina, il protocollo può essere continuato. In caso contrario, si consiglia di riavviare il protocollo. Nell'esempio mostrato per l'ottamero della settina umana con SEPT9_i1, la Figura 3A mostra chiaramente le bande corrispondenti a SEPT9_i1, SEPT6, SEPT7 e SEPT2 (nell'ordine dall'alto verso il basso) con intensità simili; l'intervallo di confidenza al 99% dell'intensità normalizzata era 1,128 ± 0,048 per SEPT2, 1,092 ± 0,034 per SEPT6, 1,108 ± 0,040 per SEPT7 e 1,067 ± 0,029 per SEPT9. Se SEPT2 è etichettato con msfGFP, si sposterà molto vicino al di sotto di SEPT9_i1. A seconda del sistema di elettroforesi utilizzato e della presenza del tag TEV-Strep C-terminale per SEPT7 (che lo fa migrare più lentamente rispetto a SEPT7 senza tag), le bande SEPT7 e SEPT6 a volte si fondono a causa dei loro pesi molecolari comparabili. Il prossimo passo è quello di raggruppare le frazioni e dializzarle contro il tampone di septina con DTT. Dopo la dialisi, se la concentrazione è troppo bassa (<2 μM) o è necessaria una concentrazione più alta per gli esperimenti, è possibile includere una fase di concentrazione, come descritto nel protocollo. Concentrazioni inferiori a 1 μM di solito indicano una cattiva qualità funzionale delle settine. Una concentrazione finale del complesso di settina tra 3,5 μM e 7 μM funziona bene per la maggior parte dei test in vitro . Queste concentrazioni si ottengono solitamente quando il volume dopo la concentrazione raggiunge 0,5-1 ml.
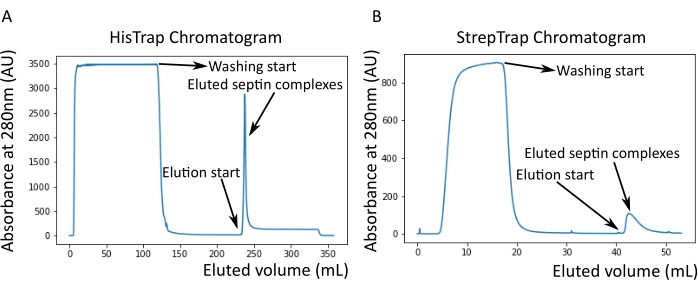
Figura 2: Esempio di cromatogrammi corrispondenti alla purificazione della settina umana scura octamers_9i1 . (A) Cromatogramma della colonna HisTrap. Dopo il picco di eluizione della settina, l'assorbanza non torna a zero, probabilmente a causa della presenza di imidazolo nel tampone. La frazione aggregata è andata dall'inizio del picco di eluizione fino a quando l'assorbanza si è stabilizzata a circa 250 ml. (B) Cromatogramma della colonna StrepTrap. La frazione aggregata è andata dall'inizio del picco di eluizione fino a quando l'assorbanza è tornata a circa 0 a 50 ml. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Per continuare con il controllo di qualità, è stata eseguita l'elettroforesi nativa, come descritto nel protocollo (Figura 3B). Nei gel si può osservare una banda maggiore corrispondente agli etero-oligomeri intatti e, di solito, una banda minore corrispondente ai dimeri. Gli esameri umani si trovano un po' al di sopra della banda marcatrice di 242 kDa, mentre gli ottameri si trovano al di sopra della banda di 480 kDa, al di sopra della loro massa molecolare calcolata. La posizione di queste bande è stata verificata mediante analisi western blot di estratti di cellule eucariotiche32. Il tagging con msfGFP accoppia ogni SEPT2 con una proteina msfGFP. Ciò provoca un aumento del peso molecolare dei complessi di septina di 53,4 kDa (molecola 26,7 kDa/msGFP). Tuttavia, sul gel di elettroforesi nativo, il peso molecolare apparente dei complessi marcati con msfGFP è indistinguibile da quello dei complessi non marcati.
Una tecnica complementare per verificare se i complessi della settina sono intatti è la fotometria di massa mediante microscopia iSCAT. iSCAT monitora la diffusione della luce delle molecole che atterrano su un vetrino amplificato dall'interferenza con la luce di riferimento, tipicamente la riflessione del laser sul fondo del vetrino. Quindi, viene utilizzato un approccio di sottrazione di sfondo per dare contrasto alle particelle. A causa di questa correzione, il segnale mostra valori positivi e negativi a seconda che le particelle atterrino sul vetro o si allontanino da esso49. Il segnale rilevato è direttamente proporzionale al peso molecolare delle proteine50. Pertanto, una calibrazione segnale-massa con uno standard di massa può determinare la massa delle proteine campione. La figura 3C mostra un esempio di ottameri di settina umana contenenti SEPT9_i1. La maggior parte delle singole particelle rilevate (~ 50%) hanno un peso molecolare atteso per ottameri completi contenenti SEPT9_i1 (423 kDa) (Figura 3C). Ci sono anche particelle con masse comprese tra 150-300 kDa, ma non si osserva un picco chiaro, indicando la possibile presenza di altre specie di settini in bassa abbondanza. Allo stesso modo, la maggior parte delle singole particelle rilevate per gli esameri di Drosophila marcati con mEGFP hanno un peso molecolare atteso per gli esameri intatti (361 kDa) (Figura 3D). Un ulteriore picco chiaro a 241 kDa indica la presenza di tetrameri stabili contenenti due proteine di arachidi, una DSep1 e una mEGFP-DSep2. Infine, sia il complesso della settina umana che quello della mosca mostrano un picco intorno agli 80 kDa che potrebbe essere un mix di monomeri e dimeri, possibilmente amplificato da una traccia di DTT o qualsiasi altra piccola molecola che si aggrega, mostrando un picco nel lato positivo del grafico45.
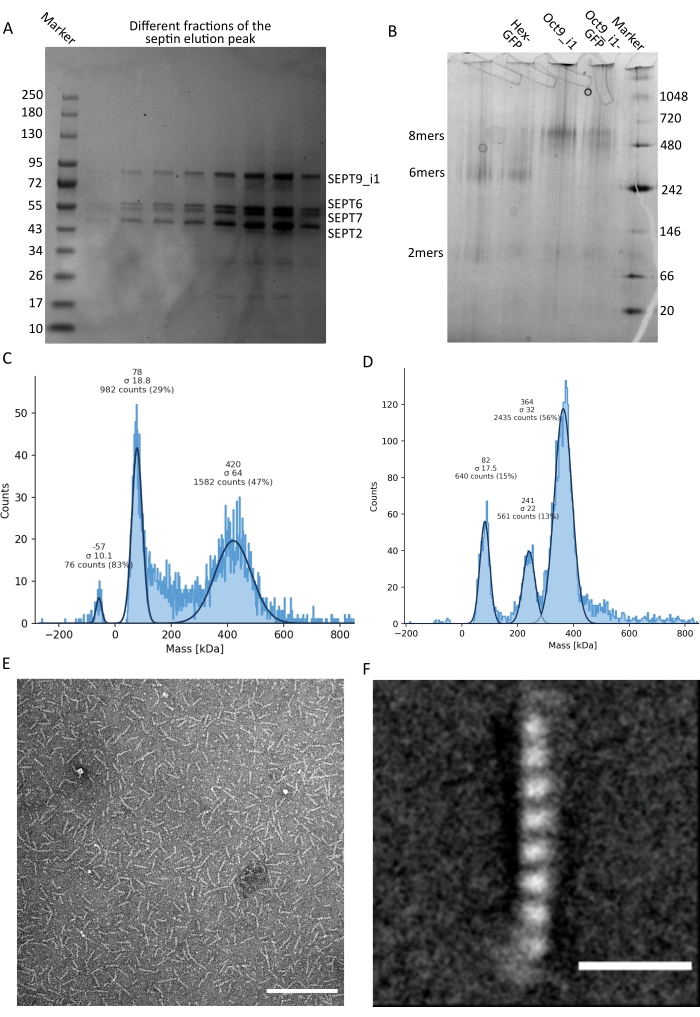
Figura 3: Esempi di risultati del controllo di qualità dell'oligomero . (A) Esempio di gel denaturante che mostra diverse frazioni del picco di eluizione dalla purificazione della settina umana scura octamers_9i1. (B) Esempio di elettroforesi nativa di diversi complessi di settini. (C,D) Diversi esempi di risultati dell'istogramma della fotometria di massa a 12,5 nM di complessi di septina: (C) settino umano scuro octamers_9i1 e (D) DSep1-msfGFP Drosophila septin hexamers. Le linee sono gaussiane fits. (E) Immagine TEM di 25 nM di settino umano scuro octamers_9i1 in tampone di settini. Barra di scala = 200 nm. (F) Immagine media della classe della settina umana SEPT2-msfGFP octamers_9i1. I tag msfGFP sono visibili come densità sfocate alle due estremità. Barra di scala = 10 nm. I pannelli (E) e (F) sono copyright di The Company of Biologists e sono stati adattati da Iv et al.10 con il permesso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Dato che sia i gel nativi che l'iSCAT forniscono solo informazioni mediate dall'insieme, è stata utilizzata la media di classe delle immagini di microscopia elettronica a trasmissione di singoli oligomeri di settina per verificare l'integrità e la purezza dei complessi mediante visualizzazione diretta. Nelle immagini TEM di complessi di septina in tampone settinico, si possono osservare bastoncelli di 24 nm (esameri) o 32 nm (ottameri) di lunghezza. Un esempio di ottamero di settina umano contenente SEPT9_i1 può essere visto nella Figura 3E. Quando si calcola la media delle classi, ciascuna delle subunità può essere osservata e contata, come si vede per l'ottamero umano marcato con msfGFP con SEPT9_i1 nella Figura 3F. Nel caso in cui l'oligomero sia marcato in modo fluorescente, si possono osservare densità extra che corrispondono al SEPT2-msfGFP all'estremità delle aste (Figura 3F).
La combinazione delle tecniche di cui sopra dimostra che gli ottameri (o esameri) con il corretto rapporto stechiometrico e l'elevata purezza possono essere purificati utilizzando il protocollo descritto. Infine, l'ultimo controllo di qualità riguarda la funzionalità dei complessi di settino in termini di capacità di polimerizzazione. In presenza di bassa concentrazione salina (<150 mM KCl con il tampone descritto 9), se le settine non sono in presenza di altre proteine o membrane lipidiche caricate negativamente, si auto-assemblano in fasci9. Le settine vengono impedite dalla polimerizzazione mantenendoli nel tampone di stoccaggio, che ha un'alta concentrazione (300 mM) di KCl. Gli etero-oligomeri della settina vengono quindi diluiti in volume 1:6 in un tampone della stessa composizione ma senza KCl per ottenere una concentrazione finale di KCl di 50 mM. Per eseguire l'imaging a fluorescenza, questo tampone è completato da un sistema di evacuazione dell'ossigeno per proteggere dal fotosbiancamento e da un soppressore lampeggiante. Nella microscopia TIRF, piccoli gruppi di proteine possono essere osservati all'interno del campo TIRF poco profondo (~100 nm; Figura 4A,B). Su un microscopio confocale, grandi gruppi di strutture filamentose possono essere visti fluttuare più in alto nella soluzione (Figura 4C). Infine, con TEM, si possono osservare piccoli fasci di settina (Figura 4D), corrispondenti ai cluster osservati dal TIRF, e grandi fasci (Figura 4E), corrispondenti alle strutture osservate al microscopio confocale. Gli inserti della Figura 4D,E rivelano che entrambi i tipi di strutture sono costituiti da filamenti lunghi e sottili che corrono in parallelo, formando fasci con estremità affusolate. Insieme, le immagini di fluorescenza e TEM dimostrano che i complessi di settina purificati possono polimerizzare in filamenti, che a loro volta si auto-assemblano in fasci.
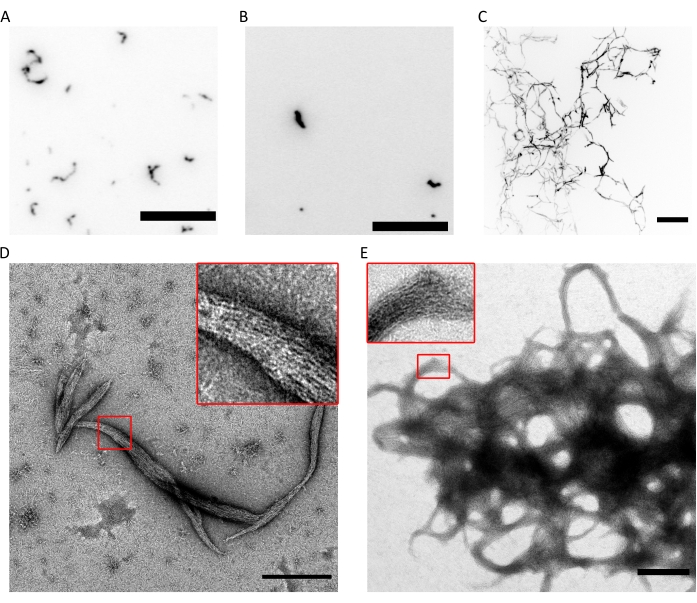
Figura 4: Esempi di risultati del controllo qualità della capacità di polimerizzazione. (A) Immagine TIRF di 300 esameri di settina umana (esameri marcati con msfGFP al 10%) in fluoSPB. (B) Immagine TIRF di 300 ottameri settini umani nM contenenti SEPT9_i1 (10% msfGFP-labelled octamers9_i1) in fluoSPB. (C) Proiezioni confocali di massima intensità di Z-stack su ~30 μm con 0,5 μm di spaziatura di 300 nM di septina umana octamers_9i3 in fluoSPB. (A-C) Barra della scala = 10 μm e scala di grigi invertita. (D,E) Esempio di immagini TEM di (D) piccoli e (E) grandi fasci di settina umana octamers_9i1 in darkSPB. Gli inserti mostrano le regioni in cui è possibile osservare filamenti chiari che corrono paralleli all'interno del fascio. Barre della scala = 500 nm. I pannelli (C-E) sono copyright di The Company of Biologists e sono stati adattati da Iv et al.10 con il permesso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Elenco dei plasmidi. Plasmidi per purificare gli oligomeri della settina seguendo questo protocollo. Tutti i plasmidi sono stati depositati in Addgene (prima colonna). Clicca qui per scaricare questa tabella.
Tabella 2: Elenco dei buffer. Composizioni tampone utilizzate per la purificazione e il controllo di qualità degli oligomeri della settina. Clicca qui per scaricare questa tabella.
Tabella 3: Pesi molecolari e coefficienti di estinzione. Elenco dei pesi molecolari (MW) e dei coefficienti di estinzione ottica (ε) ad una lunghezza d'onda di 280 nm calcolati con ProtParam sulla base delle sequenze del complesso, assumendo la fusione lineare delle subunità della settina, dei diversi complessi settonici e delle uniche subunità della settina (solo MW) che possono essere purificate con i plasmidi elencati nella Tabella 1. Clicca qui per scaricare questa tabella.
Discussione
Il metodo qui descritto consente la robusta purificazione e il controllo di qualità degli etero-oligomeri della settina preformati. Alcune delle questioni chiave da considerare per la corretta applicazione del metodo sono le seguenti. Durante le fasi di eluizione nelle separazioni cromatografiche, è importante utilizzare la portata raccomandata (o inferiore) per ridurre al minimo la diluizione dei complessi di septina. Inoltre, per massimizzare il recupero delle proteine durante la fase finale di concentrazione, la colonna del concentratore è orientata in modo tale che la soluzione non venga spinta contro il filtro (quando c'è solo un filtro su un lato). Se la soluzione va direttamente al filtro, la proteina si attacca molto di più ad esso, diminuendo sostanzialmente la resa finale. È anche importante considerare che la fase di concentrazione non è sempre necessaria. La raccolta di frazioni solo da un intervallo ristretto intorno al picco nel cromatogramma di solito fornisce una concentrazione di stock sufficientemente elevata (> 3.000 nM) per molte applicazioni di ricostituzione (che di solito operano tra 10-300 nM). Infine, per il controllo di qualità della funzionalità dei complessi di settina mediante microscopia a fluorescenza, è importante passivare correttamente la superficie dei vetrini di microscopia, poiché i complessi di settino si attaccano avidamente al vetro. La passivazione dei vetrini può essere effettuata tramite funzionalizzazione PLL-PEG o mediante la formazione di doppi strati lipidici neutri (100% DOPC) supportati11,32.
Rispetto al protocollo di purificazione originale descritto per la prima volta in Iv et al.10, c'è un cambiamento nelle composizioni tampone (Tabella 2). La concentrazione di MgCl 2 è stata ridotta da 5 mM a2 mM e la concentrazione e il pH di Tris-HCl sono stati ridotti da 50 mM a 20 mM e da 8,0 a 7,4, rispettivamente. Queste modifiche sono state apportate per rendere le condizioni tampone compatibili con gli studi sulle interazioni delle settine umane con doppi strati lipidici, filamenti di actina e microtubuli10,11,32. Questo perché gli autori hanno formato doppi strati lipidici supportati e actina polimerizzata nel tampone F, la cui composizione è identica a quella di darkSPB, a parte la presenza di ATP nel tampone F. La modifica del tampone non ha prodotto alcun cambiamento nella qualità o nella durata delle settine purificate rispetto ai tamponi originali.
Questo metodo di purificazione ha ancora diverse limitazioni. In primo luogo, diversi tentativi di purificazione possono variare in termini di resa (0,5-1 ml di complessi di settina 2-5 μM) e qualità funzionale, come controllato dalla capacità di formazione di fasci dei complessi di settina purificati. Ecco perché è molto importante eseguire costantemente i controlli di qualità descritti in questo documento. Controllare molto bene i tempi di espressione e la densità ottica della coltura batterica può aiutare a mitigare la differenza di resa. In secondo luogo, questa condotta di purificazione non è in grado di distinguere tra trimeri ed esameri o tra tetrameri e ottameri (Figura 1B). Tuttavia, gli esperimenti di controllo della qualità possono essere utilizzati per dimostrare che la maggior parte dei complessi di septina sono nella loro forma oligomerica lunga. Nel caso in cui sia necessaria una distribuzione dimensionale degli oligomeri ancora più stretta, la cromatografia di esclusione dimensionale può essere inserita tra il passaggio 1.6. e Passo 1.7. del protocollo di purificazione. Questo passaggio facoltativo, tuttavia, diminuisce drasticamente la resa e non è raccomandato a meno che non sia strettamente necessario. Un'ultima limitazione, più fondamentale, deriva dall'uso di E. coli come sistema di espressione per complessi di settina ricombinanti. Naturalmente, questo sistema non consente modifiche post-traduzionali (PTM), che sono state riportate in cellule animali, come fosforilazione, acetilazione e sumoilazione 6,51,52,53. Queste modifiche post-traduzionali potrebbero essere aggiunte implementando una strategia di purificazione simile nelle cellule di insetti o umani. Inoltre, questo articolo ha discusso solo la ricostituzione delle settine da sole, ma studi su cellule indicano che le proteine regolatrici come le proteine della famiglia Borg 54,55 e l'anillina 24,25,56 possono avere effetti sostanziali ma poco compresi sull'assemblaggio e sulle funzioni delle settine e sono, quindi, importanti da incorporare eventualmente in vitro Studi. Sono stati riportati protocolli per la purificazione delle proteine Borg e dell'anillina54,57.
Il protocollo di purificazione della settina qui riportato offre un modo standardizzato per purificare le settine nella loro forma oligomerica con la corretta stechiometria delle subunità, offrendo un importante progresso rispetto a molti precedenti studi in vitro basati su singole subunità della settina. Anche se alcune settine in contesti specifici possono agire come una singola subunità2, l'attuale corpo di letteratura suggerisce fortemente che, nelle cellule animali, le settine funzionano principalmente nei complessi 9,58. Pertanto, l'uso di etero-oligomeri preformati, come quelli descritti in questo articolo e altri 10,11,18,32,35,36,37, è di grande importanza per studiare le proprietà strutturali e biofisiche delle settine tramite in vitro. ricostituzione per sezionare le loro funzioni nella cellula. Inoltre, le settine sono proteine autoassemblanti con molti partner di interazione, tra cui la membrana e il citoscheletro, il che le rende di grande interesse per la biologia sintetica bottom-up 59,60,61 e studi di cambiamenti indotti da proteine nelle proprietà biofisiche della membrana come la curvatura42,62,63.
Divulgazioni
Gli autori non dichiarano interessi concorrenti o finanziari.
Riconoscimenti
Ringraziamo Cecilia de Agrela Pinto, Tomás de Garay e Katharina Häußermann per la loro assistenza negli esperimenti di fotometria di massa (iSCAT); Arjen Jakobi e Wiel Evers per il loro aiuto con TEM; Lucia Baldauf per la sua assistenza con TIRF; Pascal Verdier-Pinard per i suoi consigli sull'elettroforesi nativa; Agata Szuba e Marjolein Vinkenoog per il loro aiuto nella creazione degli sforzi di purificazione della settina Drosophila, e il Cell and Tissue Imaging (PICT-IBiSA), Institut Curie, membro dell'Infrastruttura nazionale di ricerca francese France-BioImaging (ANR10-INBS-04). Questa ricerca ha ricevuto finanziamenti dall'Organizzazione olandese per la ricerca scientifica (NWO / OCW) attraverso la sovvenzione di gravitazione "BaSyC-Building a Synthetic Cell" (024.003.019) e dall'Agence Nationale pour la Recherche (ANR grants ANR-17-CE13-0014: "SEPTIMORF"; ANR-13-JSV8-0002-01: "SEPTIME"; e ANR-20-CE11-0014-01: "SEPTSCORT").
Materiali
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
Riferimenti
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802(2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349(2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76(2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203(2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226(2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190(2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, Pt 3 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420(2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166(2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315(2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon