Method Article
Purificación y control de calidad de complejos de septina recombinante para la reconstitución libre de células
En este artículo
Resumen
La reconstitución in vitro de proteínas citoesqueléticas es una herramienta vital para comprender las propiedades funcionales básicas de estas proteínas. El presente artículo describe un protocolo para purificar y evaluar la calidad de los complejos de septina recombinantes, que desempeñan un papel central en la división y migración celular.
Resumen
Las septinas son una familia de proteínas eucariotas conservadas de unión a GTP que pueden formar filamentos citoesqueléticos y estructuras de orden superior a partir de complejos heterooligoméricos. Interactúan con otros componentes citoesqueléticos y la membrana celular para participar en funciones celulares importantes como la migración y la división celular. Debido a la complejidad de las muchas interacciones de las septinas, el gran número de genes de septina (13 en humanos) y la capacidad de las septinas para formar complejos heterooligoméricos con diferentes composiciones de subunidades, la reconstitución libre de células es una estrategia vital para comprender los conceptos básicos de la biología de la septina. El presente artículo describe primero un método para purificar septinas recombinantes en su forma heterooligomérica utilizando un enfoque de cromatografía de afinidad de dos pasos. Luego, se detalla el proceso de control de calidad utilizado para verificar la pureza e integridad de los complejos de septina. Este proceso combina electroforesis en gel nativo y desnaturalizante, microscopía electrónica de tinción negativa y microscopía de dispersión interferométrica. Finalmente, se proporciona una descripción del proceso para verificar la capacidad de polimerización de los complejos de septina utilizando microscopía electrónica de tinción negativa y microscopía fluorescente. Esto demuestra que es posible producir hexámeros y octámeros de septina humana de alta calidad que contienen diferentes isoformas de septin_9, así como hexámeros de septina de Drosophila .
Introducción
El citoesqueleto se ha descrito clásicamente como un sistema de tres componentes que consiste en filamentos de actina, microtúbulos y filamentos intermedios 1, pero recientemente, las septinas han sido reconocidas como un cuarto componente del citoesqueleto1. Las septinas son una familia de proteínas de unión a GTP que se conservan en eucariotas2. Las septinas están involucradas en muchas funciones celulares como la división celular3, la adhesión célula-célula4, la motilidad celular5, la morfogénesis6, la infección celular7 y el establecimiento y mantenimiento de la polaridad celular8. A pesar de sus importantes funciones, la forma en que las septinas están involucradas en tales procesos es poco conocida.
La familia de proteínas de la septina se subdivide en varios subgrupos (cuatro o siete, dependiendo de la clasificación) basados en la similitud de la secuencia de proteínas2. Los miembros de diferentes subfamilias pueden formar complejos heterooligoméricos palindrómicos, que son los bloques de construcción de filamentos y que, a su vez, se ensamblan en estructuras de orden superior como haces, anillos y mallas 1,9,10,11,12. La complejidad molecular adicional surge de la presencia de diferentes variantes de empalme, un ejemplo es el SEPT9 humano, donde hay evidencia de funciones específicas de diferentes variantes de empalme13,14,15. Además, la longitud de los heterooligómeros depende de la especie y el tipo de célula. Por ejemplo, las septinas de Caenorhabditis elegans forman tetrámeros 16, las septinas de Drosophila melanogaster forman hexámeros 17 (Figura 1A), las septinas de Saccharomyces cerevisiae forman octameros 18 y las septinas humanas forman hexámeros y octámeros19 (Figura 1A). La capacidad de las isoformas de septina, las variantes de empalme y las septinas modificadas postraduccionalmente de la misma subfamilia para sustituirse entre sí en el complejo y la (co)existencia de heterooligómeros de diferentes tamaños han dificultado la delineación de las funciones celulares de diferentes complejos heterooligoméricos12.
Otra capacidad interesante de las septinas es su capacidad para interactuar con muchos socios de unión en la célula. Las septinas se unen a la membrana plasmática y a los orgánulos membranosos durante la interfase y la división celular20,21,22. En las células en división, las septinas cooperan con la anillina 23,24,25 y la actina y la miosina durante la citocinesis 26,27. En las últimas etapas de la citocinesis, las septinas parecen regular los complejos de clasificación endosomal requeridos para el sistema de transporte (ESCRT) para la abscisión del cuerpo medio28. Además, también hay evidencia de septina localizada en la corteza de actina y fibras de estrés de actina de las células en las células de interfase 29,30,31. En tipos celulares específicos, las septinas también se unen y regulan el citoesqueleto de microtúbulos32,33.
Todas estas características hacen que las septinas sean un sistema proteico muy interesante para estudiar, pero también desafiante. La combinación del gran número de subunidades de septina (13 genes en humanos sin contar las variantes de empalme2) con el potencial de las subunidades de septina de la misma subfamilia para sustituirse entre sí y formar heterooligómeros de diferentes tamaños hace que sea difícil sacar una conclusión sobre la función celular de una septina específica por manipulación genética. Además, las múltiples interacciones de las septinas hacen que interpretar los efectos de herramientas de investigación comunes, como los medicamentos34 dirigidos a los componentes citoesqueléticos o de membrana, sea una tarea difícil.
Una forma de superar esta situación es complementar la investigación en células con la reconstitución in vitro (libre de células) de septinas. La reconstitución in vitro permite el aislamiento de un solo tipo de heterooligómeros de septina con una composición de subunidad específica y longitud 18,35,36,37. Este complejo puede ser estudiado en un ambiente controlado, ya sea solo para descubrir las propiedades estructurales y fisicoquímicas básicas de las septinas 38,39,40, o en combinación con socios deseados como biomembranas modelo 11,41,42, filamentos de actina 10,27 o microtúbulos 32,36 para descifrar la naturaleza de sus Interacciones.
Por lo tanto, un método confiable para purificar diferentes complejos de septina de manera eficiente es vital para la investigación de septinas. Sin embargo, incluso usando el mismo protocolo, diferentes purificaciones pueden dar proteínas con diferente actividad / funcionalidad o incluso integridad. Para las proteínas disponibles comercialmente, como las enzimas, la funcionalidad y la actividad enzimática se validan cuidadosamente43. Implementar un control de calidad cuidadoso para las proteínas citoesqueléticas o estructurales como las septinas puede ser un desafío, pero es esencial hacer que los experimentos entre laboratorios sean comparables.
Este artículo describe un método robusto para purificar septinas recombinantes de alta calidad en su forma heterooligomérica basado en la expresión simultánea de dos vectores que contienen construcciones mono o bicistrónicas (Tabla 1) en células de Escherichia coli. El método consiste en un enfoque de cromatografía de afinidad de dos pasos para capturar heterooligómeros de septina que contienen tanto una septina marcada con his6 como una septina marcada con Strep-II (Figura 1B, C). Este protocolo, descrito por primera vez en Iv et al.10, se ha utilizado para purificar hexámeros de septina 11,27,35 de Drosophila, hexámeros de septina humana 10 y varios octámeros de septina humanos que contienen diferentes isoformas nativas (isoformas 1, 3 y 5)10,32 o SEPT9 mutadas 32 . Además, se describe un conjunto de técnicas para evaluar la calidad de las septinas purificadas. En primer lugar, se comprueba la integridad y la estequiometría correcta de las subunidades de septina mediante electroforesis desnaturalizante y microscopía electrónica de transmisión (TEM). Luego, la presencia de heterooligómeros de la masa molecular correcta y la presencia de monómeros u oligómeros más pequeños indicativos de inestabilidad compleja se examinan mediante electroforesis nativa y fotometría de masas mediante microscopía de dispersión interferométrica (iSCAT). Finalmente, el último paso consiste en la evaluación de la actividad polimerizante de las septinas mediante microscopía de fluorescencia y TEM.
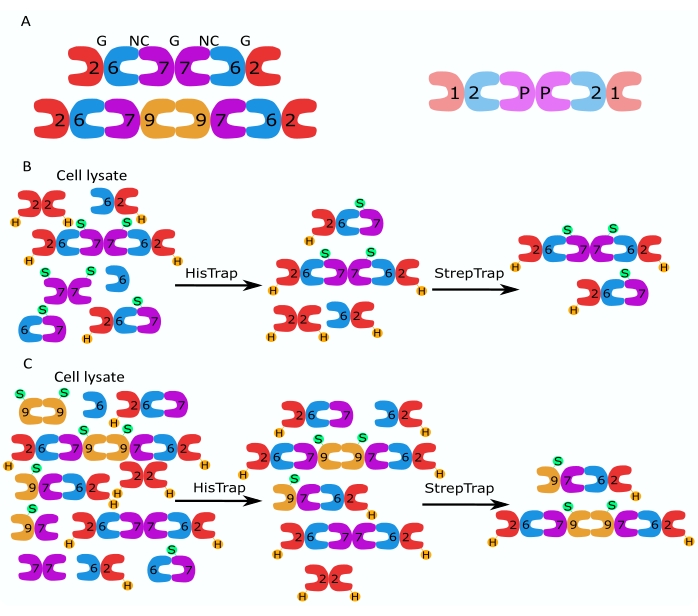
Figura 1: Estrategia de purificación. (A) Esquemas de los heterooligómeros de septina que existen en células humanas (izquierda) y Drosophila (derecha). Los números denotan subunidades de septina de los grupos indicados, y P denota maní. El SEPT9 humano puede ser cualquiera de sus isoformas. Las subunidades de septina tienen una forma asimétrica y están asociadas longitudinalmente con dos interfaces distintas, la interfaz NC: NC y la interfaz G: G, como se indica por NC y G, respectivamente, en la parte superior del hexámero humano. (B,C) Ilustración esquemática de la estrategia de cromatografía en dos pasos, mostrada para (B) hexámeros de septina humanos y (C) octamers. H indica las etiquetas his, mientras que S indica las etiquetas Strep-II. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Purificación de heterooligómeros de septina
- Co-transformación de células bacterianas con los vectores de expresión
- Seleccione una combinación de un plásmido pnEA y un plásmido pnCS44 que se utilizará para la expresión. Elija la combinación en función de la composición de subunidades deseada del heterooligómero de septina10,35 y de si se requiere o no marcado fluorescente.
NOTA: Aquí se utiliza la supercarpeta monomérica marcada con C-terminal GFP (msfGFP)-marcada SEPT2 (para septinas humanas) o msfGFP- o monomeric enhanced GFP (mEGFP)-DSep2 (para Drosophila septins) (Tabla 1). - Pipetear 1 μL de cada plásmido (~1 ng/μL) en 100 μL de células competentes de Escherichia coli BL21 e incubar en hielo durante 20 min.
- Colocar las celdas al baño maría a 42 °C durante 40 s e incubarlas inmediatamente durante 3 min en hielo.
- Añadir 0,9 ml de caldo de lisogenia (LB) medio a la suspensión celular y dejar que las células crezcan durante 1 h a 37 °C. Placa de 100 μL de células en placas tibias de LB-agar que contengan 100 μg/ml de ampicilina y 100 μg/ml de espectinomicina e incubar durante la noche a 37 °C.
- Seleccione una combinación de un plásmido pnEA y un plásmido pnCS44 que se utilizará para la expresión. Elija la combinación en función de la composición de subunidades deseada del heterooligómero de septina10,35 y de si se requiere o no marcado fluorescente.
- Precultivo bacteriano de cultivo
- Llenar un erlenmeyer de 250 ml con 100 ml de caldo Terrific (TB) o medio LB que contenga 100 μg/ml de ampicilina y 100 μg/ml de espectinomicina.
- Seleccionar una sola colonia de la placa de agar LB con un bucle de inoculación estéril y transferirla a medios frescos a partir del paso 1.2.1.
- Incubar a 37 °C en una incubadora de agitador rotativo, durante la noche o durante al menos 6 h.
NOTA: A partir de este cultivo, se puede preparar un stock de glicerol mezclando la suspensión bacteriana 1:1 con glicerol y almacenado a -80 °C. Este material se puede utilizar en el paso 1.2.2. en lugar de una colonia recién transformada.
- Cultivo bacteriano e inducción de expresión proteica
- Transfiera 100 ml de bacterias cultivadas a 5 L de TB o LB que contengan 50 μg/ml de ampicilina y 50 μg/ml de espectinomicina.
- Cultivar este cultivo a 37 °C en una incubadora agitadora hasta que alcance una densidad óptica (OD) medida a una longitud de onda de 600 nm en el rango de 2-3 para septinas no marcadas o 0.6-0.8 para septinas marcadas con msfGFP/mEGFP e inducir la expresión de proteínas agregando una concentración final de 0.5 mM IPTG. El OD más bajo para las septinas marcadas es evitar alcanzar la fase de muerte en su tiempo de expresión más largo, como se detalla en el siguiente paso.
- Incubar las células que expresan heterooligómeros de septina no marcados durante 3 h a 37 °C o las células que expresan heterooligómeros marcados con msfGFP durante la noche a 17 °C.
NOTA: El corto tiempo de expresión de proteínas para complejos no marcados, facilitado por el uso del medio TB más rico, se elige para prevenir la degradación de proteínas. El mayor tiempo de expresión combinado con una temperatura más baja para los complejos etiquetados se elige para permitir el plegado correcto de la etiqueta msfGFP.
- Lisis bacteriana y clarificación de lisados
NOTA: A partir de este momento, en el procedimiento de purificación, mantener la solución que contiene proteínas en hielo o a 4 °C en todo momento para evitar la degradación de proteínas proteolíticas o la pérdida de actividad.- Recoger las células cultivadas centrifugando a 4.000 x g durante 20 min a 4 °C. Deseche el sobrenadante.
- Opcionalmente, congele el pellet en este paso y guárdelo a -80 °C durante un máximo de 6 meses. Si se elige esta opción, asegúrese de descongelar el pellet en hielo antes de continuar.
- Disolver el pellet en 100 mL de tampón de lisis (Tabla 2) y lisar las células. Elija una de las dos opciones a continuación
- Sonicate en 7 ciclos de 30 s ON y 59 s OFF con un sonicador de punta que utiliza una amplitud del 30% (tenga en cuenta que los ajustes dependen del sonicador).
- Desglose las celdas en la prensa francesa pasándolas al menos 3x.
- Aclarar el lisado celular centrifugando a 20.000 x g durante 30 min a 4 °C y mantener el sobrenadante. Se recomienda comenzar con el paso 1.5.1. durante este paso centrífugo.
- Opcionalmente, tomar una muestra para desnaturalizar la electroforesis, como se describe en la sección 2.
- Recoger las células cultivadas centrifugando a 4.000 x g durante 20 min a 4 °C. Deseche el sobrenadante.
- Cromatografía de afinidad para proteínas marcadas con His
NOTA: Este paso produce complejos que contienen SEPT2 humano o Drosophila Sep1 utilizando una columna de níquel (Figura 1B).- Equilibrar una columna de cromatografía de alto rendimiento de níquel sefarosa preempaquetada con tampón septina (Tabla 2).
- Cargue el sobrenadante clarificado en la columna a 1 ml/min y lave la proteína unida con al menos tres volúmenes de columna de tampón septina.
- Eluya los complejos de septina con un 50% de tampón de elución HisTrap (Tabla 2) a 1 ml / min mientras recolecta fracciones de 0.5 ml para obtener una concentración de imidazol de 250 mM.
- Elija las fracciones que contienen complejos de septina, como lo indica la absorbancia óptica del eluido a 280 nm monitoreado en línea con un sistema de cromatografía líquida de proteínas rápidas (FPLC) o después de la purificación con un espectrofotómetro de microvolumen.
NOTA: El imidazol absorbe la luz a 280 nm. Esto probablemente explica por qué el pico de proteína no vuelve a la absorbancia cero después de la elución de septina (Figura 2A).
- Cromatografía de afinidad para proteínas marcadas con Strep-II
NOTA: Este paso produce complejos que contienen SEPT7 humano (hexámeros), SEPT9 humano (octámeros) o maní Drosophila usando una columna Strep-Tactin (Figura 1B). La columna de cromatografía se basa en un sistema modificado de biotina-estreptavidina. La proteína se marca con biotina modificada (Strep-II-tag), y la columna contiene una estreptavidina diseñada (Strep-Tactin). A pesar de haber sido modificado del sistema biotina-estreptavidina, no hay interferencia entre el sistema de etiqueta Strep-Tactin-Strep-II y el sistema biotina-estreptavidina. El sistema descrito se utiliza para evitar interferencias con ensayos de reconstitución utilizando biotina y estreptavidina.- Equilibrar una columna de cromatografía de alta resolución de StrepTactin sepharose preempaquetada con tampón de septina (Tabla 2). Cargue las fracciones que contienen septina recuperadas de la columna de níquel a 1 ml / min y lave la proteína unida con al menos tres volúmenes de columna de tampón de septina.
- Eluya los complejos de septina con tampón de elución StrepTrap al 100% (Tabla 2) a 1 ml / min mientras recolecta fracciones de 0.5 ml para producir una concentración de 2.5 mM de destiobiotina.
NOTA: La destiobiotina en el tampón de elución StrepTrap debe disolverse fresca. - Elija las fracciones que contienen complejos de septina, como lo indica la absorbancia óptica del eluido a 280 nm monitoreado en línea con un sistema FPLC o después de la purificación con un espectrofotómetro de microvolumen.
NOTA: La electroforesis desnaturalizante generalmente se realiza en este punto con muestras de los lavados de la columna y fracciones de septina. El orden de las columnas se puede invertir con resultados indistinguibles, es decir, el lisado clarificado después del paso 1.4. puede someterse a cromatografía de afinidad Strep-Tactin seguida de cromatografía de afinidad de níquel.
- Diálisis y almacenamiento
- Para eliminar la destiobiotina de la solución de almacenamiento final, dialice los complejos de septina en una relación de volumen de muestra a tampón de ~1:300 contra el tampón de septina (Tabla 2) suplementado con 1 mM de TDT durante la noche, o durante al menos 4 h, a 4 °C utilizando una membrana de diálisis MWCO de 30 kDa.
- Opcionalmente, concentrar las septinas utilizando una columna de concentración centrífuga MWCO de 30 kDa hasta la concentración deseada. Apunte a una concentración de 5-7 μM, medida a través de la absorbancia óptica de la solución a 280 nm y utilizando un coeficiente de extinción teórico calculado a través de ProtParam (Tabla 3).
- Alícuota los complejos proteicos en el tamaño alícuota deseado, congelar la alícuota y almacenarla a −80 °C.
NOTA: Se recomienda no almacenar la proteína durante más de 6 meses. Además, se recomienda realizar experimentos regulares de control de calidad, especialmente si la proteína se almacena durante más tiempo del recomendado.
2. Control de calidad de la pureza e integridad del heterooligómero de septina
NOTA: El control de calidad heterooligómero consiste en un conjunto de técnicas bioquímicas y de imagen que permiten la detección de la masa y la integridad de los complejos de septina presentes en la solución.
- Electroforesis desnaturalizante para comprobar la formación del heterooligómero de septina con los componentes correctos
- Mezcle 10 μL de las fracciones seleccionadas con 10 μL de 2x tampón de muestra SDS, cárguelas en un gel TGX prefabricado al 4% -15% y llene el sistema con tampón de funcionamiento Tris/glicina/SDS.
- Ejecute la electroforesis durante 35 min a 200 V y tiñe el gel (Tabla de materiales) para visualizar los resultados. Los pesos moleculares de las proteínas septina individuales y los complejos heterooligoméricos de septina se pueden encontrar en la Tabla 3.
- Mida la intensidad relativa de cada banda dentro de cada carril que contiene septinas purificadas en una imagen invertida de contraste. Haga esto calculando la intensidad media de rectángulos de igual tamaño alrededor de cada banda y de un rectángulo de igual tamaño en una región sin ninguna banda en el mismo carril. Luego, normalice los valores dividiendo la intensidad de cada banda por la intensidad de la región sin bandas.
NOTA: Si la intensidad está saturada (por ejemplo, valores de 255 para una imagen de 8 bits en una imagen con contraste invertido), omita el carril.
- Distribución de tamaño nativo promediada por conjunto mediante electroforesis nativa
- Prepare 800 ml de tampón de ánodo y 200 ml de tampón de cátodo azul claro el día anterior y guárdelos en el refrigerador. Para preparar el tampón del ánodo, diluya 40 ml de tampón de funcionamiento 20x con 760 ml de agua desionizada tipo I (agua I). Para preparar el tampón catódico azul claro, diluya 10 ml de tampón de funcionamiento 20x y 1 ml de aditivo de cátodo 20x con 189 ml de agua I. El tampón de funcionamiento y el aditivo del cátodo vienen con un kit (Tabla de materiales).
- Prepare 10 μL de la muestra mezclando ~ 500 ng de septina con la cantidad necesaria de tampón de muestra (2.5 μL en este caso, debido al uso de un tampón de muestra 4x; consulte la Tabla de materiales) y suficiente agua I para alcanzar un volumen de 10 μL.
- Cargue las muestras en el gel y llene el sistema con los tampones de ánodo y cátodo helados.
- Ejecute la electroforesis durante unos 115 minutos a 150 V con una fuente de alimentación que no se detenga a bajas corrientes y manche el gel (Tabla de materiales) para visualizar los resultados. Los pesos moleculares de las proteínas individuales y los complejos calculados en función de la secuencia se pueden encontrar en la Tabla 3.
- Distribución de masa de una sola molécula mediante fotometría de masas mediante microscopía de dispersión interferométrica
- Lave los portaobjetos de vidrio # 1.5 sonicándolos en un limpiador ultrasónico durante 5 minutos en I-water, 5 min en isopropanol y, finalmente, 5 min en I-water.
- Seque dos portaobjetos de vidrio con una corriente suave de gas nitrógeno y coloque una gota de 7 μL de solución de poli-L-lisina (PLL) al 0,01% en el centro de uno de los portaobjetos. Luego, coloque el centro de la otra diapositiva en la parte superior de la caída PLL, orientando las dos diapositivas ortogonalmente para facilitar la separación. Incubar durante 30 s.
- Lavar sumergiendo en un vaso de precipitados con I-water 1x y aplicando directamente un chorro de I-water 2x. Luego, seque los dos portaobjetos con un flujo de gas nitrógeno. Estos portaobjetos se pueden almacenar después durante aproximadamente 6 semanas a temperatura ambiente en condiciones secas.
NOTA: etiquete el lado de la diapositiva que se trata con el PLL para ejecutar correctamente el experimento.
- Lavar sumergiendo en un vaso de precipitados con I-water 1x y aplicando directamente un chorro de I-water 2x. Luego, seque los dos portaobjetos con un flujo de gas nitrógeno. Estos portaobjetos se pueden almacenar después durante aproximadamente 6 semanas a temperatura ambiente en condiciones secas.
- Justo antes del experimento, corte una pieza de juntas de 2 x 2, 3 x 2 o 3 x 3 (que produzcan 4, 6 o 9 cámaras de imagen / portaobjetos, respectivamente) y péguela en la parte tratada con PLL de un portaobjetos de vidrio mientras evita que el portaobjetos de vidrio y las juntas entren en contacto con cualquier superficie sucia. Coloque la corredera sobre un pañuelo limpiaparabrisas de servicio ligero y presione las juntas con una punta de pipeta para pegarlas con el plástico protector aún en las juntas.
- Caliente el tampón de septina (Tabla 2) a temperatura ambiente y descongele las proteínas en la mano (manténgalas en hielo después).
NOTA: iSCAT muestra la señal de algunos detergentes y moléculas pequeñas que se asemejan a señales de proteínas45. La TDT es una de esas moléculas pequeñas, y por eso no se utiliza para este experimento. Solo hay un rastro de TDT proveniente de la septina almacenada. - Coloque el portaobjetos con juntas en el sistema de fotometría de masas comercial que contiene 19 μL de tampón de septina y enfoque el microscopio utilizando la opción de enfoque automático. Siga las instrucciones del fabricante para comprobar si el enfoque encontrado es correcto. Aquí se utiliza el objetivo estándar 100x que forma parte de la configuración.
- Cree o cargue una carpeta de proyecto para almacenar los datos mediante Archivo > Nuevo proyecto o Archivo > Cargar proyecto.
- Pipetear 1 μL de muestra sobre los 19 μL de gota tampón de septina (paso 2.3.5) utilizados para enfocar y mezclar minimizando el movimiento del portaobjetos al no tocar nada mientras lo hace. Luego, grabe un video de 6,000 cuadros haciendo clic en Grabar.
- Para un análisis correcto, registre las siguientes muestras: tampón de septina, estándar de masa de proteína para la calibración de la relación señal-masa (si se dispone de una calibración reciente y las condiciones ambientales no han cambiado, esta muestra se puede omitir), y 250 nM de complejos de septina diluidos en tampón de septina sin TDT (esto da una concentración final de ~ 12.5 nM).
- Analice los videos utilizando el software del fabricante para obtener la distribución de masa de proteínas. Compruebe si hay datos de buena calidad de la siguiente manera.
- Si los picos de diferentes tamaños de heterooligómeros de septina se superponen demasiado o se detectan demasiados eventos (>3.500 eventos para un video de 6.000 fotogramas con el campo de visión regular de 128 píxeles x 34 píxeles que abarca 10,8 μm x 2,9 μm), disminuya la concentración final de septina y mida de nuevo.
- Si no hay suficientes recuentos de moléculas individuales medidas (al menos 2.500-3.500 para un video de 6.000 cuadros con el campo de visión regular), aumente la concentración de septina y mida nuevamente.
- Obtención directa de imágenes de complejos de septina mediante microscopía electrónica de transmisión de tinción negativa
- Diluir las muestras a una concentración de aproximadamente 50 nM en tampón de septina y preparar la solución de tinción (formiato de uranilo al 2% o acetato de uranilo en I-agua).
NOTA: El formiato de uranilo debe prepararse fresco. - Pipetear 4 μL de septinas diluidas sobre una rejilla de microscopía electrónica descargada incandescente e incubar durante 30 s.
- Retire la mayor parte de la solución de proteína con un papel de filtro y lave la rejilla 2x con tampón de septina y 1x con I-water para eliminar las septinas ligeramente adsorbidas.
- Tiñe con acetato de uranilo al 2% o solución de formiato de uranilo en agua I-water durante 1 minuto, absorbe la solución de tinción con un papel de filtro y seca al aire la rejilla durante unos minutos.
- Examine la rejilla utilizando un microscopio electrónico de transmisión correctamente alineado para buscar regiones de tinción mejorada y recopilar alrededor de 100 imágenes dentro de estas áreas seleccionadas.
- Recopile imágenes con un aumento de al menos 50.000x para obtener un tamaño de píxel de aproximadamente 2 Å / píxel y con un desenfoque que varía de −1 μm a −2 μm. Utilice una tensión de aceleración de 200 kV. Preferiblemente, utilice un procedimiento automatizado para recopilar los datos, que dependerá del software de adquisición disponible.
- Realice el procesamiento de imágenes 2D utilizando un software dedicado
- Empaquetar al menos 2.000 partículas utilizando un software dedicado46.
- Realice la alineación y clasificación bidimensional de forma iterativa hasta que se obtengan las clases sin más mejoras. El primer paso de alineación y clasificación debe estar libre de referencias para evitar cualquier sesgo en la clasificación.
- Utilice los promedios obtenidos de la primera clasificación sin referencias como nuevas referencias para llevar a cabo una ronda adicional de clasificación. Repita este proceso iterativamente hasta que no se logre ninguna mejora adicional. Asegúrese de que cada clase se basa en 50 a 100 partículas recogidas, y que las subunidades individuales sean claramente visibles. Se pueden utilizar diferentes herramientas de software (Spider, Eman o Relion)46,47,48.
- Diluir las muestras a una concentración de aproximadamente 50 nM en tampón de septina y preparar la solución de tinción (formiato de uranilo al 2% o acetato de uranilo en I-agua).
3. Control de calidad funcional de septina mediante análisis de polimerización
NOTA: La funcionalidad de control de calidad consiste en un conjunto de técnicas de imagen que permiten la detección de complejos de septina polimerizada. A continuación, las septinas no marcadas se denominan septinas "oscuras", y el tampón utilizado para polimerizar septinas no marcadas se denomina tampón de polimerización de septina "oscuro" (SPB).
- Imágenes de haz de septinas mediante microscopía de fluorescencia
- Preparar el fluoSPB 5x (Tabla 2) y una mezcla de septina consistente en 90% de septina oscura y 10% de msfGFP-septina a una concentración seis veces mayor que la concentración final deseada en tampón de septina + 1 mM de TDT. Una concentración típica para este ensayo es de 300 nM y, por lo tanto, la concentración es de 1.800 nM para esta mezcla.
- Polimerizar la septina mezclando, en este orden específico, I-agua (suficiente para completar hasta el volumen final deseado), 20% 5xfluoSPB (una dilución final de 1:5), 0.05 μM PCD y 16.67% mezcla de septina (una dilución final de 1:6). Para 10 μL, mezcle 6.23 μL de I-agua, 2 μL de 5xfluoSPB, 0.1 μL de PCD (con un stock de 5 μM) y 1.67 μL de mezcla de septina. Incubar esta mezcla durante al menos 30 minutos a temperatura ambiente.
- Agregue las muestras a una cámara de imágenes lavada con fluoSPB (Tabla 2) e imagine los haces de septinas. Los canales de flujo pasivados por PLL-PEG, como se describe en investigaciones anteriores10,32, funcionan bien para este experimento.
- Imágenes de haz de septinas a través de microscopía electrónica de transmisión de tinción negativa
- Prepare el 5x darkSPB (Tabla 2) y una mezcla de septina que consista en septina oscura al 100% a una concentración seis veces mayor que la concentración final deseada en tampón de septina + 1 mM de TDT. Una concentración típica para este ensayo es de 300 nM y, por lo tanto, la concentración es de 1.800 nM para esta mezcla.
- Polimerizar los complejos de septina mezclando, en este orden específico, I-agua (suficiente para completar hasta el volumen final deseado), 20% 5xdarkSPB y 16.67% mezcla de septina. Para 5 μL, mezcle 3.16 μL de I-agua, 1 μL de 5x darkSPB y 0.83 μL de mezcla de septina. Incubar esta mezcla durante al menos 30 minutos a temperatura ambiente.
- Agregue 3-5 μL de muestra a una rejilla de microscopía electrónica descargada de brillo e incube durante 1 min. Luego, lave la rejilla 2x con darkSPB (Tabla 2) absorbiendo el líquido con un papel de filtro y agregando una gota de tampón oscuroSPB, lave 1x con I-water, incube durante ~ 30 s con acetato de uranilo al 2%, seque la mancha y seque al aire la muestra durante unos minutos.
- Imagen de los haces de septina a 120 kV y aumentos entre 5.000x y 60.000x con un desenfoque de entre 1-2 μm.
Resultados
Como se mencionó en el protocolo, se cultivaron 5 L de células de E. coli co-transformadas con los dos plásmidos que expresan septina, y la expresión de septinas se indujo mediante la adición de IPTG. Después de 3 h, las células se recogieron por centrifugación, se resuspendieron en tampón de lisis y se lisaron por sonicación. El lisado se clarificó por centrifugación y la solución clarificada se aplicó a una columna HisTrap (Figura 2A). Después de la primera purificación, las fracciones que contenían septina se agruparon y se aplicaron a una columna StrepTrap (Figura 2B). Esto típicamente produce alrededor de 3-5 ml de ~ 1 μM de complejo de septina. Antes de agrupar las fracciones que contienen septina, se puede utilizar la electroforesis en gel desnaturalizante para verificar la integridad de las subunidades de septina y la relación estequiométrica equimolar entre las diferentes subunidades de septina que forman el complejo. (Figura 3A). Si el gel muestra bandas igualmente intensas correspondientes a los pesos moleculares (Tabla 3) de las subunidades de septina, se puede continuar con el protocolo. Si no es así, se recomienda iniciar el protocolo de nuevo. En el ejemplo mostrado para el octámero de septina humana con SEPT9_i1, la Figura 3A muestra claramente las bandas correspondientes a SEPT9_i1, SEPT6, SEPT7 y SEPT2 (en el orden de arriba a abajo) con intensidades similares; el intervalo de confianza del 99% de la intensidad normalizada fue de 1,128 ± 0,048 para SEPT2, 1,092 ± 0,034 para SEPT6, 1,108 ± 0,040 para SEPT7 y 1,067 ± 0,029 para SEPT9. Si SEPT2 está etiquetado con msfGFP, se desplazará muy cerca de debajo de SEPT9_i1. Dependiendo del sistema de electroforesis utilizado y de la presencia de la etiqueta C-terminal TEV-Strep para SEPT7 (lo que hace que migre más lentamente que SEPT7 sin etiquetar), las bandas SEPT7 y SEPT6 a veces se fusionan debido a sus pesos moleculares comparables. El siguiente paso es agrupar las fracciones y dializarlas contra el tampón septina con TDT. Después de la diálisis, si la concentración es demasiado baja (<2 μM) o se necesita una concentración más alta para los experimentos, se puede incluir un paso de concentración, como se describe en el protocolo. Las concentraciones por debajo de 1 μM suelen indicar una mala calidad funcional de las septinas. Una concentración final del complejo de septina entre 3,5 μM y 7 μM funciona bien para la mayoría de los ensayos in vitro . Estas concentraciones generalmente se obtienen cuando el volumen después de la concentración alcanza 0.5-1 mL.
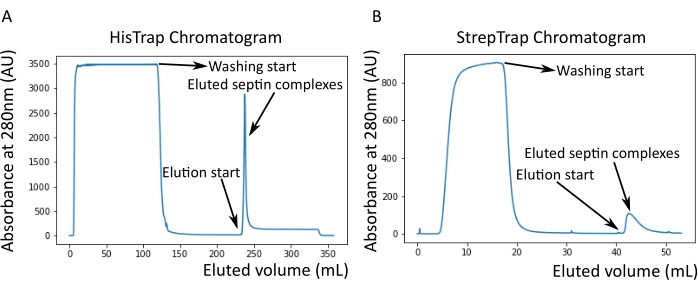
Figura 2: Ejemplo de cromatogramas correspondientes a la purificación de septina humana oscura octamers_9i1. (A) Cromatograma en columna HisTrap. Después del pico de elución de septina, la absorbancia no vuelve a cero, probablemente debido a la presencia de imidazol en el tampón. La fracción agrupada fue desde el inicio del pico de elución hasta que la absorbancia se estabilizó en alrededor de 250 ml. (B) Cromatograma en columna StrepTrap. La fracción agrupada fue desde el inicio del pico de elución hasta que la absorbancia volvió a alrededor de 0 a 50 ml. Haga clic aquí para ver una versión más grande de esta figura.
Para continuar con el control de calidad, se realizó electroforesis nativa, como se describe en el protocolo, (Figura 3B). En los geles, se puede observar una banda mayor correspondiente a los heterooligómeros intactos y, normalmente, una banda menor correspondiente a los dímeros. Los hexámeros humanos se encuentran un poco por encima de la banda de marcadores de 242 kDa, mientras que los octámeros se encuentran por encima de la banda de 480 kDa, por encima de su masa molecular calculada. La localización de estas bandas fue verificada por análisis de Western blot de extractos de células eucariotas32. El etiquetado con msfGFP acopla cada SEPT2 con una proteína msfGFP. Esto provoca un aumento en el peso molecular de los complejos de septina de 53,4 kDa (26,7 kDa/msGFP molécula). Sin embargo, en el gel de electroforesis nativo, el peso molecular aparente de los complejos marcados con msfGFP es indistinguible del de los complejos no etiquetados.
Una técnica complementaria para probar si los complejos de septina están intactos es la fotometría de masas mediante microscopía iSCAT. iSCAT monitorea la dispersión de luz de las moléculas que aterrizan en un portaobjetos de vidrio amplificado por la interferencia con la luz de referencia, típicamente el reflejo del láser en la parte inferior del portaobjetos de vidrio. Luego, se utiliza un enfoque de sustracción de fondo para dar contraste a las partículas. Debido a esta corrección, la señal muestra valores positivos y negativos dependiendo de si las partículas aterrizan en el vidrio o se alejan de él49. La señal detectada es directamente proporcional al peso molecular de las proteínas50. Por lo tanto, una calibración de señal a masa con un estándar de masa puede determinar la masa de las proteínas de la muestra. La Figura 3C muestra un ejemplo de octámeros de septina humanos que contienen SEPT9_i1. La mayoría de las partículas individuales detectadas (~ 50%) tienen un peso molecular esperado para octámeros completos que contienen SEPT9_i1 (423 kDa) (Figura 3C). También hay partículas con masas entre 150-300 kDa, pero no se observa un pico claro, lo que indica la posible presencia de otras especies de septina en baja abundancia. Del mismo modo, la mayoría de las partículas individuales detectadas para los hexámeros de Drosophila marcados con mEGFP tienen un peso molecular esperado para los hexámeros intactos (361 kDa) (Figura 3D). Un pico claro adicional a 241 kDa indica la presencia de tetrámeros estables que contienen dos proteínas de cacahuete, una DSep1 y una mEGFP-DSep2. Finalmente, tanto el complejo de septina humana como el de mosca muestran un pico alrededor de 80 kDa que podría ser una mezcla de monómeros y dímeros, posiblemente amplificados por un rastro de TDT o cualquier otra molécula pequeña que se agregue, mostrando un pico en el lado positivo de la gráfica45.
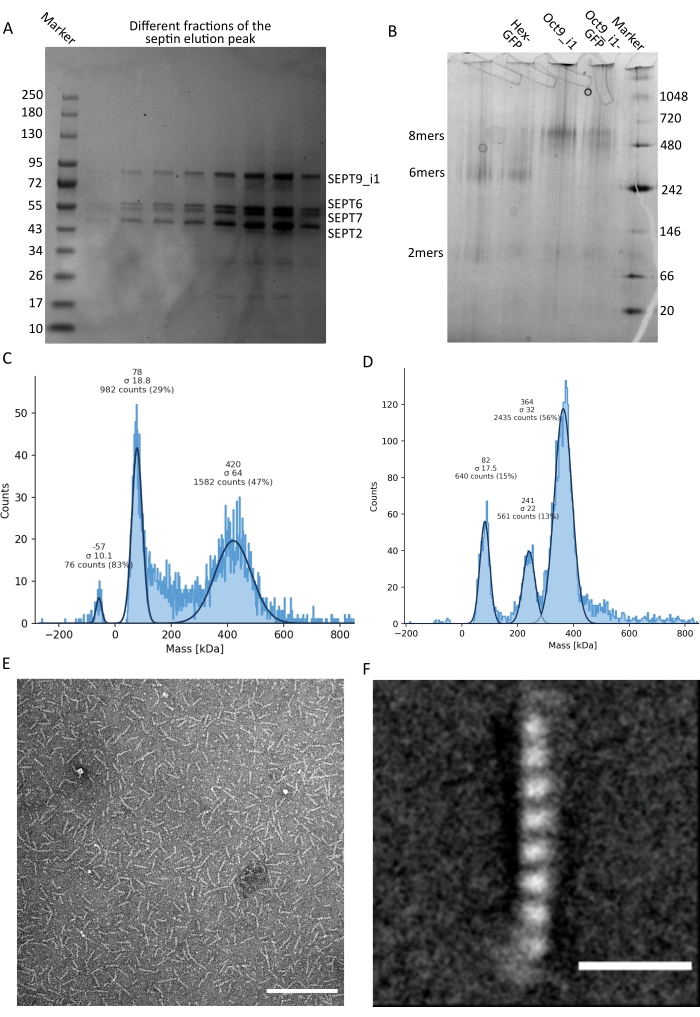
Figura 3: Ejemplos de resultados del control de calidad del oligómero . (A) Ejemplo de gel desnaturalizante que muestra diferentes fracciones del pico de elución de la purificación de la octamers_9i1 de septina humana oscura. (B) Ejemplo de electroforesis nativa de diferentes complejos de septina. (C,D) Diferentes ejemplos de histograma resultados de fotometría de masas a 12,5 nM de complejos de septina: (C) septina humana oscura octamers_9i1 y (D) DSep1-msfGFP Drosophila septina hexámeros. Las líneas son ajustes gaussianos. (E) Imagen TEM de 25 nM de octamers_9i1 de septina humana oscura en tampón de septina. Barra de escala = 200 nm. (F) Imagen promedio de clase de SEPT2-msfGFP octamers_9i1 de septina humana. Las etiquetas msfGFP son visibles como densidades difusas en los dos extremos. Barra de escala = 10 nm. Los paneles (E) y (F) son propiedad de The Company of Biologists y han sido adaptados de Iv et al.10 con permiso. Haga clic aquí para ver una versión más grande de esta figura.
Dado que tanto los geles nativos como el iSCAT proporcionan solo información promediada por conjuntos, se utilizó el promedio de clase de imágenes de microscopía electrónica de transmisión de oligómeros de septina individuales para verificar la integridad y pureza de los complejos mediante visualización directa. En imágenes TEM de complejos de septina en tampón septina, se pueden observar varillas de 24 nm (hexámeros) o 32 nm (octameros) de longitud. Un ejemplo de un octámero de septina humano que contiene SEPT9_i1 se puede ver en la Figura 3E. Cuando la clase los promedia, cada una de las subunidades se puede observar y contar, como se ve para el octámero humano marcado con msfGFP con SEPT9_i1 en la Figura 3F. En caso de que el oligómero esté marcado con fluorescencia, se pueden observar densidades adicionales que corresponden al SEPT2-msfGFP al final de las varillas (Figura 3F).
La combinación de las técnicas anteriores demuestra que los octameros (o hexámeros) con la relación estequiométrica correcta y alta pureza pueden purificarse utilizando el protocolo descrito. Finalmente, el último control de calidad es para la funcionalidad de los complejos de septina en términos de su capacidad de polimerización. En presencia de baja concentración de sal (<150 mM KCl con el tampón9 descrito), si las septinas no están en presencia de otras proteínas o membranas lipídicas cargadas negativamente, se autoensamblan en haces9. Se evita que las septinas se polimericen manteniéndolas en el tampón de almacenamiento, que tiene una alta concentración de KCl (300 mM). Los heterooligómeros de septina se diluyen a una proporción de volumen de 1:6 en un tampón de la misma composición pero sin KCl para lograr una concentración final de KCl de 50 mM. Para hacer imágenes de fluorescencia, este tampón se complementa con un sistema de eliminación de oxígeno para proteger del fotoblanqueo y con un supresor de parpadeo. En microscopía TIRF, se pueden observar pequeños grupos de proteínas dentro del campo TIRF poco profundo (~100 nm; Figura 4A,B). En un microscopio confocal, se pueden ver grandes grupos de estructuras filamentosas flotando más arriba en solución (Figura 4C). Finalmente, con TEM, se pueden observar pequeños haces de septina (Figura 4D), correspondientes a los grupos observados por TIRF, y grandes haces (Figura 4E), correspondientes a las estructuras observadas por microscopía confocal. Los recuadros de la Figura 4D,E revelan que ambos tipos de estructuras consisten en filamentos largos y delgados que corren en paralelo, formando haces con extremos cónicos. Juntas, las imágenes de fluorescencia y TEM demuestran que los complejos de septina purificados pueden polimerizarse en filamentos, que a su vez se autoensamblan en paquetes.
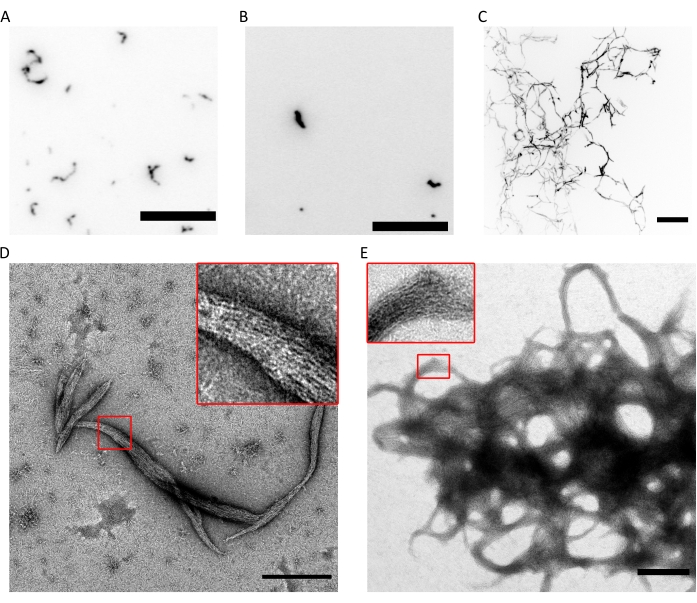
Figura 4: Ejemplos de resultados de la capacidad de polimerización de control de calidad. (A) Imagen TIRF de 300 nM hexámeros de septina humana (10% hexámeros marcados con msfGFP) en fluoSPB. (B) Imagen TIRF de 300 nM octámeros de septina humana que contienen SEPT9_i1 (10% de octamers9_i1 marcados con msfGFP) en fluoSPB. (C) Proyecciones confocales de intensidad máxima de pilas Z a través de ~ 30 μm con 0.5 μm de espaciamiento de 300 nM de septina humana octamers_9i3 en fluoSPB. (A-C) Barra de escala = 10 μm y escala de grises invertida. (D,E) Ejemplo de imágenes TEM de (D) pequeños y (E) grandes haces de septina humana octamers_9i1 en SPB oscuro. Los recuadros muestran regiones donde se pueden observar filamentos transparentes que corren paralelos dentro del haz. Barras de escala = 500 nm. Los paneles (C-E) son propiedad de The Company of Biologists y han sido adaptados de Iv et al.10 con permiso. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Lista de plásmidos. Plásmidos para purificar oligómeros de septina siguiendo este protocolo. Todos los plásmidos han sido depositados en Addgene (primera columna). Haga clic aquí para descargar esta tabla.
Tabla 2: Lista de buffers. Composiciones tampón utilizadas para la purificación y control de calidad de oligómeros de septina. Haga clic aquí para descargar esta tabla.
Tabla 3: Pesos moleculares y coeficientes de extinción. Lista de pesos moleculares (MW) y coeficientes de extinción óptica (ε) a una longitud de onda de 280 nm calculada con ProtParam basada en las secuencias del complejo, asumiendo la fusión lineal de las subunidades de septina, los diferentes complejos de septina y las subunidades únicas de septina (solo MW) que pueden purificarse con los plásmidos enumerados en la Tabla 1. Haga clic aquí para descargar esta tabla.
Discusión
El método descrito aquí permite la purificación robusta y el control de calidad de heterooligómeros de septina preformados. Algunas de las cuestiones clave a considerar para la correcta aplicación del método son las siguientes. Durante los pasos de elución en las separaciones cromatográficas, es importante utilizar el caudal recomendado (o inferior) para minimizar la dilución de los complejos de septina. Además, para maximizar la recuperación de proteínas durante el paso final de concentración, la columna del concentrador está orientada de tal manera que la solución no se empuja contra el filtro (cuando solo hay un filtro en un lado). Si la solución va directamente al filtro, la proteína se adhiere mucho más a él, disminuyendo sustancialmente el rendimiento final. También es importante considerar que el paso de concentración no siempre es necesario. La selección de fracciones solo de un rango estrecho alrededor del pico en el cromatograma generalmente da una concentración de stock suficientemente alta (>3,000 nM) para muchas aplicaciones de reconstitución (que generalmente operan entre 10-300 nM). Finalmente, para el control de calidad de la funcionalidad de los complejos de septina por microscopía de fluorescencia, es importante pasivar correctamente la superficie de los portaobjetos de microscopía, ya que los complejos de septina se adhieren ávidamente al vidrio. La pasivación de los portaobjetos de vidrio se puede realizar mediante funcionalización PLL-PEG o mediante la formación de bicapas lipídicas neutras (100% DOPC) soportadas11,32.
En comparación con el protocolo de purificación original descrito por primera vez en Iv et al.10, hay un cambio en las composiciones de los tampones (Tabla 2). La concentración de MgCl 2 se ha reducido de 5 mM a2 mM, y la concentración y el pH de Tris-HCl se han reducido de 50 mM a 20 mM y de 8,0 a 7,4, respectivamente. Estos cambios se realizaron para hacer compatibles las condiciones de amortiguación con los estudios de las interacciones de las septinas humanas con bicapas lipídicas, filamentos de actina y microtúbulos10,11,32. Esto se debe a que los autores formaron bicapas lipídicas soportadas y actina polimerizada en el F-buffer, cuya composición es idéntica a la de darkSPB, aparte de la presencia de ATP en el F-buffer. El cambio de tampón no produjo ningún cambio en la calidad o vida útil de las septinas purificadas en comparación con los tampones originales.
Este método de purificación todavía tiene varias limitaciones. En primer lugar, los diferentes intentos de purificación pueden variar en rendimiento (0,5-1 ml de complejos de septina de 2-5 μM) y calidad funcional, como lo comprueba la capacidad de formación del haz de los complejos de septina purificados. Es por eso que es muy importante realizar consistentemente los controles de calidad descritos en este documento. Controlar muy bien los tiempos de expresión y la densidad óptica del cultivo bacteriano puede ayudar a mitigar la diferencia en el rendimiento. En segundo lugar, esta tubería de purificación no puede distinguir entre trímeros y hexámeros o entre tetrámeros y octámeros (Figura 1B). Sin embargo, los experimentos de control de calidad se pueden utilizar para demostrar que la mayoría de los complejos de septina están en su forma de oligómero largo. En caso de que se requiera una distribución de tamaño de oligómero aún más estrecha, se puede insertar cromatografía de exclusión de tamaño entre el paso 1.6. y paso 1.7. del protocolo de purificación. Este paso opcional, sin embargo, disminuye drásticamente el rendimiento, y no se recomienda a menos que sea estrictamente necesario. Una última limitación, más fundamental, proviene del uso de E. coli como sistema de expresión para complejos de septina recombinantes. Naturalmente, este sistema no permite modificaciones postraduccionales (PTM), que han sido reportadas en células animales, como fosforilación, acetilación y sumoilación 6,51,52,53. Estas modificaciones postraduccionales podrían agregarse implementando una estrategia de purificación similar en células de insectos o humanas. Además, este documento solo ha discutido la reconstitución de septinas por sí mismas, pero los estudios en células indican que las proteínas reguladoras como las proteínas de la familia Borg 54,55 y la anillina 24,25,56 pueden tener efectos sustanciales pero poco conocidos sobre el ensamblaje y las funciones de las septinas y, por lo tanto, son importantes para incorporarlas eventualmente in vitro. Estudios. Los protocolos para la purificación de las proteínas Borg y la anillina han sido reportados54,57.
El protocolo de purificación de septina reportado aquí ofrece una forma estandarizada de purificar septinas en su forma de oligómero con la estequiometría de subunidades correcta, ofreciendo un avance importante sobre muchos estudios in vitro anteriores basados en subunidades de septina individuales. A pesar de que algunas septinas en contextos específicos pueden actuar como una sola subunidad2, el cuerpo actual de literatura sugiere fuertemente que, en las células animales, las septinas funcionan principalmente en complejos 9,58. Por lo tanto, el uso de heterooligómeros preformados, como los descritos en este trabajo y otros 10,11,18,32,35,36,37, es de gran importancia para estudiar las propiedades estructurales y biofísicas de las septinas vía in vitro. reconstitución para diseccionar sus funciones en la célula. Además, las septinas son proteínas autoensamblables con muchos socios de interacción, incluyendo la membrana y el citoesqueleto, lo que las hace de gran interés para la biología sintética ascendente 59,60,61 y estudios de cambios inducidos por proteínas en las propiedades biofísicas de la membrana como la curvatura42,62,63.
Divulgaciones
Los autores declaran no tener intereses contrapuestos o financieros.
Agradecimientos
Agradecemos a Cecilia de Agrela Pinto, Tomás de Garay y Katharina Häußermann por su ayuda con los experimentos de fotometría de masas (iSCAT); Arjen Jakobi y Wiel Evers por su ayuda con TEM; Lucia Baldauf por su asistencia con TIRF; Pascal Verdier-Pinard por sus consejos sobre la electroforesis nativa; Agata Szuba y Marjolein Vinkenoog por su ayuda en la creación de los esfuerzos de purificación de septina de Drosophila, y el Cell and Tissue Imaging (PICT-IBiSA), Institut Curie, miembro de la Infraestructura Nacional de Investigación de Francia-BioImaging (ANR10-INBS-04). Esta investigación recibió financiación de la Organización Holandesa para la Investigación Científica (NWO/OCW) a través de la subvención de gravitación 'BaSyC-Building a Synthetic Cell' (024.003.019) y de la Agence Nationale pour la Recherche (ANR grants ANR-17-CE13-0014: "SEPTIMORF"; ANR-13-JSV8-0002-01: "SEPTIME"; y ANR-20-CE11-0014-01: "SEPTSCORT").
Materiales
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
Referencias
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802 (2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349 (2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76 (2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203 (2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226 (2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190 (2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -. C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420 (2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315 (2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados