Method Article
Очистка и контроль качества рекомбинантных комплексов септина для бесклеточного восстановления
В этой статье
Резюме
Восстановление in vitro цитоскелетных белков является жизненно важным инструментом для понимания основных функциональных свойств этих белков. В настоящем документе описывается протокол очистки и оценки качества рекомбинантных комплексов септина, которые играют центральную роль в делении и миграции клеток.
Аннотация
Септины представляют собой семейство законсервированных эукариотических GTP-связывающих белков, которые могут образовывать цитоскелетные нити и структуры более высокого порядка из гетероолигомерных комплексов. Они взаимодействуют с другими компонентами цитоскелета и клеточной мембраной для участия в важных клеточных функциях, таких как миграция и деление клеток. Из-за сложности многих взаимодействий септинов, большого количества генов септина (13 у людей) и способности септинов образовывать гетероолигомерные комплексы с различным составом субъединиц бесклеточное восстановление является жизненно важной стратегией для понимания основ биологии септина. В настоящей работе впервые описан способ очистки рекомбинантных септинов в их гетероолигомерной форме с использованием двухступенчатого подхода аффинной хроматографии. Затем подробно описывается процесс контроля качества, используемый для проверки чистоты и целостности комплексов септина. Этот процесс сочетает в себе нативный и денатурирующий гель-электрофорез, электронную микроскопию с отрицательным пятном и интерферометрическую микроскопию рассеяния. Наконец, дано описание процесса проверки полимеризационной способности септиновых комплексов с помощью электронной микроскопии отрицательных пятен и флуоресцентной микроскопии. Это свидетельствует о том, что можно производить высококачественные гексамеры и октамеры септина человека, содержащие различные изоформы septin_9, а также гексамеры Drosophila septin.
Введение
Цитоскелет был классически описан как трехкомпонентная система, состоящая из актиновых нитей, микротрубочек и промежуточных нитей1, но недавно септины были признаны четвертым компонентом цитоскелета1. Септины представляют собой семейство GTP-связывающих белков, которые сохраняются в эукариотах2. Септины участвуют во многих клеточных функциях, таких как деление клеток3, клеточная адгезия4, подвижность клеток5, морфогенез6, клеточная инфекция7, а также установление и поддержание полярности клеток8. Несмотря на их важные функции, как септины участвуют в таких процессах, плохо изучено.
Семейство белков септина подразделяется на несколько подгрупп (четыре или семь, в зависимости от классификации) на основе сходства последовательностей белков2. Члены различных подсемейств могут образовывать палиндромные гетероолигомерные комплексы, которые являются строительными блоками нитей и которые, в свою очередь, собираются в структуры более высокого порядка, такие как пучки, кольца и сетки 1,9,10,11,12. Дальнейшая молекулярная сложность возникает из-за наличия различных вариантов сращивания, примером чего является человеческий SEPT9, где есть доказательства специфических функций различных вариантов сращивания 13,14,15. Кроме того, длина гетероолигомеров зависит от вида и типа клеток. Например, септины Caenorhabditis elegans образуют тетрамеры16, септины Drosophila melanogaster образуют гексамеры17 (рисунок 1A), saccharomyces cerevisiae septins образуют октамеры18, а человеческие септины образуют как гексамеры, так и октамеры19 (рисунок 1A). Способность изоформ септина, вариантов сращивания и посттрансляционно модифицированных септинов из одного и того же подсемейства заменять друг друга в комплексе и (со)существование гетероолигомеров разного размера затрудняют разграничение клеточных функций различных гетероолигомерных комплексов12.
Еще одной интересной способностью септинов является их способность взаимодействовать со многими партнерами по связыванию в клетке. Септины связывают плазматическую мембрану и мембранные органеллы во время интерфазы и деления клеток 20,21,22. В делящихся клетках септины взаимодействуют с аниллином 23,24,25 и актином и мионином во время цитокинеза 26,27. На поздних стадиях цитокинеза септины, по-видимому, регулируют эндосомальные сортировочные комплексы, необходимые для транспортной системы (ESCRT) для абсциссии среднего тела28. Кроме того, имеются также данные о септине, расположенном на актиновой коре и актиновых стрессовых волокнах клеток в межфазных клетках 29,30,31. В определенных типах клеток септины также связывают и регулируют микротрубочки цитоскелета32,33.
Все эти особенности делают септины очень интересной белковой системой для изучения, но также и сложной. Сочетание большого количества субъединиц септина (13 генов у человека без учета вариантов сращивания2) с потенциалом субъединиц септина из одного и того же подсемейства заменять друг друга и образовывать гетероолигомеры разного размера затрудняет вывод о клеточной функции конкретного септина путем генетических манипуляций. Кроме того, множественные взаимодействия септинов делают интерпретацию эффектов общих исследовательских инструментов, таких как препараты34 , направленные на цитоскелетные или мембранные компоненты, трудной задачей.
Способ преодолеть эту ситуацию заключается в том, чтобы дополнить исследования в клетках восстановлением септинов in vitro (бесклеточным). Восстановление in vitro позволяет выделить один тип гетероолигомеров септина с определенным субъединицей и длиной 18,35,36,37. Затем этот комплекс может быть изучен в контролируемой среде, либо в одиночку, чтобы обнаружить основные структурные и физико-химические свойства септинов 38,39,40, либо в сочетании с желаемыми партнерами, такими как модельные биомембраны 11,41,42, актиновые нити 10,27 или микротрубочки 32,36, чтобы расшифровать природу их Взаимодействия.
Поэтому надежный метод эффективной очистки различных комплексов септина жизненно важен для исследования септина. Однако, даже используя один и тот же протокол, разные очистки могут давать белки с разной активностью / функциональностью или даже целостностью. Для коммерчески доступных белков, таких как ферменты, функциональность и ферментативная активность тщательно проверяются43. Осуществление тщательного контроля качества цитоскелетных или структурных белков, таких как септины, может быть сложной задачей, но важно сделать эксперименты в лабораториях сопоставимыми.
В данной работе описан надежный метод очистки высококачественных рекомбинантных септинов в их гетероолигомерной форме, основанный на одновременной экспрессии двух векторов, содержащих моно- или бицистронные конструкции (таблица 1) в клетках кишечной палочки. Метод состоит из двухэтапного подхода аффинной хроматографии для захвата гетероолигомеров септина, содержащих как его 6-меченый септин, так и септин со стрептиком-II (рисунок 1B, C). Этот протокол, впервые описанный в Iv et al.10, был использован для очистки гексамеров септина Drosophila 11,27,35, гексамеров септина человека 10 и нескольких октамеров септина человека, содержащих различные нативные (изоформы 1, 3 и 5)10,32 или мутировавшие изоформы SEPT932 . Кроме того, дается описание набора методов оценки качества очищенных септинов. Во-первых, целостность и правильная стехиометрия субъединиц септина проверяется с помощью денатурирующего электрофореза и просвечивающей электронной микроскопии (ТЭМ). Затем наличие гетероолигомеров правильной молекулярной массы и наличие мономеров или более мелких олигомеров, указывающих на сложную нестабильность, исследуют с помощью нативного электрофореза и массовой фотометрии с помощью интерферометрической рассеянной микроскопии (iSCAT). Наконец, последний этап состоит из оценки полимеризующей активности септинов с помощью флуоресцентной микроскопии и ТЭМ.
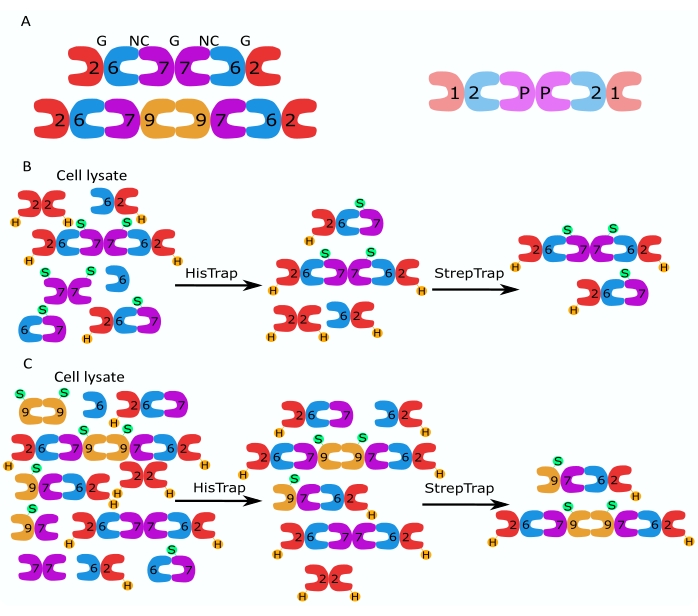
Рисунок 1: Стратегия очистки. (А) Схемы гетероолигомеров септина, которые существуют в клетках человека (слева) и дрозофилы (справа). Числа обозначают субъединицы септина из указанных групп, а P обозначает арахис. Человеческий SEPT9 может быть любой из его изоформ. Субъединицы септина имеют асимметричную форму и продольно связаны с двумя различными интерфейсами, NC:NC и интерфейсом G:G, обозначаемыми NC и G, соответственно, поверх человеческого гексамера. (В,С) Схематическая иллюстрация двухступенчатой стратегии хроматографии, показанная для (B) гексамеров септина человека и (C) октамеров. H обозначает его теги, а S — стрептококки II. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Очищение гетероолигомеров септина
- Котрансформация бактериальных клеток с векторами экспрессии
- Выберите комбинацию одной плазмиды pnEA и одной плазмидыpnCS 44, которые будут использоваться для экспрессии. Выбирайте комбинацию в зависимости от желаемого субъединичного состава гетероолигомера септина10,35 и от того, требуется ли флуоресцентная маркировка.
ПРИМЕЧАНИЕ: Здесь используется C-терминально помеченная мономерная суперпапка GFP (msfGFP) с меткой SEPT2 (для септинов человека) или msfGFP- или мономерная улучшенная GFP (mEGFP)-DSep2 (для септинов Drosophila). - Пипетка 1 мкл каждой плазмиды (~1 нг/мкл) в 100 мкл компетентных клеток BL21 Escherichia coli и инкубируется на льду в течение 20 мин.
- Поместите клетки на водяную баню при 42 °C в течение 40 с, а затем немедленно высиживайте их в течение 3 мин на льду.
- Добавьте 0,9 мл среды лизогенного бульона (LB) в клеточную суспензию и дайте клеткам расти в течение 1 ч при 37 °C. Пластина 100 мкл клеток на теплых пластинах LB-агара, содержащих 100 мкг/мл ампициллина и 100 мкг/мл спектиномицина и инкубируют в течение ночи при 37 °C.
- Выберите комбинацию одной плазмиды pnEA и одной плазмидыpnCS 44, которые будут использоваться для экспрессии. Выбирайте комбинацию в зависимости от желаемого субъединичного состава гетероолигомера септина10,35 и от того, требуется ли флуоресцентная маркировка.
- Вырастите бактериальную прекультуру
- Наполните колбу Эрленмейера объемом 250 мл 100 мл отвара Terrific (TB) или LB-среды, содержащей 100 мкг/мл ампициллина и 100 мкг/мл спектиномицина.
- Выделите одну колонию из пластины LB-агара стерильной петлей инокуляции и перенесите ее на свежие носители с шага 1.2.1.
- Инкубировать при 37 °C в ротационном шейкерном инкубаторе либо на ночь, либо в течение не менее 6 ч.
ПРИМЕЧАНИЕ: Из этой культуры можно приготовить глицериновый бульон, смешав бактериальную суспензию 1:1 с глицерином и храня при температуре −80 °C. Этот запас можно использовать на этапе 1.2.2. вместо только что преобразованной колонии.
- Индукция бактериальной культуры и экспрессии белка
- Переведите 100 мл выращенных бактерий в 5 л туберкулеза или LB, содержащих 50 мкг/мл ампициллина и 50 мкг/мл спектиномицина.
- Выращивайте эту культуру при 37 °C в шейкерном инкубаторе до тех пор, пока она не достигнет оптической плотности (OD), измеренной на длине волны 600 нм в диапазоне 2-3 для немаркированных септинов или 0,6-0,8 для msfGFP/mEGFP-меченых септинов, и индуцируйте экспрессию белка путем добавления конечной концентрации 0,5 мМ IPTG. Более низкий OD для меченых септинов заключается в том, чтобы избежать достижения фазы смерти в течение более длительного времени экспрессии, как подробно описано на следующем шаге.
- Инкубируют клетки, экспрессирующие немаркированные гетероолигомеры септина, в течение 3 ч при 37 °C или клетки, экспрессирующие меченые msfGFP гетероолигомеры в течение ночи при 17 °C.
ПРИМЕЧАНИЕ: Короткое время экспрессии белка для немаркированных комплексов, облегчаемое использованием более богатой среды туберкулеза, выбрано для предотвращения деградации белка. Более длительное время выражения в сочетании с более низкой температурой для маркированных комплексов выбрано для обеспечения правильного складывания тега msfGFP.
- Бактериальный лизис и осветление лизата
ПРИМЕЧАНИЕ: Начиная с этого момента в процедуре очистки, держите содержащий белок раствор на льду или при 4 °C в любое время, чтобы предотвратить деградацию протеолитического белка или потерю активности.- Соберите культивируемые клетки путем центрифугирования при 4000 х г в течение 20 мин при 4 °C. Выбросьте супернатант.
- При желании заморозьте гранулы на этом этапе и храните при температуре −80 °C в течение максимум 6 месяцев. Если выбран этот вариант, обязательно разморозьте гранулу на льду, прежде чем продолжить.
- Растворить гранулу в 100 мл лизисного буфера (табл. 2) и лизировать клетки. Выберите один из двух вариантов ниже
- Обработка ультразвуком в 7 циклов 30 с ON и 59 s OFF с наконечником ультразвукового аппарата с использованием амплитуды 30% (обратите внимание, что настройки зависят от ультразвука).
- Разбейте ячейки во французском прессе, пройдя их не менее 3х.
- Осветлите клеточный лизат центрифугированием при 20 000 х г в течение 30 мин при 4 °C и сохраните супернатант. Рекомендуется начинать с шага 1.5.1. во время этой центробежной стадии.
- Необязательно возьмите образец для денатурирующего электрофореза, как описано в разделе 2.
- Соберите культивируемые клетки путем центрифугирования при 4000 х г в течение 20 мин при 4 °C. Выбросьте супернатант.
- Аффинная хроматография для белков, помеченных His
ПРИМЕЧАНИЕ: На этом этапе получаются комплексы, содержащие человеческий SEPT2 или Drosophila Sep1, используя никелевую колонну (рисунок 1B).- Уравновешивают предварительно упакованную никель-сефарозную высокоэффективную хроматографическую колонку с септиновой буфером (табл. 2).
- Загрузите осветленный супернатант на колонку со скоростью 1 мл/мин и промыть связанный белок по меньшей мере тремя колонными объемами септинового буфера.
- Элюируют комплексы септина 50% буфером элюирования HisTrap (таблица 2) при 1 мл/мин при сборе фракций 0,5 мл с получением концентрации имидазола 250 мМ.
- Выбирайте фракции, содержащие комплексы септина, о чем свидетельствует оптическое поглощение элюата при 280 нм, контролируемое онлайн с помощью системы быстрой жидкостной хроматографии белка (FPLC) или после очистки микрообъемным спектрофотометром.
ПРИМЕЧАНИЕ: Имидазол поглощает свет при 280 нм. Это, вероятно, объясняет, почему пик белка не возвращается к нулевой абсорбции после элюирования септина (рисунок 2А).
- Аффинная хроматография для белков, меченных стрептококком II
ПРИМЕЧАНИЕ: На этом этапе получаются комплексы, содержащие либо человеческий SEPT7 (гексамеры), человеческий SEPT9 (октамеры), либо арахис Drosophila с использованием столбика Strep-Tactin (рисунок 1B). Хроматографическая колонка основана на модифицированной системе биотин-стрептавидин. Белок помечен модифицированным биотином (Strep-II-tag), а колонка содержит инженерный стрептавидин (Strep-Tactin). Несмотря на то, что она модифицирована из системы биотин-стрептавидин, нет никаких помех между системой Strep-Tactin-Strep-II-tag и системой биотин-стрептавидин. Описанная система используется для предотвращения вмешательства в анализы восстановления с использованием биотина и стрептавидина.- Уравновешивают предварительно упакованную высокопроизводительную хроматографическую колонку StrepTactin sepharose с септиновой буфером (таблица 2). Нагрузите септинсодержащие фракции, извлеченные из никелевой колонки, со скоростью 1 мл/мин и промывайте связанный белок по меньшей мере тремя колонными объемами септинового буфера.
- Элюируют комплексы септина 100% буфером элюирования StrepTrap (таблица 2) при 1 мл/мин при сборе фракций 0,5 мл с получением концентрации 2,5 мМ дестиобиотина.
ПРИМЕЧАНИЕ: Дестиобиотин в буфере элюирования StrepTrap должен быть растворен свежим. - Выбирайте фракции, содержащие септиновые комплексы, о чем свидетельствует оптическое поглощение элюата при 280 нм, контролируемое онлайн с помощью системы FPLC или после очистки микрообъемным спектрофотометром.
ПРИМЕЧАНИЕ: Денатурирующий электрофорез обычно проводится в этот момент с образцами промывки колонн и фракций септина. Порядок столбцов может быть перевернут с неразличимыми результатами, т.е. уточненным лизатом после шага 1.4. может подвергаться стрептококковой аффинной хроматографии с последующей никелевой аффинной хроматографией.
- Диализ и хранение
- Чтобы удалить дестиобиотин из окончательного раствора для хранения, диализуют комплексы септина в ~1:300 по отношению объема образца к буферу против буфера септина (таблица 2), дополненного 1 мМ DTT в течение ночи или в течение по меньшей мере 4 ч, при 4 °C с использованием мембраны диализа MWCO 30 кДа.
- Необязательно концентрировать септины с использованием 30 кДа центробежной концентрационной колонны MWCO до желаемой концентрации. Стремитесь к концентрации 5-7 мкМ, измеренной с помощью оптического поглощения раствора при 280 нм и с использованием теоретического коэффициента вымирания, рассчитанного с помощью ProtParam (таблица 3).
- Аликвотируйте белковые комплексы в желаемый размер аликвоты, замораживайте аликвоту и храните ее при −80 °C.
ПРИМЕЧАНИЕ: Рекомендуется не хранить белок более 6 месяцев. Кроме того, рекомендуется проводить регулярные эксперименты по контролю качества, особенно если белок хранится дольше рекомендуемого времени.
2. Контроль качества чистоты и целостности гетероолигомера септина
ПРИМЕЧАНИЕ: Контроль качества гетероолигомеров состоит из набора биохимических и визуальных методов, которые позволяют обнаруживать массу и целостность комплексов септина, присутствующих в растворе.
- Денатурирующий электрофорез для проверки образования гетероолигомера септина с правильными компонентами
- Смешайте 10 мкл выбранных фракций с 10 мкл 2x буфера образцов SDS, загрузите их в сборный гель TGX 4%-15% и заполните систему буфером работы Tris/glycine/SDS.
- Запустите электрофорез в течение 35 мин при 200 В и окрасьте гель (Таблица материалов) для визуализации результатов. Молекулярные массы отдельных белков септина и гетероолигомерных комплексов септина можно найти в таблице 3.
- Измерьте относительную интенсивность каждой полосы внутри каждой полосы, содержащей очищенные септины на контрастно-инвертированном изображении. Сделайте это, вычислив среднюю интенсивность прямоугольников одинакового размера вокруг каждой полосы и прямоугольника одинакового размера в области без какой-либо полосы в одной полосе. Затем нормализуйте значения, разделив интенсивность каждой полосы на интенсивность области без полос.
ПРИМЕЧАНИЕ: Если интенсивность насыщена (например, значения 255 для 8-битного изображения на контрастно-инвертированном изображении), пропустите полосу.
- Ансамблевое усредненное распределение нативных размеров с помощью нативного электрофореза
- Подготовьте 800 мл анодного буфера и 200 мл светло-синего катодного буфера накануне и храните их в холодильнике. Чтобы подготовить анодный буфер, разбавьте 40 мл 20-кратного рабочего буфера 760 мл деионизированной воды типа I (I-вода). Чтобы подготовить светло-синий катодный буфер, разбавьте 10 мл 20-кратного рабочего буфера и 1 мл 20-кратной катодной добавки 189 мл I-воды. Работающий буфер и катодная добавка поставляются с комплектом (Таблица материалов).
- Подготовьте 10 мкл образца путем смешивания ~500 нг септина с необходимым количеством буфера образца (2,5 мкл в данном случае, из-за использования 4-кратного буфера образца; см. Таблицу материалов) и достаточным количеством I-воды для достижения объема 10 мкл.
- Загрузите образцы на гель и заполните систему ледяными анодными и катодными буферами.
- Запустите электрофорез в течение примерно 115 минут при 150 В с источником питания, который не останавливается на низких токах и окрашивает гель (Таблица материалов), чтобы визуализировать результаты. Молекулярные массы отдельных белков и комплексов, рассчитанные на основе последовательности, можно найти в таблице 3.
- Распределение массы одной молекулы с использованием массовой фотометрии с помощью интерферометрической рассеянной микроскопии
- Промывайте 1,5 стеклянные слайды, обжаривая их ультразвуком в ультразвуковом очистителе в течение 5 минут в I-воде, 5 минут в изопропаноле и, наконец, 5 минут в I-воде.
- Высушите две стеклянные горки мягкой струей газообразного азота и поместите каплю 7 мкл раствора 0,01% поли-L-лизина (ФАПЧ) в центр одного из слайдов. Затем поместите центр другого слайда поверх капли ФАПЧ, ориентируя два слайда ортогонально для легкого разделения. Инкубировать в течение 30 с.
- Мойте, погружаясь в стакан с I-водой 1x и непосредственно применяя струю I-воды 2x. Затем высушите две горки потоком газообразного азота. Эти слайды можно хранить в течение примерно 6 недель при комнатной температуре в сухих условиях.
ПРИМЕЧАНИЕ: Пометьте сторону слайда, которая обрабатывается ФАПЧ, чтобы правильно запустить эксперимент.
- Мойте, погружаясь в стакан с I-водой 1x и непосредственно применяя струю I-воды 2x. Затем высушите две горки потоком газообразного азота. Эти слайды можно хранить в течение примерно 6 недель при комнатной температуре в сухих условиях.
- Непосредственно перед экспериментом вырежьте кусок из 2 x 2, 3 x 2 или 3 x 3 прокладок (которые дают 4, 6 или 9 камер изображений / слайдов соответственно) и наклейте его на обработанную ФАПЧ часть стеклянного слайда, избегая контакта стеклянного слайда и прокладок с любой грязной поверхностью. Поместите затвор на легкую салфетку стеклоочистителя и надавите на прокладки наконечником пипетки, чтобы приклеить их к защитному пластику, все еще находящемуся на прокладках.
- Нагрейте буфер септина (таблица 2) до комнатной температуры и разморозьте белки в руке (после этого держите их на льду).
ПРИМЕЧАНИЕ: iSCAT показывает сигнал некоторых моющих средств и небольших молекул, которые напоминают белковые сигналы45. DTT является одной из тех маленьких молекул, и именно поэтому он не используется для этого эксперимента. Есть только следЫ DTT, исходящие от накопленного септина. - Поместите слайд с прокладками на коммерческую массовую фотометрическую систему, содержащую 19 мкл буфера септина, и сфокусируйте микроскоп с помощью опции автофокусировки. Следуйте инструкциям производителя, чтобы проверить правильность найденного фокуса. Здесь используется стандартная цель 100x, которая является частью настройки.
- Создайте или загрузите папку проекта для хранения данных с помощью файлового > нового проекта или файла > загрузить проект.
- Пипетка 1 мкл образца на 19 мкл буферной капли септина (шаг 2.3.5), используемая для фокусировки и смешивания при минимизации движения слайда, не касаясь при этом ничего. Затем запишите 6000-кадровое видео, нажав кнопку «Запись».
- Для корректного анализа запишите следующие образцы: буфер септина, стандарт массы белка для калибровки отношения сигнал/масса (если имеется недавняя калибровка и условия окружающей среды не изменились, этот образец можно пропустить) и 250 нМ септиновых комплексов, разбавленных в септиновом буфере без DTT (это дает конечную концентрацию ~12,5 нМ).
- Проанализируйте видео с помощью программного обеспечения производителя, чтобы получить распределение белковой массы. Проверьте наличие данных хорошего качества следующим образом.
- Если пики различных размеров гетероолигомеров септина перекрываются слишком сильно или обнаруживается слишком много событий (>3 500 событий для видео с 6 000 кадров с обычным полем зрения 128 пикселей x 34 пикселя, охватывающих 10,8 мкм x 2,9 мкм), уменьшите конечную концентрацию септина и снова измерьте.
- Если не хватает количества измеренных одиночных молекул (не менее 2 500-3 500 для 6 000-кадрового видео с обычным полем зрения), увеличьте концентрацию септина и снова измерьте.
- Прямая визуализация септиновых комплексов с помощью электронной микроскопии с отрицательным пятном
- Развести образцы до концентрации около 50 нМ в септиновом буфере и приготовить окрашивающий раствор (2% уранилформиат или уранилацетат в I-воде).
ПРИМЕЧАНИЕ: Формат уранил должен быть приготовлен в свежем виде. - Пипетка 4 мкл разбавленных септинов на тлеющей разряженной электронной микроскопической сетке и инкубируется в течение 30 с.
- Удалите большую часть белкового раствора с помощью фильтровальной бумаги и промыть сетку 2x с буфером септина и 1x с I-водой, чтобы удалить слабо адсорбированные септины.
- Окрашивают 2% раствором уранилацетата или уранилформиата в I-воде в течение 1 мин, впитывают окрашивающий раствор фильтровальной бумагой, а сетку высушивают на воздухе в течение нескольких минут.
- Экран сетки с помощью правильно выровненного просвечивающего электронного микроскопа для поиска областей усиленного пятна и сбора около 100 изображений в этих выбранных областях.
- Собирайте изображения с увеличением не менее 50 000x для получения размера пикселя около 2 Å/пиксель и с расфокусировкой, варьирующейся от −1 мкм до −2 мкм. Используйте напряжение ускорения 200 кВ. Предпочтительно использовать автоматизированную процедуру сбора данных, которая будет зависеть от доступного программного обеспечения для сбора.
- Выполняйте обработку 2D-изображений с помощью специального программного обеспечения
- Выложите не менее 2000 частиц с помощью специального программного обеспечения46.
- Выполняйте двумерное выравнивание и классификацию итеративно до тех пор, пока классы не будут получены без дальнейшего улучшения. Первый этап выравнивания и классификации должен быть без ссылок, чтобы избежать каких-либо смещений в классификации.
- Используйте средние значения, полученные в результате первой безреференсной классификации, в качестве новых ссылок для проведения дополнительного раунда классификации. Повторяйте этот процесс итеративно до тех пор, пока не будет достигнуто дальнейшее улучшение. Убедитесь, что каждый класс основан на 50-100 отобранных частицах, и отдельные субъединицы хорошо видны. Можно использовать различные программные средства (Spider, Eman или Relion)46,47,48.
- Развести образцы до концентрации около 50 нМ в септиновом буфере и приготовить окрашивающий раствор (2% уранилформиат или уранилацетат в I-воде).
3. Функциональный контроль качества септина с помощью полимеризационного анализа
ПРИМЕЧАНИЕ: Функциональный контроль качества состоит из набора методов визуализации, которые позволяют обнаруживать полимеризованные септиновые комплексы. Ниже немаркированные септины называются «темными» септинами, а буфер, используемый для полимеризации немаркированных септинов, называется «темным» буфером полимеризации септина (SPB).
- Визуализация септинового пучка с помощью флуоресцентной микроскопии
- Готовят 5x fluoSPB (таблица 2) и смесь септина, состоящую из 90% темного септина и 10% msfGFP-септина при шестикратно более высокой концентрации, чем желаемая конечная концентрация в буфере септина + 1 мМ DTT. Типичная концентрация для этого анализа составляет 300 нМ, и, следовательно, концентрация составляет 1 800 нМ для этой смеси.
- Полимеризуйте септин путем смешивания в этом конкретном порядке I-воды (достаточной для пополнения до конечного желаемого объема), 20% 5xfluoSPB (окончательное разбавление 1:5), 0,05 мкМ PCD и 16,67% септиновой смеси (окончательное разведение 1:6). Для 10 мкл смешайте 6,23 мкл I-воды, 2 мкл 5xfluoSPB, 0,1 мкл PCD (с запасом 5 мкМ) и 1,67 мкл септиновой смеси. Инкубировать эту смесь не менее 30 мин при комнатной температуре.
- Добавьте образцы в камеру визуализации, промытую флюоСПБ (таблица 2), и визуализируйте пучки септина. ФАПЧ-ПЭГ-пассивированные проточные каналы, как описано в предыдущем исследовании10,32, хорошо работают для этого эксперимента.
- Септиновый пучок воображения с помощью электронной микроскопии с отрицательным пятном пропускания
- Готовят 5x darkSPB (таблица 2) и смесь септина, состоящую из 100% темного септина в шестикратно более высокой концентрации, чем желаемая конечная концентрация в буфере септина + 1 мМ DTT. Типичная концентрация для этого анализа составляет 300 нМ, и, следовательно, концентрация составляет 1 800 нМ для этой смеси.
- Полимеризуйте комплексы септина путем смешивания в этом конкретном порядке I-воды (достаточной для пополнения до конечного желаемого объема), 20% 5xdarkSPB и 16,67% септиновой смеси. Для 5 мкл смешайте 3,16 мкл I-воды, 1 мкл 5x темного SPB и 0,83 мкл смеси септина. Инкубировать эту смесь не менее 30 мин при комнатной температуре.
- Добавьте 3-5 мкл образца в сетку электронной микроскопии с тлеющим разрядом и инкубируйте в течение 1 мин. Затем промыть сетку 2x темным SPB (таблица 2), впитав жидкость фильтровальной бумагой и добавив каплю темного буфера SPB, промыть 1x I-водой, инкубировать в течение ~30 с 2% уранилацетатом, промокнуть пятно и высушить образец на воздухе в течение нескольких минут.
- Изобразите пучки септина при 120 кВ и увеличения от 5000x до 6000x со расфокусировкой от 1 до 2 мкм.
Результаты
Как упоминалось в протоколе, 5 л клеток E. coli , трансформированных совместно с двумя септин-экспрессирующими плазмидами, были выращены, и экспрессия септинов была индуцирована добавлением IPTG. Через 3 ч клетки собирали центрифугированием, повторно суспендировали в буфере лизиса и лизировали ультразвуком. Затем лизат осветляли центрифугированием, а осветленный раствор наносили на колонку HisTrap (рисунок 2А). После первой очистки септинсодержащие фракции объединяли и наносили на столб StrepTrap (рисунок 2B). Это обычно дает около 3-5 мл ~ 1 мкМ септинового комплекса. Перед объединением септинсодержащих фракций денатурирующий гель-электрофорез может быть использован для проверки целостности субъединиц септина и эквимолярного стехиометрического соотношения между различными субъединицами септина, образующими комплекс. (Рисунок 3А). Если гель показывает аналогичные интенсивные полосы, соответствующие молекулярным массам (таблица 3) субъединиц септина, протокол может быть продолжен. Если нет, рекомендуется запустить протокол заново. В примере, показанном для октамера септина человека с SEPT9_i1, на рисунке 3А четко показаны полосы, соответствующие SEPT9_i1, SEPT6, SEPT7 и SEPT2 (в порядке сверху вниз) с аналогичной интенсивностью; 99% доверительный интервал нормализованной интенсивности составил 1,128 ± 0,048 для SEPT2, 1,092 ± 0,034 для SEPT6, 1,108 ± 0,040 для SEPT7 и 1,067 ± 0,029 для SEPT9. Если SEPT2 помечен как msfGFP, он сместится очень близко ниже SEPT9_i1. В зависимости от используемой системы электрофореза и наличия C-концевой метки TEV-Strep для SEPT7 (что заставляет ее мигрировать медленнее, чем непомеченная SEPT7), полосы SEPT7 и SEPT6 иногда сливаются из-за их сопоставимых молекулярных масс. Следующим шагом является объединение фракций и диализ их против буфера септина с помощью DTT. После диализа, если концентрация слишком низкая (<2 мкМ) или для экспериментов необходима более высокая концентрация, может быть включен этап концентрации, как описано в протоколе. Концентрации ниже 1 мкМ обычно указывают на плохое функциональное качество септинов. Конечная концентрация комплекса септина между 3,5 мкМ и 7 мкМ хорошо работает для большинства анализов in vitro . Эти концентрации обычно получают, когда объем после концентрации достигает 0,5-1 мл.
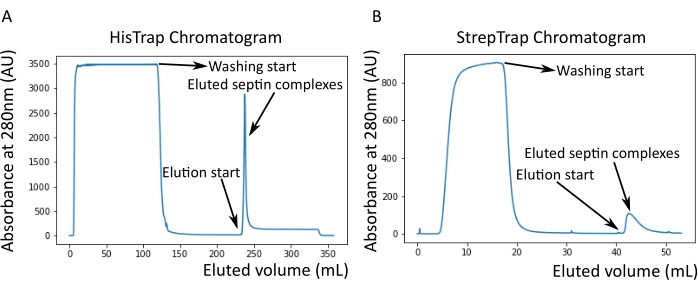
Рисунок 2: Пример хроматограмм, соответствующих очистке темного человеческого септина octamers_9i1. (A) Колонковая хроматограмма HisTrap. После пика элюирования септина абсорбция не возвращается к нулю, вероятно, из-за присутствия имидазола в буфере. Объединенная фракция шла от начала пика элюирования до стабилизации поглощения на уровне около 250 мл. (B) Столбчатая хроматограмма StrepTrap. Объединенная фракция шла от начала пика элюирования до тех пор, пока поглощение не вернулось примерно к 0 при 50 мл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Чтобы продолжить контроль качества, был выполнен нативный электрофорез, как описано в протоколе (рисунок 3B). В гелях может наблюдаться большая полоса, соответствующая интактным гетероолигомерам и, как правило, минорная полоса, соответствующая димерам. Человеческие гексамеры находятся немного выше маркерной полосы 242 кДа, в то время как октамеры находятся выше диапазона 480 кДа, выше их расчетной молекулярной массы. Расположение этих полос было проверено с помощью анализа вестерн-блоттинга экстрактов эукариотических клеток32. Маркировка с помощью msfGFP связывает каждый SEPT2 с белком msfGFP. Это вызывает увеличение молекулярной массы септиновых комплексов на 53,4 кДа (молекула 26,7 кДа/мсГФП). Тем не менее, на нативном геле электрофореза кажущаяся молекулярная масса комплексов, помеченных msfGFP, неотличима от молекулярной массы непомеченных комплексов.
Дополнительным методом проверки того, являются ли комплексы септина неповрежденными, является массовая фотометрия с помощью микроскопии iSCAT. iSCAT контролирует световое рассеяние молекул, приземляющихся на стеклянный слайд, усиленный интерференцией эталонного света, обычно отражением лазера на нижней части стеклянного слайда. Затем используется подход фонового вычитания, чтобы придать контраст частицам. Благодаря этой коррекции сигнал показывает положительные и отрицательные значения в зависимости от того, приземляются ли частицы на стекло или удаляются от него49. Обнаруженный сигнал прямо пропорционален молекулярной массе белков50. Таким образом, калибровка сигнал-масса с помощью стандарта массы может определить массу белков образца. На рисунке 3C показан пример октамеров септина человека, содержащих SEPT9_i1. Большинство обнаруженных одиночных частиц (~50%) имеют молекулярную массу, ожидаемую для полных октамеров, содержащих SEPT9_i1 (423 кДа) (рисунок 3C). Есть также частицы с массами между 150-300 кДа, но четкого пика не наблюдается, что указывает на возможное присутствие других видов септина в низком изобилии. Аналогичным образом, большинство обнаруженных одиночных частиц для меченых mEGFP гексамеров Drosophila имеют молекулярную массу, ожидаемую для интактных гексамеров (361 кДа) (рисунок 3D). Дополнительный четкий пик при 241 кДа указывает на наличие стабильных тетрамеров, содержащих два белка арахиса, один DSep1 и один mEGFP-DSep2. Наконец, комплексы септина человека и мухи показывают пик около 80 кДа, который может представлять собой смесь мономеров и димеров, возможно, усиленных следом DTT или любой другой небольшой молекулы, которая агрегируется, показывая пик в положительной стороне графика45.
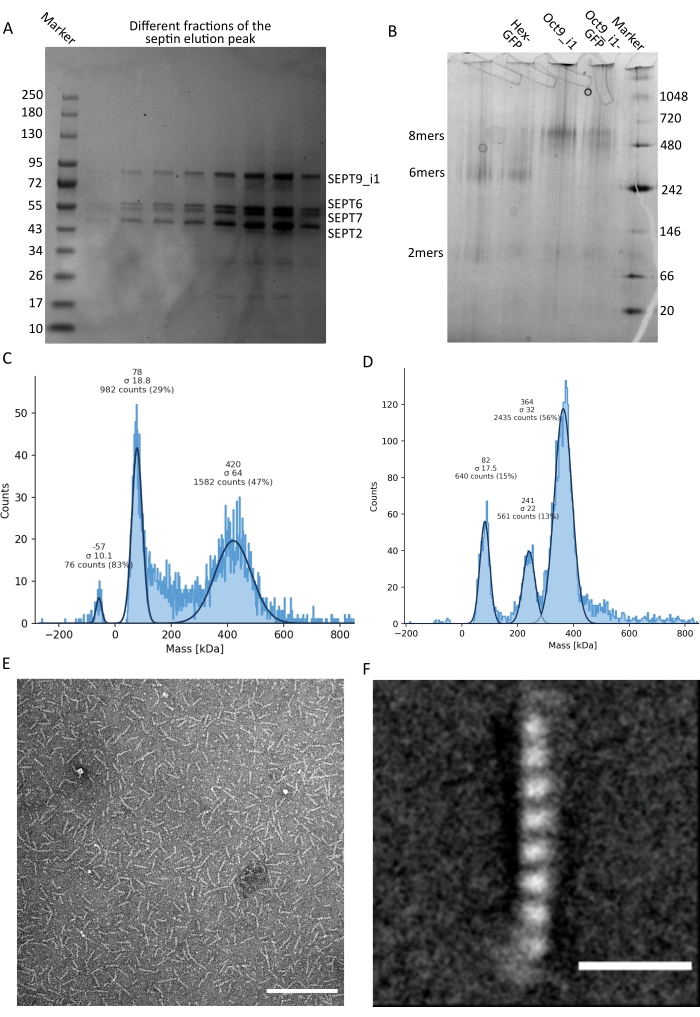
Рисунок 3: Примеры результатов контроля качества олигомера. (A) Пример денатурирующего геля, показывающий различные фракции пика элюирования от очистки темного человеческого септина octamers_9i1. (B) Пример нативного электрофореза различных комплексов септинов. (С,Г) Различные примеры результатов гистограммы массовой фотометрии при 12,5 нМ комплексов септина: (C) темный человеческий септин octamers_9i1 и (D) DSep1-msfGFP Drosophila septin гексамеры. Линии имеют гауссовские припадки. (E) TEM изображение 25 нМ темного человеческого септина octamers_9i1 в буфере септина. Шкала = 200 нм. (F) Среднеклассное изображение SEPT2-msfGFP человеческого септина octamers_9i1. Теги msfGFP видны в виде нечетких плотностей на двух концах. Шкала = 10 нм. Панели (E) и (F) являются авторским правом Компании биологов и были адаптированы из Iv et al.10 с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Учитывая, что и нативные гели, и iSCAT предоставляют только ансамблевую усредненную информацию, для проверки целостности и чистоты комплексов путем прямой визуализации использовалось усреднение классов пропускных электронных микроскопических изображений одиночных септиновых олигомеров. На снимках TEM комплексов септина в буфере септина можно наблюдать стержни длиной 24 нм (гексамеры) или 32 нм (октамеры). Пример человеческого септина октамера, содержащего SEPT9_i1, можно увидеть на рисунке 3E. При усреднении классов каждая из субъединиц может быть замечена и подсчитана, как видно для октамера человека с тегами msfGFP с SEPT9_i1 на рисунке 3F. В случае, если олигомер флуоресцентно маркирован, на конце стержней можно наблюдать дополнительные плотности, соответствующие SEPT2-msfGFP (рисунок 3F).
Сочетание вышеуказанных методик доказывает, что октамеры (или гексамеры) с правильным стехиометрическим соотношением и высокой чистотой могут быть очищены с использованием описанного протокола. Наконец, последняя проверка контроля качества касается функциональности септиновых комплексов с точки зрения их полимеризующей способности. При наличии низкой концентрации соли (<150 мМ KCl с описанным буфером9), если септины не находятся в присутствии других белков или отрицательно заряженных липидных мембран, они самособираются в пучки9. Септины предотвращают полимеризацию, сохраняя их в буфере хранения, который имеет высокую (300 мМ) концентрацию KCl. Затем гетероолигомеры септина разбавляют в объемном соотношении 1:6 в буфере того же состава, но без KCl для достижения конечной концентрации KCl 50 мМ. Для флуоресцентной визуализации этот буфер дополнен системой очистки кислорода для защиты от фотоотбеливания и подавителем мигания. В микроскопии TIRF небольшие кластеры белков могут наблюдаться в неглубоком поле TIRF (~100 нм; Рисунок 4А,В). На конфокальном микроскопе можно увидеть большие скопления нитевидных структур, плавающих выше в растворе (рисунок 4C). Наконец, с помощью ТЕА можно наблюдать небольшие пучки септина (рисунок 4D), соответствующие кластерам, наблюдаемым TIRF, и большие пучки (рисунок 4E), соответствующие структурам, наблюдаемым с помощью конфокальной микроскопии. Вставки рисунка 4D,E показывают, что оба типа структур состоят из длинных тонких нитей, которые идут параллельно, образуя пучки с коническими концами. Вместе флуоресценция и изображения ТЭМ доказывают, что очищенные комплексы септина могут полимеризоваться в нити, которые, в свою очередь, самособираются в пучки.
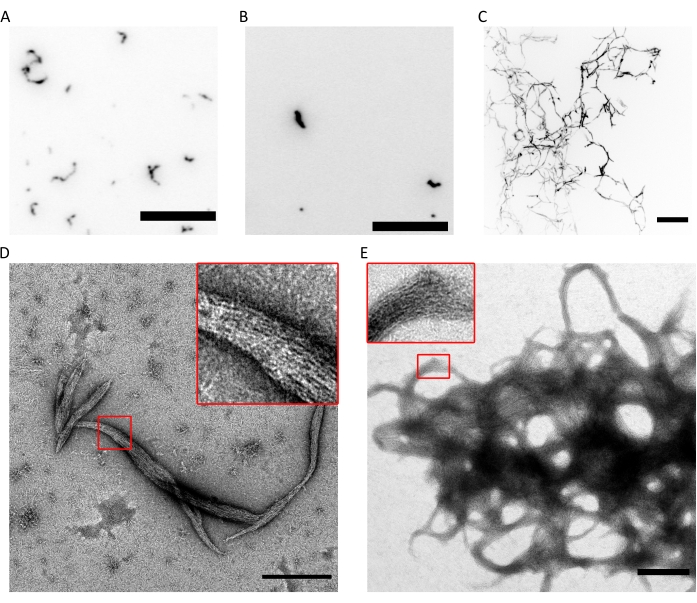
Рисунок 4: Примеры результатов контроля качества способности полимеризации. (A) TIRF изображение 300 нМ гексамиров септина человека (10% гексамеров, меченных msfGFP) в fluoSPB. (B) TIRF изображение октамеров септина человека 300 нМ, содержащих SEPT9_i1 (10% меченых msfGFP octamers9_i1) в fluoSPB. (C) Конфокальные проекции максимальной интенсивности Z-стеков на ~30 мкм с интервалом 0,5 мкм 300 нМ человеческого септина octamers_9i3 в fluoSPB. (А-С) Шкала = 10 мкм и перевернутые оттенки серого. (Д,Д) Пример изображений (D) малых и (E) больших пучков человеческого септина octamers_9i1 в темном SPB. Вставки показывают области, где можно наблюдать четкие нити, идущие параллельно внутри пучка. Шкала стержней = 500 нм. Панели (C-E) защищены авторским правом Компании биологов и были адаптированы из Iv et al.10 с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Список плазмид. Плазмиды для очистки олигомеров септина по этому протоколу. Все плазмиды были отложены в Addgene (первая колонка). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Список буферов. Буферные композиции, используемые для очистки и контроля качества олигомеров септина. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 3: Молекулярные массы и коэффициенты вымирания. Список молекулярных масс (MW) и коэффициентов оптического вымирания (ε) на длине волны 280 нм, рассчитанный с помощью ProtParam на основе последовательностей комплекса, предполагающих линейное слияние субъединиц септина, различных комплексов септина и уникальных субъединиц септина (только MW), которые могут быть очищены плазмидами, перечисленными в таблице 1. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Метод, описанный здесь, обеспечивает надежную очистку и контроль качества предварительно сформированных гетероолигомеров септина. Некоторые из ключевых вопросов, которые необходимо учитывать для правильного применения метода, заключаются в следующем. Во время стадий элюирования в хроматографических разделениях важно использовать рекомендуемую (или более низкую) скорость потока, чтобы свести к минимуму разбавление септиновых комплексов. Кроме того, чтобы максимизировать восстановление белка на конечной стадии концентрации, колонна концентратора ориентирована таким образом, чтобы раствор не прижимался к фильтру (когда с одной стороны есть только фильтр). Если раствор поступает непосредственно в фильтр, белок прилипает к нему гораздо больше, существенно уменьшая конечный выход. Также важно учитывать, что этап концентрации не всегда необходим. Отбор фракций только из узкого диапазона вокруг пика в хроматограмме обычно дает достаточно высокую концентрацию запаса (>3000 нМ) для многих приложений восстановления (которые обычно работают между 10-300 нМ). Наконец, для контроля качества функциональности септиновых комплексов методом флуоресцентной микроскопии важно правильно пассивировать поверхность микроскопических слайдов, так как септиновые комплексы жадно прилипают к стеклу. Пассивация стеклянных слайдов может осуществляться либо путем функционализации ФАПЧ-ПЭГ, либо путем образования нейтральных (100% DOPC) поддерживаемых липидных бислоев 11,32.
По сравнению с исходным протоколом очистки, впервые описанным в Iv et al.10, наблюдается изменение буферных композиций (таблица 2). КонцентрацияMgCl2 снижена с 5 мМ до 2 мМ, а концентрация и рН Tris-HCl снижены с 50 мМ до 20 мМ и с 8,0 до 7,4 соответственно. Эти изменения были сделаны, чтобы сделать буферные условия совместимыми с исследованиями взаимодействия человеческих септинов с липидными бислоями, актиновыми нитями и микротрубочками 10,11,32. Это связано с тем, что авторы сформировали поддерживаемые липидные бислои и полимеризованный актин в F-буфере, состав которого идентичен составу темного SPB, за исключением присутствия АТФ в F-буфере. Изменение буфера не привело к каким-либо изменениям в качестве или сроке службы очищенных септинов по сравнению с исходными буферами.
Этот способ очищения до сих пор имеет ряд ограничений. Во-первых, различные попытки очистки могут различаться по выходу (0,5-1 мл комплексов септина 2-5 мкМ) и функциональному качеству, что подтверждается способностью образования пучка очищенных комплексов септина. Вот почему очень важно последовательно выполнять проверки качества, описанные в этой статье. Очень хороший контроль времени экспрессии и оптической плотности бактериальной культуры может помочь смягчить разницу в урожайности. Во-вторых, этот очистительный трубопровод не может различать тримеры и гексамеры или тетрамеры и октамеры (рисунок 1B). Тем не менее, эксперименты по контролю качества могут быть использованы для доказательства того, что большинство комплексов септина находятся в своей длинной олигомерной форме. В случае, если требуется еще более узкое распределение размеров олигомеров, хроматография исключения размера может быть вставлена между этапом 1.6. и шаг 1.7. протокола очистки. Этот необязательный шаг, однако, резко снижает урожайность, и он не рекомендуется, если это строго не необходимо. Последнее, более фундаментальное, ограничение связано с использованием E. coli в качестве системы экспрессии для рекомбинантных комплексов септина. Естественно, эта система не допускает посттрансляционных модификаций (ПТМ), о которых сообщалось в клетках животных, таких как фосфорилирование, ацетилирование и сумоилирование 6,51,52,53. Эти посттрансляционные модификации могут быть добавлены путем реализации аналогичной стратегии очистки в клетках насекомых или человека. Кроме того, в этой статье обсуждается только восстановление септинов само по себе, но исследования в клетках показывают, что регуляторные белки, такие как белки из семейства Борга54,55 и анилин 24,25,56, могут оказывать существенное, но плохо изученное влияние на сборку и функции септинов и, следовательно, важны для последующего включения в in vitro. учёба. Протоколов для очистки белков Борга и аниллина было зарегистрировано54,57.
Протокол очистки септина, о котором сообщается здесь, предлагает стандартизированный способ очистки септинов в их олигомерной форме с правильной субъединицей стехиометрии, предлагая важный прогресс по сравнению со многими более ранними исследованиями in vitro, основанными на одиночных субъединицах септина. Несмотря на то, что некоторые септины в определенных контекстах могут действовать как одна субъединица2, современная литература убедительно свидетельствует о том, что в клетках животных септины в основном функционируют в комплексах 9,58. Поэтому использование предварительно сформированных гетероолигомеров, таких как описанные в этой статье и других 10,11,18,32,35,36,37, имеет большое значение для изучения структурных и биофизических свойств септинов in vitro. восстановление для рассечения их функций в клетке. Кроме того, септины являются самособирающимися белками со многими партнерами по взаимодействию, включая мембрану и цитоскелет, что делает их очень интересными для синтетической биологии снизу вверх 59,60,61 и исследований белковых изменений биофизических свойств мембраны, таких как кривизна 42,62,63.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих или финансовых интересов.
Благодарности
Мы благодарим Сесилию де Агрела Пинто, Томаса де Гарай и Катарину Хойсерманн за их помощь в экспериментах по массовой фотометрии (iSCAT); Арьен Якоби и Вил Эверс за помощь в работе с ТЕА; Лючию Бальдауф за помощь в работе МДП; Паскаль Вердье-Пинар за советы относительно нативного электрофореза; Агата Шуба и Марджолейн Винкенуг за помощь в организации усилий по очистке септина дрозофилы и визуализации клеток и тканей (PICT-IBiSA), Институт Кюри, член Французской национальной исследовательской инфраструктуры France-BioImaging (ANR10-INBS-04). Это исследование получило финансирование от Нидерландской организации научных исследований (NWO/OCW) через грант «BaSyC-Building a Synthetic Cell» Gravitation (024.003.019) и от Национального агентства по исследованиям (гранты ANR ANR-17-CE13-0014: «SEPTIMORF»; ANR-13-JSV8-0002-01: "SEPTIME"; и ANR-20-CE11-0014-01: "SEPTSCORT").
Материалы
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
Ссылки
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802(2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349(2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76(2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203(2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226(2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190(2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, Pt 3 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420(2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166(2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315(2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены