A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أدوات الموائع الدقيقة للتحقيق في التفاعلات الفطرية الميكروبية على المستوى الخلوي
In This Article
Summary
نظرا لعتامة التربة ، لا يمكن بسهولة تصور التفاعلات بين الميكروبات المكونة لها بدقة خلوية. هنا ، يتم تقديم أداتين للسوائل الدقيقة ، والتي توفر فرصا جديدة للتحقيق في التفاعلات الفطرية الميكروبية. الأجهزة متعددة الاستخدامات وسهلة الاستخدام ، مما يتيح التحكم الزماني المكاني العالي والتصوير عالي الدقة على المستوى الخلوي.
Abstract
الفطريات الخيطية هي سكان ناجحون في التربة وتلعب دورا رئيسيا في النظم الإيكولوجية للتربة ، مثل تحلل المواد العضوية وغير العضوية ، وكذلك تنظيم مستويات المغذيات. هناك يجدون أيضا العديد من الفرص للتفاعل مع مجموعة متنوعة من الميكروبات الأخرى مثل البكتيريا أو الفطريات الأخرى. ومع ذلك ، فإن دراسة التفاعلات الفطرية على المستوى الخلوي يمكن أن تكون صعبة بسبب طبيعة التربة الشبيهة بالصندوق الأسود. ويجري تطوير أدوات جديدة للموائع الدقيقة لدراسة التفاعلات الفطرية؛ يتم تسليط الضوء على منصتين مصممتين لدراسة التفاعلات البكتيرية الفطرية والفطرية والفطرية. داخل هذه القنوات الدقيقة ، يمكن مراقبة التفاعلات الفطرية الميكروبية في بيئات فيزيائية كيميائية خاضعة للرقابة بدقة زمنية ومكانية أعلى مما كان ممكنا في السابق. وقد أسفر تطبيق هذه الأدوات عن العديد من الرؤى البيولوجية الجديدة، مثل ملاحظة الارتباط القطبي البكتيري بالهيفاي أو الكشف عن العداوات الفطرية الفطرية غير المميزة. ومن السمات الرئيسية لهذه المنهجيات سهولة استخدام هذه الأداة من قبل غير الخبراء، مما ينتج عنه تكنولوجيات قابلة للترجمة بدرجة عالية لاستخدامها في مختبرات علم الأحياء الدقيقة.
Introduction
التربة هي بيئة متنوعة بشكل استثنائي تحتوي على وفرة من الكائنات الحية الدقيقة التي لها دور أساسي في دورات الكربون والفوسفور 1,2. الفطريات الخيطية هي عنصر رئيسي في العديد من النظم الإيكولوجية كمتحللة للمواد العضوية وغير العضوية ويمكن أن تعزز تغذية النباتات من خلال تشكيل علاقات تكافلية 3,4. داخل التربة ، تتفاعل الفطريات ديناميكيا مع العديد من الميكروبات مثل الفطريات الأخرى5 والبكتيريا6 والفيروسات7 والديدان الخيطية8. هذه التفاعلات لها عواقب وخيمة على صحة التربة والنبات. ومع ذلك، وبسبب الافتقار إلى النظم التجريبية المناسبة القادرة على تصوير الكائنات الحية الدقيقة المتفاعلة بدقة عالية، لا يزال العديد منها غير محدد.
وللتحقيقات المتعلقة بالتفاعلات البكتيرية الفطرية والتفاعلات الفطرية والفطرية تطبيقات قيمة في طائفة من المجالات، بما في ذلك مضادات الميكروبات في الطب وعوامل المكافحة البيولوجية في الزراعة. على سبيل المثال ، ينتج الفطر Coprinopsis cinerea الببتيد copsin، الذي ثبت أنه يظهر نشاطا مضادا للبكتيريا ضد العامل الممرض البشري Listeria monocytogenes9. وبالمثل ، يستخدم المركب المشتق من الفطريات ، griseofulvin ، على نطاق واسع كعلاج للعدوى الفطرية البشرية ، بالإضافة إلى أنه قادر على تثبيط نمو الفطريات المسببة للأمراض النباتية Alternaria solani10,11. كما ثبت أن العديد من سلالات بكتيريا Bacillus subtilis التي تعيش في التربة هي عوامل فعالة للمكافحة الحيوية للنبات الفطري الممرض Rhizoctonia solani12,13. ومع ذلك، ونظرا للقيود المرتبطة بالمنهجيات التقليدية، فإن مؤسسات التمويل الدولية ومؤسسات التمويل الأجنبي غير مفهومة بشكل جيد على مستوى الخلايا المفردة.
عادة ما تستكشف الدراسات التقليدية BFIs و FFIs على النطاق الكلي باستخدام ألواح أجار مع نوعين أو أكثر في المواجهة. يتم تقييم تفاعلها عن طريق قياس معدلات النمو وإنتاج الأيض للأنواع المواجهة14،15،16 ؛ ومع ذلك ، يتم حل هذه المنهجية فقط على مستوى المستعمرة. لدراسة التفاعلات على المستوى الخلوي ، يمكن زراعة اللقاحات البكتيرية والفطرية على شرائح المجهر الزجاجية المغلفة بالأجار والتي يتم تصويرها بعد ذلك تحت المجهر17. ومع ذلك ، قد يكون من الصعب اتباع hypha واحد باستخدام شرائح المجهر بسبب عدم وجود حبس ، مما يعني أنه من الصعب الحصول على صور الفاصل الزمني. علاوة على ذلك ، فإن فرصة حصر الكائنات الحية الدقيقة الأخرى مكانيا داخل مناطق محددة من الميسيليوم الفطري أو إنشاء بيئات كيميائية محددة يمكن إزعاجها ، على سبيل المثال ، غير ممكنة في مثل هذه الإعدادات. تضيف طبيعة "الصندوق الأسود" للتربة أيضا إلى تعقيد دراسة التفاعلات الفطرية الميكروبية على مستوى الخلايا المفردة18. من خلال مراقبة الأنواع المتفاعلة بعيدا عن التنوع المذهل لميكروبيوم التربة ، يمكن تقييم الطريقة الدقيقة التي يتفاعل بها الأعضاء الأفراد. وبالتالي ، هناك حاجة مستمرة إلى منصات متعددة الاستخدامات تمكن من التصوير عالي الدقة وخلية واحدة ل BFIs و FFIs.
توفر تقنيات الموائع الدقيقة ، ما يسمى بأنظمة المختبر على رقاقة ، منصة مثالية لدراسة BFIs و FFIs على مستوى الخلايا المفردة. تم اعتماد مجال الموائع الدقيقة ، الناشئة عن التقنيات المطورة للتحليل الكيميائي والإلكترونيات الدقيقة ، من قبل العلوم البيولوجية19. تنظم تقنيات الموائع الدقيقة كميات صغيرة من السوائل داخل شبكة مخصصة من القنوات المصغرة ، لها بعد واحد على الأقل على مقياس الميكرومتر ، ويتوسع استخدامها في الأبحاث البيولوجية20. على وجه الخصوص ، تم تطوير أجهزة الموائع الدقيقة لدراسة نمو الفطريات الخيطية21،22،23،24،25،26،27،28،29،30. إحدى فوائد استخدام هذه التكنولوجيا هي أن حبس hyphae وتوزيع العناصر الغذائية داخل القنوات الدقيقة يشبه إلى حد كبير بنية بيئة التربة أكثر من طرق الأجار التقليدية31. في الآونة الأخيرة ، تم استخدام منصات الموائع الدقيقة للتحقيق في التفاعلات بين العدلات البشرية ومسببات الأمراض الفطرية32 ، والبكتيريا وجذور النباتات 33 ، وكذلك الفطريات والديدان الخيطية34,35.
واحدة من المزايا العديدة لاستخدام الموائع الدقيقة لدراسة التفاعلات الميكروبية تشمل التحكم المحدد في بيئة القنوات الدقيقة. على سبيل المثال ، يمكن استغلال أنظمة التدفق الرقائقي لتوليد تدرجات تركيز محددة ، وهو أمر مفيد بشكل خاص عند فحص التاكسي الكيميائي البكتيري36. ميزة أخرى هي أن الطبيعة الشفافة ل poly (dimethylsiloxane) (PDMS) ، وهو بوليمر مطاطي غير مكلف ومتوافق حيويا يستخدم عادة في تصنيع أجهزة الموائع الدقيقة ، يسهل التصوير عالي الدقة للخلايا المفردة باستخدام المجهر الساطع والفلوري37. وبالمثل ، فإن حبس الميكروبات داخل القنوات الدقيقة يعني أنه يمكن إجراء تجارب الفاصل الزمني التي تتعقب الخلايا المفردة ، مما يسمح بتسجيل الاستجابات الخلوية الفردية وتحديدها كميا37. وأخيرا، بما أنه يمكن تصميم أجهزة الموائع الدقيقة لتكون سهلة الاستخدام، يمكن استخدامها بسهولة من قبل غير الخبراء38.
ومن المهم تعزيز المعرفة بالتفاعلات بين الكائنات الحية الدقيقة التي تعيش في التربة لتحسين ممارسات الإدارة المستدامة للنظم الإيكولوجية التي تحافظ على التنوع البيولوجي وللتخفيف من أثر تغير المناخ على البيئات الأرضية39. وبالتالي ، فإن تطوير أدوات جديدة للموائع الدقيقة أمر أساسي لتوسيع فهم الفطريات وتفاعلاتها على المستوى الخلوي. وسيركز البروتوكول هنا على جهازين من أجهزة الموائع الدقيقة المنتجة لدراسة BFIs40 و FFIs41 كما هو موضح في الشكل 1.

الشكل 1: التمثيل البصري والتخطيطي لأجهزة التفاعل البكتيري الفطري (BFI) والتفاعل الفطري الفطري (FFI). (أ) صورة لجهاز BFI. يتم وضع قابس mycelial عند مدخل أحد طرفي القنوات الدقيقة للسماح بنمو hyphal في الجهاز. المدخل البكتيري في الطرف المعاكس. شريط المقياس = 5 مم (B) نظرة عامة تخطيطية على جهاز BFI ، تصور موضع المداخل البكتيرية واتجاه نمو الواصلة من خلال القنوات الدقيقة التفاعلية. يبلغ عمق القنوات 10 ميكرومتر وعرضها 100 ميكرومتر وطولها 7 مم ، مع 28 قناة مراقبة في المجموع. (ج) فحص المواجهة على صفيحة أجار بين Coprinopsis cinerea و Bacillus subtilis NCIB 3610 ، شريط المقياس = 20 مم (يسار). صور مجهرية تظهر التفاعل بين C. cinerea و B. subtilis NCIB 3610 داخل القناة الدقيقة (الوسطى واليمنى) ، أي التعلق القطبي للبكتيريا ب hyphae الفطرية. شريط المقياس = 25 ميكرومتر (وسط) و 10 ميكرومتر (يمين). (د) صورة لجهاز FFI مرتبط بطبق بتري ذو قاع زجاجي ، ملقح مزدوج بسدادات mycelial. شريط المقياس = 1 سم (E) نظرة عامة تخطيطية لجهاز FFI. يتم إدخال اثنين من سدادات التطعيم الفطرية في المداخل في أي من طرفي الجهاز ، مما يسمح بالاستكشاف الواصلي للقنوات الدقيقة. ترتبط قنوات التحكم بمدخل فطري واحد فقط ولها قناة مسدودة ، مما يمنع التفاعلات بين فطريات الاختبار. تربط قنوات التفاعل كلا من المداخل الفطرية وتسمح بالتفاعلات الواصلة بين مواضيع الاختبار داخل القناة الدقيقة. تتكون كل قناة تفاعل من 18 قسما على شكل ماس ، يبلغ طولها الإجمالي 8.8 مم (490 × 430 ميكرومتر لكل ماسة) ، وعمقها 10 ميكرومتر ، ولها منطقة ربط بين كل ماسة تبلغ 20 ميكرومتر. يتم تكرار أنواع القنوات ، أشرطة المقياس = 1 مم. (F) منطقة التفاعل بين جبهتين واصليتين تقتربان ، تنمو من طرفي نقيض من قناة التفاعل المترابطة. صورة مجهرية لتباين الطور ، شريط مقياس = 250 ميكرومتر. تم تعديل اللوحات الواردة في هذا الشكل من Stanley et al., 2014 (A-C)40 and Gimeno et al., 2021 (D-F)41. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: يرد ملخص للإجراءات المبينة في هذا البروتوكول بصورة مرئية في الشكل 2.
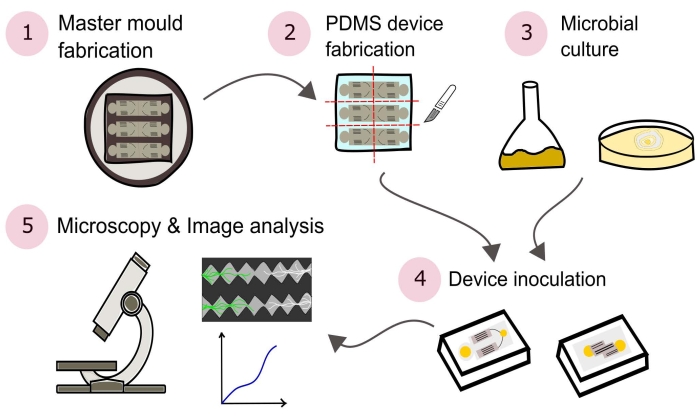
الشكل 2: تمثيل تخطيطي للمنهجية المقدمة يتألف من خمسة أقسام رئيسية مفصلة في هذا البروتوكول. يتم إنشاء تصميمات الأجهزة باستخدام برنامج التصميم بمساعدة الكمبيوتر (CAD) وقالب رئيسي يتم تصنيعه باستخدام الطباعة الحجرية الضوئية (1). يستخدم هذا لصب بولي (ثنائي ميثيل سيلوكسان) (PDMS) ، والذي يتم تقطيعه بعد ذلك إلى ألواح وربطه بأطباق بتري ذات القاع الزجاجي لتشكيل أجهزة الموائع الدقيقة (2). يتم استزراع الميكروبات التي سيتم تضمينها في الدراسة (3) واستخدامها لتلقيح الأجهزة (4). تتم دراسة التفاعلات باستخدام الفحص المجهري وتحديد كميتها باستخدام تقنيات تحليل الصور (5). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. تصنيع العفن الرئيسي
- إنتاج قناع الضوء
- إنشاء تصاميم أجهزة الموائع الدقيقة باستخدام برنامج التصميم بمساعدة الكمبيوتر (CAD). يتم إعطاء أبعاد الأجهزة المعروضة في الشكل 1 ويتم سرد المزيد من التفاصيل حول ميزات التصميم المحددة بشكل شامل في المنشورات المعنية40,41.
- قم بتصدير ملف تصميم CAD باستخدام تنسيق مناسب (على سبيل المثال، .dwg .dxf). اطبع قناع الطباعة الحجرية الضوئية للفيلم عن طريق إرسال ملف تصميم CAD المصدر إلى مزود تجاري للطباعة.
- الطباعة الحجرية الضوئية
ملاحظة: يجب إجراء الخطوات التالية في بيئة خالية من الغبار ويتم التحكم فيها بالضوء، مثل غطاء محرك السيارة الرقائقي أو مرفق الغرفة النظيفة. يتم إعطاء الشروط التجريبية المقدمة هنا كدليل ويجب تحسينها داخليا. يوصي المؤلفون بالبحث عن تدريب محدد واستشارة البروتوكولات المعمول بها42.- تحضير رقاقة السيليكون 100 ملم عن طريق الخبز في فرن على حرارة 200 درجة مئوية لمدة 2 ساعة. قم بتغطية رقاقة السيليكون بمقاومة للضوء SU-8 2010 ، بهدف تحقيق سمك مستهدف يبلغ 10 ميكرومتر ، باستخدام الشروط التالية: 500 دورة في الدقيقة لمدة 10 ثوان (تسارع 100 دورة في الدقيقة / ثانية) و 3000 دورة في الدقيقة لمدة 45 ثانية (تسارع 300 دورة في الدقيقة / ثانية).
تحذير: مقاومة الضوء SU-8 خطرة ، احذر عند التعامل معها ومنع الاستنشاق والاتصال بالجلد. إنه قابل للاشتعال ، يحتمل أن يكون مسرطنا وساما للبيئة. - تخبز رقاقة السيليكون المطلية على حرارة 95 درجة مئوية لمدة 2.5 دقيقة (خبز ناعم). قم بتعريض المقاومة للضوء للأشعة فوق البنفسجية (UV) ، باستخدام قناع الطباعة الحجرية الضوئية للفيلم وجرعة طاقة تبلغ 140 mJ / cm2 عند الطول الموجي 365 nm باستخدام محاذاة قناع.
- تخبز رقاقة السيليكون المطلية على حرارة 95 درجة مئوية لمدة 3.5 دقيقة (خبز ما بعد التعرض). اغمر رقاقة السيليكون وحركها في حل المطور لمدة 3 دقائق للكشف عن الهياكل الدقيقة عن طريق إزالة المقاومة الضوئية غير المكشوفة.
تنبيه: يمكن أن يكون حل المطور قابلا للاشتعال ، واتخاذ الاحتياطات المناسبة عند التعامل معه وتخزينه. - اشطفيه بمحلول مطور جديد لمدة 10 ثوان. شطف مع الكحول الأيزوبروبيل لمدة 10 ثانية وتجفيف الهواء. استخدم الهواء المضغوط المصفى لضمان جفاف الهياكل تماما. قم بقياس ارتفاع هياكل SU-8 ، على سبيل المثال ، باستخدام مقياس التنميط.
- قم بتسييل كل قالب رئيسي ب 50 ميكرولتر من الكلوروتريميثيل سيلان عن طريق تطبيق ضغط فراغ يبلغ 50 مللي بار لمدة 2 ساعة. لاحظ المؤلفون أن إعادة صقل القالب الرئيسي لم يكن ضروريا.
تحذير: كلوروتريميثيل سيلان مادة خطرة. ارتداء معدات الحماية الشخصية المناسبة (PPE) والتعامل معها بعناية. تجنب ملامسة الجلد والعينين ومنع الاستنشاق. يحفظ بعيدا عن مصادر الاشتعال ويستخدم في منطقة جيدة التهوية.
- تحضير رقاقة السيليكون 100 ملم عن طريق الخبز في فرن على حرارة 200 درجة مئوية لمدة 2 ساعة. قم بتغطية رقاقة السيليكون بمقاومة للضوء SU-8 2010 ، بهدف تحقيق سمك مستهدف يبلغ 10 ميكرومتر ، باستخدام الشروط التالية: 500 دورة في الدقيقة لمدة 10 ثوان (تسارع 100 دورة في الدقيقة / ثانية) و 3000 دورة في الدقيقة لمدة 45 ثانية (تسارع 300 دورة في الدقيقة / ثانية).
2. تصنيع الجهاز
ملاحظة: يجب إجراء الخطوات التالية في بيئة خالية من الغبار، مثل غطاء التدفق الرقائقي.
- تحضير ألواح البولي (ثنائي ميثيل سيلوكسان) (PDMS)
- تحضير ما يقرب من 40 غرام من PDMS عن طريق خلط القاعدة جيدا وعامل المعالجة بنسبة 10: 1 باستخدام ملعقة في كوب بلاستيكي نظيف. قم بفك الخليط لإزالة جميع فقاعات الهواء عن طريق وضع الكوب البلاستيكي الذي يحتوي على PDMS في غرفة فراغ (ضغط الفراغ = 50 مللي بار) لمدة 1 ساعة.
- قم بتأمين القالب الرئيسي في حامل بلاستيكي باستخدام شريط شفاف. نظف باستخدام الهواء المصفى المضغوط لإزالة أي جزيئات غبار.
ملاحظة: بدلا من ذلك ، يمكن تشكيل رقائق الألومنيوم حول طبق بتري زجاجي ، ثم استخدامها لإيواء القالب الرئيسي واحتواء PDMS43. - صب خليط PDMS على وسط القالب الرئيسي ، مما يضمن أنه على سطح مستو ، واتركه يستقر.
ملاحظة: يجب سكب خليط PDMS قدر الإمكان على سطح القالب الرئيسي والحفاظ على تدفق مستمر لتقليل إدخال فقاعات الهواء. يمكن إزالة فقاعات الهواء عن طريق توجيه الهواء المضغوط فوق الفقاعة أو عن طريق إخراجها باستخدام إبرة دقيقة. - قم بتغطية القالب الرئيسي بشكل فضفاض بغطاء بلاستيكي لمنع جزيئات الغبار من الاستقرار على سطح PDMS. انقل القالب الرئيسي إلى فرن وقم بمعالجته بين عشية وضحاها عند 70 درجة مئوية.
- أخرج القالب الرئيسي من الفرن واتركه ليبرد. قشر PDMS المعالج بعيدا عن القالب الرئيسي والإطار البلاستيكي ، مع الحرص على تجنب إتلاف القالب الرئيسي / PDMS.
- ضع شريطا شفافا فوق القنوات الدقيقة المنقوشة في PDMS للحفاظ على سطح خال من الغبار. تأكد من إزالة الشريط قبل الترابط.
- قم بقص PDMS إلى ألواح (أي إذا تم تضمين أجهزة متعددة في التصميم على القالب الرئيسي ، فيمكن تصنيع العديد منها من صب واحد) كما هو محدد في التصميم باستخدام مقصلة مثبتة أو شفرة حلاقة. عند قطع الفتحة الجانبية للوح BFI PDMS ، تأكد من أن القنوات الدقيقة مفتوحة بالكامل (الشكل 1A). بالنسبة للوح FFI PDMS ، تأكد من قص كل زاوية لتمكينها من التناسب مع طبق بتري ذي القاع الزجاجي الموضح في الشكل 1D.
- ثقب ثقوب مدخل / مخرج المطلوبة وفقا لتصميم الجهاز. استخدم قاطعا دقيقا لثقب ثقوب المدخل التي تبلغ 3.18 مم و 4.75 مم لأجهزة BFI و FFI النموذجية ، على التوالي.
- ربط ألواح PDMS لإنشاء أجهزة
ملاحظة: تستخدم خطوات الغسيل التالية (2.2.1-2.2.2) منظفا بالموجات فوق الصوتية مملوءا بالماء النقي (ddH2O) عند 37 كيلو هرتز. غسل ألواح PDMS يساعد على تعزيز الترابط الناجح44 وتقليل خطر التلوث. للتعامل مع ألواح PDMS ، استخدم ملقط نظيف وارفعه باستخدام فتحات المدخل لتجنب تلف القنوات الدقيقة أو سطح الجهاز.- غمر ألواح PDMS في 0.5 M NaOH وسونيكات لمدة 5 دقائق. شطف مع DDH2O. معقمة نقل ألواح PDMS إلى محلول الإيثانول 70٪ وسونيكات لمدة 5 دقائق. شطف مع DDH معقمة20.
- اغمر ألواح PDMS في DDH2O المعقمة وسونيكات لمدة 5 دقائق. قم بإزالة ألواح PDMS من ddH2O المعقمة ، وجففها باستخدام الهواء المضغوط المصفى ، وضعها في طبق بتري مربع معقم.
- ضع طبق بتري المربع الذي يحتوي على ألواح PDMS في فرن على درجة حرارة 70 درجة مئوية لمدة 1 ساعة حتى يجف. أخرجه من الفرن واتركه ليبرد في بيئة خالية من الغبار. قم بإزالة أي غبار من سطح ألواح PDMS باستخدام شريط و / أو هواء مضغوط مفلتر.
- قم بتنشيط أسطح ألواح PDMS وأطباق Petri ذات القاع الزجاجي ليتم ربطها باستخدام منظف البلازما مع الإعدادات التالية: ضغط الفراغ 0.75 مللي بار ، الطاقة 50٪ ، وقت الطلاء 1 دقيقة. ضع الأسطح المراد تنشيطها (ثم ربطها) متجهة لأعلى في منظف البلازما.
- قم بإزالة ألواح PDMS وأطباق بتري ذات القاع الزجاجي من منظف البلازما واربطها عن طريق وضع الأسطح المنشطة بلطف في اتصال مطابق مع بعضها البعض. اربط ألواح BFI و FFI PDMS بأطباق Petri ذات القاع الزجاجي التي يبلغ قطرها 35 مم و 50 مم (سمك الزجاج 0.17 مم) ، على التوالي.
ملاحظة: احرص على عدم ممارسة الكثير من الضغط عند الترابط ، لأن هذا يمكن أن يؤدي إلى انهيار القنوات الدقيقة. - تحقق من الترابط الناجح ببساطة عن طريق محاولة سحب لوح PDMS من طبق بتري ذو القاع الزجاجي باستخدام ملاقط. تصور الأجهزة بالعين أو باستخدام الفحص المجهري العام لضمان عدم انهيار مداخل التلقيح أو القنوات الدقيقة.
ملاحظة: بالنسبة للظروف المشبعة (أي الظروف المشبعة بالماء و/أو الغنية بالمغذيات)، تشمل الخطوة 2-2-7 من البروتوكول. إذا كانت الظروف غير المشبعة بالماء مطلوبة، فانتقل إلى الخطوة 2.2.8. يمكن ملء الأجهزة بالماء أو الوسائط. - املأ الأجهزة مباشرة بعد الترابط عن طريق سحب 100 ميكرولتر من المحلول المطلوب لجهاز BFI (المدخل البكتيري والفتحة الجانبية) أو 30 ميكرولتر من الوسائط في كل مدخل (إجمالي 60 ميكرولتر) لجهاز FFI. إذا كانت فقاعات الهواء موجودة ، فسوف تتبدد هذه الفقاعات بعد حوالي 10 دقائق من الملء لأن PDMS يمكن اختراقه.
- أضف ddH2O المعقم (~ 100-200 ميكرولتر) في طبق بتري للحفاظ على الرطوبة.
3. الثقافة الميكروبية
ملاحظة: توفر الخطوات التالية إجراء ميكروبيولوجيا عاما للزراعة الفطرية والبكتيرية ويجب تنفيذه في ظل ظروف معقمة (أي باستخدام كابينة اللهب أو خزانة السلامة الميكروبيولوجية) المناسبة لمستوى الاحتواء المطلوب للميكروبات المطلوبة. يتم إعطاء أمثلة محددة في نهاية كل قسم لنوع من الاهتمام.
- الثقافة الفطرية
- إعداد وسط الثقافة المطلوبة مع تكملة مع agar. أوتوكلاف الوسط عند 121 درجة مئوية لمدة 15 دقيقة. اترك الوسط ليبرد إلى 50 درجة مئوية واسكبه في أطباق بتري قطرها 9 سم ، مع الحفاظ على ظروف معقمة.
- استخدم حفار الفلين لإزالة قابس قطره 4 مم من الأجار يحتوي على الميسيليوم من مستعمرة مخزون الثلاجة من السلالة الفطرية المطلوبة لتنشيط العزلة. يتم إجراء ذلك لضمان نمو موحد وقوي للفطريات قبل تلقيح الجهاز.
ملاحظة: يمكن أيضا تنشيط الميكروبات من مخزون الجلسرين ، أي العزلات الفطرية المخزنة على سدادات أجار في محلول الجلسرين بنسبة 50٪ عند -70 درجة مئوية41. - ضع جانب القابس مع الميسيليوم على اتصال مع سطح الأجار في وسط طبق بتري غير الملقح. استبدل الغطاء الموجود أعلى طبق بتري وأغلقه قبل الحضانة في درجة الحرارة المناسبة للسلالة المطلوبة للفترة الزمنية المطلوبة ، عادة ، حوالي 3 إلى 4 أيام.
ملاحظة: مثال على ظروف الثقافة ل Trichoderma rossicum: أجار مستخلص الشعير ، المحتضن عند 25 درجة مئوية في الظلام لمدة 48 ساعة.
- الثقافة البكتيرية
- قم بإخراج العزل البكتيري المطلوب من مخزون المصدر (على سبيل المثال ، مخزون الجلسرين أو مستعمرة واحدة من صفيحة أجار) على صفيحة أجار لتحقيق مستعمرات بكتيرية واحدة وضمان عدم وجود تلوث45. ختم لوحة مع الفيلم.
- احتضان في درجة حرارة ومدة محددة لعزل الاهتمام حتى يتم ملاحظة المستعمرات الفردية.
- تحضير مرق الثقافة المطلوب. على سبيل المثال ، أضف 10 جم من التربتون و 10 جم من كلوريد الصوديوم و 5 جم من مستخلص الخميرة لكل 1 لتر من ddH2O لإعداد وسط LB لثقافة B. subtilis. أوتوكلاف الوسط عند 121 درجة مئوية لمدة 15 دقيقة.
- اترك الوسط ليبرد إلى درجة حرارة الغرفة. أضف الوسط إلى قارورة ثقافة معقمة داخل بيئة معقمة.
- المس مستعمرة بكتيرية واحدة من صفيحة الأجار باستخدام حلقة تلقيح معقمة. انقل الحلقة الملقحة إلى وسط الثقافة المعقمة عن طريق لمس السائل لفترة وجيزة مع الحلقة.
- أغلق القارورة باستخدام غطاء معقم أو رقائق معدنية ، وضعها داخل حاضنة تهتز طوال الليل باستخدام الإعدادات المناسبة للأنواع المختارة.
ملاحظة: مثال على ظروف الاستزراع ل B. subtilis: i) زراعة السائل - النمو الهوائي عند 37 درجة مئوية عند 200 دورة في الدقيقة في LB المتوسطة و ii) زراعة اللوحة - درجة حرارة الغرفة على لوحة LB agar. ارجع إلى أوراق FFI / BFI40,41 لمزيد من التفاصيل حول زراعة سلالات فطرية مختلفة.
4. تطعيم الجهاز
ملاحظة: يجب أن تتم الخطوات التالية داخل غطاء التدفق الرقائقي باستخدام معدات معقمة.
- التلقيح الفطري
- استخدم حفار الفلين المعقم (ø = 4 مم) لإزالة قابس أجار من المستعمرة على أطراف ثقافة عمرها 3 أيام (الخطوة 3.1). تأكد من أن جبهة الواصلة المتنامية لا تزال سليمة.
- أدخل القابس في المدخل الفطري ، الميسيليوم جانبا لأسفل ، مع اتجاه نمو جبهة الواصلة الموجهة نحو فتحات القنوات الدقيقة لتشجيع تسلل الواصلة للقنوات.
- كرر الخطوات 4.1.1-4.1.2 للأنواع الفطرية الثانية (إذا كنت تستخدم جهاز FFI) ، مع إدخال القابس في المدخل المقابل. في حالة استخدام جهاز BFI، قم بحذف هذه الخطوة وتابع إلى الخطوة 4.1.4.
- أغلق طبق بتري بغشاء شفاف واحتضنه على حرارة 25-28 درجة مئوية في الظلام حتى يبدأ التصوير. تحديد وقت حضانة ما قبل التصوير اعتمادا على الحدث البيولوجي المقصود الذي يجب ملاحظته ، على سبيل المثال ، المواجهات الفطرية الفطرية ، ومعدل نمو الأنواع المضمنة داخل الجهاز.
- التلقيح البكتيري
- تمييع البكتيريا من ثقافة بين عشية وضحاها (الخطوة 3.2) بنسبة 1:25 باستخدام نفس وسط الثقافة كما هو مفصل في الخطوة 3.2.3. ثقافة لمدة 3 ساعات عند 37 درجة مئوية.
- اغسل البكتيريا عن طريق تكوير الثقافة باستخدام جهاز طرد مركزي عند 2000 × g لمدة 10 دقائق. تخلص من المادة الفائقة وأعد تعليق الخلايا في الحجم المطلوب بنسبة 0.9٪ مع محلول كلوريد الصوديوم / V.
- جهاز طرد مركزي مرة أخرى للحصول على بيليه. تخلص من المادة الفائقة وأعد تعليق الخلايا في وسط سائل (على سبيل المثال ، C. cinerea الحد الأدنى من الوسط إلى OD600 من 1). تحسين قيمة OD600 للسلالة البكتيرية المعنية.
- قم بإزالة جهاز BFI من الحاضنة وافتحه في بيئة معقمة. ماصة 10 ميكرولتر من التعليق في مدخل البكتيريا.
ملاحظة: تحسين توقيت التلقيح الدقيق للتفاعلات البكتيرية الفطرية المعنية. على سبيل المثال ، أدخل البكتيريا في جهاز BFI 18 h بعد التلقيح الفطري إذا كنت تستخدم C. cinerea. - أغلق طبق بتري بفيلم شفاف واحتضنه عند 25 درجة مئوية في الظلام حتى يبدأ التصوير. قم بتخزين الجهاز في وضع مستقيم.
5. المجهر وتحليل الصور
- مجهريه
ملاحظة: يجب على الباحث اختيار طريقة التصوير المناسبة التي تتوافق مع طبيعة التجربة المراد إجراؤها ، على سبيل المثال ، التألق المقلوب واسع المجال أو المجهر البؤري. تم تقديم نظرة عامة هنا ، حيث ستعتمد التفاصيل المحددة على سمات الفحص المجهري المختار.- قم بتشغيل كمبيوتر المجهر والجسم الرئيسي للمجهر (إن وجد) والكاميرا والحاضنة التي يتم التحكم في درجة حرارتها ومصدر (مصادر) الضوء. تأكد من أن المجهر قد تم إعداده بشكل صحيح ، على سبيل المثال ، تم تطبيق إضاءة Köhler بشكل صحيح حتى لإضاءة العينة. ابدأ حزمة برامج التصوير.
ملاحظة: عند استخدام حاضنة يتم التحكم في درجة حرارتها، من المهم السماح لدرجة حرارة المجهر بالتوازن لعدة ساعات قبل بدء التجربة. - قم بتركيب جهاز الموائع الدقيقة في إدراج المرحلة. تأكد من أن الجهاز مؤمن بشكل جيد ، أي بشريط لاصق ، لمنع إزاحة الجهاز أثناء حركة المرحلة النشطة.
- احصل على صور للأجهزة الملقحة، على سبيل المثال، إما تجارب أحادية النقطة أو بفاصل زمني. يتم توفير مواصفات التصوير الشاملة ذات الصلة بالتجارب التي أجريت مع أجهزة BFI و FFI في المنشورات المذكورة أعلاه40,41.
ملاحظة: تم الحصول على صور Brightfield باستخدام الفحص المجهري لتباين الطور لتصور انتشار الواصلة من خلال قنوات النمو باستخدام برنامج التركيز البؤري التلقائي وإما التكبير بمعدل 10 أضعاف أو 0.30 NA (فتحة العدسة العددية) أو التكبير 20x أو العدسات الموضوعية 0.45 NA. تم تحقيق إثارة بروتينات المراسل الفلورسنت باستخدام محرك ضوء الصمام الثنائي الباعث للضوء عالي الطاقة مع أطوال موجية خاصة بالفلوروفور. - تصدير الصور إلى تنسيق مناسب لمعالجة الصور اللاحقة. على سبيل المثال ، .tiff.
- قم بتشغيل كمبيوتر المجهر والجسم الرئيسي للمجهر (إن وجد) والكاميرا والحاضنة التي يتم التحكم في درجة حرارتها ومصدر (مصادر) الضوء. تأكد من أن المجهر قد تم إعداده بشكل صحيح ، على سبيل المثال ، تم تطبيق إضاءة Köhler بشكل صحيح حتى لإضاءة العينة. ابدأ حزمة برامج التصوير.
- تحليل الصور
ملاحظة: يوصي المؤلفون فيجي46 كأداة لتحليل الصور ، ولكن تتوفر حزم برامج أخرى. فيما يلي أمثلة على تحليلات الصور التي أجريت باستخدام فيجي من منشورات أجهزة BFI و FFI المقدمة. هذه الخطوات خاصة بجهاز Mac وقد تختلف قليلا عند استخدام جهاز كمبيوتر.- قياسات معدل نمو الواصلة
ملاحظة: تم استخدام هذه الطريقة في مخطوطة BFI40 لقياس معدلات نمو hyphae الفردية.- قم بتنزيل فيجي وتثبيتها وتشغيلها. قم باستيراد تسلسل الصورة من تجربة بفاصل زمني عن طريق تحديد ملف > استيراد > تسلسل صورة. حدد موقع المجلد حيث يتم تخزين البيانات وحدد فتح. في النافذة خيارات التسلسل ، حدد تفضيلات، ثم موافق.
- حدد أيقونة الخط المستقيم من شريط الأدوات الرئيسي. ضع بداية الخط المستقيم عند طرف طرف الواصلة المتنامي بالنقر فوق المؤشر ثم سحبه بشكل متزامن إلى نقطة أخرى داخل النافذة. سيظهر خط أصفر مع ثلاثة مربعات تشير إلى بداية الخط ومنتصفه ونهايته.
- انتقل إلى الإطار التالي في تسلسل الصورة بالضغط مع الاستمرار على Ctrl >. ضع نهاية الخط المستقيم عند طرف الضجيج المتنامي عن طريق تحديد المربع المربع وسحبه إلى الموضع الصحيح.
- اضغط مع الاستمرار على Ctrl وM لقياس طول الخط بالبكسل. ستظهر نافذة النتائج مع البيانات المقاسة. حدد البيانات المعروضة في نافذة النتائج كما يلي: انقر فوق نافذة النتائج، ثم حدد النتائج > تعيين القياسات.
- انتقل إلى الإطار التالي في تسلسل الصورة بالضغط مع الاستمرار على Ctrl ثم >. ضع بداية الخط المستقيم عند طرف الضجيج المتنامي عن طريق تحديد المربع المربع وسحبه إلى الموضع الصحيح.
- اضغط مع الاستمرار على Ctrl ثم M لقياس طول الخط بالبكسل. ستظهر نافذة النتائج مع البيانات المقاسة.
- كرر الخطوات 5.2.1.5-5.2.1.6 حتى الانتهاء من قياس نمو hypha بالبكسل.
- حدد كافة البيانات في نافذة النتائج . انسخ والصق في برنامج آخر ، على سبيل المثال ، جدول بيانات ، لمعالجة البيانات. ارسم نمو الواصلة (بالبكسل أو الميكرومتر) كدالة للوقت واحسب متوسط معدلات النمو. قم بإجراء ما لا يقل عن ثلاثة نسخ بيولوجية لكل تجربة.
- قياسات شدة التألق
ملاحظة: تم استخدام هذه الطريقة في منشور FFI41 لتقييم التغير في شدة التألق في hyphae من Fusarium graminearum 8/1-wt-GFP عند الاتصال ب Clonostachys rosea 016 كدالة للوقت.- قم بتنزيل فيجي وتثبيتها وتشغيلها. قم باستيراد تسلسل الصور من تجربة الفاصل الزمني عن طريق تحديد ملف > استيراد > تسلسل صور. حدد موقع المجلد حيث يتم تخزين البيانات وحدد فتح. في نافذة خيارات التسلسل، حدد تفضيلات ثم موافق.
- حدد منطقة اهتمام (ROI) لقياس شدة التألق المطلقة للضجيج باستخدام الأداة المستطيلة، الموجودة في شريط الأدوات الرئيسي. يمكن تعريف حجم المربع بالضبط كما يلي: تحرير > تحديد > تحديد ؛ يمكن أيضا حفظ عائد الاستثمار للرجوع إليه في المستقبل في مدير عائد الاستثمار عن طريق تحديد تحرير > > إضافة إلى المدير.
- قم بقياس كثافة التألق المطلقة (متوسط القيمة الرمادية) ضمن عائد الاستثمار المحدد لكل صورة في تسلسل الصورة أو المكدس بأكمله كما يلي: مكدسات > الصور > قياس المكدس. سيتم فتح نافذة النتائج تلقائيا بمجرد معالجة جميع الصور الموجودة في المكدس.
ملاحظة: يمكن تعريف البيانات المعروضة في نافذة النتائج على النحو التالي: انقر فوق نافذة النتائج ثم حدد النتائج > تعيين القياسات. تأكد من تحديد متوسط قيمة رمادية. - حدد كافة البيانات في نافذة النتائج . انسخ والصق في برنامج آخر ، على سبيل المثال ، جدول بيانات ، لرسم كثافة التألق المطلقة لعائد الاستثمار المحدد كدالة للوقت.
- كرر الخطوات 5-2-2-2-5-2-2-4 لجمع قياسات كثافة التألق المطلقة لكل عائد على الاستثمار، أي على ضجيج الاهتمام، بجوار ضجيج الاهتمام أو داخل قناة التحكم المقابلة.
- احسب شدة التألق النسبية المناسبة في الوحدات التعسفية (AU)، على سبيل المثال، عن طريق قسمة شدة التألق المطلقة لعائد الاستثمار [hypha of interest] على كثافة التألق المطلقة لعائد الاستثمار [قناة التحكم]. راجع منشور FFI41 للحصول على مزيد من التفاصيل المحددة.
- قم بإجراء ما لا يقل عن ثلاث نسخ بيولوجية لكل تجربة ورسم كثافة التألق النسبية كدالة للوقت.
- قياسات معدل نمو الواصلة
Access restricted. Please log in or start a trial to view this content.
النتائج
يتم عرض النتائج التمثيلية من أجهزة BFI40 و FFI41 النموذجية. يمكن بسهولة الحصول على قياسات معدل نمو Hyphal باستخدام هذه الأجهزة مع تقنيات الفحص المجهري الأساسية. يوضح الشكل 3A-B التفاعلات البكتيرية الفطرية بين C. cinerea hyphae و B. subtilis ...
Access restricted. Please log in or start a trial to view this content.
Discussion
تقدم هذه المقالة بروتوكولا لدراسة التفاعلات الفطرية الميكروبية باستخدام الموائع الدقيقة للقناة. يهدف المؤلفون إلى إظهار تنوع هذه الأجهزة وتشجيع التكيف لتناسب اهتمامات الباحث. باستخدام أجهزة BFI و FFI النموذجية ، يمكن دراسة التفاعلات الفطرية الميكروبية بمزيد من التفصيل مما كان يمكن الوصول...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن صاحبا البلاغ عدم وجود مصالح متنافسة.
Acknowledgements
نحن نقر بالدعم المالي المقدم من قسم الهندسة الحيوية في إمبريال كوليدج لندن و The Leverhulme Trust (مرجع منحة البحث: RPG-2020-352).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
References
- Zhu, Y. -G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33(2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -Y., Zhang, Q., Li, H., Gao, J. -M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, Č, Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), Basel, Switzerland. 572(2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163(2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535(2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154(2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243(2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074(2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262(2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010(2018).
- Choi, C. -H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064(2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468(2021).
- Boenisch, M. J. Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , Staats-und Universitätsbibliothek Hamburg Carl von Ossietzky. (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved