É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ferramentas microfluídicas para sondar interações fúngicas-microbianas no nível celular
Neste Artigo
Resumo
Devido à opacidade do solo, as interações entre seus micróbios constituintes não podem ser facilmente visualizadas com resolução celular. Aqui, são apresentadas duas ferramentas microfluidas, que oferecem novas oportunidades para investigar interações fúngicas-microbianas. Os dispositivos são versáteis e simples de usar, permitindo alto controle espesso e imagens de alta resolução no nível celular.
Resumo
Os fungos filamentosos são habitantes bem sucedidos do solo e desempenham um papel importante nos ecossistemas do solo, como na decomposição da matéria orgânica e inorgânica, bem como na regulação dos níveis de nutrientes. Lá eles também encontram inúmeras oportunidades de interagir com uma variedade de outros micróbios, como bactérias ou outros fungos. Estudar interações fúngicas no nível celular, no entanto, pode ser desafiador devido à natureza do solo semelhante à caixa preta. Novas ferramentas microfluídicas estão sendo desenvolvidas para o estudo das interações fúngicas; duas plataformas projetadas para estudar interações bacteriana-fúngicas e fúngicas são destacadas. Dentro desses microcanais, as interações fúngicos-microbianas podem ser monitoradas em ambientes físico-químicos controlados em maior resolução temporal e espacial do que antes possível. A aplicação dessas ferramentas tem rendido inúmeros novos insights biológicos, como a observação do apego polar bacteriano à hifa ou a revelação de antagonismos fúngicos-fúngicos não característicos. Uma característica fundamental dessas metodologias considera a facilidade de uso desta ferramenta por não especialistas, produzindo tecnologias altamente traduzíveis para uso em laboratórios de microbiologia.
Introdução
O solo é um ambiente excepcionalmente diverso que contém uma abundância de microrganismos que são instrumentais para os ciclos de carbono e fósforo 1,2. Os fungos filamentosos são um componente importante de inúmeros ecossistemas como decomposição de matéria orgânica e inorgânica e podem melhorar a nutrição das plantas através da formação de relações simbióticas 3,4. Dentro do solo, os fungos interagem dinamicamente com uma infinidade de micróbios como outros fungos5, bactérias6, vírus7 e nematoides8. Essas interações têm consequências significativas para a saúde do solo e das plantas. No entanto, devido à falta de sistemas experimentais apropriados capazes de imagens interagindo microrganismos com alta resolução, muitos permanecem indefinidos.
Investigações relativas às interações bacteriana-fúngica (BFIs) e interações fúngicas (FFIs) têm aplicações valiosas em uma variedade de campos, incluindo antimicrobianos na medicina e agentes de controle biológico na agricultura. Por exemplo, o fungo Coprinopsis cinerea produz o peptídeo copsin, que tem sido mostrado para exibir atividade antibacteriana contra o patógeno humano Listeria monocytogenes9. Da mesma forma, o composto derivado de fungos, griseofulvin, é amplamente utilizado como tratamento para infecções fúngicas humanas e é adicionalmente capaz de inibir o crescimento do fungo patogênico da planta Alternaria solani10,11. Várias cepas da bactéria bacillus subtilis também foram demonstradas como agentes de biocontrole eficazes do patógeno fúngico da planta Rizoctonia solani12,13. No entanto, devido às limitações associadas às metodologias tradicionais, os BFIs e os FFIs são mal compreendidos ao nível de células únicas.
Estudos convencionais normalmente exploram BFIs e FFIs na macroescala usando placas de ágar com duas ou mais espécies em confronto. Sua interação é avaliada pela medição das taxas de crescimento e produção metabólica das espécies confrontantes 14,15,16; no entanto, essa metodologia só é resolvida ao nível da colônia. Para estudar interações no nível celular, inoculantes bacterianos e fúngicos podem ser cultivados em lâminas de microscópio de vidro revestidas com ágar que são então imagens sob um microscópio17. No entanto, pode ser difícil seguir uma única higifia usando slides de microscópio devido à falta de confinamento, o que significa que imagens com lapso de tempo são mais difíceis de obter. Além disso, a oportunidade de confinar espacialmente outros microrganismos dentro de regiões definidas do micélio fúngico ou criar ambientes químicos definidos que podem ser perturbados, por exemplo, não é possível nessas configurações. A natureza "caixa preta" do solo também aumenta a complexidade de estudar interações fúngicos-microbianas ao nível de células únicas18. Observando espécies interagindo longe da incrível diversidade do microbioma do solo, a maneira exata pela qual os membros interagem pode ser avaliada. Assim, há uma necessidade contínua de plataformas versáteis que permitem imagens unicelulares de alta resolução de BFIs e FFIs.
As tecnologias microfluídicas, os chamados sistemas lab-on-a-chip, fornecem uma plataforma ideal para o estudo de BFIs e FFIs ao nível de células únicas. O campo dos microfluidos, originários de tecnologias desenvolvidas para análise química e microeletrônica, tem sido adotado pelas ciências biológicas19. As tecnologias microfluidas regulam pequenos volumes de fluidos dentro de uma rede sob medida de canais miniaturizados, tendo pelo menos uma dimensão na escala de micromítre, e seu uso em pesquisas biológicas está expandindo20. Em particular, foram desenvolvidos dispositivos microfluidos para examinar o crescimento de fungos filamentosos 21,22,23,24,25,26,27,28,29,30. Um benefício do uso dessa tecnologia é que o confinamento da hifa e a distribuição de nutrientes dentro dos microcanais se assemelham mais à estrutura do ambiente do solo do que os métodos convencionais de ágar31. Recentemente, plataformas microfluidas têm sido usadas para investigar interações entre neutrófilos humanos e patógenos fúngicos32, bactérias e raízes vegetais33, além de fungos e nematoides34,35.
Uma das muitas vantagens do uso de microfluidos para o estudo de interações microbianas inclui o controle específico do ambiente microcanal. Por exemplo, regimes de fluxo laminar podem ser explorados para gerar gradientes de concentração definidos, o que é especialmente útil ao examinar a quimiotaxis bacteriana36. Outra vantagem é que a natureza transparente do poli(dimetilsiloxano) (PDMS), um polímero elastomérico barato e biocompatível comumente utilizado na fabricação de dispositivos microfluidos, facilita a imagem de alta resolução de células únicas usando microscopia de campo brilhante e fluorescência37. Da mesma forma, o confinamento de micróbios dentro de microcanais significa que experimentos de lapso de tempo que rastreiam células únicas podem ser realizados, permitindo que respostas celulares individuais sejam registradas e quantificadas37. Por fim, como os dispositivos microfluidos podem ser projetados para serem fáceis de usar, eles podem ser facilmente empregados por não-especialistas38.
O aprofundamento do conhecimento das interações entre microrganismos que habitam o solo é importante para melhorar as práticas sustentáveis de manejo do ecossistema que mantêm a biodiversidade e mitigar o impacto das mudanças climáticas nos ambientes terrestres39. Assim, o desenvolvimento de novas ferramentas microfluídicas é fundamental para ampliar a compreensão dos fungos e suas interações no nível celular. O protocolo aqui se concentrará em dois dispositivos microfluidos produzidos para o estudo das BFIs40 e FFIs41, representadas na Figura 1.

Figura 1: Representação visual e esquemática dos dispositivos de interação bacteriana-fúngica (BFI) e interação fúngico (FFI). Um plugue mycelial é colocado na entrada de uma extremidade dos microcanais para permitir o crescimento de hifas no dispositivo. A entrada bacteriana está na extremidade oposta. Barra de escala = 5 mm. (B) Visão geral esquemática do dispositivo BFI, representando o posicionamento das entradas bacterianas e a direção do crescimento hifál através dos microcanais de interação. Os canais têm 10 μm de profundidade, 100 μm de largura e 7 mm de comprimento, com 28 canais de observação no total. (C) Ensaio de confronto na placa de ágar entre Coprinopsis cinerea e Bacillus subtilis NCIB 3610, barra de escala = 20 mm (esquerda). Imagens de microscopia mostrando a interação entre C. cinerea e B. subtilis NCIB 3610 dentro do microcanal (médio e direito), ou seja, fixação polar de bactérias à hifa fúngica. Barra de escala = 25 μm (médio) e 10 μm (direita). (D) Imagem do dispositivo FFI ligado a uma placa de Petri com fundo de vidro, duplamente inoculada com plugues miceliais. Barra de escala = 1 cm. (E) Visão geral esquemática do dispositivo FFI. Dois plugues inoculantes fúngicos são introduzidos nas entradas em cada extremidade do dispositivo, permitindo a exploração higfálica dos microcanais. Os canais de controle são conectados apenas a uma entrada fúngica e têm um canal sem saída, impedindo interações entre os fungos de teste. Os canais de interação conectam ambas as entradas fúngicas e permitem interações hifais entre os sujeitos do teste dentro do microcanal. Cada canal de interação consiste em 18 seções em forma de diamante, medindo um comprimento total de 8,8 mm (490 x 430 μm por diamante), 10 μm de profundidade e tendo uma região de conexão entre cada diamante de 20 μm. Os tipos de canal são duplicados, barras de escala = 1 mm. (F) Zona de interação entre duas frentes hifais que se aproximam, crescendo a partir de extremidades opostas do canal de interação interconectada. Imagem de microscopia de contraste de fase, barra de escala = 250 μm. Os painéis desta figura foram modificados a partir de Stanley et al., 2014 (A-C)40 e Gimeno et al., 2021 (D-F)41. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
NOTA: Um resumo dos procedimentos descritos neste protocolo são visualmente retratados na Figura 2.
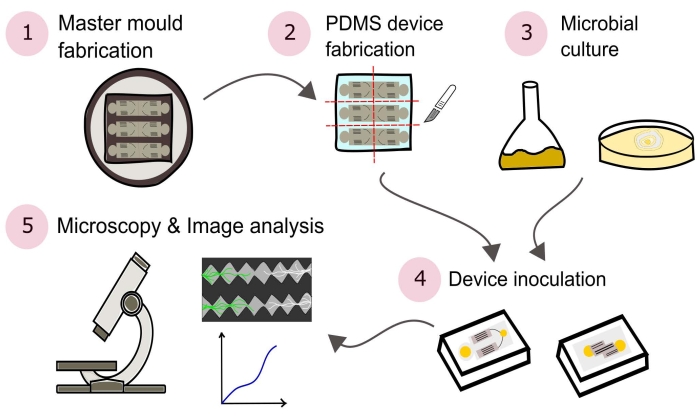
Figura 2: Representação esquemática da metodologia apresentada consistindo de cinco seções principais detalhadas neste protocolo. Os projetos dos dispositivos são criados usando o software CAD (Computer Aided Design, design auxiliado por computador) e um molde mestre fabricado usando fotolitografia (1). Este é usado para lançar poli (dimetilsiloxano) (PDMS), que é então cortado em lajes e ligado a placas de Petri com fundo de vidro para formar os dispositivos microfluidos (2). Os micróbios a serem incluídos no estudo são cultivados (3) e usados para vacinar os dispositivos (4). As interações são estudadas por meio de microscopia e quantificadas por meio de técnicas de análise de imagem (5). Clique aqui para ver uma versão maior desta figura.
1. Fabricação de moldes mestres
- Produção de máscaras fotográficas
- Gere designs de dispositivos microfluidos usando o software CAD (Computer Aided Design, design auxiliado por computador). As dimensões dos dispositivos apresentados são dadas na Figura 1 e mais detalhes sobre os recursos específicos de design estão amplamente listados nas respectivas publicações40,41.
- Exporte o arquivo de design CAD usando um formato apropriado (por exemplo, .dwg, .dxf). Imprima uma máscara de fotolitografia de filme enviando o arquivo de design CAD exportado para um provedor comercial para impressão.
- Fotolitografia
NOTA: As seguintes etapas devem ser conduzidas dentro de um ambiente livre de poeira e controlado pela luz, como um capô de fluxo laminar ou uma instalação de sala limpa. As condições experimentais aqui fornecidas são dadas como guia e devem ser otimizadas internamente. Os autores recomendam buscar treinamentos específicos e consultoria de protocolosestabelecidos 42.- Prepare um wafer de silício de 100 mm assando em um forno a 200 °C por 2 h. Gire o wafer de silício com fotoresist SU-8 2010, visando uma espessura alvo de 10 μm, utilizando as seguintes condições: 500 rpm para 10 s (aceleração 100 rpm/s) e 3.000 rpm para 45 s (aceleração de 300 rpm/s).
ATENÇÃO: O fotoresist SU-8 é perigoso, tome cuidado ao manusear e evite a inalação e o contato com a pele. É inflamável, potencialmente cancerígeno e tóxico para o meio ambiente. - Asse o wafer de silício revestido a 95 °C por 2,5 min (assado macio). Exponha o fotoresistista à luz ultravioleta (UV), usando a máscara fotolitografia do filme e uma dose de energia de 140 mJ/cm2 a 365 nm comprimento de onda usando um alinhador de máscara.
- Asse o wafer de silício revestido a 95 °C por 3,5 min (pós-exposição). Mergulhe e agitar o wafer de silício na solução do desenvolvedor por 3 minutos para revelar as estruturas microfrágicadas removendo o fotoresist não exposto.
ATENÇÃO: A solução do desenvolvedor pode ser inflamável, tomar as precauções apropriadas ao manusear e armazenar. - Enxágüe com nova solução de desenvolvedor para 10 s. Enxágüe com álcool isopropílico para 10 s e ar seco. Use ar filtrado e comprimido para garantir que as estruturas estejam completamente secas. Meça a altura das estruturas SU-8, por exemplo, usando um perfil.
- Silanize cada molde mestre com 50 μL de cloroforimilano aplicando uma pressão de vácuo de 50 mbar por 2 h. Os autores observam que a re-silanização do molde mestre não foi considerada necessária.
ATENÇÃO: A clorometilosilana é uma substância perigosa. Use equipamentos de proteção individual (EPI) adequados e manuseie com cuidado. Evite o contato com a pele e os olhos e evite a inalação. Mantenha-se afastado de fontes de ignição e use em uma área bem ventilada.
- Prepare um wafer de silício de 100 mm assando em um forno a 200 °C por 2 h. Gire o wafer de silício com fotoresist SU-8 2010, visando uma espessura alvo de 10 μm, utilizando as seguintes condições: 500 rpm para 10 s (aceleração 100 rpm/s) e 3.000 rpm para 45 s (aceleração de 300 rpm/s).
2. Fabricação de dispositivos
NOTA: As seguintes etapas devem ser conduzidas dentro de um ambiente livre de poeira, como um capô de fluxo laminar.
- Preparação de lajes de poli (dimetilsiloxano) (PDMS)
- Prepare aproximadamente 40 g de PDMS misturando completamente a base e o agente de cura em uma proporção de 10:1 usando uma espátula em um copo plástico limpo. Desgas a mistura para remover todas as bolhas de ar colocando o copo plástico contendo o PDMS em uma câmara de vácuo (pressão de vácuo = 50 mbar) por 1 h.
- Fixar o molde mestre em uma montagem de plástico usando fita transparente. Limpe usando ar filtrado comprimido para remover qualquer partículas de poeira.
NOTA: Alternativamente, a folha de alumínio pode ser moldada em torno de uma placa de vidro Petri, e depois usada para abrigar o molde mestre e conter o PDMS43. - Despeje a mistura de PDMS no centro do molde mestre, garantindo que esteja em uma superfície nivelada e deixe se instalar.
NOTA: A mistura de PDMS deve ser derramada o mais próximo possível da superfície do molde mestre e um fluxo contínuo mantido para minimizar a introdução de bolhas de ar. As bolhas de ar podem ser removidas direcionando o ar comprimido sobre a bolha ou retirando-as usando uma agulha fina. - Cubra o molde mestre livremente com uma tampa plástica para evitar que partículas de poeira se instalem na superfície do PDMS. Transfira o molde mestre para um forno e cure durante a noite a 70 °C.
- Retire o molde mestre do forno e deixe esfriar. Retire o PDMS curado do molde mestre e da estrutura plástica, tomando cuidado para evitar danificar o molde mestre/PDMS.
- Coloque fita clara sobre os microcanais gravados no PDMS para manter uma superfície livre de poeira. Certifique-se de que a fita seja removida antes da ligação.
- Corte o PDMS em lajes (ou seja, se vários dispositivos forem incluídos no design do molde mestre, muitos podem ser fabricados a partir de uma única fundição) conforme designado pelo design usando uma guilhotina montada ou lâmina de barbear. Ao cortar a abertura lateral da laje BFI PDMS, certifique-se de que os microcanais estejam totalmente abertos (Figura 1A). Para a laje FFI PDMS, certifique-se de que cada canto seja aparado para permitir que ele se encaixe na placa de Petri com fundo de vidro mostrada na Figura 1D.
- Perfurar os orifícios de entrada/saída desejados de acordo com o design do dispositivo. Use um cortador de precisão para perfurar furos de entrada de 3,18 mm e 4,75 mm para os dispositivos BFI e FFI exemplares, respectivamente.
- Ligação de lajes PDMS para criar dispositivos
NOTA: As seguintes etapas de lavagem (2.2.1-2.2.2) utilizam um limpador ultrassônico recheado com água purificada (ddH2O) a 37 kHz. Lavar as lajes do PDMS ajuda a melhorar a ligaçãobem sucedida 44 e reduzir o risco de contaminação. Para manipular as placas PDMS, use fórceps limpos e levante usando os orifícios de entrada para evitar danos aos microcanais ou à superfície do dispositivo.- Submerse as lajes PDMS em 0,5 M NaOH e sonicate por 5 min. Enxágüe com ddH2O. Transfira as lajes PDMS em solução de 70% de etanol e sonicato por 5 min. Enxágüe com ddH20 estéril.
- Mergulhe as lajes PDMS em ddH2O e sonicato por 5 min. Remova as lajes PDMS do ddH2O estéril, seque usando ar comprimido filtrado e coloque em uma placa de Petri quadrada estéril.
- Coloque a placa de Petri quadrada contendo as lajes PDMS em um forno a 70 °C por 1h para secar. Retire do forno e deixe esfriar em um ambiente sem poeira. Limpe qualquer poeira da superfície das lajes PDMS usando fita e/ou ar comprimido filtrado.
- Ative as superfícies das lajes PDMS e placas de Petri com fundo de vidro a serem ligadas usando um limpador de plasma com as seguintes configurações: pressão de vácuo de 0,75 mbar, potência 50%, tempo de revestimento 1 min. Coloque as superfícies a serem ativadas (e posteriormente ligadas) voltadas para cima no limpador de plasma.
- Remova as lajes PDMS e as placas de Petri com fundo de vidro do limpador de plasma e conecte-se suavemente colocando as superfícies ativadas em contato conformal entre si. Unindo as lajes BFI e FFI PDMS às placas de Petri com fundo de vidro de 35 mm e 50 mm de diâmetro (espessura de vidro 0,17 mm), respectivamente.
NOTA: Tome cuidado para não aplicar muita pressão ao se relacionar, pois isso pode resultar em colapso dos microcanais. - Verifique se há uma ligação bem sucedida simplesmente tentando tirar a laje PDMS da placa de Petri com pinças com pinças. Visualize os dispositivos por olho ou usando microscopia genérica para garantir que não haja colapso das entradas ou microchannels.
NOTA: Para condições saturadas (ou seja, condições saturadas de água e/ou ricas em nutrientes), incluem a etapa 2.2.7 do protocolo. Se forem necessárias condições insaturadas de água, proceda à etapa 2.2.8. Os dispositivos podem ser preenchidos com água ou mídia. - Preencha os dispositivos imediatamente após a ligação, tubos 100 μL da solução desejada para o dispositivo BFI (entrada bacteriana e abertura lateral) ou 30 μL de mídia em cada entrada (total de 60 μL) para o dispositivo FFI. Se as bolhas de ar estiverem presentes, estas se dissiparão cerca de 10 minutos após o enchimento, já que o PDMS é poroso.
- Adicione ddH2O estéril (~100-200 μL) na placa de Petri para manter a umidade.
3. Cultura microbiana
NOTA: As etapas a seguir fornecem um procedimento microbiológico geral para a cultura fúngica e bacteriana e devem ser realizadas em condições estéreis (ou seja, utilizando um gabinete de segurança de chama ou microbiológico) adequados para o nível de contenção necessário para os micróbios desejados. Exemplos específicos são dados no final de cada seção para uma espécie de interesse.
- Cultura fúngica
- Prepare o meio de cultura desejado complementado com ágar. Autoclave o médio a 121 °C por 15 min. Deixe o médio esfriar até 50 °C e despeje em placas de Petri de 9 cm de diâmetro, mantendo condições estéreis.
- Use um borer de cortiça para remover um plugue de 4 mm de diâmetro de ágar contendo micélio de uma colônia de estoque de geladeira da cepa fúngica desejada para ativar o isolado. Isso é realizado para garantir o crescimento padronizado e vigoroso do fungo antes da inoculação do dispositivo.
NOTA: Os micróbios também podem ser ativados a partir de um estoque de glicerol, ou seja, isolados fúngicos armazenados em plugues de ágar em solução de 50% de glicerol a -70 °C41. - Coloque a lateral do plugue com micélio em contato com a superfície do ágar no centro da placa de Petri não vacinada. Substitua a tampa em cima da placa de Petri e vedação antes de incubar na temperatura apropriada para a cepa desejada pela quantidade de tempo necessária, normalmente, em torno de 3 a 4 dias.
NOTA: Condições de cultura de exemplo para Trichoderma rossicum: Ágar extrato de malte, incubado a 25 °C no escuro por 48 h.
- Cultura bacteriana
- Retire o isolado bacteriano desejado do estoque de origem (por exemplo, estoque de glicerol ou colônia única da placa de ágar) em uma placa de ágar para alcançar colônias bacterianas únicas e garantir que não haja contaminação45. Sele a placa com o filme.
- Incubar a uma temperatura e duração específicas do isolamento de interesse até que sejam observadas colônias individuais.
- Prepare o caldo de cultura desejado. Por exemplo, adicione 10 g de triptona, 10 g de NaCl e 5 g de extrato de levedura por 1 L de ddH2O para preparar o meio LB para a cultura de B. subtilis. Autoclave o médio a 121 °C por 15 min.
- Deixe o médio esfriar até a temperatura ambiente. Adicione o meio a um frasco de cultura estéril dentro de um ambiente estéril.
- Toque uma única colônia bacteriana da placa de ágar usando um laço de inoculação estéril. Transfira o laço inoculado para o meio de cultura estéril tocando brevemente o líquido com o laço.
- Sele o frasco usando uma tampa ou folha estéril, e coloque dentro de uma incubadora de agitação durante a noite usando as configurações apropriadas para as espécies selecionadas.
NOTA: Condições de cultura de exemplo para B. subtilis: i) cultura líquida - crescimento aeróbico a 37 °C a 200 rpm em cultura de placas lb média e ii ) - temperatura ambiente na placa de ágar LB. Consulte os papéis FFI/BFI40,41 para obter mais detalhes sobre a cultura de diferentes cepas fúngicas.
4. Inoculação do dispositivo
NOTA: As seguintes etapas devem ocorrer dentro de um capô de fluxo laminar usando equipamento estéril.
- Inoculação fúngica
- Use um borer de cortiça esterilizado (ø = 4 mm) para remover um plugue de ágar da colônia na periferia de uma cultura de 3 dias de idade (passo 3.1). Certifique-se de que a frente higfál em crescimento permanece intacta.
- Introduza o plugue na entrada fúngica, mycelium lado para baixo, com a direção de crescimento da frente hiphal orientada para as aberturas do microcanal para incentivar a infiltração hifal dos canais.
- Repita as etapas 4.1.1-4.1.2 para a segunda espécie fúngica (se usar o dispositivo FFI), introduzindo o plugue na entrada oposta. Se usar o dispositivo BFI, omitir esta etapa e continuar a passo 4.1.4.
- Sele a placa de Petri com filme transparente e incubar a 25-28 °C no escuro até que a imagem comece. Determine o tempo de incubação pré-imagem dependendo do evento biológico pretendido a ser observado, por exemplo, confrontos fúngicos-fúngicos, e a taxa de crescimento de espécies incluídas dentro do dispositivo.
- Inoculação bacteriana
- Diluir as bactérias de uma cultura durante a noite (passo 3.2) em uma razão de 1:25 usando o mesmo meio de cultura detalhado na etapa 3.2.3. Cultura para 3 h a 37 °C.
- Lave as bactérias através da cultura de pelotização usando uma centrífuga a 2000 x g por 10 min. Descarte o supernatante e resuspenque as células no volume desejado de solução de cloreto de sódio de 0,9% w/v.
- Centrifugar novamente para obter uma pelota. Descarte o supernaspe e resuspenque as células em meio líquido (por exemplo, C. cinerea meio mínimo para um OD600 de 1). Otimize o valor OD600 para a cepa bacteriana em questão.
- Remova o dispositivo BFI da incubadora e abra-o em um ambiente estéril. Pipeta 10 μL de suspensão na entrada bacteriana.
NOTA: Otimize os tempos exatos de inoculação para as interações bacteriana-fúngica em questão. Por exemplo, introduza bactérias no dispositivo BFI 18 h de inoculação pós-fúngica se usar C. cinerea. - Sele a placa de Petri com um filme transparente e incubar a 25 °C no escuro até que a imagem comece. Armazene o dispositivo na vertical.
5. Microscopia e análise de imagem
- Microscopia
NOTA: O pesquisador deve selecionar o método adequado de concordância de imagem com a natureza do experimento a ser conduzido, por exemplo, uma epifluorescência de campo largo invertido ou microscopia confocal. Uma visão geral foi fornecida aqui, pois detalhes específicos dependerão dos atributos da microscopia escolhida.- Ligue o computador do microscópio, o corpo principal do microscópio (se aplicável), a câmera, a incubadora controlada pela temperatura e as fontes de luz. Certifique-se de que o microscópio foi configurado corretamente, por exemplo, a iluminação Köhler foi corretamente aplicada para a iluminação da amostra. Inicie o pacote de software de imagem.
NOTA: Ao usar uma incubadora controlada pela temperatura, é importante permitir que a temperatura do microscópio se equilibre por várias horas antes de iniciar um experimento. - Monte o dispositivo microfluido na inserção do estágio. Certifique-se de que o dispositivo está bem protegido, ou seja, com fita, para evitar desalojar o dispositivo durante o movimento do estágio ativo.
- Adquira imagens dos dispositivos inoculados, por exemplo, experimentos de ponto único ou lapso de tempo. As especificações abrangentes de imagem relevantes para os experimentos realizados com os dispositivos BFI e FFI são fornecidas nas respectivas publicações acima mencionadas40,41.
NOTA: As imagens brightfield foram adquiridas usando microscopia de contraste de fase para visualizar a proliferação de hifais através dos canais de crescimento usando software de foco automático e ampliação de 10x, 0,30 NA (abertura numérica) ou ampliação de 20x, lentes objetivas na 0,45. A excitação de proteínas fluorescentes de repórteres foi alcançada usando um motor leve emissor de luz de alta potência com comprimentos de onda específicos para o fluoróforo. - Exportar imagens em um formato adequado para processamento subsequente de imagens. Por exemplo, .tiff.
- Ligue o computador do microscópio, o corpo principal do microscópio (se aplicável), a câmera, a incubadora controlada pela temperatura e as fontes de luz. Certifique-se de que o microscópio foi configurado corretamente, por exemplo, a iluminação Köhler foi corretamente aplicada para a iluminação da amostra. Inicie o pacote de software de imagem.
- Análise de imagem
NOTA: Os autores recomendam Fiji46 como uma ferramenta para análise de imagens, mas outros pacotes de software estão disponíveis. A seguir, exemplos de análises de imagem realizadas utilizando Fiji a partir das publicações apresentadas de dispositivos BFI e FFI. Essas etapas são específicas para um Mac e podem diferir ligeiramente se usar um PC.- Medições da taxa de crescimento hiphal
NOTA: Este método foi utilizado no manuscrito BFI40 para medir as taxas de crescimento da hifa individual.- Baixe, instale e inicie Fiji. Importe a sequência de imagem de um experimento de lapso de tempo selecionando Arquivo > Importar > Sequência de imagem. Localize a pasta onde os dados são armazenados e selecione Abrir. Na janela Opções de sequência , selecione Preferências e, em seguida, OK.
- Selecione o ícone Linha Reta na barra de ferramentas principal. Posicione o início da linha reta na ponta da ponta hignótica em crescimento clicando e, em seguida, arrastando concomitantemente o cursor para outro ponto dentro da janela. Uma linha amarela aparecerá com três caixas indicando o início, o ponto médio e o fim da linha.
- Mova-se para o próximo quadro na sequência de imagem pressionando e segurando Ctrl e >. Posicione a extremidade da linha reta na ponta do higese em crescimento selecionando e arrastando a caixa quadrada para a posição correta.
- Pressione e segure Ctrl e M para medir o comprimento da linha em pixels. Uma janela Resultados aparecerá com os dados medidos. Defina os dados exibidos na janela Resultados da seguinte forma: clique na janela Resultados e selecione Resultados > Definir medidas.
- Mova-se para o próximo quadro na sequência de imagem pressionando e segurando Ctrl e, em seguida, >. Posicione o início da linha reta na ponta do higese em crescimento selecionando e arrastando a caixa quadrada para a posição correta.
- Pressione e segure Ctrl e, em seguida, M para medir o comprimento da linha em pixels. Uma janela Resultados aparecerá com os dados medidos.
- Repetimos as etapas 5.2.1.5-5.2.1.6 até terminar de medir o crescimento do hypha em pixels.
- Selecione todos os dados na janela Resultados . Copie e cole em outro programa de software, por exemplo, uma planilha, para processar os dados. Plote o crescimento hifal (em pixels ou micrômetros) em função do tempo e calcule as taxas médias de crescimento. Realize pelo menos três réplicas biológicas por experimento.
- Medidas de intensidade de fluorescência
NOTA: Este método foi utilizado na publicaçãoFFI 41 para avaliar a alteração na intensidade da fluorescência na hifa de Fusarium graminearum 8/1-wt-GFP após contato com Clonostachys rosea 016 em função do tempo.- Baixe, instale e inicie Fiji. Importe a sequência de imagens de um experimento de lapso de tempo selecionando o Arquivo > importar > sequência de imagem. Localize a pasta onde os dados são armazenados e selecione Abrir. Na janela Opções de sequência selecione Preferências e, em seguida, OK.
- Especifique uma região de interesse (ROI) para medir a intensidade absoluta de fluorescência de um higifize usando a ferramenta retangular, localizada na barra principal de ferramentas. O tamanho do quadrado pode ser definido exatamente da seguinte forma: Editar > Seleção > Especificar; o ROI também pode ser salvo para referência futura no Gerenciador de ROI selecionando Editar > Seleção > Adicionar ao Gerente.
- Meça a intensidade absoluta de fluorescência (valor cinza médio) dentro do ROI definido para cada imagem em toda a sequência de imagem ou pilha da seguinte forma: Image > Stacks > Measure Stack. A janela Resultados será aberta automaticamente assim que todas as imagens da pilha forem processadas.
NOTA: Os dados exibidos na janela Resultados podem ser definidos da seguinte forma: clique na janela Resultados e selecione Resultados > Definir medidas. Certifique-se de que o Valor Cinza Médio foi selecionado. - Selecione todos os dados na janela Resultados . Copie e cole em outro programa de software, por exemplo, uma planilha, para traçar as intensidades absolutas de fluorescência do ROI especificado em função do tempo.
- Repetir as etapas 5.2.2.2-5.2.2.4 para coletar medidas absolutas de intensidade de fluorescência para cada ROI, ou seja, sobre o hypha de interesse, ao lado do hypha de interesse ou dentro do canal de controle correspondente.
- Calcule as intensidades de fluorescência relativa apropriadas em unidades arbitrárias (UA), por exemplo, dividindo a intensidade absoluta de fluorescência do ROI [hypha of interest] pela intensidade absoluta de fluorescência do ROI [canal de controle]. Consulte a publicaçãoFFI 41 para obter mais detalhes específicos.
- Realizar pelo menos três réplicas biológicas por experimento e traçar as intensidades relativas de fluorescência em função do tempo.
- Medições da taxa de crescimento hiphal
Access restricted. Please log in or start a trial to view this content.
Resultados
Os resultados representativos são apresentados dos dispositivos BFI40 eFFI 41 exemplares. As medidas da taxa de crescimento hiphal podem ser facilmente obtidas usando esses dispositivos em combinação com técnicas básicas de microscopia. A Figura 3A-B ilustra interações bacteriana-fúngicas entre C. cinerea hyphae e B. subtilis NCIB 3610. A presença de B. subtilis interrompe o ...
Access restricted. Please log in or start a trial to view this content.
Discussão
Este artigo apresenta um protocolo para o estudo das interações fúngicos-microbianas utilizando microfluidos de canal. Os autores visam demonstrar a versatilidade desses dispositivos e incentivar a adaptação para atender aos interesses do pesquisador. Usando os dispositivos BFI e FFI exemplares, as interações fúngicos-microbianas podem ser estudadas com mais detalhes do que previamente acessíveis. Ao remover a complexidade de fundo e a heterogeneidade do solo, moderando o crescimento da hifa de tal forma que ele...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não declaram interesses concorrentes.
Agradecimentos
Reconhecemos o apoio financeiro do Departamento de Bioengenharia do Imperial College London e do Leverhulme Trust (Research Grant Reference: RPG-2020-352).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
Referências
- Zhu, Y. -G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33(2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -Y., Zhang, Q., Li, H., Gao, J. -M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, Č, Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), Basel, Switzerland. 572(2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163(2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535(2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154(2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243(2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074(2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262(2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010(2018).
- Choi, C. -H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064(2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468(2021).
- Boenisch, M. J. Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , Staats-und Universitätsbibliothek Hamburg Carl von Ossietzky. (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados