需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于在细胞水平上探测真菌 - 微生物相互作用的微流体工具
摘要
由于土壤的不透明度,其组成微生物之间的相互作用不能用细胞分辨率轻松可视化。在这里,介绍了两种微流体工具,它们为研究真菌 - 微生物相互作用提供了新的机会。这些器件用途广泛且易于使用,可在细胞水平上实现高时空控制和高分辨率成像。
摘要
丝状真菌是土壤的成功居民,在土壤生态系统中起着重要作用,例如有机和无机物质的分解以及养分水平的调节。在那里,他们还发现了许多与各种其他微生物(如细菌或其他真菌)相互作用的机会。然而,由于土壤的黑匣子性质,在细胞水平上研究真菌相互作用可能具有挑战性。正在开发新的微流体工具,用于研究真菌相互作用;突出显示了两个旨在研究细菌 - 真菌和真菌 - 真菌相互作用的平台。在这些微通道中,可以在受控的物理化学环境中以比以前更高的时间和空间分辨率监测真菌 - 微生物相互作用。这些工具的应用产生了许多新的生物学见解,例如观察细菌对菌丝的极性附着或揭示未表征的真菌 - 真菌拮抗作用。这些方法的一个关键特征是非专家易于使用该工具,从而产生了用于微生物实验室的高度可翻译的技术。
引言
土壤是一个非常多样化的环境,含有丰富的微生物,有助于碳和磷循环1,2。丝状真菌是许多生态系统的主要组成部分,是有机和无机物质的分解者,可以通过形成共生关系来增强植物的营养3,4。在土壤中,真菌与多种微生物动态相互作用,例如其他真菌5,细菌6,病毒7 和线虫8。这些相互作用对土壤和植物健康具有重大影响。然而,由于缺乏能够对具有高分辨率的相互作用微生物进行成像的适当实验系统,许多系统仍未定义。
关于细菌-真菌相互作用(BFI)和真菌-真菌相互作用(FFI)的研究在一系列领域具有有价值的应用,包括医学中的抗菌剂和农业中的生物控制剂。例如,真菌 Coprinopsis cinerea 产生肽copsin,其已被证明对人病原体 李斯特菌单核细胞增多性9表现出抗菌活性。类似地,真菌衍生的化合物灰黄霉素被广泛用作治疗人类真菌感染的药物,并且还能够抑制植物病原真菌 Alternaria solani10,11的生长。土壤居住细菌 枯草芽孢 杆菌的几种菌株也被证明是真菌植物病原体 根瘤菌Solani 12,13的有效生物防治剂。然而,由于与传统方法相关的局限性,BFI和FFI在单细胞水平上知之甚少。
常规研究通常在宏观尺度上探索BFI和FFI,使用具有两个或更多物种对抗的琼脂平板。通过测量对抗物种14,15,16的生长速率和代谢物产生来评估它们的相互作用;然而,这种方法只能解决到殖民地水平。为了在细胞水平上研究相互作用,可以在涂有琼脂的玻璃显微镜载玻片上培养细菌和真菌接种剂,然后在显微镜下成像17。然而,由于缺乏限制,使用显微镜载玻片跟踪单个菌丝可能很困难,这意味着延时图像更难获得。此外,在这种设置中,不可能有机会在空间上将其他微生物限制在真菌菌丝体的已定义区域内或创建可以扰动的已定义化学环境。土壤的"黑匣子"性质也增加了在单细胞18水平上研究真菌 - 微生物相互作用的复杂性。通过观察远离土壤微生物组令人难以置信的多样性的相互作用物种,可以评估单个成员相互作用的确切方式。因此,对多功能平台的持续需求,以实现BFI和FFI的高分辨率单细胞成像。
微流体技术,即所谓的芯片实验室系统,为在单细胞水平上研究BFI和FFI提供了理想的平台。微流体领域起源于为化学分析和微电子学开发的技术,已被生物科学19采用。微流体技术在定制的微型通道网络中调节少量流体,在微米尺度上至少具有一个维度,并且它们在生物学研究中的应用正在扩大20。特别是,已经开发了微流体装置来检查丝状真菌21,22,23,24,25,26,27,28,29,30的生长。使用该技术的一个好处是,与传统的琼脂方法31相比,菌丝的局限性和微通道内养分的分布更接近土壤环境的结构。最近,微流体平台已被用于研究人类嗜中性粒细胞与真菌病原体32,细菌和植物根33以及真菌和线虫34,35之间的相互作用。
使用微流体研究微生物相互作用的众多优点之一包括对微通道环境的特定控制。例如,可以利用层流状态来产生定义的浓度梯度,这在检查细菌趋化性36时特别有用。另一个优点是聚(二甲基硅氧烷)(PDMS)(一种廉价的,生物相容性的弹性聚合物,通常用于制造微流体器件)的透明性质,有利于使用明场和荧光显微镜37对单细胞进行高分辨率成像。同样,微生物在微通道内的局限性意味着可以进行跟踪单个细胞的延时实验,从而可以记录和量化单个细胞的反应37。最后,由于微流体装置可以设计为用户友好,因此它们可以很容易地被非专家使用38。
进一步了解土壤微生物之间的相互作用,对于改进可持续生态系统管理做法,以维持生物多样性和减轻气候变化对陆地环境的影响十分重要39.因此,新型微流体工具的开发是在细胞水平上扩展对真菌及其相互作用的理解的基础。此处的协议将重点介绍为研究BFI40和FFI41而生产的两种微流体装置,如图 1所示。

图 1:细菌-真菌相互作用 (BFI) 和真菌-真菌相互作用 (FFI) 装置的视觉和示意图。 (A) BFI 装置的图像。在微通道一端的入口处放置一个菌丝塞,以允许菌丝生长进入设备。细菌入口位于另一端。比例尺= 5 mm. (B) BFI装置的示意图概述,描绘了细菌入口的位置和通过相互作用微通道的菌丝生长方向。通道深度为10 μm,宽100 μm,长7 mm,共有28个观察通道。(C)在 栉 水母和 枯草芽孢杆菌 NCIB 3610之间的琼脂平板上进行对抗试验,比例尺= 20 mm(左)。显微镜图像显示C . cinerea 和 枯草芽孢杆菌 NCIB 3610在微通道(中间和右侧)内的相互作用,即细菌与真菌菌丝的极性附着。比例尺 = 25 μm(中)和 10 μm(右)。(D)FFI装置粘合到玻璃底培养皿上的图像,用菌丝塞双重接种。比例尺 = 1 cm. (E) FFI 设备的原理图概述。两个真菌孕育剂塞子被引入设备两端的入口,允许对微通道进行菌丝探索。控制通道仅连接到一个真菌入口,并具有死端通道,从而防止测试真菌之间的相互作用。相互作用通道连接两个真菌入口,并允许微通道内测试对象之间的菌丝相互作用。每个相互作用通道由18个菱形部分组成,总长度为8.8毫米(每颗钻石490 x 430μm),深10μm,每颗金刚石之间有一个20μm的连接区域。通道类型是重复的,比例尺 = 1 mm.(F) 两个接近的菌丝前沿之间的相互作用区,从相互连接的相互作用通道的两端增长。相差显微镜图像,比例尺= 250μm。该图中的面板已从Stanley等人,2014(A-C)40 和Gimeno等人,2021(D-F)41进行了修改。 请点击此处查看此图的大图。
Access restricted. Please log in or start a trial to view this content.
研究方案
注:此协议中概述的过程摘要直观地显示在 图 2 中。
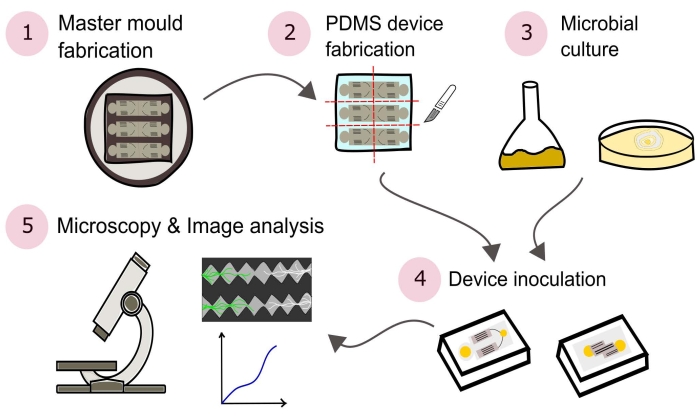
图2:所提出的方法的示意图,由该协议中详述的五个主要部分组成。 设备设计是使用计算机辅助设计(CAD)软件和用光刻制造的主模(1)创建的。这用于浇注聚(二甲基硅氧烷)(PDMS),然后将其切成板状并粘合到玻璃底培养皿上以形成微流体装置(2)。将包括在研究中的微生物被培养(3)并用于接种设备(4)。使用显微镜研究相互作用,并使用图像分析技术进行量化(5)。 请点击此处查看此图的大图。
1. 掌握模具制造
- 光掩模生产
- 使用计算机辅助设计 (CAD) 软件生成微流体设备设计。所展示器件的尺寸如图 1 所示,有关具体设计功能的更多详细信息在相应的出版物40,41中全面列出。
- 使用适当的格式(例如,.dwg、.dxf)导出 CAD 设计文件。通过将导出的 CAD 设计文件发送给商业提供商进行打印,打印胶片光刻掩模。
- 光刻
注意:以下步骤应在无尘和光控环境中进行,例如层流罩或洁净室设施。此处提供的实验条件仅供参考,应在内部进行优化。作者建议寻求特定的培训和咨询建立的协议42。- 通过在200°C的烤箱中烘烤2小时来制备100毫米硅片。使用以下条件用SU-8 2010光刻胶旋转涂覆硅片,目标是目标厚度为10μm:500 rpm持续10 s(加速度100 rpm / s)和3,000 rpm持续45 s(加速度300 rpm / s)。
注意:SU-8光刻胶是有害的,处理时要小心,防止吸入和皮肤接触。它是易燃的,可能致癌,对环境有毒。 - 将涂层硅片在95°C下烘烤2.5分钟(软烘烤)。使用胶片光刻掩模将光刻胶暴露在紫外线(UV)光下,并使用掩模对准器在365nm波长处的能量剂量为140 mJ / cm2 。
- 将涂层硅片在95°C下烘烤3.5分钟(曝光后烘烤)。将硅晶片浸入显影液中搅拌3分钟,通过去除未曝光的光刻胶来揭示微加工结构。
注意:显影剂溶液可能易燃,在处理和储存时应采取适当的预防措施。 - 用新鲜的显影液冲洗10秒。用异丙醇冲洗10秒,然后风干。使用过滤的压缩空气,以确保结构彻底干燥。测量SU-8结构的高度,例如,使用轮廓仪。
- 通过施加50 mbar的真空压力2小时,用50μL三甲基氯硅烷硅烷化每个主模具。作者指出,没有发现有必要对主模进行硅烷化。
注意:三甲基氯硅烷是一种有害物质。穿戴适当的个人防护装备(PPE)并小心处理。避免接触皮肤和眼睛,防止吸入。远离火源,在通风良好的地方使用。
- 通过在200°C的烤箱中烘烤2小时来制备100毫米硅片。使用以下条件用SU-8 2010光刻胶旋转涂覆硅片,目标是目标厚度为10μm:500 rpm持续10 s(加速度100 rpm / s)和3,000 rpm持续45 s(加速度300 rpm / s)。
2. 设备制造
注意:以下步骤应在无尘环境中进行,例如层流罩。
- 聚二甲基硅氧烷(PDMS)板坯的制备
- 通过在干净的塑料杯中使用刮刀以10:1的比例将基底和固化剂彻底混合,制备约40克PDMS。通过将含有PDMS的塑料杯放入真空室(真空压力= 50 mbar)中1小时,对混合物进行脱气以除去所有气泡。
- 使用透明胶带将母模固定到塑料支架中。使用压缩过滤空气进行清洁,以去除任何灰尘颗粒。
注意:或者,铝箔可以在玻璃培养皿周围成型,然后用于容纳主模具并包含PDMS43。 - 将PDMS混合物倒入主模具的中心,确保其位于水平表面上,并允许沉降。
注意:PDMS混合物应尽可能靠近主模具的表面倒入,并保持连续流动,以尽量减少气泡的引入。通过将压缩空气引导到气泡上或使用细针将它们舀出,可以去除气泡。 - 用塑料盖松散地盖住主模具,以防止灰尘颗粒落在PDMS表面上。将母模转移到烤箱中,在70°C下固化过夜。
- 从烤箱中取出母模,让其冷却。将固化的PDMS从主模和塑料框架上剥离,注意避免损坏主模/ PDMS。
- 将透明胶带放在压花到PDMS中的微通道上,以保持无尘表面。确保在粘合之前取下胶带。
- 将PDMS切割成板坯(即,如果主模具的设计中包含多个设备,则许多设备可以从单个铸件中制造),如设计使用安装的断头台或剃须刀片指定的那样。切割 BFI PDMS 板的横向开口时,请确保微通道完全打开(图 1A)。对于FFI PDMS板坯,请确保每个角都经过修剪,使其适合 图1D所示的玻璃底培养皿。
- 根据设备设计冲压所需的入口/出口孔。使用精密切割机分别为示例性 BFI 和 FFI 设备冲压 3.18 mm 和 4.75 mm 的入口孔。
- 绑定 PDMS 板以创建设备
注:以下清洗步骤(2.2.1-2.2.2)使用装有37 kHz纯净水(ddH2O)的超声波清洗机。清洗PDMS板坯有助于增强成功粘合44 并降低污染风险。要操作 PDMS 板坯,请使用干净的镊子,并使用入口孔抬起,以避免损坏微通道或设备表面。- 将PDMS板浸没在0.5M NaOH中并超声处理5分钟。用无菌的ddH2O冲洗,将PDMS板放入70%乙醇溶液中并超声处理5分钟。用无菌ddH20冲洗。
- 将PDMS板浸入无菌的ddH2O中并超声处理5分钟。从无菌的ddH2O中取出PDMS板,使用过滤的压缩空气干燥,然后放入无菌的方形培养皿中。
- 将含有PDMS板的方形培养皿放入70°C的烤箱中烘干1小时。从烤箱中取出,在无尘环境中冷却。使用胶带和/或过滤的压缩空气清除 PDMS 板坯表面的任何灰尘。
- 使用具有以下设置的等离子清洗机激活要粘合的PDMS板和玻璃底培养皿的表面:真空压力0.75 mbar,功率50%,涂层时间1分钟。将要激活(并随后粘合)的表面朝上放置在等离子体清洁器中。
- 从等离子体清洁器中取出PDMS板和玻璃底培养皿,并通过轻轻地将激活的表面彼此保形接触来粘合。将BFI和FFI PDMS板分别粘合到直径为35 mm和50 mm的玻璃底培养皿(玻璃厚度为0.17 mm)上。
注意:粘接时注意不要施加太大的压力,因为这可能导致微通道崩溃。 - 只需尝试用镊子将PDMS板从玻璃底培养皿上拉出,即可检查粘合是否成功。通过眼睛或使用通用显微镜可视化设备,以确保接种入口或微通道不会塌陷。
注意:对于饱和条件(即水饱和和/或营养丰富的条件),请包括方案的步骤2.2.7。如果需要不饱和水条件,请继续执行步骤 2.2.8。设备可以装满水或介质。 - 通过在BFI设备(细菌入口和侧开口)的所需溶液中移液100μL或将30μL培养基移入FFI设备的每个入口(总共60μL)来立即填充设备。如果存在气泡,由于PDMS是多孔的,气泡将在填充后约10分钟消散。
- 在培养皿中加入无菌的ddH2O(〜100-200μL)以保持湿度。
3. 微生物培养
注意:以下步骤为真菌和细菌培养提供了一般的微生物程序,并且应在适合所需微生物所需密封水平的无菌条件下(即使用火焰或微生物安全柜)进行。每个部分的末尾给出了感兴趣的物种的具体示例。
- 真菌培养
- 准备补充琼脂的所需培养基。将培养基在121°C下高压灭菌15分钟。让培养基冷却至50°C,倒入直径9厘米的培养皿中,保持无菌条件。
- 使用软木螟从所需真菌菌株的冰箱原料菌落中取出4毫米直径的含有菌丝体的琼脂塞,以激活分离株。这样做是为了确保在设备接种之前真菌的标准化和剧烈生长。
注意:微生物也可以从甘油储备液中激活,即,在-70°C41下储存在琼脂塞中的50%甘油溶液中的真菌分离物。 - 将与菌丝体接触的塞子的一侧放在未接种培养皿的中心,与琼脂表面接触。更换培养皿顶部的盖子并密封,然后在适当的温度下孵育所需的菌株所需的时间,通常约为3至4天。
注意: 红木霉的示例培养条件:麦芽提取物琼脂,在25°C下在黑暗中孵育48小时。
- 细菌培养
- 将所需的细菌分离物从源浆料(例如,甘油原液或琼脂平板中的单个菌落)划线到琼脂平板上,以实现单个细菌菌落并确保没有污染45。用薄膜密封板。
- 在特定于目标分离物的温度和持续时间下孵育,直到观察到单个菌落。
- 准备所需的培养液。例如,每1升ddH2O加入10克胰蛋白酶,10克NaCl和5克酵母提取物,以制备用于 枯草芽孢杆菌培养的LB培养基。将培养基在121°C下高压灭菌15分钟。
- 让介质冷却至室温。将培养基加入无菌环境中的无菌培养瓶中。
- 使用无菌接种环从琼脂平板中触摸单个细菌菌落。通过用环短暂接触液体,将接种的环转移到无菌培养基中。
- 使用无菌盖子或铝箔密封烧瓶,并使用适合所选物种的设置将其置于振荡培养箱内过夜。
注: 枯草芽孢杆菌的示例培养条件:i)液体培养 - 在LB培养基中以200rpm在37°C下好氧生长和ii)板培养 - LB琼脂平板上的室温。请参阅FFI / BFI论文40,41 ,以获取有关培养不同真菌菌株的更多详细信息。
4. 设备接种
注意:以下步骤应使用无菌设备在层流罩内进行。
- 真菌接种
- 使用无菌软木螟(ø = 4 mm)从3天龄培养物外围的菌落中取出琼脂塞(步骤3.1)。确保不断增长的菌丝前叶保持完整。
- 将塞子引入真菌入口,菌丝体面朝下,菌丝体前部的生长方向朝向微通道开口,以鼓励菌丝渗透通道。
- 对第二种真菌(如果使用FFI设备)重复步骤4.1.1-4.1.2,将插头引入相反的入口。如果使用 BFI 设备,请省略此步骤并继续执行步骤 4.1.4。
- 用透明薄膜密封培养皿,并在25-28°C的黑暗中孵育,直到成像开始。根据要观察到的预期生物事件(例如真菌 - 真菌对抗)以及设备内所包含物种的生长速率来确定成像前的孵育时间。
- 细菌接种
- 使用步骤3.2.3中详述的相同培养基,以1∶25的比例从过夜培养物(步骤3.2)中稀释细菌。在37°C下培养3小时。
- 通过使用离心机以2000× g 的离心机沉淀培养10分钟来洗涤细菌。弃去上清液,将细胞重悬于所需体积的0.9%w / v氯化钠溶液中。
- 再次离心以获得沉淀。弃去上清液并将细胞重悬于液体培养基中(例如, C. cinerea 最小培养基至OD600 为1)。优化相关细菌菌株的OD600 值。
- 从培养箱中取出BFI设备,并在无菌环境中打开。将10μL悬浮液移液到细菌入口中。
注意:优化所讨论的细菌 - 真菌相互作用的确切接种时间。例如,如果使用 C. cinerea,则在真菌接种后18小时将细菌引入BFI装置中。 - 用透明薄膜密封培养皿,并在25°C的黑暗中孵育,直到成像开始。将设备直立存放。
5. 显微镜和图像分析
- 显微术
注意:研究人员应选择与要进行的实验的性质相一致的适当成像方法,例如,倒置宽视场落射荧光或共聚焦显微镜。这里提供了一般概述,因为具体细节将取决于所选显微镜设置的属性。- 打开显微镜计算机、显微镜主体(如适用)、照相机、温控培养箱和光源。确保显微镜设置正确,例如,科勒照明已正确应用于样品的均匀照明。启动映像软件包。
注意:使用温控培养箱时,在开始实验之前,让显微镜温度平衡几个小时非常重要。 - 将微流体装置安装到载物台插件中。确保设备牢固,即使用胶带,以防止在主动载物台移动期间移位设备。
- 获取接种设备的图像,例如单点或延时实验。与使用BFI和FFI设备进行的实验相关的综合成像规范在上述各自的出版物40,41中提供。
注意:通过使用相差显微镜,使用自动对焦软件和10倍放大倍率,0.30 NA(数值孔径)或20倍放大倍率,0.45 NA物镜通过生长通道可视化菌丝增殖来获取明场图像。荧光报告蛋白的激发是使用具有高功率发光二极管光引擎实现的,其波长特定于荧光团。 - 将图像导出为合适的格式,以便进行后续图像处理。例如,.tiff。
- 打开显微镜计算机、显微镜主体(如适用)、照相机、温控培养箱和光源。确保显微镜设置正确,例如,科勒照明已正确应用于样品的均匀照明。启动映像软件包。
- 图像分析
注:作者推荐斐济46 作为图像分析的工具,但其他软件包可用。以下是从所介绍的BFI和FFI设备出版物中使用斐济进行的图像分析示例。这些步骤特定于 Mac,如果使用 PC,则可能会略有不同。- 菌丝生长速率测量
注:该方法在BFI手稿40 中用于测量单个菌丝的生长速率。- 下载、安装和启动斐济。通过选择"文件">"导入图像序列",从延时实验中导入图像序列>图像序列。找到存储数据的文件夹,然后选择"打开"。在"序列选项"窗口中,选择"首选项",然后选择"确定"。
- 从主工具栏中选择" 直线" 图标。将直线的起点定位在不断增长的菌丝尖端的尖端,方法是单击并同时将光标拖动到窗口中的另一个点。将出现一条黄线,其中包含三个框,指示线的起点、中点和终点。
- 通过按住 Ctrl 并 >移动到图像序列中的下一帧。通过选择正方形框并将其拖动到正确的位置,将直线的末端定位在生长的菌丝的尖端。
- 按住 Ctrl 和 M 可测量线条的长度(以像素为单位)。将出现一个结果窗口,其中包含测量数据。按如下方式定义"结果"窗口中显示的数据:单击"结果"窗口,然后选择"结果">"设置度量值"。
- 通过按住 Ctrl 移动到图像序列中的下一帧 , 然后 >。通过将方形框拖动到正确的位置,将直线的起点定位在生长的菌丝的尖端。
- 按住 Ctrl 键 ,然后按住 M 键以测量线条的长度(以像素为单位)。将出现一个 结果 窗口,其中包含测量数据。
- 重复步骤5.2.1.5-5.2.1.6,直到以像素为单位完成测量菌丝的生长。
- 在 结果 窗口中选择所有数据。复制并粘贴到另一个软件程序中,例如电子表格,以处理数据。绘制菌丝生长(以像素或微米为单位)作为时间的函数并计算平均增长率。每个实验至少进行三次生物重复。
- 荧光强度测量
注:该方法在FFI出版物41中使用,以评估与红景天016接触时禾谷镰刀菌8/1-wt-GFP菌丝中荧光强度的变化作为时间的函数。- 下载、安装和启动斐济。通过选择"文件">"导入图像序列",从延时实验导入图像序列>图像序列。找到存储数据的文件夹,然后选择"打开"。在"序列选项"窗口中,选择"首选项",然后选择"确定"。
- 指定感兴趣区域 (ROI),以使用位于主工具栏中的矩形工具测量 hypha 的绝对荧光强度。正方形的大小可以完全按如下方式定义: 编辑>选择 > 指定;还可以通过选择" 编辑>选择">"添加到管理器"来保存 ROI 以供将来在 ROI 管理器中参考。
- 测量整个图像序列或堆栈中每个图像的已定义 ROI 内的绝对荧光强度(平均灰度值),如下所示: 图像>堆栈>测量堆栈。处理完堆栈中的所有图像后," 结果 "窗口将自动打开。
注意:" 结果 "窗口中显示的数据可以定义如下:单击" 结果 "窗口,然后选择" 结果">"设置测量值"。确保已选择 灰度值平均值 。 - 在 结果 窗口中选择所有数据。复制并粘贴到另一个软件程序中,例如电子表格,以绘制指定ROI的绝对荧光强度作为时间的函数。
- 重复步骤5.2.2.2-5.2.2.4以收集每个ROI的绝对荧光强度测量值,即在感兴趣的菌丝上,在感兴趣的菌丝旁边或在相应的控制通道内。
- 以任意单位(AU)计算适当的相对荧光强度,例如,通过将ROI的绝对荧光强度[感兴趣的hypa]除以ROI [对照通道]的绝对荧光强度。有关更多具体详细信息,请参阅 FFI 出版物41 。
- 每个实验至少进行三次生物重复,并将相对荧光强度绘制为时间的函数。
- 菌丝生长速率测量
Access restricted. Please log in or start a trial to view this content.
结果
代表性的结果来自示例性 BFI40 和 FFI41 设备。使用这些设备结合基本的显微镜技术可以很容易地获得菌丝生长速率测量值。图3A-B说明了C. cinerea hyphae和枯草芽孢杆菌NCIB 3610之间的细菌 - 真菌相互作用。枯草芽孢杆菌的存在在共同接种后约5小时后阻止了C. cinerea的生长(图3B...
Access restricted. Please log in or start a trial to view this content.
讨论
本文介绍了一种使用通道微流体研究真菌 - 微生物相互作用的方案。作者旨在证明这些设备的多功能性,并鼓励适应研究人员的兴趣。使用示例性BFI和FFI设备,可以比以前更详细地研究真菌 - 微生物相互作用。通过消除土壤的背景复杂性和异质性,减缓菌丝的生长,使它们局限于单个单层,并严格调节环境参数,随着时间的推移,可以捕获这些生物事件的高分辨率图像。使用这些设备,已经使用?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明没有相互竞争的利益。
致谢
我们感谢伦敦帝国理工学院生物工程系和Leverhulme Trust的财政支持(研究资助参考:RPG-2020-352)。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
参考文献
- Zhu, Y. -G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33(2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -Y., Zhang, Q., Li, H., Gao, J. -M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, Č, Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), Basel, Switzerland. 572(2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163(2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535(2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154(2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243(2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074(2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262(2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010(2018).
- Choi, C. -H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064(2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468(2021).
- Boenisch, M. J. Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , Staats-und Universitätsbibliothek Hamburg Carl von Ossietzky. (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。