JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포 수준에서 곰팡이 - 미생물 상호 작용을 조사하기위한 미세 유체 도구
요약
토양의 불투명도로 인해 구성 미생물 간의 상호 작용은 세포 분해능으로 쉽게 시각화 될 수 없습니다. 여기에서는 곰팡이 - 미생물 상호 작용을 조사하기위한 새로운 기회를 제공하는 두 가지 미세 유체 도구가 제시됩니다. 이 장치는 다재다능하고 사용하기 쉬우므로 세포 수준에서 높은 시공간 제어 및 고해상도 이미징이 가능합니다.
초록
필라멘트 균류는 토양의 성공적인 거주자이며 유기 및 무기 물질의 분해뿐만 아니라 영양소 수준의 조절과 같은 토양 생태계에서 중요한 역할을합니다. 거기에서 그들은 또한 박테리아 나 다른 곰팡이와 같은 다양한 다른 미생물과 상호 작용할 수있는 수많은 기회를 발견합니다. 그러나 세포 수준에서 곰팡이 상호 작용을 연구하는 것은 토양의 블랙 박스와 같은 특성 때문에 어려울 수 있습니다. 곰팡이 상호 작용의 연구를 위해 새로운 미세 유체 도구가 개발되고 있습니다. 박테리아 - 곰팡이 및 곰팡이 - 곰팡이 상호 작용을 연구하기 위해 고안된 두 가지 플랫폼이 강조됩니다. 이러한 마이크로채널 내에서, 진균-미생물 상호작용은 이전에 가능했던 것보다 더 높은 시간적 및 공간적 분해능으로 제어된 물리-화학적 환경에서 모니터링될 수 있다. 이러한 도구의 적용은 균사에 대한 박테리아 극성 부착의 관찰 또는 특징이없는 곰팡이 - 곰팡이 적대감을 드러내는 것과 같은 수많은 새로운 생물학적 통찰력을 산출했습니다. 이러한 방법론의 주요 특징은 비 전문가가이 도구의 사용 편의성과 관련하여 미생물학 실험실에서 사용할 수있는 번역 가능성이 높은 기술을 제공합니다.
서문
토양은 탄소와 인 순환 1,2에 도움이되는 풍부한 미생물을 포함하는 매우 다양한 환경입니다. 필라멘트 균류는 유기 및 무기 물질의 분해제로서 수많은 생태계의 주요 구성 요소이며 공생 관계형성 3,4을 통해 식물의 영양을 향상시킬 수 있습니다. 토양 내에서 곰팡이는 다른 곰팡이5, 박테리아6, 바이러스7 및 선충류8과 같은 수많은 미생물과 동적으로 상호 작용합니다. 이러한 상호 작용은 토양과 식물 건강에 중요한 영향을 미칩니다. 그러나 고해상도로 상호 작용하는 미생물을 이미징 할 수있는 적절한 실험 시스템이 없기 때문에 많은 사람들이 정의되지 않은 채로 남아 있습니다.
박테리아 - 곰팡이 상호 작용 (BFI) 및 곰팡이 - 곰팡이 상호 작용 (FFIs)에 관한 조사는 의학의 항균제 및 농업의 생물학적 조절제를 포함하여 다양한 분야에서 가치있는 응용 프로그램을 가지고 있습니다. 예를 들어, 곰팡이 코프리놉시스 시네레아는 펩티드 콥신을 생산하며, 이는 인간 병원체 리스테리아 모노사이토게네스9에 대해 항균 활성을 나타내는 것으로 나타났다. 유사하게, 진균 유래 화합물인 그리세오풀빈은 인간 진균 감염에 대한 치료제로서 널리 이용되며, 추가적으로 식물 병원성 진균인 알터나리아 솔라니10,11의 성장을 억제할 수 있다. 토양 거주 박테리아 바실러스 서브틸리스의 몇몇 균주는 또한 진균 식물 병원균인 리조토니아 솔라니12,13의 효과적인 생물조절제인 것으로 입증되었다. 그럼에도 불구하고 전통적인 방법론과 관련된 한계로 인해 BFI 및 FFI는 단일 셀 수준에서 제대로 이해되지 않습니다.
전통적인 연구는 일반적으로 두 종 이상의 종과 대결하는 한천 플레이트를 사용하여 매크로 스케일에서 BFI와 FFI를 탐구합니다. 이들의 상호작용은 대립하는 종14,15,16의 성장 속도와 대사산물 생산을 측정함으로써 평가된다; 그러나이 방법론은 식민지 수준에서만 해결됩니다. 세포 수준에서의 상호작용을 연구하기 위해, 박테리아 및 진균 접종제는 한천으로 코팅된 유리 현미경 슬라이드에서 배양될 수 있고, 그 후 현미경(17)으로 이미지화된다. 그럼에도 불구하고 감금이 부족하기 때문에 현미경 슬라이드를 사용하여 단일 hypha를 따르는 것이 어려울 수 있으며, 이는 타임랩스 이미지를 얻기가 더 어렵다는 것을 의미합니다. 또한, 진균 균사체의 정의된 영역 내에 다른 미생물을 공간적으로 가두거나 교란될 수 있는 정의된 화학적 환경을 만들 수 있는 기회는, 예를 들어, 이러한 셋업에서 가능하지 않다. 토양의 "블랙 박스"특성은 또한 단일 세포(18)의 수준에서 곰팡이 - 미생물 상호 작용을 연구하는 복잡성을 추가합니다. 토양 미생물의 놀라운 다양성에서 벗어나 상호 작용하는 종을 관찰함으로써 개별 구성원이 상호 작용하는 정확한 방식을 평가할 수 있습니다. 따라서 BFI 및 FFI의 고해상도, 단일 셀 이미징을 가능하게 하는 다목적 플랫폼에 대한 지속적인 요구가 존재한다.
마이크로유체 기술, 소위 랩온어칩 시스템(lab-on-a-chip systems)은 단일 세포 수준에서 BFI 및 FFI 연구를 위한 이상적인 플랫폼을 제공합니다. 화학 분석 및 마이크로 일렉트로닉스를 위해 개발 된 기술에서 유래 한 미세 유체 공학 분야는 생물 과학19에 의해 채택되었습니다. 마이크로유체 기술은 마이크로미터 규모에서 적어도 하나의 차원을 갖는 소형화된 채널의 맞춤형 네트워크 내에서 소량의 유체를 조절하며, 생물학적 연구에서의 사용은 확대되고 있다20. 특히, 사상균21,22,23,24,25,26,27,28,29,30의 성장을 조사하기 위해 미세유체 장치가 개발되었다. 이 기술을 사용하는 한 가지 이점은 균사의 감금과 마이크로 채널 내의 영양소 분포가 기존의 한천 방법(31)보다 토양 환경의 구조와 더 밀접하게 유사하다는 것입니다. 최근에, 미세유체 플랫폼이 인간 호중구와 진균 병원체(32), 박테리아 및 식물 뿌리(33), 진균 및 선충류(34,35) 사이의 상호작용을 조사하기 위해 이용되고 있다.
미생물 상호작용을 연구하기 위해 마이크로유체학을 사용하는 많은 이점 중 하나는 마이크로채널 환경의 특이적 조절을 포함한다. 예를 들어, 층류 정권은 정의된 농도 구배를 생성하기 위해 이용될 수 있으며, 이는 박테리아 화학주성(36)을 검사할 때 특히 유용하다. 또 다른 장점은 미세 유체 장치의 제조에 일반적으로 사용되는 저렴하고 생체 적합성 엘라스토머 폴리머 인 폴리 (디메틸 실록산) (PDMS)의 투명한 특성이 밝은 필드 및 형광 현미경(37)을 사용하여 단일 세포의 고해상도 이미징을 용이하게한다는 것입니다. 마찬가지로, 마이크로채널 내의 미생물의 감금은 단일 세포를 추적하는 타임랩스 실험이 수행될 수 있다는 것을 의미하며, 개별 세포 반응이 기록되고 정량화될 수 있게 한다(37). 마지막으로, 미세유체 장치가 사용자 친화적으로 설계될 수 있기 때문에, 이들은 비전문가(38)에 의해 용이하게 이용될 수 있다.
토양-거주 미생물 사이의 상호작용에 대한 지식을 증진시키는 것은 생물 다양성을 유지하는 지속 가능한 생태계 관리 관행을 개선하고 기후 변화가 육상 환경에 미치는 영향을 완화하는 데 중요하다39. 따라서, 새로운 미세유체 도구의 개발은 세포 수준에서 곰팡이와 그들의 상호 작용에 대한 이해를 넓히는 데 필수적입니다. 여기서 프로토콜은 그림 1에 표시된 바와 같이 BFIs(40) 및 FFIs(41)의 연구를 위해 생산된 두 개의 미세유체 장치에 초점을 맞출 것이다.

그림 1: 박테리아-진균 상호작용(BFI) 및 곰팡이-진균 상호작용(FFI) 장치의 시각적 및 개략적 표현. (A) BFI 장치의 이미지. 균사 플러그는 마이크로 채널의 한쪽 끝 입구에 배치되어 장치로 하이팔 성장을 허용합니다. 박테리아 입구는 반대쪽 끝에 있습니다. 스케일 바 = 5 mm. (B) 상호작용 마이크로채널을 통한 박테리아 입구의 위치 및 최면 성장의 방향을 묘사하는 BFI 장치의 개략적인 개요. 채널은 깊이 10μm, 너비 100μm, 길이 7mm이며 총 28개의 관측 채널이 있습니다. (c) Coprinopsis cinerea와 Bacillus subtilis NCIB 3610 사이의 한천 플레이트에서의 대결 분석, 스케일 바 = 20 mm (왼쪽). C. cinerea와 B. subtilis NCIB 3610 내 마이크로채널(중간 및 오른쪽) 사이의 상호작용, 즉 진균균 균사에 대한 박테리아의 극성 부착을 보여주는 현미경 이미지. 스케일 바 = 25 μm (중간) 및 10 μm (오른쪽). (d) 균사체 플러그로 이중 접종된 유리 바닥 페트리 접시에 결합된 FFI 장치의 이미지. 스케일 바 = 1cm. (E) FFI 장치의 개략적인 개요. 두 개의 곰팡이 접종제 플러그가 장치의 양쪽 끝에있는 입구에 도입되어 마이크로 채널의 최면 탐사가 가능합니다. 제어 채널은 하나의 진균 유입구에만 연결되며 막 다른 채널을 가지고있어 테스트 진균 간의 상호 작용을 방지합니다. 상호작용 채널은 진균 유입구를 연결하고 마이크로채널 내의 피험자 사이의 최면 상호작용을 허용한다. 각 인터랙션 채널은 18개의 다이아몬드 모양의 섹션으로 구성되며, 총 길이는 8.8mm(다이아몬드당 490 x 430μm), 깊이는 10μm, 각 다이아몬드 사이에는 20μm의 연결 영역을 가집니다. 채널 유형은 중복되고, 스케일 막대 = 1mm입니다. (F) 상호 연결된 상호 작용 채널의 반대쪽 끝에서 자라는 두 개의 접근하는 하이팔 전선 사이의 상호 작용 영역입니다. 위상차 현미경 이미지, 스케일 바 = 250 μm. 이 도면의 패널은 Stanley et al., 2014 (A-C)40 및 Gimeno et al., 2021 (D-F)41에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
참고: 이 프로토콜에 설명된 절차에 대한 요약은 그림 2에 시각적으로 묘사되어 있습니다.
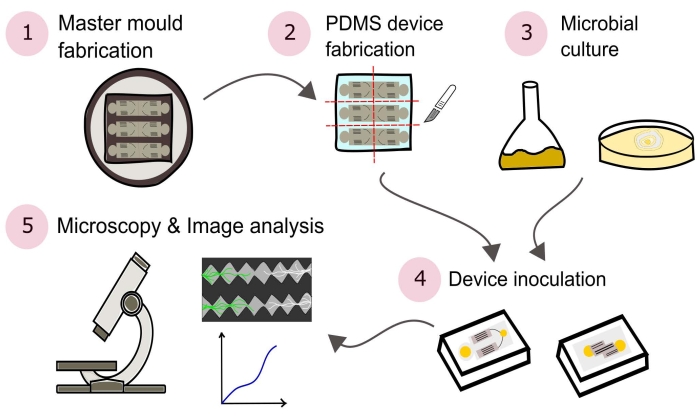
그림 2: 이 프로토콜에 자세히 설명된 다섯 개의 주요 섹션으로 구성된 제시된 방법론의 개략적인 표현. 장치 설계는 CAD(컴퓨터 지원 설계) 소프트웨어와 포토리소그래피(1)를 사용하여 제조된 마스터 몰드를 사용하여 만들어집니다. 이것은 폴리 (디메틸 실록산) (PDMS)를 주조하는 데 사용되며, 이는 슬래브로 다이싱되고 유리 바닥 페트리 접시에 결합되어 미세 유체 장치 (2)를 형성합니다. 연구에 포함될 미생물은 배양(3)되고 장치(4)를 접종하는데 사용된다. 상호 작용은 현미경을 사용하여 연구되고 이미지 분석 기술을 사용하여 정량화됩니다 (5). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 마스터 금형 제작
- 포토마스크 제작
- CAD(컴퓨터 지원 설계) 소프트웨어를 사용하여 미세유체 장치 설계를 생성합니다. 제시된 장치의 치수는 도 1에 제시되어 있으며, 특정 설계 특징에 대한 자세한 내용은 각각의 간행물40,41에 종합적으로 열거되어 있다.
- CAD 설계 파일을 적절한 형식(예: .dwg, .dxf)을 사용하여 내보냅니다. 내보낸 CAD 디자인 파일을 인쇄를 위해 상용 공급자에게 전송하여 필름 포토리소그래피 마스크를 인쇄합니다.
- 포토 리소그래피
참고: 다음 단계는 층류 후드 또는 클린룸 시설과 같은 먼지가 없고 빛이 조절되는 환경에서 수행해야 합니다. 여기에 제공된 실험 조건은 지침으로 제공되며 사내에서 최적화되어야합니다. 저자는 특정 교육 및 컨설팅 확립 된 프로토콜42를 찾는 것이 좋습니다.- 200°C의 오븐에서 2시간 동안 베이킹하여 100 mm 실리콘 웨이퍼를 제조하였다. 실리콘 웨이퍼를 SU-8 2010 포토레지스트로 스핀 코팅하여 목표 두께 10μm를 목표로 합니다: 10초(가속 100rpm/s)의 경우 500rpm, 45초(가속도 300rpm/s)의 경우 3,000rpm.
주의: SU-8 포토레지스트는 위험하며, 취급 시 주의하고 흡입 및 피부와의 접촉을 방지합니다. 그것은 가연성이며 잠재적으로 발암 성이며 환경에 독성이 있습니다. - 코팅된 실리콘 웨이퍼를 95°C에서 2.5분 동안 베이크한다(소프트 베이크). 필름 포토리소그래피 마스크와 마스크 얼라이너를 사용하여 365nm 파장에서 140mJ/cm2 의 에너지 용량을 사용하여 포토레지스트를 자외선(UV) 빛에 노출시킵니다.
- 코팅된 실리콘 웨이퍼를 95°C에서 3.5분 동안 베이크한다(노출 후 베이크). 실리콘 웨이퍼를 현상액에 3분 동안 침지 및 교반하여 미노광 포토레지스트를 제거하여 미세제작된 구조를 드러낸다.
주의: 개발자 솔루션은 가연성일 수 있으므로 취급 및 보관 시 적절한 예방 조치를 취하십시오. - 신선한 개발자 용액으로 10 초 동안 헹구십시오. 이소프로필 알코올로 10 초 동안 헹구고 공기 건조하십시오. 여과된 압축 공기를 사용하여 구조물이 완전히 건조한지 확인하십시오. SU-8 구조물의 높이를 측정하십시오, 예를 들어, profilometer를 사용하여.
- 각 마스터 몰드를 50 μL의 클로로트리메틸실란으로 실란화하여 2시간 동안 50 mbar의 진공 압력을 가한다. 저자들은 마스터 몰드의 재 사일란화가 필요하지 않은 것으로 판명되었다고 지적합니다.
주의: 클로로트리메틸실란은 유해 물질입니다. 적절한 개인 보호 장비 (PPE)를 착용하고 조심스럽게 다루십시오. 피부와 눈과의 접촉을 피하고 흡입을 방지하십시오. 발화원을 멀리하고 환기가 잘되는 곳에서 사용하십시오.
- 200°C의 오븐에서 2시간 동안 베이킹하여 100 mm 실리콘 웨이퍼를 제조하였다. 실리콘 웨이퍼를 SU-8 2010 포토레지스트로 스핀 코팅하여 목표 두께 10μm를 목표로 합니다: 10초(가속 100rpm/s)의 경우 500rpm, 45초(가속도 300rpm/s)의 경우 3,000rpm.
2. 장치 제작
참고: 다음 단계는 층류 후드와 같은 먼지가 없는 환경에서 수행해야 합니다.
- 폴리(디메틸실록산)(PDMS) 슬라브의 제조
- 깨끗한 플라스틱 컵에 주걱을 사용하여 베이스와 경화제를 10:1 비율로 완전히 혼합하여 약 40 g의 PDMS를 준비한다. PDMS를 포함하는 플라스틱 컵을 진공 챔버 (진공 압력 = 50 mbar)에 1 시간 동안 위치시켜 혼합물을 탈기시켜 모든 기포를 제거한다.
- 투명 테이프를 사용하여 마스터 몰드를 플라스틱 마운트에 고정합니다. 압축 여과 된 공기를 사용하여 청소하여 먼지 입자를 제거하십시오.
참고: 대안적으로, 알루미늄 호일은 유리 페트리 접시 주위에 형상화될 수 있고, 이어서 마스터 몰드를 수용하고 PDMS(43)를 포함하는 데 사용될 수 있다. - PDMS 혼합물을 마스터 몰드의 중앙에 붓고 평평한 표면에 있는지 확인하고 침전 할 수 있도록하십시오.
참고: PDMS 혼합물은 마스터 몰드의 표면에 가능한 한 가깝게 부어 기포의 유입을 최소화하기 위해 연속 흐름을 유지해야 합니다. 기포는 압축 공기를 기포 위로 향하게 하거나 미세한 바늘을 사용하여 압축공기를 스쿠핑하여 제거할 수 있습니다. - 마스터 몰드를 플라스틱 뚜껑으로 느슨하게 덮어 먼지 입자가 PDMS 표면에 침전되지 않도록 합니다. 마스터 몰드를 오븐으로 옮기고 70°C에서 하룻밤 동안 경화시킨다.
- 오븐에서 마스터 몰드를 제거하고 식히십시오. 경화 된 PDMS를 마스터 몰드 및 플라스틱 프레임에서 떼어내어 마스터 몰드 / PDMS가 손상되지 않도록주의하십시오.
- PDMS에 엠보싱된 마이크로채널 위에 투명 테이프를 올려 먼지가 없는 표면을 유지합니다. 접착하기 전에 테이프를 제거했는지 확인하십시오.
- PDMS를 슬래브로 절단(즉, 여러 장치가 마스터 몰드의 설계에 포함된 경우, 많은 장치가 단일 주조로 제작될 수 있음)은 장착된 단두대 또는 면도날을 사용하여 설계에 의해 지정됩니다. BFI PDMS 슬래브의 측면 개구부를 절단할 때 마이크로채널이 완전히 열려 있는지 확인하십시오(그림 1A). FFI PDMS 슬래브의 경우 그림 1D에 표시된 유리 바닥 페트리 접시에 맞도록 각 모서리를 다듬어야 합니다.
- 장치 설계에 따라 원하는 입구 / 출구 구멍을 펀치하십시오. 정밀 커터를 사용하여 예시 BFI 및 FFI 장치에 대해 각각 3.18mm 및 4.75mm의 입구 구멍을 펀치합니다.
- PDMS 슬래브를 본딩하여 장치 생성
참고: 다음 세척 단계(2.2.1-2.2.2)는 37kHz에서 정제수(ddH2O)로 채워진 초음파 세척기를 사용합니다. PDMS 슬래브를 세척하는 것은 성공적인 접합(44 )을 강화하고 오염의 위험을 감소시키는 데 도움이 된다. PDMS 슬래브를 조작하려면 깨끗한 포셉을 사용하고 입구 구멍을 사용하여 리프트를 사용하여 마이크로 채널 또는 장치 표면의 손상을 방지하십시오.- PDMS 슬라브를 0.5 M NaOH에 침수시키고 5분 동안 초음파 처리한다. 멸균ddH2O. PDMS 슬라브를 70% 에탄올 용액으로 옮기고 5분 동안 초음파 처리하여 헹구십시오. 멸균 ddH20으로 헹구십시오.
- PDMS 슬라브를 멸균ddH2O에 담그고 5분 동안 초음파 처리한다. 멸균된ddH2O로부터 PDMS 슬라브를 제거하고, 여과된 압축 공기를 사용하여 건조시키고, 멸균된 사각 페트리 접시에 넣는다.
- PDMS 슬라브가 들어있는 사각 페트리 접시를 70°C의 오븐에 넣고 1시간 동안 건조시킨다. 오븐에서 꺼내어 먼지가없는 환경에서 식히십시오. 테이프 및/또는 여과된 압축 공기를 사용하여 PDMS 슬래브 표면의 먼지를 제거합니다.
- PDMS 슬래브 및 유리 바닥 페트리 접시의 표면을 활성화하여 진공 압력 0.75mbar, 전력 50%, 코팅 시간 1분이라는 설정으로 플라즈마 클리너를 사용하여 접착할 수 있습니다. 활성화 될 표면을 플라즈마 클리너에서 위쪽을 향하게(그리고 이후에 결합) 배치하십시오.
- 플라즈마 클리너에서 PDMS 슬래브와 유리 바닥 페트리 접시를 제거하고 활성화 된 표면을 서로 등각 접촉으로 부드럽게 배치하여 결합하십시오. BFI 및 FFI PDMS 슬래브를 각각 직경 35mm 및 50mm 유리 바닥 페트리 접시(유리 두께 0.17mm)에 접착한다.
참고: 접합 시 너무 많은 압력을 가하지 않도록 주의하십시오, 이것은 마이크로채널의 붕괴를 초래할 수 있습니다. - 핀셋으로 유리 바닥 페트리 접시에서 PDMS 슬래브를 떼어내는 것만으로 성공적인 접합을 확인하십시오. 장치를 눈으로 시각화하거나 일반 현미경을 사용하여 접종 입구 또는 마이크로 채널이 붕괴되지 않도록하십시오.
참고: 포화 조건(즉, 물 포화 및/또는 영양소가 풍부한 조건)의 경우 프로토콜의 2.2.7단계를 포함합니다. 물 불포화 조건이 필요한 경우 2.2.8단계로 진행하십시오. 장치는 물 또는 매체로 채워질 수 있습니다. - 접합 직후에 100 μL의 BFI 장치용 원하는 용액(박테리아 입구 및 측면 개구부) 또는 30 μL의 배지를 FFI 장치에 대한 각 입구(총 60 μL)에 피펫팅하여 장치를 채운다. 기포가 존재하면, 이들은 PDMS가 다공성이기 때문에 충진 후 약 10 분 후에 소산됩니다.
- 습도를 유지하기 위해 페트리 접시에 멸균ddH2O(~ 100-200 μL)를 첨가하십시오.
3. 미생물 배양
참고: 다음 단계는 곰팡이 및 박테리아 배양을 위한 일반적인 미생물 절차를 제공하며 원하는 미생물에 필요한 봉쇄 수준에 적합한 멸균 조건(즉, 화염 또는 미생물 안전 캐비닛 사용)에서 수행해야 합니다. 구체적인 예는 관심있는 종에 대해 각 섹션의 끝에 주어진다.
- 곰팡이 문화
- 한천으로 보충된 원하는 배양 배지를 준비한다. 배지를 121°C에서 15분 동안 오토클레이브한다. 배지를 50°C까지 식히고 직경 9cm의 페트리 접시에 부어 멸균 상태를 유지합니다.
- 코르크 보러를 사용하여 원하는 진균 균주의 냉장고 스톡 콜로니로부터 균사체를 함유하는 한천의 직경 4 mm 플러그를 제거하여 단리물을 활성화시킨다. 이것은 장치 접종 전에 곰팡이의 표준화되고 활발한 성장을 보장하기 위해 수행됩니다.
참고: 미생물은 또한 글리세롤 스톡, 즉 -70°C에서 50% 글리세롤 용액의 한천 플러그에 저장된 진균 단리물로부터 활성화될 수 있다(41). - 균사체가있는 플러그의 측면을 접종되지 않은 페트리 접시의 중앙에있는 한천 표면과 접촉시킵니다. 페트리 접시 위에 있는 뚜껑을 교체하고 필요한 시간, 전형적으로 약 3 내지 4일 동안 원하는 균주를 적절한 온도에서 배양하기 전에 밀봉한다.
참고: 트리코더마 로시쿰에 대한 배양 조건의 예: 맥아 추출물 한천, 암흑에서 25°C에서 48시간 동안 인큐베이션하였다.
- 박테리아 문화
- 공급원 스톡으로부터 원하는 박테리아 단리물(예를 들어, 글리세롤 스톡 또는 한천 플레이트로부터의 단일 콜로니)을 한천 플레이트 상에 스트리킹하여 단일 박테리아 콜로니를 달성하고 오염이 없음을 보장한다(45). 플레이트를 필름으로 밀봉하십시오.
- 개별 콜로니가 관찰될 때까지 관심있는 분리물에 특이적인 온도 및 지속 시간에서 인큐베이션한다.
- 원하는 배양액을 준비한다. 예를 들어,ddH2O의 1 L 당 트립톤 10 g, NaCl 10 g 및 효모 추출물 5 g을 첨가하여 B. subtilis의 배양을 위한 LB 배지를 제조하였다. 배지를 121°C에서 15분 동안 오토클레이브한다.
- 매체를 실온으로 식히십시오. 배지를 멸균 환경 내부의 멸균 배양 플라스크에 첨가한다.
- 멸균 접종 루프를 사용하여 한천 플레이트에서 단일 박테리아 콜로니를 터치합니다. 접종된 루프를 루프로 액체를 간단히 만짐으로써 멸균 배양 배지 내로 옮긴다.
- 멸균 뚜껑 또는 호일을 사용하여 플라스크를 밀봉하고, 선택된 종에 적합한 설정을 사용하여 밤새 진탕 인큐베이터 내부에 배치한다.
참고: B. subtilis에 대한 실시예 배양 조건: i) 액체 배양 - LB 배지에서 200 rpm으로 37°C에서 호기성 성장 및 ii) 플레이트 배양 - LB 한천 플레이트 상에서 실온. 다른 곰팡이 균주를 배양하는 방법에 대한 자세한 내용은 FFI / BFI 논문 40,41을 참조하십시오.
4. 장치 접종
참고: 다음 단계는 멸균 장비를 사용하는 층류 후드 내부에서 수행되어야 합니다.
- 곰팡이 접종
- 멸균된 코르크 보어(ø = 4 mm)를 사용하여 3일령 배양물의 주변에 있는 콜로니로부터 한천 플러그를 제거하였다(단계 3.1). 성장하는 하이팔 앞면이 손상되지 않았는지 확인하십시오.
- 플러그를 곰팡이 입구에 넣고 균사체 쪽을 아래로 향하게하고 하이팔 앞쪽의 성장 방향이 마이크로 채널 개구부를 향하여 채널의 최면 침투를 촉진합니다.
- 두 번째 곰팡이 종에 대해 4.1.1-4.1.2 단계를 반복하십시오 (FFI 장치를 사용하는 경우), 플러그를 반대쪽 입구에 도입하십시오. BFI 장치를 사용하는 경우 이 단계를 생략하고 4.1.4단계를 계속하십시오.
- 페트리 접시를 투명 필름으로 밀봉하고 이미징이 시작될 때까지 어둠 속에서 25-28°C에서 인큐베이션한다. 관찰하고자 하는 의도된 생물학적 사건, 예를 들어, 진균-진균 대립, 및 장치 내에 포함된 종의 성장 속도에 따라 사전 이미징 인큐베이션 시간을 결정한다.
- 세균 접종
- 하룻밤 배양물(단계 3.2)로부터 박테리아를 단계 3.2.3에 상술된 것과 동일한 배지를 사용하여 1:25 비율로 희석한다. 37°C에서 3시간 동안 배양하였다.
- 10분 동안 2000 x g 에서 원심분리기를 사용하여 펠릿화 배양물에 의해 박테리아를 세척한다. 상청액을 버리고 세포를 0.9 % w / v 염화나트륨 용액의 원하는 부피로 재현탁하십시오.
- 다시 원심분리하여 펠렛을 얻었다. 상청액을 버리고 세포를 액체 배지 (예를 들어, C. 시네레아 최소 배지 내지 OD600의 OD600)에 재현탁시킨다. 문제의 박테리아 균주에 대한OD600 값을 최적화하십시오.
- 인큐베이터에서 BFI 장치를 제거하고 멸균 환경에서 엽니 다. 10 μL의 현탁액을 박테리아 입구에 피펫한다.
참고 : 문제의 박테리아 - 곰팡이 상호 작용에 대한 정확한 접종 타이밍을 최적화하십시오. 예를 들어, C. cinerea를 사용하는 경우 진균 접종 후 18 시간 동안 BFI 장치에 박테리아를 도입하십시오. - 페트리 접시를 투명 필름으로 밀봉하고 이미징이 시작될 때까지 어둠 속에서 25°C에서 인큐베이션한다. 장치를 똑바로 보관합니다.
5. 현미경 및 이미지 분석
- 현미경 검사 법
참고 : 연구원은 수행 할 실험의 성격과 일치하는 적절한 이미징 방법, 예를 들어 거꾸로 된 광역 장내 후광 형광 또는 공초점 현미경을 선택해야합니다. 구체적인 세부 사항은 선택한 현미경 검사의 특성에 따라 달라지기 때문에 일반적인 개요가 여기에 제공되었습니다.- 현미경 컴퓨터, 현미경 본체(해당하는 경우), 카메라, 온도 제어 인큐베이터 및 광원을 켭니다. 현미경이 올바르게 설정되었는지 확인하십시오 (예 : Köhler 조명이 샘플의 조명에도 올바르게 적용되었습니다). 이미징 소프트웨어 패키지를 시작합니다.
참고: 온도 조절 인큐베이터를 사용하는 경우 실험을 시작하기 전에 현미경 온도가 몇 시간 동안 평형을 이루도록 하는 것이 중요합니다. - 미세 유체 장치를 스테이지 인서트에 장착하십시오. 활성 단계 이동 중에 장치가 이탈되는 것을 방지하기 위해 장치가 테이프와 같이 잘 고정되어 있는지 확인하십시오.
- 접종된 장치의 이미지, 예를 들어, 단일 시점 또는 타임랩스 실험을 획득한다. BFI 및 FFI 장치로 수행된 실험과 관련된 포괄적인 이미징 사양은 각각 전술한 간행물40,41에 제공된다.
참고: 브라이트필드 이미지는 위상차 현미경을 사용하여 자동 초점 소프트웨어와 10x 배율, 0.30NA(수치 조리개) 또는 20x 배율, 0.45NA 대물 렌즈를 사용하여 성장 채널을 통한 최면 증식을 시각화하여 획득했습니다. 형광 리포터 단백질의 여기는 형광단에 특이적인 파장을 갖는 고출력 발광 다이오드 광 엔진을 사용하여 달성되었다. - 이미지를 후속 이미지 처리에 적합한 형식으로 내보냅니다. 예를 들어, .tiff.
- 현미경 컴퓨터, 현미경 본체(해당하는 경우), 카메라, 온도 제어 인큐베이터 및 광원을 켭니다. 현미경이 올바르게 설정되었는지 확인하십시오 (예 : Köhler 조명이 샘플의 조명에도 올바르게 적용되었습니다). 이미징 소프트웨어 패키지를 시작합니다.
- 이미지 분석
참고 : 저자는 피지를 추천합니다.46 이미지 분석을위한 도구이지만 다른 소프트웨어 패키지를 사용할 수 있습니다. 다음은 제시된 BFI 및 FFI 장치 간행물에서 피지를 사용하여 수행 된 이미지 분석의 예입니다. 이러한 단계는 Mac에만 해당되며 PC를 사용하는 경우 약간 다를 수 있습니다.- 히팔 성장률 측정
참고 :이 방법은 BFI 원고40 에서 개별 균사의 성장률을 측정하는 데 사용되었습니다.- 피지를 다운로드, 설치 및 실행합니다. 파일 > 이미지 시퀀스 가져오기를 선택하여 타임랩스 실험에서 이미지 시퀀스> 가져옵니다. 데이터가 저장된 폴더를 찾아 열기를 선택합니다. 시퀀스 옵션 창에서 기본 설정을 선택한 다음 확인을 선택합니다.
- 기본 도구 모음에서 직선 아이콘을 선택합니다. 를 클릭하여 성장하는 하이팔 팁의 끝에 직선의 시작 부분을 배치한 다음 동시에 커서를 창 내의 다른 점으로 드래그합니다. 노란색 선이 나타나고 선의 시작, 중간 점 및 끝을 나타내는 세 개의 상자가 나타납니다.
- Ctrl 키를 누른 상태에서 이미지 시퀀스의 다음 프레임으로 이동한 다>. 사각형 상자를 선택하고 올바른 위치로 드래그하여 성장하는 하이파의 끝에 직선의 끝을 놓습니다.
- Ctrl 및 M을 길게 눌러 선의 길이를 픽셀 단위로 측정합니다. 측정된 데이터와 함께 결과 창이 나타납니다. 결과 창에 표시되는 데이터를 다음과 같이 정의합니다. 결과 창을 클릭한 다음 결과 > 측정값 설정을 선택합니다.
- Ctrl 키를 누른 상태에서 이미지 시퀀스의 다음 프레임으로 이동한 다음 >니다. 사각형 상자를 선택하고 올바른 위치로 드래그하여 성장하는 하이파의 끝에 직선의 시작 부분을 배치합니다.
- Ctrl 키를 누른 다음 M을 눌러 선의 길이를 픽셀 단위로 측정합니다. 측정된 데이터와 함께 결과 창이 나타납니다.
- 하이파의 성장을 픽셀 단위로 측정하기 시작할 때까지 5.2.1.5-5.2.1.6단계를 반복합니다.
- 결과 창에서 모든 데이터를 선택합니다. 다른 소프트웨어 프로그램(예: 스프레드시트)에 복사하여 붙여 넣어 데이터를 처리합니다. 최면 성장률(픽셀 또는 마이크로미터)을 시간 함수로 플로팅하고 평균 성장률을 계산합니다. 실험당 적어도 세 번의 생물학적 반복실험을 수행한다.
- 형광 강도 측정
참고: 이 방법은 시간의 함수로서 클로노스타키스 로사016과의 접촉시 푸사리움 그램인나룸 8/1-wt-GFP의 균사에서 형광 강도의 변화를 평가하기 위해 FFI 간행물 41에서 사용되었다.- 피지를 다운로드, 설치 및 실행합니다. 파일 > 이미지 시퀀스 가져오기를 선택하여 타임랩스 실험 에서 이미지 시퀀스> 가져옵니다. 데이터가 저장된 폴더를 찾아 열기를 선택합니다. 시퀀스 옵션 창에서 기본 설정을 선택한 다음 확인을 선택합니다.
- 관심 영역(ROI)을 지정하여 주 도구 모음에 있는 직사각형 도구를 사용하여 하이파의 절대 형광 강도를 측정합니다. 사각형의 크기는 다음과 같이 정확하게 정의 할 수 있습니다 : 편집 > 선택 > 지정; ROI는 나중에 참조할 수 있도록 > 선택 편집 >는 관리자에 추가를 선택하여 ROI 관리자에서 저장할 수도 있습니다.
- 다음과 같이 전체 이미지 시퀀스 또는 스택의 각 이미지에 대해 정의된 ROI 내에서 절대 형광 강도(평균 회색 값)를 측정합니다: 이미지 > 스택 > 측정 스택. 스택의 모든 이미지가 처리되면 결과 창이 자동으로 열립니다.
참고: 결과 창에 표시되는 데이터는 다음과 같이 정의할 수 있습니다. 결과 창을 클릭한 다음 결과 > 측정 설정을 선택합니다. 평균 회색 값이 선택되었는지 확인합니다. - 결과 창에서 모든 데이터를 선택합니다. 다른 소프트웨어 프로그램(예: 스프레드시트)에 복사하여 붙여 넣어 지정된 ROI의 절대 형광 강도를 시간의 함수로 플로팅합니다.
- 5.2.2.2-5.2.2.4단계를 반복하여 각 ROI, 즉 관심 있는 하이파, 관심 있는 하이파 옆 또는 해당 제어 채널 내에서 절대 형광 강도 측정값을 수집합니다.
- 임의의 단위(AU)에서 적절한 상대적 형광 강도를 계산하고, 예를 들어, ROI[관심있는 하이파]의 절대 형광 강도를 ROI[제어 채널]의 절대 형광 강도로 나눕니다. 보다 구체적인 세부사항은 FFI 간행물(41) 을 참조한다.
- 실험당 적어도 세 번의 생물학적 반복실험을 수행하고 상대적 형광 강도를 시간의 함수로 플로팅합니다.
- 히팔 성장률 측정
Access restricted. Please log in or start a trial to view this content.
결과
대표적인 결과는 예시 BFI40 및 FFI41 디바이스로부터 제시된다. 히팔 성장률 측정은 기본적인 현미경 기술과 함께 이러한 장치를 사용하여 쉽게 얻을 수 있습니다. 도 3A-B는 C. cinerea hyphae와 B. subtilis NCIB 3610 사이의 박테리아-진균 상호작용을 도시한다. B. subtilis의 존재는 공동 접종 후 약 5 시간 ?...
Access restricted. Please log in or start a trial to view this content.
토론
이 기사는 채널 미세 유체학을 사용하는 곰팡이 - 미생물 상호 작용의 연구를위한 프로토콜을 제시합니다. 저자는 이러한 장치의 다양성을 입증하고 연구자의 이익에 맞게 적응을 장려하는 것을 목표로합니다. 예시적인 BFI 및 FFI 장치를 사용하여, 진균-미생물 상호작용은 이전에 접근가능한 것보다 더 상세하게 연구될 수 있다. 토양의 배경 복잡성과 이질성을 제거하고, 균사의 성장을 단일 단층?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
우리는 임페리얼 칼리지 런던의 생명 공학과와 Leverhulme Trust (연구 보조금 참조 : RPG-2020-352)의 재정 지원을 인정합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
참고문헌
- Zhu, Y. -G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33(2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -Y., Zhang, Q., Li, H., Gao, J. -M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, Č, Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), Basel, Switzerland. 572(2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163(2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535(2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154(2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243(2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074(2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262(2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010(2018).
- Choi, C. -H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064(2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468(2021).
- Boenisch, M. J. Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , Staats-und Universitätsbibliothek Hamburg Carl von Ossietzky. (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유