Method Article
تصنيع اللوحات الوعائية الهندسية باستخدام تقنيات الطباعة 3D
In This Article
Summary
تتطلب اللوحات الهندسية شبكة وعائية وظيفية مدمجة. في هذا البروتوكول ، نقدم طريقة لتصنيع رفرف الأنسجة المطبوعة 3D التي تحتوي على شبكة الأوعية الدموية الهرمية ومفاغرتها الجراحية المجهرية المباشرة إلى الشريان الفخذي للفئران.
Abstract
تتطلب هندسة الأنسجة السميكة القابلة للزرع والوظيفية تصميم شبكة وعائية هرمية. الطباعة الحيوية 3D هي تقنية تستخدم لإنشاء الأنسجة عن طريق إضافة طبقة فوق طبقة من المواد الحيوية القابلة للطباعة ، وتسمى الأحبار الحيوية ، والخلايا بطريقة منظمة وتلقائية ، مما يسمح بإنشاء هياكل معقدة للغاية لا تستطيع تقنيات هندسة الأنسجة التقليدية تحقيقها. وبالتالي ، فإن الطباعة الحيوية 3D هي نهج جذاب في المختبر لتقليد بنية الأوعية الدموية المعقدة الأصلية ، بدءا من الأوعية المليمترية إلى شبكات الأوعية الدموية الدقيقة.
مكن التقدم في الطباعة الحيوية 3D في الهلاميات المائية الحبيبية من البثق عالي الدقة للأحبار الحيوية القائمة على المصفوفة خارج الخلية منخفضة اللزوجة. يقدم هذا العمل مجتمعة الطباعة الحيوية ثلاثية الأبعاد ونهج الطباعة ثلاثية الأبعاد القائم على القوالب التضحية لتصنيع لوحات الأنسجة الوعائية الهندسية. يتم استخدام الطباعة الحيوية 3D للخلايا البطانية والدعم باستخدام الحبر الحيوي المؤتلف من الكولاجين والميثاكريليت داخل حمام دعم الجيلاتين لتصنيع شبكة شعرية ذاتية التجميع. يتم تجميع هذه الأوعية الدموية الدقيقة المطبوعة حول سقالة مسامية تشبه الأوعية الدموية متوسطة الحجم ، ويتم تصنيعها باستخدام قالب مطبوع 3D مضحي ، ويتم زرعها بخلايا بطانية.
يحفز هذا التجميع بطانة الوعاء المتوسط الحجم على المفاغرة مع الشبكة الشعرية المحيطة ، وإنشاء شبكة وعائية هرمية داخل رفرف الأنسجة المهندس. ثم يتم زرع السديلة الهندسية مباشرة عن طريق المفاغرة الجراحية إلى الشريان الفخذي للفئران باستخدام تقنية الكفة. يمكن توسيع الطرق الموصوفة لتصنيع مختلف اللوحات النسيجية الوعائية لاستخدامها في جراحة إعادة البناء ودراسات الأوعية الدموية.
Introduction
تحدث عيوب الأنسجة الشديدة بسبب الإصابات المؤلمة أو العيوب الخلقية أو المرض ، والمعيار الذهبي الحالي لعلاج هذه العيوب هو باستخدام الطعوم الذاتية ، ولوحات الأنسجة الوعائية ، واللوحات الحرة للأوعية الدموية الدقيقة كبدائل للأنسجة. ومع ذلك ، فإن هذه الخيارات لها عيوب محدودية أنسجة موقع المتبرع واعتلال موقع المتبرع1. وبالتالي ، هناك طلب متزايد على بدائل الأنسجة البديلة التي يمكن استخدامها لتصحيح هذه العيوب2. إن سمك هياكل الأنسجة الهندسية محدود بانتشار العناصر الغذائية والغازات نحو الخلايا ، وبالتالي ، فإن شبكة الأوعية الدموية المناسبة ضرورية لتوليد سقالات كبيرة وسميكة ومغذية بشكل صحيح.
تم تطبيق العديد من النهج لتعزيز الأوعية الدموية للغرسات الهندسية3 ، بما في ذلك التوظيف في الجسم الحي لدعم الأوعية الدموية من المضيف ، وتوصيل عوامل النمو والسيتوكينات داخل السقالات ، وقبل الأوعية الدموية للغرسات ، وتوليد سرير الأوعية الدقيقة المتفرعة القابلة للنفخ باستخدام تقنيات الأنماط الدقيقة4 ، واستخدام مواد التضحية لتشكيل القناة الوعائية / الشبكة5 ، فضلا عن إنشاء قنوات داخل 3D المطبوعات الحيوية يبني 5,6. يتطلب الأوعية الدموية للأنسجة السميكة دمج شبكة وعائية هرمية تتكون من أوعية على نطاق واسع وعلى نطاق الشعيرات الدموية الدقيقة. تقوم الأوعية ذات النطاق الكلي بتوزيع الدم بشكل فعال في جميع أنحاء البناء وتسمح بمفاغرة الجراحة المجهرية مع الأوعية الدموية المضيفة ، في حين تسمح الأوعية ذات النطاق الشعري الدقيق بنشر المغذيات.
اكتسبت الطباعة الحيوية اهتماما قويا في السنوات الأخيرة بسبب المزايا التي تقدمها على طرق هندسة الأنسجة التقليدية. الأنسجة والأعضاء هي كائنات 3D معقدة ومعقدة مع بنية محددة. تتيح الطباعة الحيوية ثلاثية الأبعاد ، مع قدرتها على إيداع طبقات من المواد الحيوية بدقة عالية ، القدرة على إنشاء بدائل معقدة للأنسجة والأعضاء (مثل الكلى والرئة والكبد) 7. تم تكييف العديد من تقنيات الطباعة للطباعة الحيوية ، بما في ذلك الطباعة القائمة على البثق ، النافثة للحبر8 ، والترسب بمساعدة الليزر9،10 ، والطباعة الحيوية القائمة على الطباعة الحجرية المجسمة11،12. تعتمد التقنيات القائمة على البثق على بثق المادة من خلال فوهة عن طريق الضغط على سطح المادة السائبة المقابل للفوهة.
التضمين الحر القابل للانعكاس للهيدروجيل المعلق (FRESH) هو تقنية طباعة حيوية 13,14 تستخدم مادة دعم حبيبية يتم فيها إيداع المادة المبثوقة وتثبيتها في مكانها بواسطة حمام الدعم. يوفر حمام الدعم دعما ميكانيكيا للحبر الحيوي المبثوق والمتقاطع مسبقا حتى يتم ربطه. الميزة الرئيسية لهذه التقنية هي أن حمام الدعم يسمح بقذف المواد منخفضة اللزوجة التي لا يمكنها الحفاظ على شكلها بعد البثق وقبل الربط المتقاطع15. هذا يوسع مجموعة المواد المتاحة التي يمكن استخدامها كأحبار حيوية.
تقدم هذه الورقة بروتوكولا لتوليد رفرف وعائي يجمع بين الأوعية الدموية المجهرية والمتوسطة. ولتحقيق ذلك، يتم إنشاء شبكات الأوعية الدموية الدقيقة المطبوعة بيولوجيا وذاتية التجميع في هيدروجيل ميثاكريليت الكولاجين البشري المؤتلف (rhCollMA)، والذي يتصل بعد ذلك بالجزء الداخلي من سقالة وعائية أكبر وقابلة للزرع، مما يؤدي إلى رفرف الأنسجةالمصمم بالكامل 16. لإنشاء تروية سريعة ومباشرة للأنسجة الهندسية ، يلزم إجراء مفاغرة جراحية مجهرية مباشرة لاستضافة الأوعية. لا تحتوي السقالة الوعائية على قوة كافية للاحتفاظ بالخياطة لاستخدامها باستخدام خياطة جدار الأوعية المجهرية التقليدية. لذلك ، نصف طريقة "الكفة"17،18،19 لتحقيق مفاغرة مع الشريان الفخذي المشترك للفئران. في هذه الطريقة ، يتم تأمين نهايات السفينة بخيوط محيطية ، دون الحاجة إلى ثقب جدار السفينة.
على الرغم من أن البروتوكول المقترح قد تم إعداده لدراسة الأوعية الدموية الهرمية في بيئة rhCollMA ، إلا أنه يمكن توسيع هذا النهج وتطبيقه على مجموعة متنوعة من التطبيقات الجديدة. يمكن تطبيق البروتوكول على الطباعة الحيوية لمختلف الخلايا الخاصة بالأنسجة في أحبار حيوية مختلفة. علاوة على ذلك ، يمكن تعديل هندسة وحجم التركيبات بسهولة لتناسب متطلبات محددة ، مثل إعادة بناء الأنسجة الكبيرة أو الدراسات البيولوجية.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية وتنفيذها تحت إشراف هيئة التخنيون للبحوث ما قبل السريرية (PCRA Technion ، موافقة الأخلاقيات رقم 058-05-20). تم استخدام ذكور الفئران Sprague-Dawley (275-350 جم) لهذه الدراسات. راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والمعدات والبرامج المستخدمة في هذا البروتوكول.
1. تصنيع سقالة الأوعية الدموية
- قم بإنشاء نموذج كمبيوتر ثلاثي الأبعاد لشكل سقالة الأوعية الدموية المطلوبة باستخدام برنامج التصميم بمساعدة الكمبيوتر (CAD) أو قم بتنزيل ملف ثلاثي الأبعاد لهيكل الأوعية الدموية المطلوب من المستودعات عبر الإنترنت.
- قم بإنشاء أسطوانة بقطر داخلي يبلغ 0.9 مم ، وقطر خارجي يبلغ 2 مم ، وارتفاع 18 مم. أضف الحشوات الشعاعية التي يبلغ قطرها 0.22 مم إلى جانب جدار الأسطوانة.
- إنشاء قالب للسقالة باستخدام برنامج تصميم 3D وتصديره كملف . ملف المحكمة. بعد ذلك ، أضف قمعا إلى التصميم لتسهيل ملء القالب لاحقا.
- استيراد ملف . STL في برنامج التقطيع لطابعة 3D لنمذجة الترسيب المنصهر (FDM). قم بتقطيع النموذج بارتفاع طبقة يبلغ 0.1 مم ، وقم بتصديره ك .gcode أو أرسله مباشرة إلى الطابعة ثلاثية الأبعاد.
- 3D طباعة القالب على طابعة FDM 3D مجهزة فوهة 0.25 ملم، وذلك باستخدام خيوط البوليمر المشترك للفيوتين ديول الكحول القابل للذوبان في الماء (BVOH). قم بتخزين القوالب المطبوعة في غرفة فراغ حتى الاستخدام.
تحذير: تجنب التعامل مع خيوط BVOH بأيدي عارية لأنها حساسة للرطوبة. بالإضافة إلى ذلك ، يوصى بتخزين الخيوط في غرفة فراغ لتجنب التعرض للرطوبة. - تحضير محلول بوليمر من خليط 1: 1 من حمض البولي لبنيك (PLLA) وحمض متعدد اللاكتيك المشترك (PLGA) في 1,4-ديوكسان.
- يزن 350 ملغ من PLLA و 350 ملغ من PLGA وينقل إلى قارورة زجاجية سعة 20 مل.
- قياس 10 مل من 1,4-ديوكسان ونقلها إلى قارورة زجاجية باستخدام ماصة زجاجية. أضف قضيب تحريك مغناطيسي صغير إلى القارورة الزجاجية.
تحذير: 1,4-الديوكسان هو مذيب عضوي خطير. استخدم معدات السلامة الشخصية المناسبة واعمل داخل غطاء الدخان. - ضع القارورة الزجاجية داخل حمام ماء ساخن ساخن إلى 70 درجة مئوية واخلط محتوياتها طوال الليل حتى تذوب جميع البوليمرات بالكامل. قم بتخزين المحلول في وعاء زجاجي محكم الإغلاق حتى الاستخدام.
- املأ قوالب BVOH بمحلول PLLA:PLGA.
- باستخدام ماصة إزاحة إيجابية ، قم بقياس 30 ميكرولتر من محلول البوليمر واملأ القالب.
ملاحظة: سيتغير الحجم اللازم لملء القالب وفقا لحجم الوعاء المصمم. استمر في إضافة محلول البوليمر حتى يتم ملء قمع القالب بالكامل. - جهاز طرد مركزي القالب في 100 × غرام لمدة 2 دقيقة. قم بتعبئة القالب ب 20 ميكرولتر أخرى من محلول البوليمر لضمان الملء الكامل.
- باستخدام ماصة إزاحة إيجابية ، قم بقياس 30 ميكرولتر من محلول البوليمر واملأ القالب.
- قم بتجميد القوالب المملوءة عند -80 درجة مئوية لمدة 30 دقيقة على الأقل لضمان تجميد جميع محلول البوليمر. قم بإزالة المذيب من القوالب عن طريق تجميدها بين عشية وضحاها.
ملاحظة: يجب أن يتحول لون البوليمر في القالب من شفاف إلى أبيض بعد عملية التجفيف بالتجميد. - لإزالة مادة قالب الأضحية ، انقل القوالب بعد عملية التجفيف بالتجميد إلى حمام مائي منزوع الأيونات سعة 5 لتر تحت تحريك لطيف. استبدل الماء في الحمام عندما يصبح غائما. عندما يذوب كل BVOH ، جفف السقالات في الهواء وتخزينها في غرفة فراغ حتى الاستخدام.
2. طلاء سقالة الأوعية الدموية مع الفيبرونيكتين
- تطهير السقالات الوعائية PLLA: PLGA عن طريق غمرها في 70٪ من الإيثانول لمدة 30 دقيقة.
- اغسل السقالات 3 × 5 دقائق باستخدام PBS.
- تحضير تخفيف 50 ميكروغرام / مل من الفيبرونيكتين البشري في PBS وطلاء السقالات.
- امزج 500 ميكرولتر من محلول الفيبرونيكتين (1 مجم / مل) مع 9.5 مل من PBS.
- اغمر السقالات الوعائية المطهرة في محلول الفيبرونيكتين هذا واحتضنها عند 37 درجة مئوية لمدة 60 دقيقة للسماح بامتزاز البروتين.
- بعد الحضانة ، اشطف السقالات باستخدام PBS لإزالة الفيبرونيكتين غير المقيد. قم بتخزين هذه السقالات المطلية على درجة حرارة 4 درجات مئوية لمدة تصل إلى 1 أسبوع.
3. إعداد الحبر الحيوي rhCollMA
- قم بإعداد مخزن مؤقت للفوسفات لتحييد مخزون الحبر الحيوي rhCollMA الحمضي.
- قم بإعداد مخزون 10x من الفوسفات العازل عن طريق إذابة 5.495 جم من Na2 HPO 4 و 1.55 جم من NaH2PO4 و 30 mg من كلوريد الصوديوم في 50 مل من الماء منزوع الأيونات.
- قم بإعداد تخفيف 10 أضعاف من المخزن المؤقت للفوسفات 10x عن طريق الجمع بين جزء واحد من المخزن المؤقت للفوسفات 10x مع 9 أجزاء من الماء منزوع الأيونات.
- الجمع بين 900 ميكرولتر من محلول rhCollMA مع 100 ميكرولتر من المخزن المؤقت للفوسفات 10x لتحييد محلول rhCollMA الحمضي.
- قم بتخفيف محلول rhCollMA المحايد إلى التركيز المطلوب البالغ 10 مجم / مل عن طريق خلطه مع الكمية المطلوبة من المخزن المؤقت للفوسفات 1x.
ملاحظة: يختلف تركيز مخزون rhCollMA بين اللوتات. لذلك ، سيختلف حجم المخزن المؤقت للفوسفات 1x اللازم للوصول إلى التركيز المطلوب. - قم بإعداد محلول البوروجين الضوئي (PEO-LAP) ليتم دمجه مع rhCollMA المحايد المخفف.
- تحضير محلول 1.6٪ (ث / v) من بولي (أكسيد الإيثيلين) (PEO) في DMEM خالية من الفينول الأحمر عن طريق إذابة 160 ملغ من PEO في 10 مل من DMEM.
- أضف 20 ملغ من الليثيوم فينيل-2,4,6-ثلاثي ميثيل بنزويل فوسفينات (LAP) إلى هذا المحلول للحصول على 0.2٪ (ث / v) LAP في المحلول. من هذه النقطة ، قم بتغطية المحلول بورق الألومنيوم أو احتفظ به في مكان مظلم لحمايته من الضوء.
- قم بتعقيم محلول PEO-LAP عن طريق تمريره عبر مرشح 0.22 ميكرومتر. تخزين هذا الحل في 4 درجة مئوية لمدة تصل إلى 1 أسبوع.
- قبل الطباعة الحيوية، امزج محلول rhCollMA المحايد المخفف مع محلول PEO-LAP بنسبة 1:1 للحصول على محلول الحبر الحيوي النهائي. استخدم السحب ، بدلا من الدوامة ، لخلط المحاليل مع تجنب فقاعات الهواء.
- إذا تم إدخال الكثير من الفقاعات في المحلول ، فقم بطرده مركزيا عند 2000 × جم لمدة 30 ثانية. بعد الطرد المركزي ، اخلط محلول الحبر الحيوي مرة أخرى لضمان التجانس.
4. إعداد حمام الدعم الحبيبي
- تحضير مواد دعم حبيبية الجيلاتين.
- في خزانة السلامة البيولوجية ، قسم محتويات أنبوب واحد سعة 2 جم من مواد الدعم المجمدة إلى أنبوبين مخروطيين معقمين سعة 50 مل ، يحتوي كل منهما على 1 جم تقريبا.
- أضف 40 مل من DMEM البارد (4 درجات مئوية) الخالي من الفينول الأحمر إلى كل أنبوب ، ودوامة بقوة حتى تذوب جميع مواد الدعم المجمدة.
- دع الطين الناتج يجلس عند 4 درجات مئوية للسماح للمادة الداعمة بإعادة الترطيب.
- قم بتفريغ مادة الدعم في غرفة فراغ لمدة 30 دقيقة لتقليل الفقاعات.
- جهاز الطرد المركزي لمواد الدعم عند 2000 × جم لمدة 5 دقائق. تأكد من أن المادة في الجزء السفلي من الأنبوب وأن المادة الفائقة واضحة.
- شفط supernatant ، مع الحرص على عدم شفط مواد الدعم في الأسفل.
ملاحظة: يجب ألا تتدفق مادة الدعم أثناء إمالة الأنبوب بعد إزالة السوبرناتانت. إذا تدفقت المادة ، فقم بطردها مركزيا مرة أخرى باستخدام نفس الإعدادات ولكن دون إضافة جهاز supernatant جديد.
- انقل ما يقرب من 4 مل من مواد الدعم المضغوطة المعدة إلى كل بئر من صفيحة 12 بئرا باستخدام ماصة إزاحة موجبة. اضغط على صفيحة البئر على سطح صلب لإجبار مادة الدعم على الانتشار بالتساوي في البئر.
ملاحظة: الحد الأدنى الموصى به من حجم مواد الدعم هو 3 أضعاف حجم البنية التي سيتم طباعتها فيه. - ضع صفيحة البئر مع مادة الدعم على مرحلة طابعة حيوية مبردة ، أو عند 4 درجات مئوية ، حتى يتم استخدامها لمنع جزيئات الجيلاتين من الذوبان.
5. دمج الخلايا البطانية ودعم الخلايا مع الحبر الحيوي
- قم بإعداد وسط الخلايا البطانية وفقا لتعليمات الشركة المصنعة عن طريق خلط الوسط القاعدي مع مكون المجموعة المتوسطة المقابل له ، بما في ذلك محلول مضاد حيوي ، مصل بقري جنيني ، ومكملات نمو الخلايا البطانية.
- تحضير وسط الخلايا الجذعية لب الأسنان عن طريق الجمع بين 500 مل من DMEM منخفض الجلوكوز ، و 58 مل من مصل البقر الجنيني ، و 5.8 مل من الأحماض الأمينية غير الأساسية (NEAA) ، و 5.8 مل من بديل الجلوتامين ، و 5.8 مل من 1 M HEPES ، و 5.8 مل من محلول البنسلين والستربتومايسين والنيستاتين.
- تحضير تعليق يحتوي على 2 × 10 6 ZsGreen1 - الخلايا البطانية الوعائية الدقيقة الدهنية البشرية (HAMEC-ZsGreen1) و 6 × 106 خلايا جذعية لب الأسنان (DPSCs) في 10 مل من وسط الخلايا البطانية.
- قم بالطرد المركزي لتعليق الخلية عند 200 × جم لمدة 4 دقائق للحصول على حبيبة خلوية. شفط الوسط الفائق.
- أعد تعليق حبيبات الخلية في 1 مل من الحبر الحيوي rhCollMA المعد مسبقا (الذي يحتوي على PEO-LAP) للحصول على حبر حيوي بتركيز إجمالي للخلية يبلغ 8 × 106 خلايا لكل 1 مل من الحبر الحيوي.
تنبيه: بعد دمج الحبر الحيوي مع الخلايا، انتقل فورا إلى الخطوة التالية. إذا تركت الخلايا في التعليق لفترة طويلة ، فسوف تغرق الخلايا في قاع الأنبوب ، وستتدهور صلاحيتها. بالنسبة للتجارب التي لا تنطوي على خلايا، إما تخطي الخطوات 5.1-5.5، أو دمج حبات الفلورسنت مع الحبر الحيوي بدلا من الخلايا لتحسين التصور المجهري للتركيبات المطبوعة. - انقل خليط الخلايا والحبر الحيوي إلى خراطيش الطباعة.
- قم بتركيب إبرة قطرها الداخلي 0.22 مم على خرطوشة طباعة كهرمانية سعة 3 مل ووضع الخرطوشة في أنبوب مخروطي سعة 50 مل.
- انقل 1 مل من خليط الخلايا والحبر الحيوي إلى خرطوشة الطباعة عن طريق ملئها من الأعلى، باستخدام ماصة إزاحة إيجابية لتقليل الفقاعات.
- قم بتركيب خرطوشة الطباعة في الأداة المناسبة في الطابعة الحيوية.
6. الطباعة الحيوية لشبكات الأوعية الدموية الدقيقة باستخدام الحبر الحيوي rhCollMA
- إنشاء تصميم CAD 3D لشبكة الأوعية الدموية الدقيقة المطبوعة بيولوجيا.
- ارسم نمطا ثنائي الأبعاد لمربع 4 مم يحتوي على قناة دائرية قطرها 2 مم في وسطها. ابثق الرسم بمقدار 4 مم للحصول على مكعب 4 مم × 4 مم × 4 مم مع قناة مركزية. تصدير هذا الكائن ك . ملف المحكمة.
- استيراد لوحة 12 بئر . قالب STL في علامة التبويب النمذجة الصلبة في برنامج تقطيع الطابعة الحيوية ووضعه في المنطقة المخصصة من سرير الطباعة الافتراضي.
- استيراد ملف . ملف STL لشكل المكعب في علامة تبويب النمذجة الصلبة في برنامج تقطيع الطابعة الحيوية. انقر فوق خانة الاختيار استخدام مقسم طريقة العرض الخارجية | تكوين مقسم طريقة العرض ضمن قسم خصائص الكائن . في النافذة المنبثقة، اختر نمطا مستقيما لنمط التعبئة، واكتب 30٪ في كثافة التعبئة. انقر على قبول.
- ضع نسخة من شكل المكعب في كل بئر افتراضي مرغوب فيه بالنقر فوق المكعب وتحريكه باستخدام الماوس.
- قم بإنشاء إعدادات مواد جديدة للحبر الحيوي rhCollMA في علامة تبويب المواد في برنامج تقطيع الطابعة الحيوية بالنقر فوق الزر إضافة مادة . اختر إعدادات المادة للطباعة. للضغط ، اكتب 2 رطل لكل بوصة مربعة في المربع المقابل. للسرعة ، اكتب 20 مم / ثانية في المربع المقابل.
ملاحظة: تحتوي كل مادة من مواد الحبر الحيوي على إعدادات طباعة مختلفة خاصة بها يمكن حفظها في قائمة المواد في التطبيق. - قم بتعيين قيم عرض الخط وارتفاع الخط إلى 0.24 مم وقيمة التسارع إلى 400 مم/ثانية2، عن طريق كتابة هذه القيم في المربعات المقابلة.
- في علامة التبويب النمذجة الصلبة ، انقر فوق كائن المكعب ، ثم انقر فوق مادة rhCollMA من قسم المواد لتعيينها إلى شكل المكعب. في علامة التبويب bioassembly ، انقر فوق الزر إرسال مهمة الطباعة لإرسال مهمة الطباعة إلى الطابعة الحيوية.
- قم بتحميل خرطوشة الطباعة المحملة بالحبر الحيوي الخلوي في أداة التوزيع الهوائية المحيطة سعة 3 مل للطابعة الحيوية ثلاثية الأبعاد القائمة على البثق.
- اضبط درجة حرارة سرير الطباعة على 4 درجات مئوية بالنقر فوق الزر " تبريد" ضمن علامة التبويب التحكم في التسخين/التبريد في شاشة واجهة الطابعة الحيوية. قم بتحميل اللوحة بحمام الدعم الموجود على سرير الطابعة.
ملاحظة: قد تتغير إعدادات المادة لضغط الطباعة وسرعتها بسبب الاختلافات في درجة الحرارة المحيطة أو تباين دفعة الحبر الحيوي. على سبيل المثال ، في الأيام الباردة ، هناك حاجة إلى ضغط أعلى أو سرعة أبطأ لبثق نفس الكمية من المواد. - في علامة التبويب طباعة على شاشة واجهة الطابعة الحيوية، انقر فوق مهمة الطباعة المرسلة في الخطوة 6.7. وانقر فوق ابدأ | انتقل لبدء مهمة الطباعة.
- بعد الطباعة، قم بتعريض لوحة البئر لمصدر ضوء 405 نانومتر بكثافة 3 ميجاوات/سم2 لمدة 30 ثانية لبدء الربط المتقاطع للحبر الحيوي rhCollMA.
- بعد الربط المتقاطع ، احتضن لوحة البئر عند 37 درجة مئوية و 5٪ CO2 لمدة 20 دقيقة على الأقل حتى يذوب كل حمام الدعم.
- استنشق حمام الدعم المسال بلطف واستبدله بوسط خلية بطانية. احتضان التركيبات عند 37 درجة مئوية و 5٪ CO2 حتى الاستخدام في خطوات أخرى.
ملاحظة: نظرا لتقلص البنية بعد الطباعة، يوصى بتنفيذ الخطوة 7 للتجميع في نفس يوم الخطوة 6.
7. تجميع شبكة الأوعية الدموية الدقيقة المطبوعة بيولوجيا مع سقالة الأوعية الدموية للحصول على رفرف الأوعية الدموية الهندسية
- مباشرة بعد إزالة مواد الدعم لشبكة الأوعية الدموية الدقيقة المطبوعة بيولوجيا ، ضع سقالة الأوعية الدموية PLLA:PLGA المغلفة بالفيبرونيكتين في القناة الرئيسية للهيكل المطبوع بيولوجيا.
- احتضان الهياكل المجمعة عند 37 درجة مئوية و 5٪ CO2 لمدة يومين.
- خط تجويف السقالة الوعائية مع الخلايا البطانية.
- تحضير تعليق خلوي للخلايا البطانية الوعائية الدقيقة البشرية المعبرة عن الطماطم (HAMEC-tdTomato) بتركيز 1 × 107 خلايا/مل.
- ضع قطرة 20 ميكرولتر من هذا التعليق الخلوي على سطح مسعور (أي طبق غير مزروع بالأنسجة [nonTC] بحجم 10 سم).
- ضع السقالات الوعائية بلطف أعلى القطرة ، بحيث يتلامس تجويف السقالة على أحد طرفيها مع قطرة الخلية.
- استنشاق القطرة من الطرف المقابل للسقالة (أي النهاية التي لا تتصل بالقطرة) ، وملء تجويفها بتعليق الخلية.
- ضع السقالة المبذرة في أنبوب جهاز طرد مركزي دقيق وضعها في دوار بالداخل في حاضنة مرطبة لمدة 60 دقيقة. بعد ذلك ، انقل السقالة إلى صفيحة من 12 بئرا وأضف 2 مل من وسط الخلايا البطانية.
- قم بزراعة اللوحات الهندسية لمدة 7 أيام ، مع استبدال الوسط كل 2 أيام بوسط خلية بطانية جديد.
8. المجهر البؤري وتلطيخ التألق المناعي لللوحات الهندسية
- بعد 4 أيام و 7 أيام من الثقافة، قم بإجراء تصوير الخلايا الحية للسقالات المجمعة باستخدام مجهر المسح الضوئي بالليزر البؤري.
- حدد قنوات التألق ل ZsGreen1 و tdTomato البروتينات الفلورية على برنامج الحصول على صور المجهر.
- اختر عدسة موضوعية 5x/0.16 مع تكبير/تصغير 0.5x (حجم البكسل 5 ميكرومتر)، وحدد مكدس Z مع 22 شريحة بسماكة 41 ميكرومتر لكل منها.
- حدد مسح تجانب 3 × 2 لتصوير والتقاط البنية بأكملها.
- اضبط كثافة الليزر وقيم الكسب للحصول على إشارة فلورسنت واضحة بدون تشبع وخلفية ضئيلة والحصول على الصور.
- قم بإجراء إسقاط أقصى كثافة ل Z-stack المكتسب للحصول على صورة 2D واحدة باستخدام برنامج الحصول على صورة المجهر أو برنامج تحليل الصور المماثل.
- قم بإجراء تصوير تكبير أعلى لمنطقة ذات أهمية.
- قم بالتبديل إلى عدسة موضوعية 10x/0.3 مع تكبير/تصغير 0.5 (حجم البكسل 1.25 ميكرومتر) وحدد مكدس Z ب 9 شرائح بسماكة 41 ميكرومتر.
- تنفيذ الخطوات 8.2.-8.3.
- بعد 7 أيام من الثقافة ، قم بإصلاح اللوحات الهندسية عن طريق غمرها في 4٪ paraformaldehyde لمدة 20 دقيقة.
- اغسل الهياكل 3 × 5 دقائق باستخدام PBS.
- أضف 0.3٪ (v / v) Triton-X في PBS إلى التركيبات واحتضنها لمدة 15 دقيقة في درجة حرارة الغرفة لاختراق الخلايا.
- اغسل الهياكل 3 × 5 دقائق باستخدام PBS.
- قم بإعداد محلول حجب عن طريق إذابة 5٪ (ث / v) ألبومين مصل البقر (BSA) في PBS. أضف محلول الحجب إلى اللوحات الهندسية واحتضنه لمدة 1 ساعة في درجة حرارة الغرفة.
- قم بإعداد محلول الأجسام المضادة الأساسي عن طريق تخفيف أجسام الأكتين المضادة للعضلات الملساء (anti-SMA) للفأر بنسبة 1:50 في محلول BSA بنسبة 5٪ الذي تم إعداده مسبقا لتلطيخ خلايا الدعم المعبرة عن SMA.
- احتضان السقالات في محلول الأجسام المضادة الأساسي بين عشية وضحاها عند 4 درجات مئوية.
- اغسل 3 × 5 دقائق باستخدام PBS.
- تحضير محلول الأجسام المضادة الثانوي عن طريق تخفيف الماعز المقترن Cy3 المضاد للفأر IgG 1:400 و 4',6-diamidino-2-phenylindole (DAPI ، 2.5 ميكروغرام / مل) في PBS.
- ضع محلول الأجسام المضادة الثانوي على السقالات واحتضنه لمدة 3 ساعات في درجة حرارة الغرفة.
- اغسل 3 × 5 دقائق باستخدام PBS.
- تخزين الإنشاءات في 4 درجة مئوية في PBS لمدة تصل إلى 1 شهر.
- صور السقالات الملطخة باستخدام مجهر المسح الضوئي بالليزر متحد البؤرة.
- حدد قنوات التألق الثلاث (DAPI و ZsGreen و Cy3) على برنامج الحصول على صور المجهر.
- حدد مكدس Z بسماكة مقطع 2 ميكرومتر يمتد بسماكة إجمالية قدرها 50 ميكرومتر. بعد ذلك، قم بتعريف مسح تجانب ضوئي لتصوير مساحات أكبر من البناء.
- اضبط معلمات الاكتساب للحصول على إشارة فلورسنت واضحة بدون تشبع والحد الأدنى من الخلفية.
- احصل على الصور باستخدام هدف 20x/0.8 مع تكبير/تصغير بمعدل 1.0x (حجم البكسل 0.31 ميكرومتر).
- قم بإجراء إسقاط أقصى كثافة ل Z-stack المكتسب للحصول على صورة 2D واحدة باستخدام برنامج الحصول على صورة المجهر أو برنامج تحليل الصور المماثل.
9. مفاغرة السديلة الهندسية مباشرة إلى الشريان الفخذي للفئران باستخدام تقنية الكفة
- قم بإعداد وتعقيم (الأوتوكلاف) الأدوات الجراحية التالية: المشرط رقم 15 ، وزوج من الملقط ذو الأسنان الدقيقة ، وزوج صغير من المقص ذو المقبض الحلقي. بالإضافة إلى ذلك ، قم بإعداد وتعقيم أدوات الجراحة المجهرية التالية: ملقط صائغ مستقيم مدبب رقم 3 ، ملقط صائغ بزاوية ، حامل إبرة مستدير مع فكين منحنيين ، زوج من موسعات الأوعية ، مقص تشريح ، مقص adventitia ، وكذلك مشابك الأوعية مع قضيبها.
- تحضير محلول من 100 وحدة دولية / مل من محلول ملحي هيبارين عن طريق تخفيف 5 مل من محلول الهيبارين مع 195 مل من المياه المالحة.
- قطع وتعقيم أساور البوليميد.
- قطع أقسام 2.5 مم من أنبوب البوليميد تحت مجهر تشريح.
- في أحد طرفي كل قسم، قم بعمل شق طولي 1.25 مم في جدار الأنبوب للحصول على مقبض الكفة. قم بعمل قطع بزاوية في الطرف الآخر من الأنبوب لتسهيل انقلاب الوعاء.
- اغمري الأصفاد في 70٪ من الإيثانول متبوعا بغسولين بمحلول ملحي هيبارين.
- إعداد ذكر الفئران Sprague-Dawley (275-350 جم) للجراحة.
- قبل سبعة أيام من الجراحة ، ابدأ في إعطاء جرعة يومية تحت الجلد من السيكلوسبورين (10 ملغ كغ-1) لتحقيق قمع المناعة.
- قبل الجراحة ، قم بتخدير الحيوان باستخدام استنشاق الأيزوفلوران بنسبة 3٪ وفقا للإجراء التشغيلي الموحد المؤسسي باستخدام غرفة تحريض. تحقق من التخدير العميق عن طريق قرص كلتا القدمين والتحقق من ردود الفعل.
- إدارة جرعة تحت الجلد من البوبرينورفين المسكن (0.03 ملغ كغ-1) والهيبارين المضاد للتخثر (200 وحدة دولية كجم-1).
- ضع مرهم العين المشحم على عيون الحيوان لمنع الجفاف.
- حلق المنطقة الجراحية للفئران وتطهير الموقع باليود ثم 70٪ من الإيثانول. تأمين أطراف الحيوان على الطاولة باستخدام شريط لاصق.
- كشف وعزل الشريان الفخذي المشترك.
- قم بعمل شق مائل بطول 2 سم عبر الجلد ، على طول التقعر بين الساق والبطن.
- باستخدام الملقط والمقص الحاد ، حرر الجلد من الأنسجة الأساسية لتصور وسادة الدهون الأربية.
- باستخدام المقص والملقط ، قم بقطع وسادة الدهون حول الهوامش العلوية والإنسية والسفلية. انتبه إلى عدم قطع الأوعية الكبيرة تحت وسادة الدهون.
- تعكس وسادة الدهون أفقيا ، وترك الأوعية الشرسوفية سليمة. ضع شاشا مبللا على وسادة الدهون المنعكسة لمنع التجفيف وقم بتثبيته في مكانه. تأكد من أن الأوعية الفخذية الشائعة مرئية.
ملاحظة: سيتم استخدام وسادة الدهون لاحقا لتطبيق ضغط ناعم على المفاغرة. - تعريض الشريان الفخذي من الرباط الإربي القريب إلى نقطة تفرع الشريان الشرسوفي بشكل بعيد عن طريق استخراجه من غمده.
تحذير: عادة ما يكون هناك فرع من الشريان الفخذي يمتد تحته، ويسمى عادة فرع ميرفي. انتبه إلى عدم إتلاف هذا الفرع الذي يصعب رؤيته. - قسم فرع ميرفي عن طريق ربطه ، ثم قم بربط الشريان الفخذي برباطين في منتصف الشريان متباعدين بمقدار 1 مم. احتفظ بأحد طرفي خيط الرباط لفترة طويلة لاستخدامه لاحقا لسحب نهاية الوعاء عبر الكفة.
- قطع الشريان بين الرباط باستخدام مقص adventitia.
تنبيه: يجب ألا يكون هناك أي نزيف عند إجراء هذا القطع. إذا نزفت نهاية الشرايين، فقم بتثبيت الشريان وإعادة تطبيق الرباط. - باستخدام الطرف الطويل من خياطة الرباط ، أدخل كل طرف وعاء في كفة بوليميد ، كما تم إعداده في الخطوة السابقة ، بحيث تشير مقابض الكفتين بعيدا عن بعضهما البعض.
- بعد الإدخال ، ضع مشبكا في وقت واحد على مقبض الكفة والوعاء ، مع تثبيت الكفة في مكانها.
- تحضير محلول ملحي هيبارين في حقنة مجهزة بإبرة 27 غرام.
- اسحب نهاية الوعاء المربوط وقطعه بالقرب من الرباط. اغسل على الفور نهاية الوعاء جيدا بالمحلول الملحي الهيباريني حتى لا يظهر أي دم في التجويف.
تحذير: تأكد من غسل نهاية الوعاء جيدا لأن أي دم يترك في الداخل سيشكل جلطة ، والتي سيتم إدخالها إلى مجرى الدم عند الانتهاء من الإجراء. هذا قد يؤدي إلى انسداد السفينة وفقدان التروية في الساق. - قم بتوسيع تجويف الوعاء عن طريق حمله من غمده بيد واحدة وتوسيع تجويفه باستخدام موسع الوعاء باليد الأخرى.
- ضع خياطة محيطية فضفاضة من 6-0 من البولي بروبيلين حول جسم الكفة. ينتهي الوعاء باستخدام موسعين للوعاء فوق جسم الكفة ويثبته في مكانه عن طريق تشديد الخياطة المحيطية.
ملاحظة: إذا تسرب أي دم عبر الوعاء المثبت أثناء التلاعب ، اغسل التجويف جيدا بالمحلول الملحي الهيبارين. - اشطف الرفرف المصمم هندسيا بمحلول ملحي هيبارين، ثم أدخل الكفة المبطنة بالأوعية في تجويف السقالة الوعائية. ثبت السقالة في مكانها عن طريق وضع خياطة محيطية من البولي بروبيلين 6-0 حول السقالة وجسم الكفة. قم بهذه الخطوة لكلا جانبي السقالة الوعائية.
- لف مرشح غشاء البوليسترين 0.2 ميكرومتر حول موقع المفاغرة لعزل السديلة الهندسية عن الأنسجة المحيطة.
- الافراج عن المشبك البعيد أولا ؛ ثم ، حرر المشبك القريب لإعادة تدفق الدم عبر الوعاء.
- لوقف أي نزيف من خلال المفاغرة ، اعكس وسادة الدهون مرة أخرى فوق الأوعية الفخذية واضغط بضغط لطيف باستخدام شاش معقم لمدة 3 دقائق.
- خياطة وسادة الدهون مرة أخرى في مكانها باستخدام 6-0 البولي بروبيلين. ثم ، خياطة الجلد باستخدام 5-0 خيوط PGA قابلة للامتصاص.
- تنظيف منطقة الجرح مع المالحة وتطبيق محلول اليود.
- للألم بعد العملية الجراحية وإدارة الحيوانات ، قم بإعداد 0.1٪ (v / v) من الترامادول في مياه الشرب. علاوة على ذلك ، قم بإعطاء جرعة يومية من الهيبارين (200 وحدة دولية كجم -1) والسيكلوسبورين (10 ملغ كغ-1).
- ضع الحيوان في قفص نظيف من تلقاء نفسه تحت مصباح تدفئة. استمر في مراقبة الحيوان حتى يستعيد وعيه الكافي للحفاظ على الاستلقاء القصي.
النتائج
يصف هذا البروتوكول تصنيع رفرف هندسي يتكون من سقالة وعائية (الشكل 1Ai) و microvasculature مطبوعة بيولوجيا (الشكل 1Aii) ، والتي تم تجميعها لتحقيق الأوعية الدموية المتوسطة الحجم والمجهرية (الشكل 1Aiii). بعد البروتوكول ، تم تصميم قوالب BVOH من سقالة الأوعية الدموية وطباعة 3D (الشكل 1B ، C). تم فحص الهياكل المطبوعة التي تم الحصول عليها بصريا بحثا عن خيوط صغيرة من BVOH ، والتي يمكن العثور عليها في المساحات الفارغة من القوالب (الشكل 1D). تشير هذه الخيوط عادة إلى إعدادات المواد غير الصحيحة أو إلى أن BVOH قد امتص الرطوبة. يجب إزالة هذه الخيوط لأنها قد تؤدي إلى ملء غير كامل للعفن والعيوب الهيكلية في السقالة الوعائية الناتجة. بعد ذلك ، تم ملء القوالب بمحلول PLLA: PLGA ، متبوعا بعملية التجفيف بالتجميد وخطوات الغسيل ، كما هو موضح في البروتوكول. تم فحص سقالة الأوعية الدموية PLLA:PLGA التي تم الحصول عليها بصريا للتحقق من سلامة جدار السفينة والمباح التجويف (الشكل 1E).
تم تحضير حبر حيوي محايد من نوع rhCollMA بتركيز 10 ملغم/مل ودمجه بنسبة 1:1 مع محلول PEO:LAP. تم إعادة تعليق الخلايا البطانية الوعائية الدقيقة الدهنية البشرية الموسومة ب Zs-Green1 والخلايا الجذعية لب الأسنان باستخدام الحبر الحيوي rhCollMA ، وتم تحميل المحلول في خرطوشة طباعة وعلى الطابعة. تمت طباعة أشكال الصناديق ذات القناة المركزية ذات النمط المستقيم (الشكل 1D) بيولوجيا داخل حمام دعم الجيلاتين. بعد الطباعة ، تم ربط التركيبات ، وتم إذابة حمام الدعم وغسله. بعد 4 أيام من الثقافة ، تم تصوير التركيبات مباشرة للتحقق من التجميع الذاتي لشبكة الأوعية الدموية الدقيقة. يوضح الشكل 1D مثالا على شبكة الأوعية الدموية الدقيقة HAMEC-ZsGreen1 المتطورة للغاية في البنية المطبوعة بيولوجيا.
بعد ذلك ، تم إدخال سقالة وعائية مغلفة بالفيبرونيكتين في القناة المركزية للبنية المطبوعة (الشكل 2A). تم استزراع الهياكل المجمعة لمدة 2 أيام ، حيث تنقبض الخلايا على الجل ، وتربطه بقوة بالسقالة الوعائية. بعد ذلك ، تم اصطفاف سقالة الأوعية الدموية مع HAMECs التي تعبر عن tdTomato، وفقا للبروتوكول. بعد 7 أيام من الثقافة ، تم إصلاح الهياكل وتصويرها. ويبين الشكل 2 باء منظرا جانبيا للهياكل المجمعة حيث تصور الخلايا البطانية في الأوعية الدموية الدقيقة المطبوعة بيولوجيا باللون الأخضر، بينما تصور البطانة البطانية للسقالة الوعائية باللون الأحمر. تظهر الصورة تجميعا ذاتيا للأوعية الدموية الدقيقة الخضراء في الجل المطبوع بيولوجيا ، بينما تصطف السقالة الوعائية بخلايا بطانية حمراء. مع تكبير أعلى ، ينظر إلى البراعم الناشئة عن بطانة البطانية الحمراء وهي تنبت وتفاغرة مع شبكة الأوعية الدموية الدقيقة المطبوعة بيولوجيا (الشكل 2C). بعد ذلك ، تم تلطيخ التركيبات لأكتين العضلات الملساء α (SMA) كعلامة للخلايا الجذعية لب الأسنان. بعد التلطيخ المناعي ، تم تصوير التركيبات باستخدام مجهر بؤري بؤري مسح بالليزر (الشكل 2D).
أخيرا ، بعد 7 أيام من الثقافة ، تم مفاغرة اللوحات الهندسية جراحيا مجهريا إلى الشريان الفخذي للفئران ، كما هو موضح في البروتوكول. يمكن مشاهدة مقطع فيديو لإجراء تمثيلي في الفيديو التكميلي S1. ويبين الشكل 2 هاء صورة تمثيلية لمفاغرة مكتملة قبل إزالة المشبك، ويبين الشكل 2 واو صورة تمثيلية لموقع المفاغرة بعد إزالة المشبك والإرقاء. يجب ألا يكون هناك نزيف مرئي قبل إغلاق الجرح.
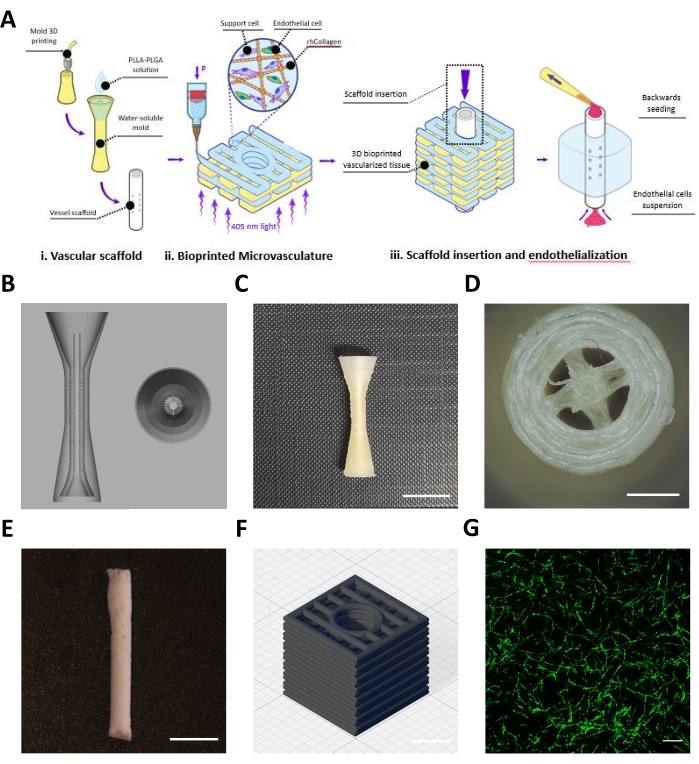
الشكل 1: صور تمثيلية للأوعية المتوسطة والدقيقة المصنعة. (أ) نظرة عامة تخطيطية على خطوات البروتوكول. مستنسخة بإذن16. (ب) تصميم CAD لقالب التضحية من سقالة الأوعية الدموية. (C) منظر جانبي لقالب تضحية مطبوع 3D تمثيلي (شريط المقياس = 0.5 مم). (D) المنظر العلوي لقالب الأضحية (شريط المقياس = 0.5 مم) (E) سقالة الأوعية الدموية التمثيلية المصنعة باستخدام بروتوكول الوصف (شريط المقياس = 5 مم). (F) تصميم CAD لشبكة الأوعية الدموية الدقيقة 3D المطبوعة بيولوجيا rhCollMA. خطوط الشبكة = 1 مم. (G) صورة تمثيلية لشبكة وعائية مطبوعة بيولوجيا متطورة للغاية تظهر HAMEC-ZsGreen1 باللون الأخضر. شريط المقياس = 200 ميكرومتر. الاختصارات: CAD = التصميم بمساعدة الكمبيوتر; rhCollMA = ميثاكريلات الكولاجين البشري المؤتلف. HAMEC = الخلايا البطانية الوعائية الدقيقة الدهنية البشرية; PLLA = حمض بولي ل لاكتيك. PLGA = حمض الجليكوليك متعدد اللاكتيك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صور تمثيلية للرفرف الوعائي المجمع . (أ) صورة فوتوغرافية لمجموعة تمثيلية للأوعية الدموية الدقيقة المطبوعة بيولوجيا والسقالة الوعائية. شريط المقياس = 1 مم (B) منظر جانبي لرفرف هندسي تمثيلي تم تصويره بعد 4 أيام من البطانة البطانية للسقالة الوعائية. تظهر الأوعية الدموية الدقيقة المطبوعة بيولوجيا باللون الأخضر (HAMEC-ZsGreen1)، بينما تظهر البطانة البطانية باللون الأحمر (HAMEC-tdTomato). شريط المقياس = 1 مم (C) صورة تمثيلية للمفاغرة بين الأوعية الدموية المطبوعة بيولوجيا باللون الأخضر والبطانة البطانية باللون الأحمر. شريط المقياس = 200 ميكرومتر (D) صورة تمثيلية للتلطيخ المناعي للأكتين العضلي الأملس (الأحمر) والنوى (الأزرق) والخلايا البطانية (الأخضر) بعد 7 أيام من الحضانة. شريط المقياس = 0.1 مم (E) صورة تمثيلية لمفاغرة مكتملة للرفرف الهندسي مع الشريان الفخذي للفئران قبل إزالة المشبك و (F) بعد إزالة المشبك. الاختصارات: HAMEC = الخلايا البطانية الوعائية الدقيقة الدهنية البشرية. SMA = أكتين العضلات الملساء. DAPI = 4',6-diamidino-2-phenylindole. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو تكميلي S1: إجراء جراحي مجهري تمثيلي لمفاغرة سقالة الأوعية الدموية إلى الشريان الفخذي للفئران. يرجى النقر هنا لتنزيل هذا الفيديو.
Discussion
هندسة الأنسجة الوعائية هي واحدة من التحديات الرئيسية لهندسة الأنسجة20. تركز الطرق الحالية لإنشاء أنسجة الأوعية الدموية الهندسية على إنشاء الأوعية الدموية الدقيقة المجمعة ذاتيا 21,22,23 أو تصنيع سقالات الأوعية الدموية متوسطة الحجم 24,25 وليس على إعادة إنشاء نظام الأوعية الدموية الهرمي ، والذي يمكن اختراقه على الفور ومباشرة عندالزرع 26 . في هذا العمل ، نصف بروتوكولا يستخدم طريقتين للطباعة 3D لتصنيع شبكة سفن هرمية تتكون من الأوعية الدموية الدقيقة والمتوسطة. يجمع البروتوكول بين شبكة الأوعية الدموية الدقيقة المطبوعة بيولوجيا 3D وذاتية التجميع مع سقالة وعائية متوسطة الحجم ، مما يحقق رفرف قابل للزرع والأوعية الدموية. علاوة على ذلك ، تقدم هذه الورقة بروتوكولا لمفاغرة هذا السديلة مباشرة إلى الشريان الفخذي للفئران.
اكتسبت الطباعة الحيوية 3D اهتماما في السنوات الأخيرة بسبب تنوعها على تقنيات هندسة الأنسجة التقليدية. في حين يصف هذا البروتوكول توليد شبكة الأوعية الدموية الدقيقة في الحبر الحيوي rhCollMA ، يمكن تطبيق الطرق المستخدمة مع تعديلات قليلة على العديد من الأحبار الحيوية الأخرى من عدد كبير من الأحبار الحيوية المدروسة والجديدة وحمامات الدعم27,28. اخترنا استخدام rhCollMA كحبر حيوي بسبب وفرة الكولاجين من النوع الأول في ECM البشري ، مما يوفر بيئة مناسبة لربط الخلايا. علاوة على ذلك ، يتم إنتاجه بشكل مؤتلف في النباتات وتعديله بشكل أكبر مع مجموعات الميثاكريليت ، مما يسمح بالبلمرة الضوئية وتشكيل هيدروجيل 3D مستقر29,30. تم تحقيق الربط الضوئي عن طريق إضافة البادئ الضوئي LAT ، والذي ثبت أنه غير سام ويتم تنشيطه عن طريق التعرض للضوء الأزرق 405 نانومتر ، مما يقلل من السمية الضوئية المحتملة للأشعة فوق البنفسجية. ومع ذلك ، فإن استخدام الأحبار الحيوية الحساسة للضوء يتطلب استخدام وسط استزراع خال من الفينول الأحمر لإعداد الحبر الحيوي والمواد الداعمة. علاوة على ذلك ، يصف البروتوكول استخدام مواد دعم الجيلاتين ، والتي تمكن من البثق عالي الدقة للأحبار الحيوية مثل rhCollMA. وبالتالي ، من الأهمية بمكان ضمان استخدام الوسط البارد أثناء إعداده وتبريد سرير الطابعة. قد يحدث التسخين المفرط بسبب مصدر الضوء المستخدم للربط المتبادل أو من درجات الحرارة المحيطة المرتفعة.
تم استخدام طابعة حيوية قائمة على البثق هنا لإنشاء شبكة الأوعية الدموية الدقيقة المطبوعة بيولوجيا ، وهناك حاليا العديد من الطابعات الحيوية المتاحة تجاريا والتي يمكنها توليد هياكل مماثلة. علاوة على ذلك ، يمكن تعديل الطرق المقترحة وتطبيقها بسهولة لدراسة الأشكال الهندسية والأحجام وأنماط التعبئة المختلفة. في هذا العمل ، تم اختيار نمط ملء مستقيم لإنشاء مسام مترابطة ، ويمكن طباعتها بسرعة نسبية بدقة عالية.
تشكل فقاعات الهواء تحديا كبيرا في الطباعة الحيوية للبثق ، خاصة داخل مواد الدعم. لذلك ، من الأهمية بمكان تقليل وجود وتكوين هذه الفقاعات باستخدام ماصات الإزاحة الإيجابية لنقل مواد الدعم ، وإعداد تعليق خلية الحبر الحيوي ، ونقلها إلى خراطيش الطباعة.
في هذا العمل ، تم استخدام الخلايا البطانية المشتقة من الدهون البشرية والخلايا الجذعية لب الأسنان كخلايا داعمة بسبب عزلها السهل نسبيا عن المرضى. علاوة على ذلك ، تم اختيار تركيز إجمالي للخلايا يبلغ 8 × 106 خلايا / مل حيث ثبت أن هذا التركيز ينشئ شبكات الأوعية الدموية الأكثر تطورا16. في حين يمكن استخدام هذا البروتوكول لتوليد الأوعية الدموية الدقيقة باستخدام أنواع ومصادر مختلفة من الخلايا ، وكذلك الأحبار الحيوية المختلفة ، يجب إجراء معايرة لتركيز الخلايا لتهيئة أفضل الظروف لتطوير شبكة الأوعية الدموية الدقيقة. علاوة على ذلك ، يمكن دمج الخلايا الخاصة بالأنسجة (أي الأرومات العضلية أو الأرومات العظمية) داخل الحبر الحيوي لتحقيق لوحات وعائية خاصة بالأنسجة.
تم تصنيع قالب السقالة الوعائية المسامية باستخدام مواد مطبوعة 3D قابلة للذوبان في الماء على طابعة 3D البثق المتاحة تجاريا. وهذا يؤدي إلى تقنية فعالة من حيث التكلفة تعتمد على منصات النماذج الأولية السريعة ، بحيث يمكن دراسة العديد من الأشكال الهندسية والأحجام المختلفة للسقالات الوعائية وفحصها بسرعة31. ومع ذلك ، فإن أحد قيود هذه الطريقة هو حد الدقة لمعظم الطابعات ثلاثية الأبعاد32. ومع ذلك ، مع التطور السريع للصناعة المحيطة بالتصنيع المضاف ، من المتوقع أن تتحسن هذه الحدود بمرور الوقت. يعد استخدام المذيبات العضوية لعملية التصنيع قيدا آخر للبروتوكول ، حيث أن معظم المذيبات العضوية سامة للخلايا ، مما يمنع القدرة على الجمع بين إجراء الطباعة الحيوية وعملية تصنيع السقالة الوعائية.
الطريقة الموصوفة لبذر تجويف السقالة باستخدام الشفط بدلا من دفع تعليق الخلية لها تأثيرات كبيرة على توطين الخلايا البذرية. يسمح استخدام الضغط السلبي بإنداج التجويف الداخلي للسقالة مع تقليل أي انسكاب لتعليق الخلية من خلال الثقوب الموجودة على جدار السقالة16.
يمكن تعديل طريقة "الكفة" الموصوفة للمفاغرة الجراحية المجهرية بسهولة وتكييفها مع مواد أو أحجام سقالات الأوعية الدموية المختلفة ، وكذلك مع الشرايين والأوردة المختلفة في نطاق واسع من النماذج الحيوانية. وستشمل التعديلات على البروتوكول أحجاما مختلفة لأنابيب البوليميد وأحجاما للخياطة. لا تتطلب هذه الطريقة ثقب جدار السقالة ، مما قد يؤدي إلى تطور العيوب. يقدم هذا العمل بروتوكولا يمكن توسيعه ليشمل العديد من التطبيقات. تمثل الجوانب الحاسمة لهذا البروتوكول ، والتي تشمل تصنيع الأوعية الدموية المتوسطة والمجهرية وتجميعها وزرعها ، جوانب حاسمة من اللوحات الهندسية لكل من التطبيقات الترميمية ، وكذلك دراسات هندسة الأوعية الدموية وغيرها من الأنسجة.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تلقى هذا المشروع تمويلا من مجلس البحوث الأوروبي (ERC) في إطار برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي (اتفاقية المنحة رقم 818808). تم توفير rhCollMA بسخاء من قبل CollPlant (رحوفوت ، إسرائيل). يشكر المؤلفون هيئة البحوث ما قبل السريرية في التخنيون على المساعدة في رعاية الحيوانات ، وكذلك جانيت زافين وغاليا بن ديفيد وعيدان ريدينسكي.
Materials
| Name | Company | Catalog Number | Comments |
| 1,4-Dioxane | Biosolve Chemical | 42405 | |
| 27 G x 0.5" blunt tip dispensing needles | CML supply | 901-27-050 | |
| 3cc amber syringe barrel & piston set | Nordson EFD | 7012085 | Amber syringes used to block light and prevent premature crosslinking |
| 5-0 AssuCryl PGA absorbale suture | Assut Sutures | Absorbable sutures used for skin wound closure | |
| 6-0 polypropelene sutures | Assut Sutures | 9351 | |
| Acland clamps | S&T | B-1V | |
| Adventitia scissors | S&T | SAS-15 | |
| Angled no.3 jeweler's forceps | S&T | JFAL-3-18 | |
| BioAssemblyBot 400 3D Bioprinter | Advanced Solutions | a 6-axis 3D bioprinter | |
| Bovine albumin serum Probumin | Millipore | 82-045-1 | |
| Buprenorphine | vetmarket | B15100 | |
| BVOH filament | Verbatim | 55903 | a water-soluble 1.75 mm diameter filament |
| Clamp applying forceps | S&T | CAF-4 | |
| Dental pulp stem cells | Lonza | PT-5025 | |
| Dietrich bulldog clamps | Fine Science Tools (FST) | 18039-45 | |
| di-Sodium hydrogen phosphate (Na2HPO4) | Carlo Erba Reagents | 480141 | |
| Dissection scissors | S&T | 18039-45 | |
| DMEM, High Glucose, No Phenol Red | Sartorius | 01-053-1A | |
| Duratears | Alcon | DJ03 | |
| ECM media + bullet kit | Sciencell | #1001 | |
| Ethanol 96% | Gadot-Group | 64-17-5 | |
| GlutaMAX | Gibco | 35050061 | glutamine substitute |
| Goat anti-mouse Cy3 antibody | Jackson | 115-166-072 | |
| Heparin Sodium 5,000 I.U./mL | Panpharma | - | |
| Human adipose microvascular cells | Sciencell | #7200 | |
| Human fibronectin | Sigma | F0895-5MG | A stock concentration of 1 mg/mL |
| Isoflurane, USP Terrell | Piramal Critical Care | NDC 66794-011-25 | |
| LifeSupport | Advanced Biomatrix | 5244 | a gelatin support slurry for FRESH 3D bioprinting |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | |
| Low-glucose DMEM | Biological Industries | 01-050-1A | |
| MICROMAN E M1000E, 100-1,000 µL | Gilson | FD10006 | |
| Mouse anti-SMA antibody | Dako | M0851 | |
| NEAA | Gibco | 11140068 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Paraformaldehyde solution 4% in PBS | ChemCruz | SC-281692 | |
| Penicillin-Streptomycin-Nystatin Solution | Biological Industries | 03-032-1B | |
| Phospate buffered saline (PBS) | Sigma | P5368-10PAK | |
| Poly(ethylene oxide), M.W. 250,000 to 400,000 | Acros Organics | 178602500 | |
| Poly(L-lactic acid), IV 5.0 dl/g (PLLA) | Polysciencse, Inc. | 18582-10 | |
| Polyimide tubing, ID: 0.0249", OD: 0.0273" | Cole-Parmer | 95820-05 | A thin-walled tube used to fabricate cuffs for microsurgical anastomoses |
| Prusa I3 MK2.5 3D Printer | Prusa Research | http://www.prusa3d.com/ | a popular commercial 3D printer |
| Resomer RG 503 H, Poly(D,L-lactide-co-glycolide) (PLGA) | Evonik Industries | 719870 | |
| rhCollMA | CollPlant | https://collplant.com/ | generously provided by CollPlant (Rehovot, Israel) |
| round-handled needle holder | S&T | B-15-8 | |
| Scalpel handle - #3 | Fine Science Tools (FST) | 10003-12 | |
| small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Sodium Chloride | Biosolve Chemical | 19030591 | |
| Sodium Phosphate dibasic (NaH2PO4) | Riedel-de Haen | 4276 | |
| Solidworks | Dassault Systems | CAD software | |
| Straight no.3 jeweler's forceps | S&T | JF-3-18 | |
| Straight serrated forceps | Fine Science Tools (FST) | 11050-10 | |
| Surgical Scalpel Blade No.15 | Swann-Morton Limited | 305 | |
| Triton-X 100 | BioLab LTD | 57836 | |
| TSIM | Advanced Solutions | 3D slicing and design software for the BioAssembly Bot | |
| Vessel dilator | S&T | D-5a.1 | |
| Zeiss Tivato 700 surgical microscope | Zeiss |
References
- Wallace, C. G., Wei, F. -C. C. The current status, evolution and future of facial reconstruction. Chang Gung Medical Journal. 31 (5), 441-449 (2008).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), 12(2012).
- Duan, B. State-of-the-art review of 3D bioprinting for cardiovascular tissue engineering. Annals of Biomedical Engineering. 45 (1), 195-209 (2017).
- Kim, J. J., Hou, L., Huang, N. F. Vascularization of three-dimensional engineered tissues for regenerative medicine applications. Acta Biomaterialia. 41, 17-26 (2016).
- Ouyang, L., Armstrong, J. P. K., Chen, Q., Lin, Y., Stevens, M. M. Void-free 3D bioprinting for in situ endothelialization and microfluidic perfusion. Advanced Functional Materials. 30 (1), 1908349(2020).
- Baltazar, T., et al. Three dimensional bioprinting of a vascularized and perfusable skin graft using human keratinocytes, fibroblasts, pericytes, and endothelial cells. Tissue Engineering - Part A. 26 (5-6), 227-238 (2020).
- Chia, H. N., Wu, B. M. Recent advances in 3D printing of biomaterials. Journal of Biological Engineering. 9 (1), 4(2015).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Guillotin, B., et al. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials. 31 (28), 7250-7256 (2010).
- Catros, S., et al. Laser-assisted bioprinting for creating on-demand patterns of human osteoprogenitor cells and nano-hydroxyapatite. Biofabrication. 3 (2), (2011).
- Ronca, A., Ambrosio, L., Grijpma, D. W. Preparation of designed poly(d,l-lactide)/nanosized hydroxyapatite composite structures by stereolithography. Acta Biomaterialia. 9 (4), 5989-5996 (2013).
- Lan, P. X., Lee, J. W., Seol, Y. J., Cho, D. W. Development of 3D PPF/DEF scaffolds using micro-stereolithography and surface modification. Journal of Materials Science: Materials in Medicine. 20 (1), 271-279 (2009).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655(2015).
- Szklanny, A. A., et al. 3D bioprinting of engineered tissue flaps with hierarchical vessel networks (VesselNet) for direct host-to-implant perfusion. Advanced Materials. 33 (42), 2102661(2021).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. Journal of Visualized Experiments JoVE. (69), (2012).
- Sucher, R., et al. Mouse hind limb transplantation: A new composite tissue allotransplantation model using nonsuture supermicrosurgery. Transplantation. 90 (12), 1374-1380 (2010).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), (2014).
- Novosel, E. C., Kleinhans, C., Kluger, P. J. Vascularization is the key challenge in tissue engineering. Advanced Drug Delivery Reviews. 63 (4-5), 300-311 (2011).
- Landau, S., et al. Tropoelastin coated PLLA-PLGA scaffolds promote vascular network formation. Biomaterials. 122, 72-82 (2017).
- Szklanny, A. A., et al. High-throughput scaffold system for studying the effect of local geometry and topology on the development and orientation of sprouting blood vessels. Advanced Functional Materials. 1901335, 1-13 (2019).
- Song, W., et al. Engineering transferrable microvascular meshes for subcutaneous islet transplantation. Nature Communications. 10 (1), 1-12 (2019).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Ying, G. L., et al. Aqueous two-phase emulsion bioink-enabled 3D bioprinting of porous hydrogels. Advanced Materials. 30 (50), 1-9 (2018).
- Rouwkema, J., Khademhosseini, A. Vascularization and angiogenesis in tissue engineering: beyond creating static networks. Trends in Biotechnology. 34 (9), 733-745 (2016).
- Jang, J., Park, J. Y., Gao, G., Cho, D. W. Biomaterials-based 3D cell printing for next-generation therapeutics and diagnostics. Biomaterials. 156, 88-106 (2018).
- Suntornnond, R., An, J., Chua, C. K. Roles of support materials in 3D bioprinting - present and future. International Journal of Bioprinting. 3 (1), 83-86 (2017).
- Shoseyov, O., Posen, Y., Grynspan, F. Human recombinant type I collagen produced in plants. Tissue Engineering - Part A. 19 (13-14), 1527-1533 (2013).
- Stein, H., et al. Production of bioactive, post-translationally modified, heterotrimeric, human recombinant type-I collagen in transgenic tobacco. Biomacromolecules. 10 (9), 2640-2645 (2009).
- Kaplan, B., et al. Rapid prototyping fabrication of precision polyester scaffolds for axonal guidance. Biomaterials. , 120062(2020).
- Karakurt, I., Lin, L. 3D printing technologies: techniques, materials, and post-processing. Current Opinion in Chemical Engineering. 28, 134-143 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved