Method Article
3D 프린팅 기술을 이용한 혈관 플랩 제작
요약
엔지니어링 플랩은 통합된 기능적 혈관 네트워크가 필요합니다. 이 프로토콜에서, 우리는 계층 적 혈관 네트워크와 쥐 대퇴 동맥에 대한 직접적인 미세 외과 적 해부학을 포함하는 3D 인쇄 된 조직 플랩을 제작하는 방법을 제시합니다.
초록
이식 가능하고 기능적이며 두꺼운 조직을 엔지니어링하려면 계층적 혈관 네트워크를 설계해야 합니다. 3D 바이오 프린팅은 인쇄 가능한 바이오 재료, 바이오 잉크 및 세포의 층에 질서 정연하고 자동 방식으로 레이어를 추가하여 조직을 만드는 데 사용되는 기술로, 전통적인 조직 공학 기술이 달성 할 수없는 매우 복잡한 구조를 만들 수 있습니다. 따라서 3D 바이오 프린팅은 밀리미터 혈관에서 미세 혈관 네트워크에 이르기까지 네이티브 혈관 구조 복합체 구조를 모방하는 매력적인 시험관 내 접근 방식입니다.
과립형 하이드로젤의 3D 바이오프린팅의 발전은 저점도 세포외 매트릭스 기반 바이오잉크의 고해상도 압출을 가능하게 했습니다. 이 작품은 엔지니어링 된 혈관 조직 플랩을 제조하기위한 결합 된 3D 바이오 프린팅 및 희생 금형 기반 3D 인쇄 접근법을 제시합니다. 젤라틴 지지조 내에서 재조합 콜라겐-메타크릴레이트 바이오잉크를 이용한 내피 및 지지 세포의 3D 바이오프린팅은 자기조립된 모세관 네트워크의 제조에 활용된다. 이 인쇄된 미세혈관구조는 메조스케일 용기형 다공성 스캐폴드 주위에 조립되고, 희생적인 3D 프린트된 몰드를 사용하여 제작되며, 내피 세포로 시딩된다.
이 조립체는 중규모 혈관의 내피를 주변 모세관 네트워크와 함께 아나스토모스로 유도하여, 조작된 조직 플랩 내에 계층적 혈관 네트워크를 구축한다. 그런 다음 조작 된 플랩은 커프 기술을 사용하여 쥐 대퇴골 동맥에 외과 적 해부학에 의해 직접 이식됩니다. 기술된 방법은 재건 수술 및 혈관화 연구에 사용하기 위한 다양한 혈관화된 조직 플랩의 제조를 위해 확장될 수 있다.
서문
심한 조직 결함은 외상성 손상, 선천성 결함 또는 질병으로 인해 발생하며, 이러한 결함을 치료하기위한 현재의 황금 표준은 자가 이식편, 혈관화 된 조직 플랩 및 미세 혈관 프리 플랩을 조직 대체물로 사용하는 것입니다. 그러나, 이러한 옵션은 제한된 공여자 부위 조직 및 공여자 부위 이환률1의 단점을 갖는다. 따라서, 이러한 결함(2)을 교정하는데 사용될 수 있는 대체 조직 대체물에 대한 요구가 증가하고 있다. 조작된 조직 구축물의 두께는 세포를 향한 영양분 및 가스의 확산에 의해 제한되며, 따라서 적절한 혈관 네트워크는 크고 두껍고 적절하게 영양이 공급된 스캐폴드를 생성하는 데 필수적입니다.
숙주로부터 혈관 지지체의 생체내 모집, 스캐폴드 내의 성장 인자 및 사이토카인의 전달, 임플란트의 혈관 전형성, 마이크로패터닝 기술을 이용한 퍼퓨저블 분지화 마이크로혈관베드의 생성(4), 혈관 채널/네트워크 형성을 위한 희생 물질의 사용5 등 조작된 임플란트(3)의 혈관화를 촉진하기 위해 몇 가지 접근법이 적용되었다. , 뿐만 아니라 3D 생체 인쇄 구조 내에서 채널의 생성 5,6. 두꺼운 조직의 혈관화는 거대 규모 및 미세 모세관 규모의 혈관으로 구성된 계층 적 혈관 네트워크의 통합을 필요로합니다. 거대 규모의 혈관은 구조물 전체에 혈액을 효과적으로 분배하고 숙주 혈관을 가진 미세 외과 적 해부학을 허용하는 반면, 미세 모세관 규모의 혈관은 영양 확산을 허용합니다.
바이오 프린팅은 기존의 조직 공학 방법에 비해 제공하는 이점으로 인해 최근 몇 년 동안 강한 주목을 받고 있습니다. Tissues와 기관은 특정 아키텍처를 가진 복잡하고 복잡한 3D 객체입니다. 3D 바이오 프린팅은 생체 재료의 층을 고해상도로 증착 할 수있는 능력을 통해 복잡한 조직 및 장기 대용품 (예 : 신장, 폐, 간)을 만들 수 있습니다7. 압출 기반, 잉크젯 8, 레이저 보조 증착9,10 및 입체 조형 기반 11,12 바이오 프린팅을 포함한 여러 인쇄 기술이 바이오 인쇄에 적용되었습니다. 압출 기반 기술은 노즐과 반대되는 재료 벌크 표면에 압력을 가하여 노즐을 통해 재료를 압출하는 데 의존합니다.
현탁 하이드로겔(FRESH)의 자유형 가역적 매립은 압출된 물질이 지지조에 의해 제자리에 증착되고 고정되는 과립형 지지체 재료를 사용하는 바이오프린팅 기술(13,14)이다. 지지 배스는 가교 될 때까지 압출되고 미리 가교 된 바이오 잉크에 대한 기계적 지원을 제공합니다. 이 기술의 주요 장점은 지지 욕이 압출 후 및 가교(15) 전에 형상을 유지할 수없는 저점도 물질을 압출 할 수 있다는 것입니다. 이것은 바이오 잉크로 사용할 수있는 사용 가능한 재료의 풀을 확장합니다.
이 논문은 마이크로 스케일과 중규모 혈관을 결합한 혈관화 플랩의 생성을 위한 프로토콜을 제시한다. 이를 달성하기 위해, 생체인쇄된, 자기조립된, 미세혈관 네트워크는 재조합 인간 콜라겐 메타크릴레이트(rhCollMA) 하이드로젤에서 생성되고, 그 후 더 크고, 이식가능한 혈관 스캐폴드의 내부에 연결되어, 완전히 조작된 조직 플랩(16)을 생성한다. 조작 된 조직의 신속하고 직접적인 관류를 확립하기 위해서는 숙주 혈관에 대한 직접적인 미세 외과 적 해부학이 필요합니다. 상기 혈관 스캐폴드는 기존의 미세외과적 혈관벽 봉합법을 사용하여 해부학적으로 분석될 수 있는 충분한 봉합사 보유 강도를 갖지 않는다. 따라서 우리는 쥐의 일반적인 대퇴 동맥으로 해부학을 달성하기위한 "커프"17,18,19 방법을 설명합니다. 이 방법에서, 용기 끝은 혈관 벽을 천공 할 필요없이 원주 봉합사로 고정됩니다.
비록 제안된 프로토콜이 rhCollMA 환경에서 계층적 혈관구조를 연구하기 위해 준비되었지만, 이 접근법은 확장되고 다양한 새로운 응용에 적용될 수 있다. 이 프로토콜은 다양한 바이오잉크의 다양한 조직 특이적 세포를 바이오프린팅에 적용할 수 있다. 또한, 구조물의 기하학적 구조 및 크기는 대형 조직 재건 또는 생물학적 연구와 같은 특정 요구 사항에 맞게 쉽게 수정할 수 있습니다.
프로토콜
모든 동물 절차는 Technion Pre-Clinical Research Authority (PCRA Technion, 윤리 승인 번호 058-05-20)의 감독하에 승인되고 수행되었습니다. 수컷 Sprague-Dawley 래트 (275-350 g)를 이들 연구에 사용하였다. 이 프로토콜에 사용되는 모든 재료, 장비 및 소프트웨어와 관련된 자세한 내용은 재료 표를 참조하십시오.
1. 혈관 비계 제작
- CAD(컴퓨터 지원 설계) 소프트웨어를 사용하여 원하는 혈관 스캐폴드 모양의 3D 컴퓨터 모델을 만들거나 온라인 저장소에서 원하는 혈관 구조의 3D 파일을 다운로드합니다.
- 내경이 0.9mm, 외경이 2mm, 높이가 18mm인 실린더를 만듭니다. 실린더 벽과 함께 직경이 0.22mm인 방사형 fenestration을 추가합니다.
- 3D 설계 소프트웨어를 사용하여 스캐폴드용 금형을 만들고 . STL 파일. 그런 다음 나중에 금형을 쉽게 채울 수 있도록 깔때기를 설계에 추가하십시오.
- 를 가져옵니다. STL 파일을 융합 증착 모델링 (FDM) 3D 프린터를위한 슬라이싱 소프트웨어에 넣습니다. 레이어 높이가 0.1mm인 모델을 슬라이스하여 .gcode로 내보내거나 3D 프린터로 직접 보냅니다.
- 수용성 부텐-디올 비닐 알코올 공중합체(BVOH) 필라멘트를 사용하여 0.25mm 노즐이 장착된 FDM 3D 프린터에 몰드를 3D 인쇄합니다. 인쇄된 금형을 사용할 때까지 진공 챔버에 보관하십시오.
주의: BVOH 필라멘트는 습기에 민감하므로 맨손으로 취급하지 마십시오. 또한 습기에 노출되지 않도록 필라멘트를 진공 챔버에 보관하는 것이 좋습니다. - 1,4-디옥산 중의 폴리-L-락트산(PLLA)과 폴리락틱-코-글리콜산(PLGA)의 1:1 혼합물의 중합체 용액을 제조한다.
- 350mg의 PLLA와 350mg의 PLGA를 재량하고 20mL 유리 바이알로 옮깁니다.
- 1,4-다이옥산 10 mL를 측정하고 유리 피펫을 사용하여 유리 바이알로 옮깁니다. 작은 자석 교반 막대를 유리 바이알에 넣으십시오.
주의: 1,4-디옥산은 위험한 유기 용매입니다. 적절한 개인 안전 장비를 사용하고 흄 후드 내부에서 작업하십시오. - 유리 바이알을 70°C로 가열된 온수 욕조 안에 넣고 모든 중합체가 완전히 용해될 때까지 밤새 내용물을 혼합한다. 사용할 때까지 용액을 밀폐 유리 용기에 보관하십시오.
- BVOH 몰드를 PLLA:PLGA 솔루션으로 채웁니다.
- 포지티브 변위 피펫을 사용하여 폴리머 용액 30 μL를 측정하고 몰드에 채웁니다.
참고: 금형을 채우는 데 필요한 부피는 설계된 용기의 부피에 따라 변경됩니다. 몰드의 깔때기가 완전히 채워질 때까지 폴리머 용액을 계속 첨가하십시오. - 주형을 100 × g 에서 2분 동안 원심분리한다. 완전한 충전을 보장하기 위해 20 μL의 중합체 용액으로 주형을 충전하십시오.
- 포지티브 변위 피펫을 사용하여 폴리머 용액 30 μL를 측정하고 몰드에 채웁니다.
- 충전된 주형을 -80°C에서 적어도 30분 동안 동결시켜 모든 중합체 용액이 동결되도록 한다. 밤새 동결건조하여 주형으로부터 용매를 제거한다.
참고 : 금형에있는 폴리머의 색상은 동결 건조 공정 후에 투명에서 흰색으로 바뀌어야합니다. - 희생 몰드 재료를 제거하려면, 동결 건조 공정 후 몰드를 부드러운 교반 하에 5 L 탈이온수 욕조로 옮깁니다. 흐려지면 욕조의 물을 교체하십시오. 모든 BVOH가 용해되면, 스캐폴드를 공기 건조시키고 사용 전까지 진공 챔버에 보관한다.
2. 피브로넥틴으로 혈관 스캐폴드 코팅
- PLLA:PLGA 혈관 스캐폴드를 70% 에탄올에 30분 동안 침지시켜 소독합니다.
- 스캐폴드를 PBS로 3x 5분 동안 세척한다.
- PBS에서 50 μg/mL의 인간 피브로넥틴을 희석하여 준비하고 스캐폴드를 코팅한다.
- 500 μL의 스톡 피브로넥틴 용액(1 mg/mL)을 PBS 9.5 mL와 혼합한다.
- 소독된 혈관 스캐폴드를 이 피브로넥틴 용액에 담그고 이를 37°C에서 60분 동안 인큐베이션하여 단백질 흡착을 허용한다.
- 인큐베이션 후, 스캐폴드를 PBS로 헹구어 결합되지 않은 피브로넥틴을 제거하였다. 이들 코팅된 스캐폴드를 최대 1주일 동안 4°C에서 보관한다.
3. rhCollMA 바이오잉크 준비
- 산성 rhCollMA 바이오잉크 스톡을 중화시키기 위한 포스페이트 완충액을 제조하였다.
- 50 mL의 탈이온수에 5.495 g의 Na2HPO4, 1.55 g의NaH2PO4, 및 30 mg의 NaCl을 용해시킴으로써 10x 스톡의 포스페이트 버퍼를 제조하였다.
- 10x 인산염 완충액 1부를 탈이온수 9부와 결합하여 10x 스톡 포스페이트 버퍼의 10배 희석액을 제조하였다.
- 900 μL의 스톡 rhCollMA 용액을 100 μL의 10x 인산염 완충액과 결합하여 산성 rhCollMA 용액을 중화시킨다.
- 중화 된 rhCollMA 용액을 필요한 양의 1x 인산염 완충액과 혼합하여 원하는 농도 10 mg / mL로 희석하십시오.
참고 : rhCollMA의 재고 농도는 로트마다 다릅니다. 따라서, 원하는 농도에 도달하기 위해 필요한 1x 인산염 완충액의 부피는 다양할 것이다. - 희석된 중성 rhCollMA와 합할 포로겐-광개시제 용액(PEO-LAP)을 준비한다.
- 160mg의 PEO를 10mL의 DMEM에 용해시켜 페놀 레드가 없는 DMEM에 폴리(에틸렌 옥사이드)(PEO)의 1.6%(w/v) 용액을 준비한다.
- 이 용액에 리튬 페닐-2,4,6-트리메틸벤조일포스피네이트(LAP) 20mg을 첨가하여 용액에 0.2%(w/v) LAP를 얻었다. 이 시점부터 용액을 알루미늄 호일로 덮거나 어두운 곳에 보관하여 빛으로부터 보호하십시오.
- PEO-LAP 용액을 0.22 μm 필터를 통과시켜 멸균한다. 이 용액을 최대 1 주 동안 4 °C에서 보관하십시오.
- 바이오프린팅 전에, 희석된 중성 rhCollMA 용액과 PEO-LAP 용액을 1:1 비율로 혼합하여 최종 바이오잉크 용액을 얻었다. 소용돌이가 아닌 피펫팅을 사용하여 기포를 피하면서 용액을 혼합하십시오.
- 많은 기포가 용액에 도입되면 2,000 ×g에서 30 초 동안 원심 분리하십시오. 원심분리 후, 바이오잉크 용액을 다시 혼합하여 균질성을 보장한다.
4. 과립 지원 목욕 준비
- 젤라틴 과립 지지 물질을 준비하십시오.
- 생물학적 안전 캐비닛에서 동결건조된 지지체 재료 2g 튜브 1개에 해당하는 내용물을 각각 약 1g을 포함하는 멸균 50mL 코니컬 튜브 2개로 나눕니다.
- 차가운 (4°C) 페놀-레드 프리 DMEM 40 mL를 각 튜브에 첨가하고, 동결건조된 모든 지지체 물질이 용해될 때까지 격렬하게 와류한다.
- 생성된 슬러리를 4°C에서 앉히고 지지체 물질이 재수화되도록 한다.
- 기포를 줄이기 위해 지지 재료를 진공 챔버에서 30분 동안 탈기시킨다.
- 지지체 물질을 2,000 × g 에서 5분 동안 원심분리한다. 재료가 튜브의 바닥에 있고 상청액이 깨끗한지 확인하십시오.
- 상층액을 흡인하면서 바닥에서지지 물질을 흡인하지 않도록주의하십시오.
참고: 상층액을 제거한 후 튜브를 기울이는 동안 지지 재료가 흐르지 않아야 합니다. 물질이 흐르면 동일한 설정을 사용하지만 새로운 상청액을 추가하지 않고 다시 원심 분리하십시오.
- 준비된, 압축된 지지 재료의 약 4 mL를 포지티브 변위 피펫을 사용하여 12-웰 플레이트의 각 웰로 옮긴다. 딱딱한 표면의 웰 플레이트를 탭하여 지지 재료가 웰에 고르게 퍼지도록 강제합니다.
참고 : 지원 재료의 최소 권장 볼륨은 인쇄 될 구조물의 3 배입니다. - 지지체 재료와 함께 웰 플레이트를 냉각된 바이오프린터 스테이지 상에 놓거나, 젤라틴 입자가 용융되는 것을 방지하기 위해 그것의 용도가 될 때까지 4°C에서 놓는다.
5. 내피 세포 및 지지 세포를 바이오 잉크와 혼입
- 기본 배지를 항생제 용액, 태아 소 혈청 및 내피 세포 성장 보충제를 포함한 해당 배지 키트 성분과 혼합하여 제조업체의 지시에 따라 내피 세포 배지를 준비하십시오.
- 저포도당 DMEM 500 mL, 소 태아 혈청 58 mL, 비필수 아미노산(NEAA) 5.8 mL, 글루타민 대체물 5.8 mL, 1 M HEPES 5.8 mL, 페니실린-스트렙토마이신-니스타틴 용액 5.8 mL를 조합하여 치과용 펄프 줄기세포 배지를 제조하였다.
- 2 × 106 ZsGreen1 발현 인간 지방미세혈관 내피세포(HAMEC-ZsGreen1) 및 6 × 10,6 치과용 펄프 줄기세포(DPSCs)를 10 mL의 내피세포 배지에 함유하는 현탁액을 제조하였다.
- 세포 현탁액을 200 × g 에서 4분 동안 원심분리하여 세포 펠렛을 얻었다. 상청액 배지를 흡인한다.
- 세포 펠릿을 이전에 제조된 rhCollMA 바이오잉크(PEO-LAP 함유) 1 mL에 재현탁시켜 바이오잉크 1 mL당 총 세포 농도가 8 × 106 세포인 바이오잉크를 얻었다.
주의: 바이오잉크를 세포와 결합시킨 후 즉시 다음 단계로 진행하십시오. 세포가 오랫동안 현탁액에 남아 있으면 세포가 튜브 바닥으로 가라 앉고 생존력이 악화됩니다. 세포를 포함하지 않는 실험의 경우, 단계 5.1-5.5를 건너뛰거나 인쇄된 구조물의 향상된 현미경 시각화를 위해 세포 대신 형광 비드를 바이오잉크와 통합하십시오. - 세포-바이오잉크 혼합물을 인쇄 카트리지로 옮긴다.
- 0.22mm 내부 직경 바늘을 3mL 호박색 인쇄 카트리지에 맞추고 카트리지를 50mL 원뿔형 튜브에 넣습니다.
- 세포-바이오잉크 혼합물 1 mL를 포지티브 변위 피펫을 사용하여 위에서 채움으로써 인쇄 카트리지로 옮기고, 기포를 감소시킨다.
- 인쇄 카트리지를 바이오 프린터의 해당 도구에 설치합니다.
6. rhCollMA 바이오잉크를 이용한 마이크로혈관 네트워크 바이오프린팅
- 생체 인쇄 된 미세 혈관 네트워크에 대한 3D CAD 설계를 작성하십시오.
- 중앙에 직경 2mm 원형 채널이 포함된 4mm 정사각형의 2D 패턴을 스케치합니다. 스케치를 4mm 밀어서 중앙 채널이 있는 4mm x 4mm x 4mm 큐브를 가져옵니다. 이 개체를 . STL 파일.
- 12웰 플레이트를 가져옵니다. STL 템플릿은 바이오 프린터 슬라이싱 소프트웨어의 솔리드 모델링 탭에 넣고 가상 인쇄 베드의 지정된 영역에 배치합니다.
- 를 가져옵니다. 큐브 모양의 STL 파일을 바이오 프린터 슬라이싱 소프트웨어의 솔리드 모델링 탭으로 만듭니다. 외부 슬라이서 사용 확인란을 클릭| 개체 속성 섹션 아래에 슬라이서를 구성합니다. 팝업 창에서 채우기 패턴의 직선형 패턴을 선택하고 채우기 밀도에 30%를 입력합니다. 수락을 클릭합니다.
- 큐브를 클릭하고 마우스를 사용하여 이동하여 원하는 각 가상 웰에 큐브 모양의 복사본을 배치합니다.
- 재료 추가 단추를 클릭하여 바이오프린터 슬라이싱 소프트웨어의 재료 탭에서 rhCollMA 바이오잉크에 대한 새 재료 설정을 만듭니다. 인쇄할 재료의 설정을 선택합니다. 압력의 경우 해당 상자에 2 psi를 입력하십시오. 속도를 보려면 해당 상자에 20mm/s를 입력합니다.
참고: 각 bioink 재료에는 응용 프로그램의 재료 목록에 저장할 수 있는 고유한 인쇄 설정이 있습니다. - 해당 상자에 이러한 값을 입력하여 선 너비 및 선 높이 값을 0.24mm 로, 가속도 값을 400mm/s2로 지정합니다.
- 솔리드 모델링 탭에서 큐브 객체를 클릭한 다음 재료 섹션에서 rhCollMA 재료를 클릭하여 큐브 모양에 할당합니다. 바이오어셈블리 탭에서 인쇄 작업 보내기 버튼을 클릭하여 인쇄 작업을 바이오 프린터로 보냅니다.
- 셀룰러 바이오잉크가 로딩된 인쇄 카트리지를 3D 압출 기반 바이오프린터의 3mL 주변 공압 디스펜스 도구에 로드합니다.
- 바이오프린터 인터페이스 화면의 난방/냉각 제어(Control-Heating/Cooling Tab) 아래에 있는 냉각 버튼을 클릭하여 인쇄층 온도를 4°C로 설정합니다. 프린터 침대에 지지대와 함께 플레이트를 로드합니다.
참고: 인쇄 압력 및 속도에 대한 재료의 설정은 주변 온도 또는 바이오잉크 배치 변동성의 차이로 인해 변경될 수 있습니다. 예를 들어, 추운 날에는 동일한 양의 재료를 압출하기 위해 더 높은 압력 또는 느린 속도가 필요합니다. - 바이오 프린터 인터페이스 화면의 인쇄 탭에서 6.7단계에서 전송된 인쇄 작업을 클릭합니다. 을 클릭하고 시작| 클릭하여 인쇄 작업을 시작합니다.
- 인쇄 후, 웰 플레이트를 30초 동안 3mW/cm2 의 강도로 405nm 광원에 노출시켜 rhCollMA 바이오잉크의 가교결합을 개시한다.
- 가교결합 후, 웰 플레이트를 모든 지지체 욕조가 녹을 때까지 적어도20 분 동안 37°C 및 5% CO2에서 인큐베이션한다.
- 액화된 지지체 배쓰를 부드럽게 흡인하고 내피 세포 배지로 교체한다. 구축물을 추가 단계에서 사용할 때까지 37°C 및 5%CO2 에서 인큐베이션한다.
참고: 인쇄 후 구조물이 수축하기 때문에 6단계와 같은 날에 조립 단계 7을 수행하는 것이 좋습니다.
7. 생체 인쇄 된 미세 혈관 네트워크를 혈관 스캐폴드와 조립하여 조작 된 혈관화 플랩을 얻습니다.
- 생체 인쇄 된 미세 혈관 네트워크의 지지 물질 제거 직후, 피브로넥틴 코팅 PLLA:PLGA 혈관 스캐폴드를 바이오 프린팅 구조의 주 채널에 배치하십시오.
- 조립된 구축물을 2일 동안 37°C 및 5%CO2 에서 인큐베이션한다.
- 혈관 스캐폴드의 내강을 내피 세포와 함께 정렬합니다.
- tdTomato를 발현하는 인간 지방 미세혈관 내피 세포 (HAMEC-tdTomato)의 세포 현탁액을 1 × 107 세포 / mL의 농도로 준비하십시오.
- 이 세포 현탁액의 20 μL 액적을 소수성 표면 상에 놓는다 (즉, 비조직 배양물 [nonTC] 10 cm 디쉬).
- 혈관 스캐폴드를 물방울 위에 부드럽게 올려 놓으면 한쪽 끝에있는 스캐폴드의 내강이 세포 방울과 접촉합니다.
- 스캐폴드의 반대쪽 끝 (즉, 액적과 접촉하지 않는 끝)에서 물방울을 흡인하여 루멘을 세포 현탁액으로 채 웁니다.
- 시딩된 스캐폴드를 마이크로원심분리 튜브에 넣고 60분 동안 가습된 인큐베이터의 내부 회전기에 넣는다. 다음으로, 스캐폴드를 12-웰 플레이트로 옮기고 내피 세포 배지 2 mL를 첨가한다.
- 조작된 플랩을 7일 동안 배양하고, 2일마다 배지를 신선한 내피 세포 배지로 교체한다.
8. 공초점 현미경 검사 및 조작 된 플랩의 면역 형광 염색
- 배양 4일 및 7일 후, 공초점 레이저 스캐닝 현미경을 이용하여 조립된 스캐폴드의 라이브 세포 이미징을 수행한다.
- 현미경 이미지 획득 소프트웨어에서 ZsGreen1 및 tdTomato 형광 단백질에 대한 형광 채널을 정의합니다.
- 0.5배 줌(픽셀 크기 5μm)의 5x/0.16 대물 렌즈를 선택하고 두께가 41μm인 22개의 슬라이스로 Z 스택을 정의합니다.
- 3 x 2 타일 스캔을 정의하여 전체 구문을 이미지화하고 캡처합니다.
- 레이저 강도와 이득 값을 조정하여 채도가없고 배경이 최소화 된 명확한 형광 신호를 얻고 이미지를 획득하십시오.
- 획득한 Z-스택의 최대 강도 프로젝션을 수행하여 현미경 이미지 획득 소프트웨어 또는 유사한 이미지 분석 소프트웨어를 사용하여 단일 2D 이미지를 획득한다.
- 관심 영역의 더 높은 배율 이미징을 수행합니다.
- 0.5 줌(픽셀 크기 1.25μm)의 10x/0.3 대물 렌즈로 전환하고 두께 41μm의 9조각으로 Z 스택을 정의합니다.
- 8.2.-8.3단계를 수행합니다.
- 배양 7일 후, 조작된 플랩을 20분 동안 4% 파라포름알데히드에 침수시켜 고정시킨다.
- 구축물을 PBS로 3x 5분 동안 세척한다.
- PBS 중의 0.3% (v/v) 트리톤-X를 구축물에 첨가하고, 실온에서 15분 동안 인큐베이션하여 세포를 투과시킨다.
- 구축물을 PBS로 3x 5분 동안 세척한다.
- PBS에 5% (w/v) 소 혈청 알부민 (BSA)을 용해시켜 블로킹 용액을 준비한다. 블로킹 용액을 조작된 플랩에 첨가하고 실온에서 1시간 동안 인큐베이션한다.
- SMA 발현 지지체 세포를 염색하기 위해 이전에 준비한 5% BSA 용액에 마우스 항평활근 액틴(anti-SMA) 항체를 1:50으로 희석하여 1차 항체 용액을 제조하였다.
- 스캐폴드를 4°C에서 하룻밤 동안 일차 항체 용액으로 인큐베이션한다.
- PBS로 3x 5분간 세척한다.
- Cy3-접합된 염소 항-마우스 IgG 1:400 항체 및 4',6-디아미디노-2-페닐인돌 (DAPI, 2.5 μg/mL)을 PBS로 희석하여 2차 항체 용액을 제조하였다.
- 이차 항체 용액을 스캐폴드에 적용하고 실온에서 3시간 동안 인큐베이션한다.
- PBS로 3x 5분간 세척한다.
- 구축물을 PBS에 4°C에서 최대 1개월 동안 보관한다.
- 공초점 레이저 스캐닝 현미경을 사용하여 염색된 스캐폴드를 이미지화한다.
- 현미경 이미지 수집 소프트웨어에서 3개의 형광 채널(DAPI, ZsGreen 및 Cy3)을 정의합니다.
- 50μm의 총 두께에 걸쳐 2μm의 단면 두께를 갖는 Z-스택을 정의하십시오. 다음으로, 타일 스캔을 정의하여 구성의 더 큰 영역을 이미지화합니다.
- 채도가 없고 배경이 최소화된 명확한 형광 신호를 얻기 위해 수집 파라미터를 조정하십시오.
- 1.0x 줌(픽셀 크기 0.31μm)으로 20x/0.8 목표를 사용하여 이미지를 획득합니다.
- 획득한 Z-스택의 최대 강도 프로젝션을 수행하여 현미경 이미지 획득 소프트웨어 또는 유사한 이미지 분석 소프트웨어를 사용하여 단일 2D 이미지를 획득한다.
9. 커프 기술을 사용하여 조작 된 플랩을 쥐의 대퇴 동맥에 직접 해부학 적으로 분석
- 다음 수술 도구를 준비하고 살균 (오토클레이브) : No. 15 메스, 한 쌍의 미세 이빨 포셉 및 작은 한 쌍의 고리 처리 가위. 또한 직선으로 미세 뾰족한 3 번 보석상의 포셉, 각진 보석상의 포셉, 구부러진 턱이있는 둥근 처리 바늘 홀더, 한 쌍의 용기 확장기, 해부 가위, 모험 가위, 어플리케이터가있는 용기 클램프와 같은 미세 수술 도구를 준비하고 멸균하십시오.
- 헤파린 원료 용액 5 mL를 식염수 195 mL로 희석하여 헤파린화 식염수 100 IU/mL의 용액을 준비한다.
- 폴리이미드 커프스를 자르고 살균하십시오.
- 해부 현미경으로 폴리이미드 튜브의 2.5mm 섹션을 절단하십시오.
- 각 섹션의 한쪽 끝에서 튜브 벽에 1.25mm 길이로 절개하여 커프 핸들을 얻습니다. 혈관 전환을 쉽게하기 위해 튜브의 다른 쪽 끝에서 각진 절단을하십시오.
- 커프스를 70 % 에탄올에 담근 다음 헤파린화 된 식염수로 두 번 씻으십시오.
- 수술을 위해 수컷 Sprague-Dawley 쥐 (275-350 g)를 준비하십시오.
- 수술 7 일 전에, 면역 억제를 달성하기 위해 사이클로스포린 (10 mg kg-1)의 피하 일일 복용량을 투여하기 시작하십시오.
- 수술 전에, 유도 챔버를 사용하여 기관 SOP에 따라 3% 이소플루란 흡입을 사용하여 동물을 마취시킨다. 두 발을 꼬집고 반사 신경을 검사하여 깊은 마취를 확인하십시오.
- 진통 부프레노르핀 (0.03 mg kg-1)과 항응고 헤파린 (200 IU kg-1)의 피하 용량을 투여하십시오.
- 탈수를 방지하기 위해 동물의 눈에 윤활 눈 연고를 바르십시오.
- 쥐의 수술 부위를 면도하고 요오드와 70 % 에탄올로 부위를 소독하십시오. 접착 테이프를 사용하여 동물의 팔다리를 테이블에 고정하십시오.
- 일반적인 대퇴 동맥을 노출시키고 분리하십시오.
- 다리와 복부 사이의 오목함을 따라 피부를 통해 2cm 길이의 비스듬한 절개를하십시오.
- 포셉과 무딘 가위를 사용하여 기본 조직에서 피부를 풀어 사타구니 지방 패드를 시각화하십시오.
- 가위와 포셉을 사용하여 위쪽, 중간 및 아래쪽 여백 주위의 뚱뚱한 패드를 통해 오른쪽으로 자릅니다. 뚱뚱한 패드 밑에있는 큰 혈관을 자르지 않도록주의하십시오.
- 뚱뚱한 패드를 옆으로 반사하여 상복부 혈관을 그대로 두십시오. 젖은 거즈를 반사 된 지방 패드에 올려 놓으면 건조를 방지하고 제자리에 고정하십시오. 일반적인 대퇴골 혈관이 보이는지 확인하십시오.
참고 : 뚱뚱한 패드는 나중에 해부학에 부드러운 압력을 가하는 데 사용됩니다. - 사타구니 인대에서 대퇴 동맥을 외피에서 추출하여 상복부 동맥 분지 지점까지 원위 방향으로 노출시킵니다.
주의: 보통 대퇴골 동맥의 가지가 그 밑으로 흐르고 있는데, 흔히 머피의 가지라고 불립니다. 이 보기 어려운 가지를 손상시키지 않도록 주의하십시오. - 머피의 가지를 결찰하여 나눈 다음 대퇴골 동맥을 1mm 간격으로 간격을 둔 동맥 중앙에 두 개의 합자로 합자를 합치십시오. 합자 봉합사의 한쪽 끝을 길게 유지하여 나중에 커프를 통해 용기 끝을 당기는 데 사용하십시오.
- adventitia 가위를 사용하여 두 합자 사이의 동맥을 자릅니다.
주의: 이 절단을 수행할 때 출혈이 없어야 합니다. 동맥 끝이 피를 흘리면 동맥을 고정하고 합자를 다시 바르십시오. - 합자 봉합사의 긴 끝을 사용하여 이전 단계에서 준비한 것처럼 각 용기 끝을 폴리이미드 커프에 삽입하여 두 커프스의 핸들이 서로 멀어지도록 합니다.
- 삽입 후 커프 핸들과 용기에 클램프를 동시에 적용하여 커프를 제자리에 고정시킵니다.
- 헤파린화 식염수 용액을 27 G 바늘이 장착된 주사기로 준비한다.
- 결찰 된 용기 끝을 당겨 합자 가까이로 자릅니다. 루멘에 혈액이 보이지 않을 때까지 즉시 헤파린화 된 식염수로 혈관 끝을 철저히 씻으십시오.
주의: 내부에 남아있는 혈액이 응고를 형성하여 절차를 완료하면 혈류에 유입되므로 혈관 끝이 잘 씻겨 졌는지 확인하십시오. 이것은 혈관의 폐색과 다리에 대한 관류의 손실로 이어질 수 있습니다. - 한 손으로 칼집을 잡고 다른 손으로 선박 확장기로 내강을 팽창시켜 선박의 내강을 확장하십시오.
- 느슨한 6-0 폴리프로필렌 원주 봉합사를 커프 본체 주위에 놓습니다. 커프 본체 위에 두 개의 용기 확장기를 사용하여 용기 끝을 뚫고 원주 봉합사를 조여서 제자리에 고정시킵니다.
참고 : 조작 중에 고정 된 혈관을 통해 혈액이 누출되면 헤파린 화 식염수로 루멘을 철저히 씻으십시오. - 조작된 플랩을 헤파린화 식염수로 헹구고 혈관이 늘어선 커프를 혈관 스캐폴드의 내강에 삽입합니다. 스캐폴드와 커프 몸체 주위에 원주 6-0 폴리프로필렌 봉합사를 배치하여 스캐폴드를 제자리에 고정시킨다. 혈관 스캐폴드의 양쪽에 대해이 단계를 수행하십시오.
- 해부학 부위 주위에 0.2 μm 폴리스티렌 멤브레인 필터를 감싸서 조작된 플랩을 주변 조직으로부터 분리한다.
- 원위 클램프를 먼저 해제하십시오. 그런 다음 근위 클램프를 풀어 혈관을 통한 혈류를 재설정하십시오.
- 해부학을 통한 출혈을 막으려면 대퇴골 혈관 위에 지방 패드를 다시 반영하고 3 분 동안 멸균 거즈를 사용하여 부드러운 압력을 가하십시오.
- 지방 패드를 다시 제자리에 봉합하여 6-0 폴리프로필렌을 사용하여; 그런 다음 5-0 PGA 흡수성 봉합사를 사용하여 피부를 봉합합니다.
- 식염수로 상처 부위를 닦고 요오드 용액을 바르십시오.
- 수술 후 통증 및 동물 관리를 위해 식수에 0.1 % (v / v)의 트라마돌을 준비하십시오. 또한 헤파린 (200 IU kg-1)과 사이클로스포린 (10 mg kg-1)의 1 일 복용량을 투여하십시오.
- 동물을 난방 램프 아래에 놓은 깨끗한 새장에 넣으십시오. 흉골 잔해를 유지하기에 충분한 의식을 회복 할 때까지 동물을 계속 모니터링하십시오.
결과
이 프로토콜은 혈관 스캐폴드 (그림 1Ai)와 생체 인쇄 된 미세 혈관 구조 (그림 1Aii)로 구성된 엔지니어링 플랩의 제조를 설명하며, 이는 메조 스케일 및 마이크로 스케일 혈관 구조를 달성하기 위해 조립되었습니다 (그림 1Aiii). 프로토콜에 따라, 혈관 스캐폴드의 BVOH 주형이 설계되고 3D 인쇄되었다(그림 1B,C). 획득 된 인쇄 된 구조물은 BVOH의 작은 가닥을 육안으로 검사했으며, 이는 금형의 빈 공간에서 발견 될 수 있습니다 (그림 1D). 이 가닥은 일반적으로 잘못된 재료 설정 또는 BVOH가 수분을 흡수했음을 나타냅니다. 이러한 가닥은 곰팡이의 불완전한 충전과 결과 혈관 스캐폴드의 구조적 결함으로 이어질 수 있으므로 제거해야합니다. 다음에, 주형을 PLLA:PLGA 용액으로 충전하고, 이어서 프로토콜에 기재된 바와 같이 동결건조 공정 및 세척 단계를 따랐다. 얻어진 PLLA:PLGA 혈관 스캐폴드를 육안으로 검사하여 혈관벽 완전성 및 루멘 개통도를 검증하였다(도 1E).
10 mg/mL의 농도로 중화된 rhCollMA 바이오잉크를 제조하고 PEO:LAP 용액과 1:1 비율로 조합하였다. Zs-Green1 및 치과용 펄프 줄기 세포로 표지된 인간 지방 미세혈관 내피 세포를 rhCollMA 바이오잉크로 재현탁시키고, 용액을 인쇄 카트리지에 로딩하고 프린터 상에 로딩하였다. 직선형 패턴(도 1D)을 갖는 중앙 채널을 갖는 박스 형상은 젤라틴 지지 욕조 내부에 생체인쇄되었다. 인쇄 후, 구조물을 가교 결합시키고, 지지 욕을 용해시키고 세척하였다. 배양 4일 후, 구축물을 생중-영상화하여 미세혈관 네트워크 자가조립을 확인하였다. 도 1D 는 생체인쇄 구축물에서 고도로 발달된 HAMEC-ZsGreen1 미세혈관 네트워크의 예를 도시한다.
다음에, 피브로넥틴-코팅된 혈관 스캐폴드를 인쇄된 구축물의 중앙 채널에 삽입하였다(도 2A). 조립된 구축물을 2일 동안 배양하였고, 그 동안 세포는 겔을 수축시키고, 이를 혈관 스캐폴드에 단단히 부착시켰다. 이어서, 혈관 스캐폴드를 프로토콜에 따라 tdTomato를 발현하는 HAMECs로 라이닝하였다. 배양 7일 후, 구축물을 고정시키고 이미지화하였다. 도 2B 는 생체인쇄된 미세혈관구조에서 내피 세포가 녹색으로 묘사되는 반면, 혈관 스캐폴드의 내피 내막은 적색으로 묘사되는 조립된 구조물의 측면도를 도시한다. 이미지는 생체 인쇄 된 젤에서 녹색 미세 혈관 자기 조립을 보여 주며, 혈관 스캐폴드는 적색 내피 세포로 줄 지어 있습니다. 배율이 높을수록 적색 내피 내막에서 유래 한 콩나물이 생 인쇄 된 미세 혈관 네트워크로 돋아나는 것과 아나스토모싱되는 것을 볼 수 있습니다 (그림 2C). 다음에, 작제물을 치과용 펄프 줄기 세포에 대한 마커로서 α평활근 액틴 (SMA)에 대해 염색하였다. 면역염색 후, 구축물을 레이저 스캐닝 공초점 현미경을 사용하여 영상화하였다(도 2D).
마지막으로, 배양 7일 후, 조작된 플랩을 프로토콜에 기술된 바와 같이 래트의 대퇴동맥에 미세외과적으로 분석하였다. 대표적인 절차에 대한 비디오는 보충 비디오 S1에서 볼 수 있습니다. 도 2E 는 클램프 제거 전에 완성된 해부학의 대표적인 이미지를 나타내고, 도 2F 는 클램프 제거 및 지혈 후의 해부학 부위의 대표적인 이미지를 도시한다. 상처 폐쇄 전에 출혈이 보이지 않아야합니다.
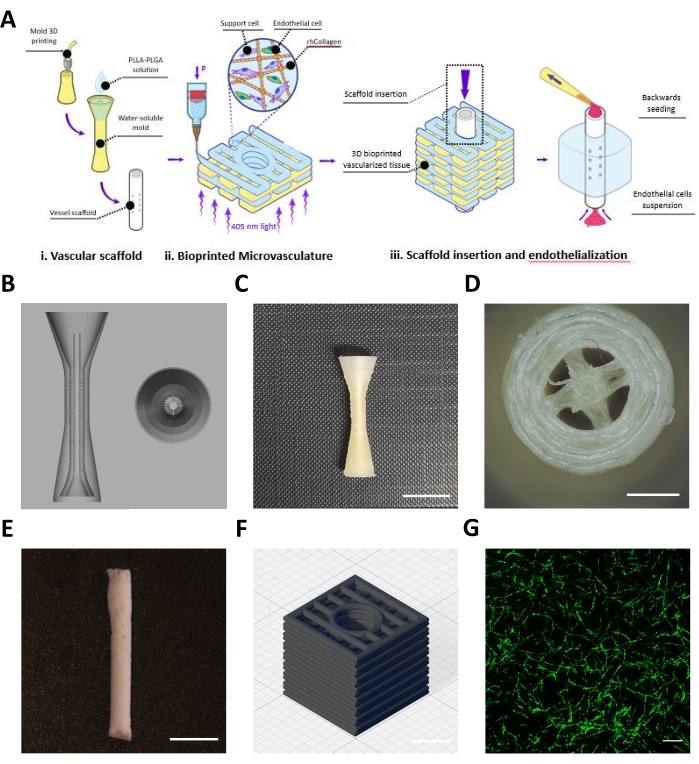
그림 1: 제작된 메조- 및 마이크로스케일 용기의 대표적인 이미지. (A) 프로토콜 단계에 대한 개략적인 개요. 허락을 받아 복제16. (B) 혈관 스캐폴드의 희생 금형에 대한 CAD 설계. (C) 대표적인 3D 인쇄 희생 금형의 측면도(스케일 바 = 0.5mm). (d) 희생 주형의 상면도 (스케일 바 = 0.5 mm) (E) 설명 프로토콜을 사용하여 제조된 대표적인 혈관 스캐폴드 (스케일 바 = 5 mm). (F) 3D 생체 인쇄 rhCollMA 미세혈관 네트워크를 위한 CAD 설계. 그리드 라인 = 1 mm. (G) HAMEC-ZsGreen1을 녹색으로 보여주는 고도로 발달된 생체 인쇄 혈관 네트워크의 대표 이미지. 스케일 바 = 200 μm. 약어: CAD = 컴퓨터 지원 설계; rhCollMA = 재조합 인간 콜라겐 메타크릴레이트; HAMEC = 인간 지방 미세혈관 내피 세포; PLLA = 폴리-L-락트산; PLGA = 폴리락틱-코-글리콜산. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 조립된 혈관화된 플랩의 대표적인 이미지. (A) 생체인쇄된 미세혈관구조와 혈관 스캐폴드의 대표적인 조립체의 사진. 스케일 바 = 1 mm. (B) 혈관 스캐폴드의 내피 라이닝 4일 후 영상화된 대표적인 조작된 플랩의 측면도. 생체 인쇄 된 미세 혈관 구조는 녹색 (HAMEC-ZsGreen1)으로 표시되고 내피 내막은 빨간색 (HAMEC-tdTomato)으로 표시됩니다. 스케일 바 = 1 mm. (C) 녹색의 생체 인쇄 혈관 구조와 빨간색의 내피 라이닝 사이의 해부학의 대표적인 이미지. 스케일 바 = 200 μm. (D) 배양 7일 후 평활근 액틴(적색), 핵(청색) 및 내피세포(녹색)에 대한 면역염색의 대표적인 이미지. 스케일 바 = 0.1 mm. (E) 클램프 제거 전 및 (F) 클램프 제거 후 래트의 대퇴동맥을 갖는 조작된 플랩의 완성된 해부학의 대표적인 이미지. 약어: HAMEC = 인간 지방 미세혈관 내피 세포; SMA = 평활근 액틴; DAPI = 4',6-디아미디노-2-페닐인돌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 비디오 S1 : 쥐의 대퇴 동맥에 혈관 비계를 해부학하기위한 대표적인 미세 수술 절차. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
혈관화 된 조직 공학은 조직 공학20의 주요 과제 중 하나입니다. 공학적 혈관 조직을 만들기 위한 현재의 방법은 자기조립된 미세혈관구조(21,22,23)를 만들거나 중규모 혈관 스캐폴드(24,25)를 제작하는 데 초점을 맞추고 이식 시 즉시 그리고 직접 관류될 수 있는 계층적 혈관 구조 시스템을 재창조하는 데 초점을 맞추고 있다(26) . 이 작업에서는 두 가지 3D 인쇄 형식을 사용하여 마이크로 스케일과 중규모 혈관으로 구성된 계층 적 혈관 네트워크를 제작하는 프로토콜을 설명합니다. 이 프로토콜은 3D 생체 인쇄, 자체 조립 된 미세 혈관 네트워크와 메조 스케일 혈관 스캐폴드를 결합하여 이식 가능한 혈관 플랩을 달성합니다. 또한,이 논문은이 플랩을 쥐의 대퇴 동맥에 직접 해부학하기위한 프로토콜을 제시합니다.
3D 바이오 프린팅은 전통적인 조직 공학 기술에 대한 다양성으로 인해 최근 몇 년 동안 관심을 끌었습니다. 이 프로토콜이 rhCollMA 바이오잉크에서 미세혈관 네트워크의 생성을 기술하는 반면, 사용된 방법은 연구되고 신규한 바이오잉크 및 지지욕(27,28)의 과다함으로부터 많은 다른 바이오잉크에 약간의 변형으로 적용될 수 있다. 우리는 인간 ECM에 I 형 콜라겐이 풍부하기 때문에 rhCollMA를 바이오 잉크로 사용하여 세포 부착에 적합한 환경을 제공하기로 결정했습니다. 더욱이, 그것은 식물에서 재조합적으로 생산되고 메타크릴레이트 그룹으로 추가로 변형되어 광중합 및 안정한 3D 하이드로겔29,30의 형성을 허용한다. 광가교는 광개시제 LAP의 첨가에 의해 달성되었으며, 이는 무독성인 것으로 나타났으며, 405 nm 청색광에 노출됨으로써 활성화되어, UV 광의 가능한 광독성을 감소시킨다. 그러나, 감광성 바이오잉크의 사용은 바이오잉크 및 지지체 물질의 제조를 위해 페놀 무함유 배양 배지의 사용을 필요로 한다. 또한, 프로토콜은 rhCollMA와 같은 바이오 잉크의 고충실도 압출을 가능하게하는 젤라틴 지지 물질의 사용을 설명합니다. 따라서 프린터 베드를 준비하고 냉각하는 동안 차가운 매체를 사용하는 것이 중요합니다. 과도한 가열은 가교에 사용되는 광원 또는 상승된 주변 온도로 인해 발생할 수 있습니다.
압출 기반 바이오 프린터는 생체 인쇄 된 미세 혈관 네트워크를 만들기 위해 여기에서 사용되어 왔으며 현재 유사한 구조를 생성 할 수있는 많은 상업적으로 이용 가능한 바이오 프린터가 있습니다. 더욱이, 제안된 방법들은 상이한 기하학들, 크기들, 및 채우기 패턴들을 연구하기 위해 쉽게 수정되고 적용될 수 있다. 이 작업에서는 상호 연결된 기공을 만들기 위해 직선형 채우기 패턴을 선택했으며, 이는 높은 충실도로 비교적 빠르게 인쇄 할 수 있습니다.
기포는 압출 바이오 프린팅, 특히 내부 지지 재료에 중요한 도전을 안겨줍니다. 따라서, 지지 물질의 이송, 바이오잉크-세포 현탁액의 준비, 및 인쇄 카트리지로의 이송을 위해 포지티브 변위 피펫을 사용함으로써 이러한 기포의 존재 및 형성을 최소화하는 것이 중요하다.
이 연구에서, 인간 지방 유래 내피 세포 및 치과 펄프 줄기 세포는 환자로부터 비교적 쉽게 분리되기 때문에 지원 세포로 사용되었다. 더욱이, 8 x 106 세포/mL의 총 세포 농도가 선택되었는데, 그 이유는 이 농도가 가장 발달된 혈관 네트워크(16)를 확립하는 것으로 보여졌기 때문이다. 이 프로토콜은 다른 세포 유형 및 소스뿐만 아니라 다른 바이오 잉크를 사용하여 미세 혈관을 생성하는 데 사용될 수 있지만, 미세 혈관 네트워크의 개발을위한 최상의 조건을 수립하기 위해 세포 농도의 교정이 수행되어야합니다. 또한, 조직-특이적 세포(즉, 근아세포 또는 조골세포)는 조직 특이적 혈관화된 플랩을 달성하기 위해 바이오잉크 내에 혼입될 수 있다.
다공성 혈관 스캐폴드용 몰드는 시판되는 압출 3D 프린터에서 3D 프린팅된 수용성 물질을 사용하여 제작되었다. 이는 신속한 프로토타이핑 플랫폼에 기초한 비용 효율적인 기술을 초래하여, 혈관 스캐폴드의 다양한 형상 및 크기가 신속하게 연구되고 스크리닝될 수 있게 한다(31). 그럼에도 불구하고, 이 방법의 한계는 대부분의 3D 프린터(32)의 해상도 한계이다. 그러나 적층 제조를 둘러싼 산업이 급속히 발전함에 따라 이러한 한계는 시간이 지남에 따라 개선 될 것으로 예상됩니다. 제조 공정을 위한 유기 용매의 사용은 프로토콜의 또 다른 한계이며, 대부분의 유기 용매는 세포에 독성이 있기 때문에, 바이오프린팅 절차와 혈관 스캐폴드 제조 공정을 결합하는 능력을 방지한다.
세포 현탁액을 밀어내는 것과 반대로 흡인을 사용하여 스캐폴드의 루멘을 시딩하는 기술된 방법은 시딩된 세포의 국소화에 큰 영향을 미친다. 음압을 사용하여 스캐폴드의 내부 내강으로의 내피화를 허용하면서 스캐폴드의 벽(16) 상의 천공을 통한 세포 현탁액의 임의의 유출을 최소화한다.
미세외과적 해부학을 위한 기술된 "커프" 방법은 상이한 혈관 스캐폴드 물질 또는 크기뿐만 아니라 광범위한 동물 모델에서 상이한 동맥 및 정맥에 용이하게 변형되고 적응될 수 있다. 프로토콜에 대한 적응에는 다른 폴리이미드 튜브 크기와 봉합사 크기가 포함됩니다. 이 방법은 스캐폴드 벽의 천공을 필요로하지 않으며, 이로 인해 결함이 발생할 수 있습니다. 이 작업은 많은 응용 프로그램으로 확장 할 수있는 프로토콜을 제공합니다. 중소 및 마이크로 스케일 혈관 구조의 제작과 조립 및 이식을 포함한이 프로토콜의 중요한 측면은 재건 응용 프로그램뿐만 아니라 혈관 및 기타 조직 공학 연구를위한 엔지니어링 플랩의 중요한 측면을 나타냅니다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
이 프로젝트는 유럽 연합의 Horizon 2020 연구 및 혁신 프로그램 (보조금 계약 번호 818808)에 따라 유럽 연구위원회 (ERC)로부터 자금을 지원받았습니다. rhCollMA는 CollPlant (Rehovot, 이스라엘)에 의해 관대하게 제공되었습니다. 저자들은 동물 보호에 대한 도움을 주신 Technion의 전임상 연구 당국과 Janette Zavin, Galia Ben David 및 Idan Redenski에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1,4-Dioxane | Biosolve Chemical | 42405 | |
| 27 G x 0.5" blunt tip dispensing needles | CML supply | 901-27-050 | |
| 3cc amber syringe barrel & piston set | Nordson EFD | 7012085 | Amber syringes used to block light and prevent premature crosslinking |
| 5-0 AssuCryl PGA absorbale suture | Assut Sutures | Absorbable sutures used for skin wound closure | |
| 6-0 polypropelene sutures | Assut Sutures | 9351 | |
| Acland clamps | S&T | B-1V | |
| Adventitia scissors | S&T | SAS-15 | |
| Angled no.3 jeweler's forceps | S&T | JFAL-3-18 | |
| BioAssemblyBot 400 3D Bioprinter | Advanced Solutions | a 6-axis 3D bioprinter | |
| Bovine albumin serum Probumin | Millipore | 82-045-1 | |
| Buprenorphine | vetmarket | B15100 | |
| BVOH filament | Verbatim | 55903 | a water-soluble 1.75 mm diameter filament |
| Clamp applying forceps | S&T | CAF-4 | |
| Dental pulp stem cells | Lonza | PT-5025 | |
| Dietrich bulldog clamps | Fine Science Tools (FST) | 18039-45 | |
| di-Sodium hydrogen phosphate (Na2HPO4) | Carlo Erba Reagents | 480141 | |
| Dissection scissors | S&T | 18039-45 | |
| DMEM, High Glucose, No Phenol Red | Sartorius | 01-053-1A | |
| Duratears | Alcon | DJ03 | |
| ECM media + bullet kit | Sciencell | #1001 | |
| Ethanol 96% | Gadot-Group | 64-17-5 | |
| GlutaMAX | Gibco | 35050061 | glutamine substitute |
| Goat anti-mouse Cy3 antibody | Jackson | 115-166-072 | |
| Heparin Sodium 5,000 I.U./mL | Panpharma | - | |
| Human adipose microvascular cells | Sciencell | #7200 | |
| Human fibronectin | Sigma | F0895-5MG | A stock concentration of 1 mg/mL |
| Isoflurane, USP Terrell | Piramal Critical Care | NDC 66794-011-25 | |
| LifeSupport | Advanced Biomatrix | 5244 | a gelatin support slurry for FRESH 3D bioprinting |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | |
| Low-glucose DMEM | Biological Industries | 01-050-1A | |
| MICROMAN E M1000E, 100-1,000 µL | Gilson | FD10006 | |
| Mouse anti-SMA antibody | Dako | M0851 | |
| NEAA | Gibco | 11140068 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Paraformaldehyde solution 4% in PBS | ChemCruz | SC-281692 | |
| Penicillin-Streptomycin-Nystatin Solution | Biological Industries | 03-032-1B | |
| Phospate buffered saline (PBS) | Sigma | P5368-10PAK | |
| Poly(ethylene oxide), M.W. 250,000 to 400,000 | Acros Organics | 178602500 | |
| Poly(L-lactic acid), IV 5.0 dl/g (PLLA) | Polysciencse, Inc. | 18582-10 | |
| Polyimide tubing, ID: 0.0249", OD: 0.0273" | Cole-Parmer | 95820-05 | A thin-walled tube used to fabricate cuffs for microsurgical anastomoses |
| Prusa I3 MK2.5 3D Printer | Prusa Research | http://www.prusa3d.com/ | a popular commercial 3D printer |
| Resomer RG 503 H, Poly(D,L-lactide-co-glycolide) (PLGA) | Evonik Industries | 719870 | |
| rhCollMA | CollPlant | https://collplant.com/ | generously provided by CollPlant (Rehovot, Israel) |
| round-handled needle holder | S&T | B-15-8 | |
| Scalpel handle - #3 | Fine Science Tools (FST) | 10003-12 | |
| small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Sodium Chloride | Biosolve Chemical | 19030591 | |
| Sodium Phosphate dibasic (NaH2PO4) | Riedel-de Haen | 4276 | |
| Solidworks | Dassault Systems | CAD software | |
| Straight no.3 jeweler's forceps | S&T | JF-3-18 | |
| Straight serrated forceps | Fine Science Tools (FST) | 11050-10 | |
| Surgical Scalpel Blade No.15 | Swann-Morton Limited | 305 | |
| Triton-X 100 | BioLab LTD | 57836 | |
| TSIM | Advanced Solutions | 3D slicing and design software for the BioAssembly Bot | |
| Vessel dilator | S&T | D-5a.1 | |
| Zeiss Tivato 700 surgical microscope | Zeiss |
참고문헌
- Wallace, C. G., Wei, F. -C. C. The current status, evolution and future of facial reconstruction. Chang Gung Medical Journal. 31 (5), 441-449 (2008).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), 12(2012).
- Duan, B. State-of-the-art review of 3D bioprinting for cardiovascular tissue engineering. Annals of Biomedical Engineering. 45 (1), 195-209 (2017).
- Kim, J. J., Hou, L., Huang, N. F. Vascularization of three-dimensional engineered tissues for regenerative medicine applications. Acta Biomaterialia. 41, 17-26 (2016).
- Ouyang, L., Armstrong, J. P. K., Chen, Q., Lin, Y., Stevens, M. M. Void-free 3D bioprinting for in situ endothelialization and microfluidic perfusion. Advanced Functional Materials. 30 (1), 1908349(2020).
- Baltazar, T., et al. Three dimensional bioprinting of a vascularized and perfusable skin graft using human keratinocytes, fibroblasts, pericytes, and endothelial cells. Tissue Engineering - Part A. 26 (5-6), 227-238 (2020).
- Chia, H. N., Wu, B. M. Recent advances in 3D printing of biomaterials. Journal of Biological Engineering. 9 (1), 4(2015).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Guillotin, B., et al. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials. 31 (28), 7250-7256 (2010).
- Catros, S., et al. Laser-assisted bioprinting for creating on-demand patterns of human osteoprogenitor cells and nano-hydroxyapatite. Biofabrication. 3 (2), (2011).
- Ronca, A., Ambrosio, L., Grijpma, D. W. Preparation of designed poly(d,l-lactide)/nanosized hydroxyapatite composite structures by stereolithography. Acta Biomaterialia. 9 (4), 5989-5996 (2013).
- Lan, P. X., Lee, J. W., Seol, Y. J., Cho, D. W. Development of 3D PPF/DEF scaffolds using micro-stereolithography and surface modification. Journal of Materials Science: Materials in Medicine. 20 (1), 271-279 (2009).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655(2015).
- Szklanny, A. A., et al. 3D bioprinting of engineered tissue flaps with hierarchical vessel networks (VesselNet) for direct host-to-implant perfusion. Advanced Materials. 33 (42), 2102661(2021).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. Journal of Visualized Experiments JoVE. (69), (2012).
- Sucher, R., et al. Mouse hind limb transplantation: A new composite tissue allotransplantation model using nonsuture supermicrosurgery. Transplantation. 90 (12), 1374-1380 (2010).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), (2014).
- Novosel, E. C., Kleinhans, C., Kluger, P. J. Vascularization is the key challenge in tissue engineering. Advanced Drug Delivery Reviews. 63 (4-5), 300-311 (2011).
- Landau, S., et al. Tropoelastin coated PLLA-PLGA scaffolds promote vascular network formation. Biomaterials. 122, 72-82 (2017).
- Szklanny, A. A., et al. High-throughput scaffold system for studying the effect of local geometry and topology on the development and orientation of sprouting blood vessels. Advanced Functional Materials. 1901335, 1-13 (2019).
- Song, W., et al. Engineering transferrable microvascular meshes for subcutaneous islet transplantation. Nature Communications. 10 (1), 1-12 (2019).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Ying, G. L., et al. Aqueous two-phase emulsion bioink-enabled 3D bioprinting of porous hydrogels. Advanced Materials. 30 (50), 1-9 (2018).
- Rouwkema, J., Khademhosseini, A. Vascularization and angiogenesis in tissue engineering: beyond creating static networks. Trends in Biotechnology. 34 (9), 733-745 (2016).
- Jang, J., Park, J. Y., Gao, G., Cho, D. W. Biomaterials-based 3D cell printing for next-generation therapeutics and diagnostics. Biomaterials. 156, 88-106 (2018).
- Suntornnond, R., An, J., Chua, C. K. Roles of support materials in 3D bioprinting - present and future. International Journal of Bioprinting. 3 (1), 83-86 (2017).
- Shoseyov, O., Posen, Y., Grynspan, F. Human recombinant type I collagen produced in plants. Tissue Engineering - Part A. 19 (13-14), 1527-1533 (2013).
- Stein, H., et al. Production of bioactive, post-translationally modified, heterotrimeric, human recombinant type-I collagen in transgenic tobacco. Biomacromolecules. 10 (9), 2640-2645 (2009).
- Kaplan, B., et al. Rapid prototyping fabrication of precision polyester scaffolds for axonal guidance. Biomaterials. , 120062(2020).
- Karakurt, I., Lin, L. 3D printing technologies: techniques, materials, and post-processing. Current Opinion in Chemical Engineering. 28, 134-143 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유