Method Article
3D Baskı Teknolojileri Kullanılarak Mühendislik Vasküler Flaplarının İmalatı
Bu Makalede
Özet
Tasarlanmış flepler, dahil edilmiş bir fonksiyonel vasküler ağ gerektirir. Bu protokolde, hiyerarşik vasküler ağ ve onun doğrudan mikrocerrahi anastomozlarını sıçan femoral arterine içeren 3D baskılı bir doku flebi üretme yöntemini sunuyoruz.
Özet
İmplante edilebilir, fonksiyonel, kalın dokuların mühendisliği, hiyerarşik bir vasküler ağ tasarlamayı gerektirir. 3D biyobaskı, yazdırılabilir biyomalzemelerin, biyomürekkeplerin ve hücrelerin katman katman üzerine düzenli ve otomatik bir şekilde eklenmesiyle doku oluşturmak için kullanılan ve geleneksel doku mühendisliği tekniklerinin elde edemeyeceği son derece karmaşık yapılar oluşturmaya izin veren bir teknolojidir. Bu nedenle, 3D biyobaskı, milimetrik damarlardan mikrovasküler ağlara kadar değişen doğal vaskülatür karmaşık yapısını taklit etmek için çekici bir in vitro yaklaşımdır.
Granüler hidrojellerde 3D biyobaskıdaki ilerlemeler, düşük viskoziteli hücre dışı matris bazlı biyomürekkeplerin yüksek çözünürlüklü ekstrüzyonunu mümkün kılmıştır. Bu çalışma, mühendislik ürünü vaskülarize doku kapaklarını imal etmek için birleşik bir 3D biyobaskı ve kurban kalıp tabanlı 3D baskı yaklaşımı sunmaktadır. Bir jelatin destek banyosu içinde rekombinant kollajen-metakrilat biyomürekkep kullanılarak endotel ve destek hücrelerinin 3D biyobaskısı, kendiliğinden monte edilmiş bir kılcal ağın üretimi için kullanılır. Bu baskılı mikrovaskülatür, mezoölçekli bir kap benzeri gözenekli iskele etrafında toplanır, kurbanlık bir 3D baskılı kalıp kullanılarak imal edilir ve endotel hücreleri ile tohumlanır.
Bu düzenek, mezoölçek damarının endotelini çevreleyen kılcal ağ ile anastomoza indükleyerek mühendislik doku flebi içinde hiyerarşik bir vasküler ağ oluşturur. Mühendislik flebi daha sonra cerrahi anastomoz ile doğrudan bir manşet tekniği kullanılarak bir sıçan femoral arterine implante edilir. Tarif edilen yöntemler, rekonstrüksiyon cerrahisi ve vaskülarizasyon çalışmalarında kullanılmak üzere çeşitli vaskülarize doku fleplerinin üretimi için genişletilebilir.
Giriş
Ciddi doku defektlerine travmatik yaralanmalar, konjenital defektler veya hastalıklar neden olur ve bu defektlerin tedavisinde mevcut altın standart, otolog greftler, vaskülarize doku flepleri ve mikrovasküler serbest fleplerin doku ikamesi olarak kullanılmasıdır. Bununla birlikte, bu seçeneklerin sınırlı donör bölge dokusu ve donör bölge morbiditesi1'in dezavantajları vardır. Bu nedenle, bu kusurları düzeltmek için kullanılabilecek alternatif doku ikamelerine yönelik artan bir talep vardır2. Mühendislik doku yapılarının kalınlığı, besin maddelerinin ve gazların hücrelere doğru yayılmasıyla sınırlıdır ve bu nedenle, büyük, kalın ve uygun şekilde beslenmiş iskeleler üretmek için uygun bir vasküler ağ gereklidir.
Mühendislik implantlarının vaskülarizasyonunu teşvik etmek için, konakçıdan vasküler desteğin in vivo alımı, iskeleler içinde büyüme faktörlerinin ve sitokinlerin verilmesi, implantların prevaskülarizasyonu, mikrodesenleme teknikleri kullanılarak perfüze edilebilir dallanan bir mikrodamar yatağının oluşturulması4, vasküler kanal / ağ oluşumu için kurban malzemelerinin kullanımı dahil olmak üzere çeşitli yaklaşımlar uygulanmıştır 3, vasküler kanal / ağ oluşumu için kurban malzemelerinin kullanımı5 , ayrıca 3D biyobaskılı yapılar içinde kanalların oluşturulması 5,6. Kalın dokuların vaskülarizasyonu, makro ölçekli ve mikrokılcal ölçekli damarlardan oluşan hiyerarşik bir vasküler ağın dahil edilmesini gerektirir. Makro ölçekli damarlar kanı yapı boyunca etkili bir şekilde dağıtır ve konakçı kan damarları ile mikrocerrahi anastomozlara izin verirken, mikrokılcal ölçekli damarlar besin difüzyonuna izin verir.
Biyobaskı, geleneksel doku mühendisliği yöntemlerine göre sunduğu avantajlar nedeniyle son yıllarda büyük ilgi görmüştür. Dokular ve organlar, belirli bir mimariye sahip karmaşık ve karmaşık 3D nesnelerdir. 3D biyobaskı, biyomalzeme katmanlarını yüksek çözünürlükte biriktirme kabiliyeti ile, karmaşık doku ve organ ikameleri (örneğin, böbrek, akciğer, karaciğer) oluşturma yeteneğini sağlar7. Ekstrüzyon tabanlı, mürekkep püskürtmeli8, lazer destekli biriktirme9,10 ve stereolitografi tabanlı 11,12 biyobaskı dahil olmak üzere çeşitli baskı teknolojileri biyobaskı için uyarlanmıştır. Ekstrüzyon bazlı teknolojiler, nozulun karşısındaki malzeme dökme yüzeyine basınç uygulayarak malzemenin bir nozuldan ekstrüzyonuna dayanır.
Asılı hidrojellerin (FRESH) serbest formlu geri dönüşümlü gömülmesi, ekstrüde edilmiş malzemenin destek banyosu tarafından biriktirildiği ve yerine sabitlendiği granüler bir destek malzemesi kullanan bir biyobaskı tekniği 13,14'tür. Destek banyosu, ekstrüde edilmiş, önceden çapraz bağlanmış biyomürekkep için çapraz bağlanana kadar mekanik destek sağlar. Bu tekniğin temel avantajı, destek banyosunun, ekstrüzyondan sonra veçapraz bağlama 15'ten önce şekillerini koruyamayan düşük viskoziteli malzemelerin ekstrüzyonuna izin vermesidir. Bu, biyomürekkep olarak kullanılabilecek mevcut malzemelerin havuzunu genişletir.
Bu yazıda mikroskal ve mezoölçekli vaskülatürleri birleştiren vaskülarize flep üretimi için bir protokol sunulmaktadır. Bunu başarmak için, biyobaskılı, kendi kendine montajlı, mikrovasküler ağlar, rekombinant insan kollajen metakrilat (rhCollMA) hidrojelinde üretilir ve daha sonra daha büyük, implante edilebilir, vasküler bir iskelenin içine bağlanır ve tamamen tasarlanmış bir doku kapağı16 ile sonuçlanır. Mühendislik dokularının hızlı ve doğrudan perfüzyonunu sağlamak için, konakçı damarlara doğrudan mikrocerrahi bir anastomoz gereklidir. Vasküler iskele, geleneksel mikrocerrahi damar duvarı dikişi kullanılarak anastomoz edilmek için yeterli dikiş tutma gücüne sahip değildir. Bu nedenle, bir sıçanın ortak femoral arteri ile bir anastomoz elde etmek için bir "manşet"17,18,19 yöntemini tanımlamaktayız. Bu yöntemde, damar uçları, damar duvarını delmeye gerek kalmadan çevresel dikişlerle sabitlenir.
Önerilen protokol rhCollMA ortamında hiyerarşik vaskülatürü incelemek için hazırlanmış olmasına rağmen, bu yaklaşım genişletilebilir ve çeşitli yeni uygulamalara uygulanabilir. Protokol, farklı biyomürekkeplerde çeşitli dokuya özgü hücrelerin biyo-baskısına uygulanabilir. Ayrıca, yapıların geometrisi ve boyutu, büyük doku rekonstrüksiyonu veya biyolojik çalışmalar gibi belirli gereksinimlere uyacak şekilde kolayca değiştirilebilir.
Protokol
Tüm hayvan prosedürleri, Technion Klinik Öncesi Araştırma Otoritesi'nin (PCRA Technion, etik onay no. 058-05-20) gözetiminde onaylanmış ve yürütülmüştür. Bu çalışmalar için erkek Sprague-Dawley sıçanları (275-350 g) kullanılmıştır. Bu protokolde kullanılan tüm malzemeler, ekipmanlar ve yazılımlarla ilgili ayrıntılar için Malzeme Tablosu'na bakın.
1. Vasküler iskele imalatı
- Bilgisayar destekli tasarım (CAD) yazılımını kullanarak istenen vasküler iskele şeklinin 3D bilgisayar modelini oluşturun veya çevrimiçi depolardan istenen vasküler yapının 3D dosyasını indirin.
- İç çapı 0,9 mm, dış çapı 2 mm ve yüksekliği 18 mm olan bir silindir oluşturun. Silindir duvarının yanına 0,22 mm çapında radyal fenestrasyonlar ekleyin.
- 3D tasarım yazılımını kullanarak iskele için bir kalıp oluşturun ve . STL dosyası. Ardından, daha sonra kalıbın doldurulmasını kolaylaştırmak için tasarıma bir huni ekleyin.
- . STL dosyası, kaynaşmış biriktirme modelleme (FDM) 3D yazıcı için dilimleme yazılımına dönüşür. Modeli 0,1 mm katman yüksekliğinde dilimleyin ve .gcode olarak dışa aktarın veya doğrudan 3B yazıcıya gönderin.
- 3D, kalıbı, suda çözünür büten-diol vinil alkol kopolimeri (BVOH) filamenti kullanarak 0,25 mm'lik bir nozulla donatılmış bir FDM 3D yazıcıya yazdırın. Basılı kalıpları kullanıma kadar bir vakum odasında saklayın.
DİKKAT: BVOH filamentini neme duyarlı olduğu için çıplak elle kullanmaktan kaçının. Ek olarak, neme maruz kalmayı önlemek için filamentin bir vakum odasında saklanması önerilir. - 1,4-dioksan'da 1: 1 poli-L-laktik-asit (PLLA) ve polilaktik-ko-glikolik-asit (PLGA) karışımından oluşan bir polimer çözeltisi hazırlayın.
- 350 mg PLLA ve 350 mg PLGA tartın ve 20 mL'lik bir cam şişeye aktarın.
- 10 mL 1,4-dioksan ölçün ve bir cam pipet kullanarak cam şişeye aktarın. Cam şişeye küçük bir manyetik karıştırma çubuğu ekleyin.
DİKKAT: 1,4-Dioksan tehlikeli bir organik çözücüdür. Uygun kişisel güvenlik ekipmanlarını kullanın ve bir duman davlumbazının içinde çalışın. - Cam şişeyi 70 ° C'ye ısıtılmış bir sıcak su banyosuna yerleştirin ve tüm polimerler tamamen çözünene kadar içeriği gece boyunca karıştırın. Çözeltiyi kullanana kadar hava geçirmez bir cam kapta saklayın.
- BVOH kalıplarını PLLA:PLGA çözümü ile doldurun.
- Pozitif deplasmanlı pipet kullanarak, polimer çözeltisinin 30 μL'sini ölçün ve kalıbı doldurun.
NOT: Kalıbı doldurmak için gereken hacim, tasarlanan kabın hacmine göre değişecektir. Kalıbın hunisi tamamen dolana kadar polimer çözeltisini eklemeye devam edin. - Kalıbı 2 dakika boyunca 100 × g'da santrifüj yapın. Tam doldurmayı sağlamak için kalıbı 20 μL polimer çözeltisi ile doldurun.
- Pozitif deplasmanlı pipet kullanarak, polimer çözeltisinin 30 μL'sini ölçün ve kalıbı doldurun.
- Tüm polimer çözeltisinin donmasını sağlamak için doldurulmuş kalıpları -80 ° C'de en az 30 dakika dondurun. Çözücüyü gece boyunca liyofilize ederek kalıplardan çıkarın.
NOT: Dondurarak kurutma işleminden sonra kalıptaki polimerin rengi berraktan beyaza dönmelidir. - Kurban kalıp malzemesini çıkarmak için, dondurarak kurutma işleminden sonra kalıpları hafifçe karıştırarak 5 L'lik deiyonize su banyosuna aktarın. Bulutlu olduğunda banyodaki suyu değiştirin. Tüm BVOH çözündüğünde, iskeleleri havayla kurutun ve kullanıma kadar bir vakum odasında saklayın.
2. Vasküler iskelenin fibronektin ile kaplanması
- PLLA: PLGA vasküler iskeleleri 30 dakika boyunca% 70 etanol içine batırarak dezenfekte edin.
- İskeleleri PBS ile 3x 5 dakika yıkayın.
- PBS'de 50 μg / mL insan fibronektininin seyreltilmesini hazırlayın ve iskeleleri kaplayın.
- 500 μL stok fibronektin çözeltisini (1 mg / mL) 9.5 mL PBS ile karıştırın.
- Dezenfekte edilmiş vasküler iskeleleri bu fibronektin çözeltisine batırın ve protein adsorpsiyonuna izin vermek için 60 dakika boyunca 37 ° C'de inkübe edin.
- Kuluçkadan sonra, bağlanmamış fibronektini çıkarmak için iskeleleri PBS ile durulayın. Bu kaplamalı iskeleleri 4 °C'de 1 haftaya kadar saklayın.
3. rhCollMA biyomürekkep hazırlama
- Asidik rhCollMA biyomürekkep stoğunu nötralize etmek için bir fosfat tamponu hazırlayın.
- 50 mL deiyonize suda 5.495 g Na 2 HPO 4, 1.55 gNaH2PO4 ve 30 mg NaCl çözerek 10x fosfat tamponu stoğu hazırlayın.
- 10x fosfat tamponunun 1 parçasını 9 parça deiyonize su ile birleştirerek 10x stok fosfat tamponunun 10 kat seyreltilmesini hazırlayın.
- Asidik rhCollMA çözeltisini nötralize etmek için 900 μL stok rhCollMA çözeltisini 100 μL 10x fosfat tamponu ile birleştirin.
- Nötralize edilmiş rhCollMA çözeltisini, gerekli miktarda 1x fosfat tamponu ile karıştırarak istenen 10 mg / mL konsantrasyonuna seyreltin.
NOT: rhCollMA'nın stok konsantrasyonu lotlar arasında değişir. Bu nedenle, istenen konsantrasyona ulaşmak için gereken 1x fosfat tamponunun hacmi değişecektir. - Porojen-fotobaşlatıcı çözeltisini (PEO-LAP) seyreltilmiş nötr rhCollMA ile birleştirilecek şekilde hazırlayın.
- 10 mL DMEM'de 160 mg PEO'yu çözerek fenol kırmızısı içermeyen DMEM'de% 1.6'lık bir poli(etilen oksit) (PEO) çözeltisi hazırlayın.
- Çözeltide% 0.2 (w / v) LAP elde etmek için bu çözeltiye 20 mg lityum fenil-2,4,6-trimetilbenzoilfosfin (LAP) ekleyin. Bu noktadan itibaren, çözeltiyi alüminyum folyo ile örtün veya ışıktan korumak için karanlık bir yerde saklayın.
- PEO-LAP çözeltisini 0,22 μm'lik bir filtreden geçirerek sterilize edin. Bu çözeltiyi 4 ° C'de 1 haftaya kadar saklayın.
- Biyobaskıdan önce, nihai biyomürekkep çözeltisini elde etmek için seyreltilmiş nötr rhCollMA çözeltisini PEO-LAP çözeltisi ile 1: 1 oranında karıştırın. Hava kabarcıklarından kaçınırken çözeltileri karıştırmak için bir girdap yerine pipetleme kullanın.
- Çözeltiye çok fazla kabarcık girerse, 30 s boyunca 2.000 × g'de santrifüj yapın. Santrifüjlemeden sonra, homojenliği sağlamak için biyomürekkep çözeltisini tekrar karıştırın.
4. Granüler destek banyosu hazırlığı
- Jelatin granüler destek malzemesi hazırlayın.
- Biyolojik bir güvenlik kabininde, bir 2 g'lık liyofilize destek malzemesi tüpünün içeriğini, her biri yaklaşık 1 g içeren iki steril 50 mL konik tüpe bölün.
- Her tüpe 40 mL soğuk (4 °C) fenol-kırmızı içermeyen DMEM ekleyin ve tüm liyofilize destek malzemesi çözülene kadar kuvvetli bir şekilde vorteks yapın.
- Destek malzemesinin yeniden hidrasyonuna izin vermek için elde edilen bulamacın 4 ° C'de oturmasına izin verin.
- Kabarcıkları azaltmak için destek malzemesini bir vakum odasında 30 dakika boyunca gazdan arındırın.
- Destek malzemesini 5 dakika boyunca 2.000 × g'da santrifüj yapın. Malzemenin tüpün dibinde olduğundan ve süpernatantın net olduğundan emin olun.
- Alttaki destek malzemesini aspire etmemeye dikkat ederken, süpernatanı aspire edin.
NOT: Destek malzemesi, süpernatan çıkarıldıktan sonra tüpü eğimli hale getirirken akmamalıdır. Malzeme akarsa, aynı ayarları kullanarak ancak yeni süpernatant eklemeden tekrar santrifüj yapın.
- Hazırlanmış, sıkıştırılmış destek malzemesinin yaklaşık 4 mL'sini, pozitif deplasmanlı bir pipet kullanarak 12 delikli bir plakanın her bir kuyucuğuna aktarın. Destek malzemesini kuyuya eşit şekilde yayılmaya zorlamak için kuyu plakasına sert bir yüzeye dokunun.
NOT: Önerilen minimum destek malzemesi hacmi, içine yazdırılacak yapının hacminin 3 katıdır. - Kuyu plakasını, jelatin parçacıklarının erimesini önlemek için kullanılıncaya kadar soğutulmuş bir biyoyazıcı aşamasına veya 4 ° C'ye destek malzemesiyle birlikte yerleştirin.
5. Endotel hücrelerinin ve destek hücrelerinin biyomürekkeple birleştirilmesi
- Bazal ortamı, bir antibiyotik çözeltisi, fetal sığır serumu ve endotel hücresi büyüme takviyeleri dahil olmak üzere karşılık gelen orta kit bileşeniyle karıştırarak üreticinin talimatlarına göre endotel hücre ortamı hazırlayın.
- 500 mL düşük glukozlu DMEM, 58 mL fetal sığır serumu, 5.8 mL esansiyel olmayan amino asitler (NEAA), 5.8 mL glutamin ikamesi, 5.8 mL 1 M HEPES ve 5.8 mL penisilin-streptomisin-nistatin çözeltisini birleştirerek diş pulpası kök hücre ortamı hazırlayın.
- 10 mL endotel hücre ortamında 2 × 10 6 ZsGreen1 eksprese eden insan yağ mikrovasküler endotel hücreleri (HAMEC-ZsGreen1) ve 6 × 106 diş pulpası kök hücresi (DPSC) içeren bir süspansiyon hazırlayın.
- Bir hücre peleti elde etmek için hücre süspansiyonunu 200 × g'da 4 dakika boyunca santrifüj yapın. Süpernatant ortamı aspire edin.
- Hücre peletini daha önce hazırlanan 1 mL rhCollMA biyomürekkebinde (PEO-LAP içeren) yeniden askıya alarak, 1 mL biyomürekkep başına toplam hücre konsantrasyonu 8 × 106 hücreye sahip bir biyomürekkep elde edin.
DİKKAT: Biyomürekkebi hücrelerle birleştirdikten sonra, hemen bir sonraki adıma geçin. Hücreler süspansiyonda uzun süre bırakılırsa, hücreler tüpün dibine batar ve canlılıkları bozulur. Hücreleri içermeyen deneyler için, Adım 5.1-5.5'i atlayın veya basılı yapıların gelişmiş mikroskobik görselleştirmesi için hücreler yerine biyomürekkeple floresan boncukları dahil edin. - Hücreler-biyomürekkep karışımını baskı kartuşlarına aktarın.
- 3 mL amber yazıcı kartuşuna 0,22 mm dahili çaplı bir iğne takın ve kartuşu 50 mL'lik konik bir tüpe yerleştirin.
- Kabarcıkları azaltmak için pozitif yer değiştirmeli bir pipet kullanarak 1 mL hücre-biyomürekkep karışımını üstten doldurarak yazıcı kartuşuna aktarın.
- Yazıcı kartuşunu biyoyazıcıdaki uygun araca takın.
6. rhCollMA biyomürekkep kullanarak mikrovasküler ağların biyobaskısı
- Biyobaskılı mikrovasküler ağ için bir 3B CAD tasarımı oluşturun.
- Merkezinde 2 mm çapında dairesel bir kanal içeren 4 mm'lik bir karenin 2B desenini çizin. Merkezi kanallı 4 mm x 4 mm x 4 mm küp elde etmek için çizimi 4 mm ekstrüzyon yapın. Bu nesneyi . STL dosyası.
- 12 kuyulu bir plaka ithal edin. STL şablonu, biyoyazıcı dilimleme yazılımındaki katı modelleme sekmesine yerleştirin ve sanal baskı yatağının belirlenen alanına yerleştirin.
- . Küp şeklinin STL dosyası, biyoyazıcı dilimleme yazılımındaki katı modelleme sekmesine yerleştirilir. Harici dilimleyici kullan onay kutusuna tıklayın | nesne özellikleri bölümünün altında dilimleyiciyi yapılandırın. Açılır pencerede, dolgu deseni için doğrusal bir desen seçin ve dolgu yoğunluğuna %30 yazın. Kabul et'i tıklayın.
- Küp şeklinin bir kopyasını, küpe tıklayarak ve fareyi kullanarak hareket ettirerek istediğiniz her sanal kuyucuğa yerleştirin.
- Malzeme ekle düğmesini tıklatarak biyoyazıcı dilimleme yazılımının malzemeler sekmesinde rhCollMA bioink için yeni malzeme ayarları oluşturun. Yazdırma için malzemenin ayarlarını seçin. Basınç için, ilgili kutuya 2 psi yazın. Hız için, ilgili kutuya 20 mm/s yazın.
NOT: Her biyomürekkep malzemesinin, uygulamadaki malzeme listesine kaydedilebilen kendi farklı yazdırma ayarları vardır. - Çizgi genişliği ve çizgi yüksekliği değerlerini 0,24 mm'ye ve ivme değerini 400 mm/s2'ye atayın, bu değerleri ilgili kutulara yazın.
- Katı modelleme sekmesinde, küp nesnesine tıklayın ve ardından küp şekline atamak için malzemeler bölümünden rhCollMA malzemesine tıklayın. Biyomontaj sekmesinde, yazdırma işini biyoyazıcıya göndermek için yazdırma işini gönder düğmesine tıklayın.
- Hücresel biyomürekkeple yüklü baskı kartuşunu, 3D ekstrüzyon tabanlı biyoyazıcının 3 mL ortam pnömatik dağıtım aracına yükleyin.
- Bioprinter arabirim ekranındaki Kontrol-Isıtma/Soğutma sekmesinin altındaki soğutma düğmesine tıklayarak baskı yatağı sıcaklığını 4 °C'ye ayarlayın. Plakayı yazıcı yatağındaki destek banyosuyla yükleyin.
NOT: Malzemenin baskı basıncı ve hızı ayarları, ortam sıcaklığındaki farklılıklar veya biyomürekkep toplu iş değişkenliği nedeniyle değişebilir. Örneğin, soğuk günlerde, aynı miktarda malzemeyi ekstrüzyon yapmak için daha yüksek bir basınç veya daha yavaş bir hız gerekir. - Biyoyazıcı arabirimi ekranındaki yazdır sekmesinde, Adım 6.7'de gönderilen yazdırma işini tıklatın. tıklayın ve yazdırma işine başlamak için başlat | gidin'i tıklatın.
- Baskıdan sonra, rhCollMA biyomürekkebinin çapraz bağlanmasını başlatmak için kuyu plakasını 30 s boyunca 3 mW /cm2 yoğunluğa sahip 405 nm ışık kaynağına maruz bırakın.
- Çapraz bağlamadan sonra, kuyu plakasını 37 ° C'de ve% 5 CO2'de , tüm destek banyosu eriyene kadar en az 20 dakika boyunca inkübe edin.
- Sıvılaştırılmış destek banyosunu nazikçe aspire edin ve endotel hücre ortamı ile değiştirin. Sonraki adımlarda kullanana kadar yapıları 37 °C ve %5 CO2'de inkübe edin.
NOT: Baskıyı takiben yapının büzülmesi nedeniyle, montaj Adım 7'nin Adım 6 ile aynı gün yapılması önerilir.
7. Mühendislik vaskülarize flebi elde etmek için biyobaskılı mikrovasküler ağın vasküler iskele ile birleştirilmesi
- Biyobaskılı mikrovasküler ağın destek malzemesinin çıkarılmasından hemen sonra, biyobaskılı yapının ana kanalına fibronektin kaplı bir PLLA: PLGA vasküler iskele yerleştirin.
- Montajlı yapıları 2 gün boyunca 37 ° C'de ve% 5 CO2'de inkübe edin.
- Vasküler iskelenin lümenini endotel hücreleri ile hizalayın.
- TdDomates eksprese eden insan yağ mikrovasküler endotel hücrelerinin (HAMEC-tdDomates) hücre süspansiyonunu 1 × 107 hücre / mL konsantrasyonunda hazırlayın.
- Bu hücre süspansiyonunun 20 μL'lik bir damlacığını hidrofobik bir yüzeye (yani, doku dışı bir kültür [TC olmayan] 10 cm'lik bir kab) yerleştirin.
- Vasküler iskeleleri damlacığın üzerine yavaşça yerleştirin, böylece bir ucundaki iskelenin lümeni hücre damlacığı ile temas eder.
- Damlacığı iskelenin karşı ucundan (yani, damlacıkla temas etmeyen uçtan) aspire edin, lümenini hücre süspansiyonu ile doldurun.
- Tohumlanmış iskeleyi bir mikrosantrifüj tüpüne yerleştirin ve 60 dakika boyunca nemlendirilmiş bir inkübatörün içindeki bir rotatöre koyun. Daha sonra, iskeleyi 12 delikli bir plakaya aktarın ve 2 mL endotel hücre ortamı ekleyin.
- Kültür, mühendislik fleplerini 7 gün boyunca şekillendirirken, her 2 günde bir besiyeri taze endotel hücre ortamı ile değiştirir.
8. Konfokal mikroskopi ve mühendislik fleplerinin immünofloresan boyanması
- 4 gün ve 7 günlük kültürden sonra, konfokal lazer tarama mikroskobu kullanarak monte edilmiş iskelelerin canlı hücre görüntülemesini gerçekleştirin.
- Mikroskop görüntü yakalama yazılımında ZsGreen1 ve tdDomates floresan proteinleri için floresan kanallarını tanımlayın.
- 0,5x yakınlaştırmalı (piksel boyutu 5 μm) 5x/0,16 objektif bir lens seçin ve her biri 41 μm kalınlığa sahip 22 dilimli bir Z-yığını tanımlayın.
- Tüm yapıyı görüntülemek ve yakalamak için 3 x 2 karo taraması tanımlayın.
- Doygunluk olmadan ve minimum arka plan olmadan net bir floresan sinyali elde etmek ve görüntüleri elde etmek için lazer yoğunluğunu ayarlayın ve değerler kazanın.
- Mikroskop görüntü alma yazılımını veya benzer görüntü analiz yazılımını kullanarak tek bir 2D görüntü elde etmek için edinilen Z-yığınının maksimum yoğunlukta bir projeksiyonunu gerçekleştirin.
- İlgilenilen bir bölgenin daha yüksek büyütmeli görüntülemesini gerçekleştirin.
- 0,5 yakınlaştırmalı (piksel boyutu 1,25 μm) 10x/0,3 objektif lense geçin ve 9 dilim kalınlığında 41 μm kalınlığında bir Z-yığını tanımlayın.
- 8.2.-8.3 Adımlarını gerçekleştirin.
- 7 günlük kültürden sonra, mühendislik kapaklarını 20 dakika boyunca% 4 paraformaldehit içine batırarak sabitleyin.
- Yapıları PBS ile 3x 5 dakika yıkayın.
- PBS'de% 0.3 (v / v) Triton-X'i yapılara ekleyin ve hücreleri geçirgenleştirmek için oda sıcaklığında 15 dakika inkübe edin.
- Yapıları PBS ile 3x 5 dakika yıkayın.
- PBS'de% 5 (w / v) sığır serum albümini (BSA) çözerek bir blokaj çözeltisi hazırlayın. Blokaj solüsyonunu mühendislik kapaklarına ekleyin ve oda sıcaklığında 1 saat inkübe edin.
- SMA eksprese eden destek hücrelerini boyamak için daha önce hazırlanan% 5 BSA çözeltisinde fare anti-düz kas aktinini (anti-SMA) 1:50 antikoru seyrelterek birincil antikor çözeltisini hazırlayın.
- İskeleleri birincil antikor çözeltisinde gece boyunca 4 ° C'de inkübe edin.
- PBS ile 3x 5 dakika yıkayın.
- PBS'de Cy3-konjuge keçi anti-fare IgG 1:400 antikoru ve 4',6-diamidino-2-fenilindol (DAPI, 2.5 μg / mL) seyrelterek ikincil antikor çözeltisini hazırlayın.
- İkincil antikor çözeltisini iskelelere uygulayın ve oda sıcaklığında 3 saat inkübe edin.
- PBS ile 3x 5 dakika yıkayın.
- Yapıları PBS'de 4 °C'de 1 aya kadar saklayın.
- Lekeli iskeleleri konfokal lazer tarama mikroskobu kullanarak görüntüleyin.
- Mikroskop görüntü yakalama yazılımında üç floresan kanalı (DAPI, ZsGreen ve Cy3) tanımlayın.
- Toplam kalınlığı 50 μm'ye yayılan 2 μm kesit kalınlığına sahip bir Z-yığını tanımlayın. Ardından, yapının daha büyük alanlarını görüntülemek için bir döşeme taraması tanımlayın.
- Doygunluk olmadan ve minimum arka plan olmadan net bir floresan sinyali elde etmek için alma parametrelerini ayarlayın.
- 1,0x yakınlaştırma (piksel boyutu 0,31 μm) ile 20x/0,8 hedef kullanarak görüntüleri elde edin.
- Mikroskop görüntü alma yazılımını veya benzer görüntü analiz yazılımını kullanarak tek bir 2D görüntü elde etmek için edinilen Z-yığınının maksimum yoğunlukta bir projeksiyonunu gerçekleştirin.
9. Bir manşet tekniği kullanarak mühendislik flebinin doğrudan bir sıçanın femoral arterine anastomoz edilmesi
- Aşağıdaki cerrahi aletleri hazırlayın ve sterilize edin (otoklav): No. 15 neşter, bir çift ince dişli forseps ve küçük bir çift halka saplı makas. Ek olarak, aşağıdaki mikrocerrahi aletleri hazırlayın ve sterilize edin: düz ince sivri uçlu No. 3 kuyumcu forsepsleri, açılı bir kuyumcu forsepsleri, kavisli çeneli yuvarlak saplı bir iğne tutucu, bir çift damar dilatörü, disseksiyon makasları, adventitia makasları ve aplikatörleriyle damar kelepçeleri.
- 5 mL stok heparin çözeltisini 195 mL salin ile seyrelterek 100 IU / mL heparinize salin çözeltisi hazırlayın.
- Poliimid manşetleri kesin ve sterilize edin.
- Diseksiyon mikroskobu altında bir poliimid tüpün 2,5 mm'lik bölümlerini kesin.
- Her bölümün bir ucunda, bir manşet sapı elde etmek için tüpün duvarında 1.25 mm'lik uzunlamasına bir kesi yapın. Damar sapmasını kolaylaştırmak için tüpün diğer ucunda açılı bir kesim yapın.
- Manşetleri% 70 etanol içine batırın, ardından heparinize salin ile iki yıkama yapın.
- Ameliyat için bir erkek Sprague-Dawley sıçanı (275-350 g) hazırlayın.
- Ameliyattan yedi gün önce, bağışıklık baskılanmasını sağlamak için deri altı günlük siklosporin dozu (10 mg kg-1) uygulamaya başlayın.
- Ameliyattan önce, bir indüksiyon odası kullanarak kurumsal SÇP'ye göre %3 izofluran inhalasyonu kullanarak hayvanı uyuşturun. Her iki ayağı da sıkıştırarak ve refleksleri kontrol ederek derin anesteziyi doğrulayın.
- Subkutan dozda analjezik buprenorfin (0.03 mg kg-1) ve antikoagülatif heparin (200 IU kg-1) uygulayın.
- Dehidrasyonu önlemek için hayvanın gözlerine yağlayıcı bir göz merhemi uygulayın.
- Sıçanın cerrahi bölgesini tıraş edin ve bölgeyi iyot ve% 70 etanol ile dezenfekte edin. Yapışkan bant kullanarak hayvanın uzuvlarını masaya sabitleyin.
- Ortak femoral arteri açığa çıkarın ve izole edin.
- Bacak ve karın arasındaki konkavite boyunca deriden 2 cm uzunluğunda, eğik bir kesi yapın.
- Forseps ve künt uçlu makas kullanarak, kasık yağ yastığını görselleştirmek için cildi altta yatan dokudan serbest bırakın.
- Makas ve forseps kullanarak, üst, medial ve alt kenar boşluklarının etrafındaki yağ yastığını kesin. Yağ yastığının altındaki büyük damarları kesmemeye dikkat edin.
- Yağ yastığını yanal olarak yansıtın ve epigastrik damarları sağlam bırakın. Kurumasını önlemek için yansıyan yağ yastığına ıslak bir gazlı bez yerleştirin ve yerine sabitleyin. Ortak femoral damarların görünür olduğundan emin olun.
NOT: Yağ yastığı daha sonra anastomozlara yumuşak basınç uygulamak için kullanılacaktır. - Femoral arteri inguinal ligamentten epigastrik arter dallanma noktasına distal olarak kılıfından çıkararak maruz bırakın.
DİKKAT: Genellikle altında çalışan femoral arterin bir dalı vardır, genellikle Murphy dalı olarak adlandırılır. Bu görülmesi zor dala zarar vermemeye dikkat edin. - Murphy'nin dalını bağlayarak bölün ve ardından femoral arteri, arterin ortasındaki 1 mm aralıklı iki ligatür ile bağlayın. Ligatür süderinin bir ucunu, damar ucunu manşetten çekmek için daha sonra kullanmak üzere uzun tutun.
- Adventitia makası kullanarak iki ligatür arasındaki arteri kesin.
DİKKAT: Bu kesimi yaparken kanama olmamalıdır. Arteriyel uç kanarsa, arteri kelepçeleyin ve bir ligatürü tekrar uygulayın. - Ligatür süderinin uzun ucunu kullanarak, her bir damar ucunu önceki adımda hazırlandığı gibi bir poliimid manşete yerleştirin, böylece iki manşetin tutamaçları birbirinden uzağa bakacak şekilde yerleştirilir.
- Yerleştirdikten sonra, manşet sapına ve kaba aynı anda bir kelepçe uygulayın ve manşeti yerine sabitleyin.
- 27 G iğne ile donatılmış bir şırıngada heparinize bir salin çözeltisi hazırlayın.
- Bağlı damar ucunu çekin ve ligatüre yakın kesin. Hemen damar ucunu heparinize salin ile lümende kan görünmeyene kadar iyice yıkayın.
DİKKAT: Damar ucunun iyice yıkandığından emin olun, çünkü içeride kalan herhangi bir kan, prosedürü tamamladıktan sonra kan dolaşımına sokulacak bir pıhtı oluşturacaktır. Bu, damarın tıkanmasına ve bacağa perfüzyon kaybına neden olabilir. - Geminin lümenini bir elinizle kılıfından tutarak ve diğer elinizle damar dilatörüyle lümenini genişleterek genişletin.
- Manşet gövdesinin etrafına gevşek bir 6-0 polipropilen çevresel dikiş yerleştirin. Damar, manşet gövdesi üzerinde iki damar dilatörü kullanarak sona erer ve çevresel sütürü sıkarak yerine sabitler.
NOT: Manipülasyonlar sırasında kelepçelenmiş damardan herhangi bir kan sızarsa, lümeni heparinize salin ile iyice yıkayın. - Mühendislik kapağını heparinize salin ile durulayın ve ardından damar kaplı manşeti vasküler iskelenin lümenine yerleştirin. İskele ve manşet gövdesinin etrafına çevresel 6-0 polipropilen dikiş yerleştirerek iskeleyi yerine sabitleyin. Bu adımı vasküler iskelenin her iki tarafı için yapın.
- Mühendislik kapağını çevreleyen dokudan izole etmek için anastomoz bölgesinin etrafına 0,2 μm'lik bir polistiren membran filtresi sarın.
- Önce distal kelepçeyi serbest bırakın; Daha sonra, damardaki kan akışını yeniden sağlamak için proksimal kelepçeyi serbest bırakın.
- Anastomozlardan herhangi bir kanamayı durdurmak için, yağ yastığını femur damarlarının üzerine geri yansıtın ve 3 dakika boyunca steril bir gazlı bez kullanarak hafif bir basınç uygulayın.
- Yağ yastığını 6-0 polipropilen kullanarak tekrar yerine dikiştirin; Daha sonra 5-0 PGA emilebilir dikiş kullanarak cildi dikin.
- Yara bölgesini salin ile temizleyin ve iyot çözeltisi uygulayın.
- Postoperatif ağrı ve hayvan yönetimi için, içme suyunda% 0.1 (v / v) tramadol hazırlayın. Ayrıca, günlük bir heparin (200 IU kg-1) ve siklosporin (10 mg kg-1) dozu uygulayın.
- Hayvanı bir ısıtma lambasının altına yerleştirilmiş temiz bir kafese yerleştirin. Sternal yatışlığı korumak için yeterli bilinci yeniden kazanana kadar hayvanı izlemeye devam edin.
Sonuçlar
Bu protokol, mezoölçek ve mikro ölçekli vaskülatürler elde etmek için bir araya getirilen vasküler bir iskele (Şekil 1Ai) ve biyobaskılı bir mikrovaskülatürden (Şekil 1Aii) oluşan mühendislik ürünü bir flebin imalatını açıklamaktadır (Şekil 1Aiii). Protokolü takiben, vasküler iskelenin BVOH kalıpları tasarlanmış ve 3D baskı yapılmıştır (Şekil 1B, C). Elde edilen basılı yapılar, kalıpların boş alanlarında bulunabilecek küçük BVOH iplikçikleri için görsel olarak incelenmiştir (Şekil 1D). Bu teller genellikle yanlış malzeme ayarlarını veya BVOH'un nemi emdiğini gösterir. Bu teller, kalıbın eksik doldurulmasına ve ortaya çıkan vasküler iskelede yapısal kusurlara yol açabileceğinden çıkarılmalıdır. Daha sonra, kalıplar PLLA: PLGA çözeltisi ile dolduruldu, ardından protokolde açıklandığı gibi dondurarak kurutma işlemi ve yıkama adımları takip edildi. Elde edilen PLLA:PLGA vasküler iskele, damar duvarı bütünlüğünü ve lümen açıklığını doğrulamak için görsel olarak incelendi (Şekil 1E).
10 mg / mL konsantrasyonunda nötralize edilmiş bir rhCollMA biyomürekkebi hazırlandı ve PEO: LAP çözeltisi ile 1: 1 oranında birleştirildi. Zs-Green1 ve diş pulpası kök hücreleri ile etiketlenmiş insan yağ mikrovasküler endotel hücreleri rhCollMA biyomürekkebi ile yeniden askıya alındı ve çözelti bir yazıcı kartuşuna ve yazıcıya yüklendi. Doğrusal desenli merkezi kanallı kutu şekilleri (Şekil 1D) jelatin destek banyosunun içine biyo-baskılanmıştır. Baskıyı takiben, yapılar çapraz bağlandı ve destek banyosu çözüldü ve yıkandı. 4 günlük kültürden sonra, mikrovasküler ağın kendi kendine montajını kontrol etmek için yapılar canlı olarak görüntülendi. Şekil 1D, biyobaskılı yapıda oldukça gelişmiş bir HAMEC-ZsGreen1 mikrovasküler ağın bir örneğini göstermektedir.
Daha sonra, fibronektin kaplı bir vasküler iskele, basılı yapının merkezi kanalına yerleştirildi (Şekil 2A). Toplanan yapılar, hücrelerin jeli büzüştürdüğü ve vasküler iskeleye sıkıca tutturulduğu 2 gün boyunca kültürlendi. Daha sonra, vasküler iskele, protokole göre tdTomato'yu ifade eden HAMEC'lerle kaplandı. 7 günlük kültürden sonra, yapılar sabitlendi ve görüntülendi. Şekil 2B, biyobaskılı mikrovaskülatürdeki endotel hücrelerinin yeşil renkle tasvir edildiği, vasküler iskelenin endotel astarının kırmızı renkte tasvir edildiği birleştirilmiş yapıların yan görünümünü göstermektedir. Görüntü, biyobaskılı jelde yeşil bir mikrovasküler kendi kendine montajı gösterirken, vasküler iskele kırmızı endotel hücreleri ile kaplıdır. Daha yüksek büyütme ile kırmızı endotel astarından kaynaklanan filizlerin biyobaskılı mikrovasküler ağ ile filizlenme ve anastomoz yaptığı görülmektedir (Şekil 2C). Daha sonra, yapılar diş pulpası kök hücreleri için bir belirteç olarak α-düz kas aktinine (SMA) boyandı. İmmün boyama işlemini takiben, yapılar lazer taramalı bir konfokal mikroskop kullanılarak görüntülendi (Şekil 2D).
Son olarak, 7 günlük kültürden sonra, mühendislik flepleri, protokolde açıklandığı gibi, bir sıçanın femoral arterine mikrocerrahi olarak anastomoz edildi. Temsili bir prosedürün videosu Ek Video S1'de görülebilir. Şekil 2E , kelepçenin çıkarılmasından önce tamamlanmış bir anastomozun temsili bir görüntüsünü gösterir ve Şekil 2F , kelepçe çıkarılması ve hemostazdan sonra anastomoz bölgesinin temsili bir görüntüsünü gösterir. Yara kapanmadan önce gözle görülür bir kanama olmamalıdır.
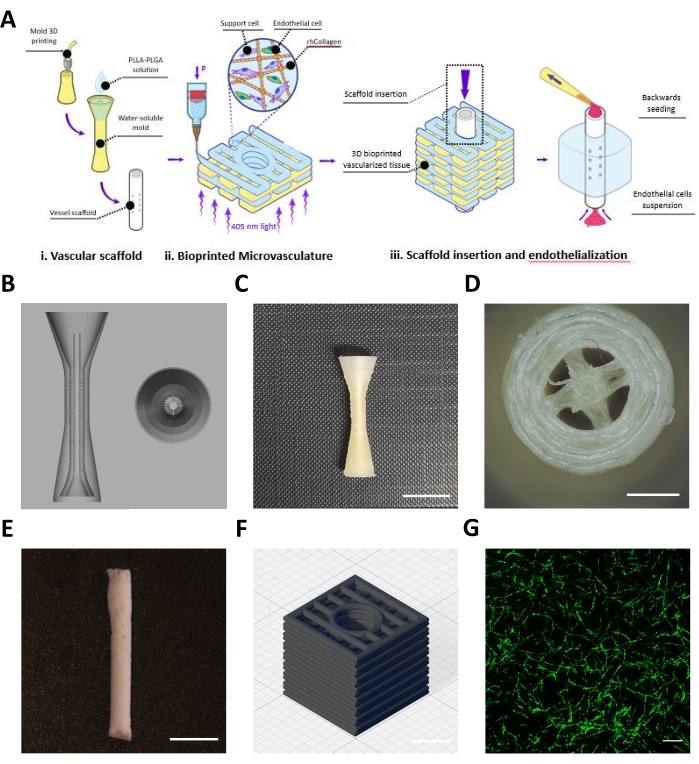
Resim 1: Fabrikasyon mezo ve mikro ölçekli gemilerin temsili görüntüleri. (A) Protokolün adımlarına şematik genel bakış. İzinle çoğaltılmıştır16. (B) Vasküler iskelenin kurban kalıbı için CAD tasarımı. (C) Temsili bir 3D baskılı kurban kalıbının yandan görünümü (ölçek çubuğu = 0,5 mm). (D) Kurban kalıbının üstten görünümü (ölçek çubuğu = 0,5 mm) (E) Tanımlayıcı protokol kullanılarak imal edilen temsili vasküler iskele (ölçek çubuğu = 5 mm). (F) 3D biyobaskılı rhCollMA mikrovasküler ağı için CAD tasarımı. Izgara çizgileri = 1 mm. (G) HAMEC-ZsGreen1'i yeşil renkte gösteren oldukça gelişmiş bir biyobaskılı vasküler ağın temsili görüntüsü. Ölçek çubuğu = 200 μm. Kısaltmalar: CAD = bilgisayar destekli tasarım; rhCollMA = rekombinant insan kollajen metakrilat; HAMEC = insan yağ mikrovasküler endotel hücreleri; PLLA = poli-L-laktik asit; PLGA = polilaktik-ko-glikolik asit. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 2: Birleştirilmiş vaskülarize flebin temsili görüntüleri . (A) Biyobaskılı mikrovaskülatür ve vasküler iskelenin temsili bir montajının fotoğrafı. Ölçek çubuğu = 1 mm. (B) Vasküler iskelenin endotel kaplamasından 4 gün sonra görüntülenen temsili mühendislik flebinin yandan görünümü. Biyobaskılı mikrovaskülatür yeşil (HAMEC-ZsGreen1) ile gösterilirken, endotel astarı kırmızı (HAMEC-tdDomates) ile gösterilmiştir. Ölçek çubuğu = 1 mm. (C) Biyobaskılı vaskülatür ile kırmızı renkte endotel astarı arasındaki anastomozların temsili görüntüsü. Ölçek çubuğu = 200 μm. (D) 7 günlük inkübasyondan sonra düz kas aktinini (kırmızı), çekirdekler (mavi) ve endotel hücreleri (yeşil) için immün boyamanın temsili görüntüsü. Ölçek çubuğu = 0.1 mm. (E) Kelepçe çıkarılmadan önce ve (F) kelepçe çıkarıldıktan sonra bir sıçanın femoral arteri ile mühendislik flebinin tamamlanmış bir anastomozunun temsili görüntüsü. Kısaltmalar: HAMEC = insan yağ mikrovasküler endotel hücreleri; SMA = düz kas aktin; DAPI = 4',6-diamidino-2-fenilindol. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Video S1: Vasküler iskelenin bir sıçanın femoral arterine anastomoz edilmesi için temsili mikrocerrahi prosedür. Bu videoyu indirmek için lütfen tıklayınız.
Tartışmalar
Vaskülarize dokuların mühendisliği, doku mühendisliğinin ana zorluklarından biridir20. Mühendislik vasküler dokusu oluşturmak için mevcut yöntemler, kendinden montajlı mikrovaskülatür 21,22,23 oluşturmaya veya mezoölçekli vasküler iskeleler24,25 üretmeye odaklanır ve implantasyondan hemen sonra ve doğrudan perfüze edilebilen hiyerarşik vaskülatür sistemini yeniden yaratmaya odaklanmaz26 . Bu çalışmada, mikro ölçekli ve mezoölçekli vaskülatürlerden oluşan hiyerarşik bir damar ağı oluşturmak için iki 3D baskı yönteminden yararlanan bir protokolü açıklıyoruz. Protokol, 3D biyobaskılı, kendinden montajlı bir mikrovasküler ağı mezoölçekli bir vasküler iskele ile birleştirerek implante edilebilir, vaskülarize bir flep elde eder. Ayrıca, bu makale bu flebi bir sıçanın femoral arterine doğrudan anastomoz etmek için bir protokol sunmaktadır.
3D biyobaskı, geleneksel doku mühendisliği tekniklerine göre çok yönlülüğü nedeniyle son yıllarda ilgi kazanmıştır. Bu protokol, rhCollMA biyomüktüründe mikrovasküler bir ağın oluşumunu tanımlarken, kullanılan yöntemler, çalışılan ve yeni biyomürekkeplerin bolluğundan ve destek banyolarından27,28'den diğer birçok biyoinkte birkaç değişiklikle uygulanabilir. İnsan ECM'sindeki tip I kollajen bolluğu nedeniyle rhCollMA'yı biyomürekkep olarak kullanmayı seçtik ve hücre bağlanması için uygun bir ortam sağladık. Ayrıca, bitkilerde rekombinant olarak üretilir ve fotopolimerizasyona ve kararlı 3D hidrojellerin oluşumuna izin veren metakrilat grupları ile daha da modifiye edilir29,30. Fotoçapraz bağlama, toksik olmadığı gösterilen ve 405 nm mavi ışığa maruz kalarak aktive olan ve UV ışığının olası fototoksisitesini azaltan fotobaşlatıcı LAP'nin eklenmesiyle elde edildi. Bununla birlikte, ışığa duyarlı biyomürekkeplerin kullanımı, biyomürekkebin ve destek malzemesinin hazırlanması için fenol kırmızısı içermeyen bir kültür ortamının kullanılmasını gerektirir. Ayrıca, protokol, rhCollMA gibi biyomürekkeplerin yüksek doğrulukta ekstrüzyonunu sağlayan jelatin destek malzemesinin kullanımını açıklamaktadır. Bu nedenle, hazırlanması ve yazıcı yatağının soğutulması sırasında soğuk ortamın kullanılmasını sağlamak çok önemlidir. Çapraz bağlama için kullanılan ışık kaynağı veya yüksek ortam sıcaklıkları nedeniyle aşırı ısınma meydana gelebilir.
Burada biyobaskılı mikrovasküler ağı oluşturmak için ekstrüzyon tabanlı bir biyoyazıcı kullanılmıştır ve şu anda benzer yapılar üretebilen birçok ticari biyoyazıcı bulunmaktadır. Ayrıca, önerilen yöntemler farklı geometrileri, boyutları ve dolgu desenlerini incelemek için kolayca değiştirilebilir ve uygulanabilir. Bu çalışmada, birbirine bağlı gözenekler oluşturmak için doğrusal bir dolgu deseni seçildi ve bu, yüksek doğrulukla nispeten hızlı bir şekilde basılabilir.
Hava kabarcıkları, ekstrüzyon biyobaskısında, özellikle de destek malzemelerinin içinde önemli bir zorluk yaratmaktadır. Bu nedenle, destek malzemesinin transferi, biyomürekkep hücresi süspansiyonunun hazırlanması ve bunların yazıcı kartuşlarına aktarılması için pozitif yer değiştirmeli pipetler kullanarak bu kabarcıkların varlığını ve oluşumunu en aza indirmek çok önemlidir.
Bu çalışmada, insan adipoz kaynaklı endotel hücreleri ve diş pulpası kök hücreleri, hastalardan nispeten kolay izole edilmeleri nedeniyle destekleyici hücre olarak kullanılmıştır. Ayrıca, toplam 8 x 106 hücre / mL hücre konsantrasyonu seçilmiştir, çünkü bu konsantrasyonun en gelişmiş vasküler ağları oluşturduğu gösterilmiştir16. Bu protokol, farklı hücre tipleri ve kaynakları ile farklı biyomürekkepler kullanarak mikrovaskülatür üretmek için kullanılabilirken, mikrovasküler ağın gelişimi için en iyi koşulları oluşturmak için hücre konsantrasyonunun kalibrasyonu yapılmalıdır. Ayrıca, dokuya özgü hücreler (yani, miyoblastlar veya osteoblastlar), dokuya özgü vaskülarize flepler elde etmek için biyomürekkebe dahil edilebilir.
Gözenekli vasküler iskelenin kalıbı, ticari olarak temin edilebilen bir ekstrüzyon 3D yazıcıda 3D baskılı suda çözünür malzeme kullanılarak üretildi. Bu, hızlı prototipleme platformlarına dayanan uygun maliyetli bir teknikle sonuçlanır, böylece birçok farklı geometri ve boyuttaki vasküler iskeleler incelenebilir ve hızlı bir şekilde taranabilir31. Bununla birlikte, bu yöntemin bir sınırlaması, çoğu 3D yazıcının çözünürlük sınırıdır32. Bununla birlikte, eklemeli üretimi çevreleyen hızla gelişen endüstri ile birlikte, bu sınırların zamanla iyileşmesi beklenmektedir. İmalat işlemi için organik çözücülerin kullanılması, protokolün bir başka sınırlamasıdır, çünkü çoğu organik çözücü hücreler için toksiktir ve biyobaskı prosedürünü vasküler iskele üretim süreci ile birleştirme yeteneğini önler.
İskelenin lümenini, hücre süspansiyonunu itmek yerine aspirasyon kullanarak tohumlamanın tarif edilen yöntemi, tohumlanmış hücrelerin lokalizasyonu üzerinde büyük etkilere sahiptir. Negatif basınç kullanmak, iskelenin iç lümeninin endotelizasyonuna izin verirken, hücre süspansiyonunun iskelenin duvarındaki deliklerden dökülmesini en aza indirir16.
Mikrocerrahi anastomozlar için tarif edilen "manşet" yöntemi, farklı vasküler iskele materyallerine veya boyutlarına, ayrıca çok çeşitli hayvan modellerinde farklı arterlere ve damarlara kolayca değiştirilebilir ve uyarlanabilir. Protokole adaptasyonlar farklı poliimid tüp boyutlarını ve dikiş boyutlarını içerecektir. Bu yöntem, kusurların gelişmesine yol açabilecek iskele duvarının delinmesini gerektirmez. Bu çalışma, birçok uygulamaya genişletilebilen bir protokol sunar. Mezo ve mikro ölçekli vaskülatürlerin imalatı ile bunların montajı ve implantasyonunu içeren bu protokolün kritik yönleri, hem rekonstrüktif uygulamalar hem de vasküler ve diğer doku mühendisliği çalışmaları için mühendislik fleplerinin kritik yönlerini temsil etmektedir.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Bu proje, Avrupa Birliği'nin Horizon 2020 Araştırma ve İnovasyon Programı (hibe anlaşması no. 818808) kapsamında Avrupa Araştırma Konseyi'nden (ERC) finansman almıştır. rhCollMA, CollPlant (Rehovot, İsrail) tarafından cömertçe sağlanmıştır. Yazarlar, hayvan bakımı konusundaki yardımları için Technion'un Klinik Öncesi Araştırma Otoritesi'ne, Janette Zavin, Galia Ben David ve Idan Redenski'ye teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,4-Dioxane | Biosolve Chemical | 42405 | |
| 27 G x 0.5" blunt tip dispensing needles | CML supply | 901-27-050 | |
| 3cc amber syringe barrel & piston set | Nordson EFD | 7012085 | Amber syringes used to block light and prevent premature crosslinking |
| 5-0 AssuCryl PGA absorbale suture | Assut Sutures | Absorbable sutures used for skin wound closure | |
| 6-0 polypropelene sutures | Assut Sutures | 9351 | |
| Acland clamps | S&T | B-1V | |
| Adventitia scissors | S&T | SAS-15 | |
| Angled no.3 jeweler's forceps | S&T | JFAL-3-18 | |
| BioAssemblyBot 400 3D Bioprinter | Advanced Solutions | a 6-axis 3D bioprinter | |
| Bovine albumin serum Probumin | Millipore | 82-045-1 | |
| Buprenorphine | vetmarket | B15100 | |
| BVOH filament | Verbatim | 55903 | a water-soluble 1.75 mm diameter filament |
| Clamp applying forceps | S&T | CAF-4 | |
| Dental pulp stem cells | Lonza | PT-5025 | |
| Dietrich bulldog clamps | Fine Science Tools (FST) | 18039-45 | |
| di-Sodium hydrogen phosphate (Na2HPO4) | Carlo Erba Reagents | 480141 | |
| Dissection scissors | S&T | 18039-45 | |
| DMEM, High Glucose, No Phenol Red | Sartorius | 01-053-1A | |
| Duratears | Alcon | DJ03 | |
| ECM media + bullet kit | Sciencell | #1001 | |
| Ethanol 96% | Gadot-Group | 64-17-5 | |
| GlutaMAX | Gibco | 35050061 | glutamine substitute |
| Goat anti-mouse Cy3 antibody | Jackson | 115-166-072 | |
| Heparin Sodium 5,000 I.U./mL | Panpharma | - | |
| Human adipose microvascular cells | Sciencell | #7200 | |
| Human fibronectin | Sigma | F0895-5MG | A stock concentration of 1 mg/mL |
| Isoflurane, USP Terrell | Piramal Critical Care | NDC 66794-011-25 | |
| LifeSupport | Advanced Biomatrix | 5244 | a gelatin support slurry for FRESH 3D bioprinting |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | |
| Low-glucose DMEM | Biological Industries | 01-050-1A | |
| MICROMAN E M1000E, 100-1,000 µL | Gilson | FD10006 | |
| Mouse anti-SMA antibody | Dako | M0851 | |
| NEAA | Gibco | 11140068 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Paraformaldehyde solution 4% in PBS | ChemCruz | SC-281692 | |
| Penicillin-Streptomycin-Nystatin Solution | Biological Industries | 03-032-1B | |
| Phospate buffered saline (PBS) | Sigma | P5368-10PAK | |
| Poly(ethylene oxide), M.W. 250,000 to 400,000 | Acros Organics | 178602500 | |
| Poly(L-lactic acid), IV 5.0 dl/g (PLLA) | Polysciencse, Inc. | 18582-10 | |
| Polyimide tubing, ID: 0.0249", OD: 0.0273" | Cole-Parmer | 95820-05 | A thin-walled tube used to fabricate cuffs for microsurgical anastomoses |
| Prusa I3 MK2.5 3D Printer | Prusa Research | http://www.prusa3d.com/ | a popular commercial 3D printer |
| Resomer RG 503 H, Poly(D,L-lactide-co-glycolide) (PLGA) | Evonik Industries | 719870 | |
| rhCollMA | CollPlant | https://collplant.com/ | generously provided by CollPlant (Rehovot, Israel) |
| round-handled needle holder | S&T | B-15-8 | |
| Scalpel handle - #3 | Fine Science Tools (FST) | 10003-12 | |
| small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Sodium Chloride | Biosolve Chemical | 19030591 | |
| Sodium Phosphate dibasic (NaH2PO4) | Riedel-de Haen | 4276 | |
| Solidworks | Dassault Systems | CAD software | |
| Straight no.3 jeweler's forceps | S&T | JF-3-18 | |
| Straight serrated forceps | Fine Science Tools (FST) | 11050-10 | |
| Surgical Scalpel Blade No.15 | Swann-Morton Limited | 305 | |
| Triton-X 100 | BioLab LTD | 57836 | |
| TSIM | Advanced Solutions | 3D slicing and design software for the BioAssembly Bot | |
| Vessel dilator | S&T | D-5a.1 | |
| Zeiss Tivato 700 surgical microscope | Zeiss |
Referanslar
- Wallace, C. G., Wei, F. -C. C. The current status, evolution and future of facial reconstruction. Chang Gung Medical Journal. 31 (5), 441-449 (2008).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), 12(2012).
- Duan, B. State-of-the-art review of 3D bioprinting for cardiovascular tissue engineering. Annals of Biomedical Engineering. 45 (1), 195-209 (2017).
- Kim, J. J., Hou, L., Huang, N. F. Vascularization of three-dimensional engineered tissues for regenerative medicine applications. Acta Biomaterialia. 41, 17-26 (2016).
- Ouyang, L., Armstrong, J. P. K., Chen, Q., Lin, Y., Stevens, M. M. Void-free 3D bioprinting for in situ endothelialization and microfluidic perfusion. Advanced Functional Materials. 30 (1), 1908349(2020).
- Baltazar, T., et al. Three dimensional bioprinting of a vascularized and perfusable skin graft using human keratinocytes, fibroblasts, pericytes, and endothelial cells. Tissue Engineering - Part A. 26 (5-6), 227-238 (2020).
- Chia, H. N., Wu, B. M. Recent advances in 3D printing of biomaterials. Journal of Biological Engineering. 9 (1), 4(2015).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Guillotin, B., et al. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials. 31 (28), 7250-7256 (2010).
- Catros, S., et al. Laser-assisted bioprinting for creating on-demand patterns of human osteoprogenitor cells and nano-hydroxyapatite. Biofabrication. 3 (2), (2011).
- Ronca, A., Ambrosio, L., Grijpma, D. W. Preparation of designed poly(d,l-lactide)/nanosized hydroxyapatite composite structures by stereolithography. Acta Biomaterialia. 9 (4), 5989-5996 (2013).
- Lan, P. X., Lee, J. W., Seol, Y. J., Cho, D. W. Development of 3D PPF/DEF scaffolds using micro-stereolithography and surface modification. Journal of Materials Science: Materials in Medicine. 20 (1), 271-279 (2009).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655(2015).
- Szklanny, A. A., et al. 3D bioprinting of engineered tissue flaps with hierarchical vessel networks (VesselNet) for direct host-to-implant perfusion. Advanced Materials. 33 (42), 2102661(2021).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. Journal of Visualized Experiments JoVE. (69), (2012).
- Sucher, R., et al. Mouse hind limb transplantation: A new composite tissue allotransplantation model using nonsuture supermicrosurgery. Transplantation. 90 (12), 1374-1380 (2010).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), (2014).
- Novosel, E. C., Kleinhans, C., Kluger, P. J. Vascularization is the key challenge in tissue engineering. Advanced Drug Delivery Reviews. 63 (4-5), 300-311 (2011).
- Landau, S., et al. Tropoelastin coated PLLA-PLGA scaffolds promote vascular network formation. Biomaterials. 122, 72-82 (2017).
- Szklanny, A. A., et al. High-throughput scaffold system for studying the effect of local geometry and topology on the development and orientation of sprouting blood vessels. Advanced Functional Materials. 1901335, 1-13 (2019).
- Song, W., et al. Engineering transferrable microvascular meshes for subcutaneous islet transplantation. Nature Communications. 10 (1), 1-12 (2019).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Ying, G. L., et al. Aqueous two-phase emulsion bioink-enabled 3D bioprinting of porous hydrogels. Advanced Materials. 30 (50), 1-9 (2018).
- Rouwkema, J., Khademhosseini, A. Vascularization and angiogenesis in tissue engineering: beyond creating static networks. Trends in Biotechnology. 34 (9), 733-745 (2016).
- Jang, J., Park, J. Y., Gao, G., Cho, D. W. Biomaterials-based 3D cell printing for next-generation therapeutics and diagnostics. Biomaterials. 156, 88-106 (2018).
- Suntornnond, R., An, J., Chua, C. K. Roles of support materials in 3D bioprinting - present and future. International Journal of Bioprinting. 3 (1), 83-86 (2017).
- Shoseyov, O., Posen, Y., Grynspan, F. Human recombinant type I collagen produced in plants. Tissue Engineering - Part A. 19 (13-14), 1527-1533 (2013).
- Stein, H., et al. Production of bioactive, post-translationally modified, heterotrimeric, human recombinant type-I collagen in transgenic tobacco. Biomacromolecules. 10 (9), 2640-2645 (2009).
- Kaplan, B., et al. Rapid prototyping fabrication of precision polyester scaffolds for axonal guidance. Biomaterials. , 120062(2020).
- Karakurt, I., Lin, L. 3D printing technologies: techniques, materials, and post-processing. Current Opinion in Chemical Engineering. 28, 134-143 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır