Method Article
使用3D打印技术制造工程血管瓣
摘要
工程皮瓣需要一个功能性的血管网络。在该协议中,我们提出了一种制造3D打印组织皮瓣的方法,该皮瓣包含分层血管网络及其对大鼠股动脉的直接显微外科吻合。
摘要
工程植入式、功能性、厚组织需要设计一个分层血管网络。3D生物打印是一种用于通过以有序和自动的方式添加一层又一层可打印生物材料(称为生物墨水)和细胞来创建组织的技术,这允许创建传统组织工程技术无法实现的高度复杂的结构。因此,3D生物打印是一种吸引人 的体外 方法,可以模拟天然脉管系统复杂结构,从毫米血管到微血管网络。
颗粒水凝胶中3D生物打印的进步使低粘度细胞外基质生物墨水的高分辨率挤出成为可能。这项工作提出了一种结合3D生物打印和基于牺牲模具的3D打印方法,用于制造工程化的血管化组织皮瓣。使用明胶支持浴中的重组胶原蛋白 - 甲基丙烯酸酯生物墨水对内皮和支持细胞进行3D生物打印,用于制造自组装的毛细管网络。这种打印的微脉管系统组装在中尺度容器状多孔支架周围,使用牺牲3D打印模具制造,并用内皮细胞播种。
这种组装诱导中尺度血管的内皮与周围的毛细血管网络吻合,在工程组织皮瓣内建立分层血管网络。然后使用袖带技术通过手术吻合术将工程皮瓣直接植入大鼠股动脉。所描述的方法可以扩展到制造各种血管化组织皮瓣,用于重建手术和血管形成研究。
引言
严重的组织缺陷是由创伤性损伤、先天性缺陷或疾病引起的,目前治疗这些缺陷的金标准是使用自体移植物、血管化组织皮瓣和微血管游离皮瓣作为组织替代物。然而,这些选择具有供体部位组织和供体部位发病率有限的缺点1。因此,对可用于纠正这些缺陷的替代组织替代品的需求不断增长2.工程组织结构的厚度受到营养物质和气体向细胞扩散的限制,因此,适当的血管网络对于产生大而厚且营养适当的支架至关重要。
已经应用了几种方法来促进工程植入物的血管化3,包括从宿主 体内 募集血管支持,在支架内递送生长因子和细胞因子,植入物的预血管化,使用微图案技术生成可浸出的分支微血管床4,使用牺牲材料进行血管通道/网络形成5,以及在3D生物打印结构中创建通道5,6。厚组织的血管形成需要结合由宏观和微毛细血管组成的分层血管网络。宏观尺度的血管有效地将血液分布在整个结构中,并允许与宿主血管进行显微外科吻合,而微毛细血管允许营养物质扩散。
近年来,生物打印因其相对于传统组织工程方法的优势而受到强烈关注。组织和器官是具有特定结构的复杂而错综复杂的3D对象。3D生物打印具有以高分辨率沉积生物材料层的能力,能够创建复杂的组织和器官替代品(例如,肾脏,肺,肝脏)7。几种印刷技术已被应用于生物打印,包括基于挤出的喷墨8,激光辅助沉积9,10和基于立体光刻的11,12 生物打印。基于挤出的技术依赖于通过喷嘴挤出材料,方法是在与喷嘴相反的材料块表面上施加压力。
悬浮水凝胶的自由形式可逆包埋(FRESH)是一种生物打印技术13,14 ,它使用颗粒状支撑材料,其中挤出的材料被支撑浴沉积并固定到位。支撑槽为挤出的预交联生物墨水提供机械支撑,直到其交联。该技术的主要优点是支撑浴允许挤出在挤出后和交联前不能保持其形状的低粘度材料15。这扩大了可用作生物墨水的可用材料池。
本文提出了一种结合微尺度和中尺度脉管系统的血管化皮瓣的生成方案。为了实现这一点,在重组人胶原甲基丙烯酸酯(rhCollMA)水凝胶中产生生物打印的,自组装的微血管网络,然后连接到更大的,可植入的血管支架的内部,从而产生完全工程化的组织皮瓣16。为了建立工程组织的快速和直接灌注,需要对宿主血管进行直接的显微外科吻合术。血管支架没有足够的缝合线保持强度,无法使用传统的显微外科血管壁缝合进行吻合。因此,我们描述了一种"袖带"17,18,19 方法,以实现与大鼠股骨总动脉的吻合。在这种方法中,容器末端用圆周缝合线固定,而无需穿孔容器壁。
尽管所提出的方案已经准备用于研究rhCollMA环境中的分层脉管系统,但这种方法可以扩展并应用于各种新应用。该协议可应用于在不同生物墨水中生物打印各种组织特异性细胞。此外,结构的几何形状和尺寸可以很容易地修改,以适应特定的要求,例如大型组织重建或生物学研究。
研究方案
所有动物程序均在以色列理工学院临床前研究局(PCRA以色列理工学院,伦理学批准号058-05-20)的监督下批准和进行。雄性Sprague-Dawley大鼠(275-350g)用于这些研究。有关此协议中使用的所有材料、设备和软件的详细信息,请参阅材料 表 。
1. 血管支架制造
- 使用计算机辅助设计 (CAD) 软件创建所需血管支架形状的 3D 计算机模型,或从在线存储库下载所需血管结构的 3D 文件。
- 创建内径为 0.9 mm、外径为 2 mm、高度为 18 mm 的圆柱体。在圆柱壁旁边添加直径为 0.22 mm 的径向开窗。
- 使用 3D 设计软件为基架创建模具并将其导出为 .STL 文件。接下来,在设计中添加一个漏斗,以方便以后填充模具。
- 导入 .STL文件放入切片软件中,用于熔融沉积建模(FDM)3D打印机。对图层高度为 0.1 mm 的模型进行切片,并将其导出为 .gcode 或直接发送到 3D 打印机。
- 使用水溶性丁烯 - 二醇乙烯醇共聚物(BVOH)长丝,在配备0.25 mm喷嘴的FDM 3D打印机上3D打印模具。将打印的模具存放在真空室中直至使用。
注意:避免徒手处理BVOH灯丝,因为它对湿气敏感。此外,建议将灯丝存放在真空室中,以避免暴露于潮湿环境中。 - 在1,4-二氧六环中制备聚-L-乳酸(PLLA)和聚乳酸-共乙醇酸(PLGA)的1:1混合物的聚合物溶液。
- 称取350毫克PLLA和350毫克PLGA,然后转移到20毫升玻璃瓶中。
- 测量10 mL 1,4-二恶烷,并使用玻璃移液器转移到玻璃瓶中。在玻璃小瓶中加入一个小磁力搅拌棒。
注意:1,4-二恶烷是一种有害的有机溶剂。使用适当的个人安全设备并在通风橱内工作。 - 将玻璃小瓶置于加热至70°C的热水浴中,混合内容物过夜,直到所有聚合物完全溶解。将溶液储存在密封的玻璃容器中直至使用。
- 用 PLLA:PLGA 解决方案填充 BVOH 模具。
- 使用容积式移液器,测量30μL聚合物溶液并填充模具。
注:填充模具所需的体积将根据设计容器的体积而变化。继续添加聚合物溶液,直到模具的漏斗完全填满。 - 将模具以100× 克 离心2分钟。再用 20 μL 聚合物溶液填充模具,以确保完全填充。
- 使用容积式移液器,测量30μL聚合物溶液并填充模具。
- 将填充的模具在-80°C下冷冻至少30分钟,以确保所有聚合物溶液冻结。通过冷冻过夜从模具中除去溶剂。
注意:在冷冻干燥过程后,模具中聚合物的颜色应从透明变为白色。 - 要去除牺牲模具材料,请在冷冻干燥过程后将模具转移到5L去离子水浴中,轻轻搅拌。当浴缸变得浑浊时,更换水。当所有BVOH溶解时,风干支架并将其储存在真空室中直至使用。
2. 用纤连蛋白涂覆血管支架
- 通过将PLLA:PLGA血管支架浸入70%乙醇中30分钟来对其进行消毒。
- 用PBS洗涤脚手架3x 5分钟。
- 在PBS中制备50μg/ mL人纤连蛋白的稀释液并涂覆支架。
- 将500μL储备纤连蛋白溶液(1mg / mL)与9.5mLPBS混合。
- 将消毒的血管支架浸入该纤连蛋白溶液中,并在37°C下孵育60分钟以允许蛋白质吸附。
- 孵育后,用PBS冲洗支架以除去未结合的纤连蛋白。将这些涂层支架在4°C下储存长达1周。
3. rhCollMA生物墨水制备
- 制备磷酸盐缓冲液,用于中和酸性 rhCollMA 生物墨水储备。
- 通过将5.495克Na2HPO 4,1.55克NaH2PO 4和30mg NaCl溶解在50mL去离子水中来制备10x磷酸盐缓冲液。
- 通过将1份10倍磷酸盐缓冲液与9份去离子水结合,制备10倍稀释的10倍磷酸盐缓冲液。
- 将 900 μL 储备 rhCollMA 溶液与 100 μL 10x 磷酸盐缓冲液混合,以中和酸性 rhCollMA 溶液。
- 通过将中和的rhCollMA溶液与所需量的1x磷酸盐缓冲液混合,将其稀释至所需浓度10mg / mL。
注:rhCollMA的库存浓度因批次而异。因此,达到所需浓度所需的1x磷酸盐缓冲液的体积将发生变化。 - 制备致孔剂 - 光引发剂溶液(PEO-LAP)与稀释的中性rhCollMA结合。
- 通过将160mg PEO溶解在10mL DMEM中,制备1.6%(w / v)聚环氧乙烷(PEO)在无酚红DMEM中的溶液。
- 向该溶液中加入20mg锂苯基-2,4,6-三甲基苯甲酰基次膦酸盐(LAP),在溶液中获得0.2%(w / v)LAP。从这一点开始,用铝箔覆盖溶液或将其保存在黑暗的地方以保护其免受光照。
- 通过将PEO-LAP溶液通过0.22μm过滤器对其进行灭菌。将此溶液在4°C下储存长达1周。
- 在生物打印之前,以1:1的比例将稀释的中性rhCollMA溶液与PEO-LAP溶液混合,以获得最终的生物墨水溶液。使用移液而不是涡流来混合溶液,同时避免气泡。
- 如果将大量气泡引入溶液中,将其以2,000× g 离心30秒。离心后,再次混合生物墨水溶液以确保均匀性。
4. 颗粒状支撑浴制备
- 准备明胶颗粒支撑材料。
- 在生物安全柜中,将一管2g冻干载体材料的内容物分成两个无菌的50mL锥形管,每个锥形管含有约1g。
- 向每个管中加入40mL冷(4°C)不含酚红的DMEM,并剧烈涡旋,直到所有冻干载体材料溶解。
- 让所得浆料静置在4°C,以使支撑材料再水化。
- 在真空室中对支撑材料进行脱气30分钟以减少气泡。
- 将载体材料以2,000× g 离心5分钟。确保材料位于管的底部,并且上清液是透明的。
- 吸出上清液,同时注意不要吸出底部的支撑材料。
注意:去除上清液后,倾斜管时,支撑材料不应流动。如果物料流动,请使用相同的设置再次离心,但不添加新的上清液。
- 使用容积式移液器将约4 mL制备的压实支撑材料转移到12孔板的每个孔中。在坚硬的表面上敲击孔板,以迫使支撑材料在孔中均匀扩散。
注意:建议的最小支撑材料体积是将打印在其中的结构体积的 3 倍。 - 将带有支撑材料的孔板置于冷却的生物打印机阶段,或在4°C下,直到其使用以防止明胶颗粒熔化。
5. 将内皮细胞和支持细胞与生物墨水结合
- 根据制造商的说明,通过将基础培养基与其相应的培养基试剂盒组分(包括抗生素溶液,胎牛血清和内皮细胞生长补充剂)混合来制备内皮细胞培养基。
- 通过结合500 mL低葡萄糖DMEM,58 mL胎牛血清,5.8 mL非必需氨基酸(NEAA),5.8 mL谷氨酰胺替代品,5.8mL 1 M HEPES和5.8 mL青霉素 - 链霉素 - 制霉菌素 - 制霉菌素溶液来制备牙髓干细胞培养基。
- 在10mL内皮细胞培养基中制备含有2×106 ZsGreen1表达人脂肪微血管内皮细胞(HAMEC-ZsGreen1)和6×106 个牙髓干细胞(DPSC)的悬浮液。
- 将细胞悬浮液以200× g 离心4分钟以获得细胞沉淀。吸出上清液培养基。
- 将细胞沉淀重悬于先前制备的1mLrhCollMA生物墨水(含有PEO-LAP)中,以获得总细胞浓度为8×每1mL生物墨水106 个细胞的生物墨水。
注意:将生物墨水与细胞结合后,立即进行下一步。如果细胞长时间留在悬浮液中,细胞会沉到管的底部,它们的活力会恶化。对于不涉及细胞的实验,要么跳过步骤5.1-5.5,要么将荧光珠与生物墨水而不是细胞结合,以增强印刷结构的微观可视化。 - 将细胞 - 生物墨水混合物转移到打印墨盒中。
- 将内径为 0.22 mm 的针安装到 3 mL 琥珀色打印墨盒上,然后将墨盒放入 50 mL 锥形管中。
- 使用正置换移液器从顶部填充1 mL细胞 - 生物墨水混合物到打印墨盒中以减少气泡。
- 将打印墨盒安装在生物打印机的相应工具中。
6. 使用 rhCollMA 生物墨水的生物打印微血管网络
- 为生物打印微血管网络创建 3D CAD 设计。
- 草绘 4 mm 正方形的 2D 图案,其中心包含一个直径为 2 mm 的圆形通道。将草图拉伸 4 mm,以获得具有中心通道的 4 mm x 4 mm x 4 mm 立方体。将此对象导出为 .STL 文件。
- 导入 12 孔板 。STL模板放入生物打印机切片软件的 实体建模 选项卡中,并将其放置在虚拟打印床的指定区域。
- 导入 .将立方体形状的STL文件放入生物打印机切片软件中的实体建模选项卡中。单击"使用外部切片器"复选框|在对象属性部分下配置切片器。在弹出窗口中,为填充图案选择直线图案,然后在填充密度中键入 30%。单击"接受"。
- 将立方体形状的副本放在每个所需的虚拟孔中,方法是单击立方体并使用鼠标移动它。
- 通过单击添加材料 按钮,在 生物打印机切片软件的材料选项卡中为 rhCollMA 生物墨水创建新的 材料 设置。选择材料的打印设置。对于 压力,请在相应的框中键入 2 psi 。对于 速度,请在相应的框中键入 20 mm/s 。
注意:每种生物墨水材料都有自己不同的打印设置,可以保存在应用程序的材料列表中。 - 通过在相应的框中键入线宽和线高值,将线宽和线高值指定为 0.24 mm,将加速度值指定为 400 mm/s 2。
- 在 实体建模 选项卡中,单击立方体对象,然后单击材料部分中的 rhCollMA 材料 以将其指定给立方体形状。在 生物装配选项卡 中,单击 发送打印作业 按钮,将打印作业发送到生物打印机。
- 将装有细胞生物墨水的打印墨盒装入基于 3D 挤出的生物打印机的 3 mL 环境气动点胶工具中。
- 通过单击生物打印机界面屏幕中"控制-加热/冷却"选项卡下的冷却按钮,将打印床温度设置为 4 °C。将印版与支撑浴槽一起装入打印机床上。
注意:由于环境温度或生物墨水批次变化的差异,材料的打印压力和速度设置可能会发生变化。例如,在寒冷的日子里,需要更高的压力或更慢的速度来挤出相同数量的材料。 - 在生物 打印机 界面屏幕上的打印选项卡中,单击步骤6.7中发送的打印作业。,然后单击" 开始|转到 开始打印作业。
- 打印后,将孔板暴露在强度为3 mW / cm2 的405nm光源下30秒,以启动rhCollMA生物墨水的交联。
- 交联后,将孔板在37°C和5%CO2 下孵育至少20分钟,直到所有载体浴熔化。
- 轻轻吸出液化支撑浴,并用内皮细胞培养基代替。将构建物在37°C和5%CO2 下孵育,直到在进一步的步骤中使用。
注:由于打印后结构收缩,建议在步骤6的同一天执行装配步骤7。
7. 将生物打印的微血管网络与血管支架组装,以获得工程化的血管化皮瓣
- 在支持材料去除生物打印的微血管网络后,立即在生物打印结构的主通道中放置纤连蛋白包被的PLLA:PLGA血管支架。
- 将组装好的构建体在37°C和5%CO2 下孵育2天。
- 用内皮细胞排列血管支架的管腔。
- 制备表达td番茄的人脂肪微血管内皮细胞(HAMEC-tdTomato)的细胞悬浮液,浓度为1×107 个细胞/ mL。
- 将该细胞悬浮液的20μL液滴放在疏水表面(即非组织培养[非TC]10cm培养皿)上。
- 轻轻地将血管支架放在液滴的顶部,使支架一端的管腔与细胞液滴接触。
- 从支架的相对端(即不接触液滴的一端)吸出液滴,用细胞悬浮液填充其管腔。
- 将播种的支架放入微量离心管中,并将其置于加湿培养箱内的旋转器中60分钟。接下来,将支架转移到12孔板中,并加入2mL内皮细胞培养基。
- 培养工程皮瓣7天,同时每2天用新鲜的内皮细胞培养基更换培养基。
8.共聚焦显微镜和工程瓣的免疫荧光染色
- 培养4天和7天后,使用共聚焦激光扫描显微镜对组装的支架进行活细胞成像。
- 在显微镜图像采集软件上定义 ZsGreen1 和 tdTomato 荧光蛋白的荧光通道。
- 选择变焦为 0.5 倍变焦(像素尺寸为 5 μm)的 5 倍/0.16 物镜,并定义包含 22 个切片、每个切片厚度为 41 μm 的 Z 轴堆栈。
- 定义 3 x 2 图块扫描以图像并捕获整个构造。
- 调整激光强度和增益值以获得无饱和度和最小背景的清晰荧光信号,并获取图像。
- 使用显微镜图像采集软件或类似的图像分析软件对采集的Z轴堆栈进行最大强度投影,以获得单个2D图像。
- 对感兴趣区域执行更高放大倍率的成像。
- 切换到 0.5 倍焦(像素大小 1.25 μm)的 10 倍/0.3 物镜,并定义厚度为 41 μm 的 9 片 Z 轴堆栈。
- 执行步骤 8.2.-8.3。
- 培养7天后,通过将工程瓣浸没在4%多聚甲醛中20分钟来固定它们。
- 用PBS洗涤结构3x 5分钟。
- 在PBS中加入0.3%(v / v)Triton-X到构建体中,并在室温下孵育15分钟以使细胞透化。
- 用PBS洗涤结构3x 5分钟。
- 通过在PBS中溶解5%(w / v)牛血清白蛋白(BSA)来制备封闭溶液。将封闭溶液加入工程瓣中,并在室温下孵育1小时。
- 通过在先前制备的5%BSA溶液中稀释小鼠抗平滑肌肌动蛋白(抗SMA)1:50抗体来制备一抗溶液,以染色表达SMA的支持细胞。
- 将支架在一抗溶液中在4°C下孵育过夜。
- 用PBS洗涤3x 5分钟。
- 通过在PBS中稀释Cy3偶联山羊抗小鼠IgG 1:400抗体和4',6-二脒-2-苯基吲哚(DAPI,2.5μg/ mL)来制备二抗溶液。
- 将二抗溶液应用于支架上,并在室温下孵育3小时。
- 用PBS洗涤3x 5分钟。
- 将结构在PBS中以4°C储存长达1个月。
- 使用共聚焦激光扫描显微镜对染色的支架进行成像。
- 在显微镜图像采集软件上定义三个荧光通道(DAPI、ZsGreen 和 Cy3)。
- 定义截面厚度为 2 μm 且总厚度为 50 μm 的 Z 轴堆栈。接下来,定义切片扫描以对构造的较大区域进行成像。
- 调整采集参数以获得清晰的荧光信号,没有饱和度和最小的背景。
- 使用20倍/0.8物镜和1.0倍变焦(像素大小0.31μm)采集图像。
- 使用显微镜图像采集软件或类似的图像分析软件对采集的Z轴堆栈进行最大强度投影,以获得单个2D图像。
9.使用袖带技术将工程皮瓣直接吻合到大鼠的股动脉
- 准备并消毒(高压灭菌器)以下手术工具:15号手术刀,一对细齿镊子和一小把环形剪刀。此外,准备和消毒以下显微外科工具:直的细尖3号珠宝商镊子,倾斜珠宝商的镊子,带有弯曲钳口的圆柄针架,一对血管扩张器,解剖剪刀,adventitia剪刀,以及带有施药器的容器夹。
- 通过用195 mL盐水稀释5mL原浆肝素溶液来制备100 IU / mL肝素化盐水溶液。
- 切割聚酰亚胺袖带并对其进行灭菌。
- 在解剖显微镜下切割2.5毫米的聚酰亚胺管切片。
- 在每个部分的一端,在管壁上纵向切开1.25毫米,以获得袖带手柄。在管的另一端进行倾斜切割,以缓解血管外翻。
- 将袖带浸入70%乙醇中,然后用肝素化盐水洗涤两次。
- 准备一只雄性Sprague-Dawley大鼠(275-350g)进行手术。
- 手术前七天,开始给予每日皮下剂量的环孢菌素(10mg kg-1)以实现免疫抑制。
- 手术前,根据机构SOP使用诱导室,使用3%异氟醚吸入麻醉动物。通过捏住双脚并检查反射来验证深度麻醉。
- 给予皮下剂量的镇痛药丁丙诺啡(0.03mg kg-1)和抗凝肝素(200IU kg-1)。
- 将润滑眼药膏涂抹在动物的眼睛上,以防止脱水。
- 剃除大鼠的手术区域,然后用碘和70%乙醇消毒部位。用胶带将动物的四肢固定在桌子上。
- 暴露并分离股总动脉。
- 沿着腿部和腹部之间的凹陷,通过皮肤做一个2厘米长的斜切口。
- 使用镊子和钝端剪刀,将皮肤从下层组织中释放出来,以可视化腹股沟脂肪垫。
- 使用剪刀和镊子,直接穿过上缘、内侧和下缘周围的脂肪垫。注意不要在脂肪垫下面切割大血管。
- 横向反射脂肪垫,使上腹部血管完好无损。将湿纱布放在反射的脂肪垫上以防止干燥并将其固定到位。确保常见的股骨血管可见。
注意:脂肪垫稍后将用于对吻合器施加软压力。 - 通过将股沟韧带近端的股动脉从鞘中取出,将其暴露在上腹部动脉分支点远端。
注意:通常有一个股动脉分支在其下方运行,通常称为墨菲分支。注意不要损坏这个难以看到的分支。 - 通过结扎来分割墨菲氏分支,然后用动脉中间间隔1 mm的两个结扎来连接股动脉。保持结扎缝合线的一端很长,以便以后使用,以将血管末端拉过袖带。
- 使用外挂剪刀切开两个结扎之间的动脉。
注意:进行此切割时不应有任何出血。如果动脉末端出血,夹紧动脉并重新应用结扎。 - 使用结扎缝合线的长端,将每个血管末端插入聚酰亚胺袖带中,如上一步中所示,使得两个袖带的手柄彼此远离。
- 插入后,在袖带手柄和血管上同时使用夹子,将袖带固定到位。
- 在配备27 G针头的注射器中制备肝素化盐水溶液。
- 拉扯结扎的血管末端,并将其切开到靠近结扎处。立即用肝素化盐水彻底清洗血管末端,直到管腔内看不到血液。
注意:确保血管末端清洗良好,因为留在里面的任何血液都会形成凝块,在完成手术后会将其引入血液中。这可能导致血管闭塞和腿部灌注减少。 - 通过用一只手握住血管鞘来扩大血管的管腔,并用另一只手用血管扩张器扩张其腔。
- 在袖带周围放置一个松散的6-0聚丙烯周缝线。在袖带主体上使用两个血管扩张器将血管末端固定在血管末端,并通过收紧周向缝合线将其固定到位。
注意:如果在操作过程中有任何血液通过夹紧的血管泄漏,请用肝素化盐水彻底清洗管腔。 - 用肝素化盐水冲洗工程皮瓣,然后将血管内衬的袖带插入血管支架的管腔。通过在支架和袖带主体周围放置一个周向6-0聚丙烯缝合线,将支架固定到位。对血管支架的两侧执行此步骤。
- 在吻合器部位周围包裹0.2μm聚苯乙烯膜过滤器,以将工程皮瓣与周围组织隔离开来。
- 首先松开远端钳;然后,释放近端钳夹以重新建立通过血管的血流。
- 为了阻止通过吻合器的任何出血,将脂肪垫反射回股骨血管上,并使用无菌纱布施加轻柔的压力3分钟。
- 使用6-0聚丙烯将脂肪垫缝合到位;然后,使用5-0 PGA可吸收缝合线缝合皮肤。
- 用盐水清洁伤口区域并涂抹碘溶液。
- 对于术后疼痛和动物管理,在饮用水中制备0.1%(v / v)的曲马多。此外,给予每日剂量的肝素(200 IU kg-1)和环孢菌素(10mg kg-1)。
- 将动物放在一个干净的笼子里,放在加热灯下。继续监测动物,直到它恢复足够的意识以维持胸骨卧位。
结果
该协议描述了由血管支架(图1Ai)和生物打印的微脉管系统(图1Aii)组成的工程皮瓣的制造,其组装以实现中尺度和微尺度脉管系统(图1Aiii)。根据该协议,设计并3D打印了血管支架的BVOH模具(图1B,C)。目视检查获得的印刷结构是否有小股BVOH,这些链可能在模具的空白处发现(图1D)。这些链通常表示材料设置不正确或BVOH吸收了水分。应去除这些链,因为它们可能导致模具填充不完全和由此产生的血管支架中的结构缺陷。接下来,用PLLA:PLGA溶液填充模具,然后进行冷冻干燥过程和洗涤步骤,如协议中所述。目视检查获得的PLLA:PLGA血管支架以验证血管壁完整性和管腔通畅性(图1E)。
制备了浓度为10 mg / mL的中和rhCollMA生物墨水,并以1:1的比例与PEO:LAP溶液合并。用Zs-Green1标记的人脂肪微血管内皮细胞和牙髓干细胞与rhCollMA生物墨水重悬,并将溶液装入打印盒并装入打印机上。具有具有直线图案的中心通道的盒子形状(图1D)在明胶支撑浴内生物打印。印刷后,结构物交联,支撑浴溶解并洗涤。培养4天后,对构建体进行实时成像以检查微血管网络自组装。 图1D 显示了生物打印结构中高度发达的HAMEC-ZsGreen1微血管网络的示例。
接下来,将纤连蛋白包被的血管支架插入印刷结构的中心通道中(图2A)。组装的构建体培养2天,在此期间细胞收缩凝胶,将其牢固地附着在血管支架上。然后,根据协议,血管支架内衬表达tdTomato的HAMEC。经过7天的培养,结构被固定并成像。 图2B 显示了组装结构的侧视图,其中生物打印的微脉管系统中的内皮细胞以绿色表示,而血管支架的内皮衬里以红色表示。该图像显示了生物打印凝胶中的绿色微血管自组装,而血管支架内衬红色内皮细胞。随着放大倍率的提高,可见来自红色内皮衬里的芽与生物打印的微血管网络萌芽和吻合(图2C)。接下来,将构建体染色为α平滑肌肌动蛋白(SMA),作为牙髓干细胞的标志物。免疫染色后,使用激光扫描共聚焦显微镜对结构进行成像(图2D)。
最后,在培养7天后,将工程皮瓣显微手术吻合到大鼠的股动脉,如方案中所述。代表性程序的视频可以在 补充视频S1中看到。 图2E 显示了在夹具移除之前完成的吻合器的代表性图像, 图2F 显示了夹具移除和止血后吻合器部位的代表性图像。伤口闭合前不应有可见出血。
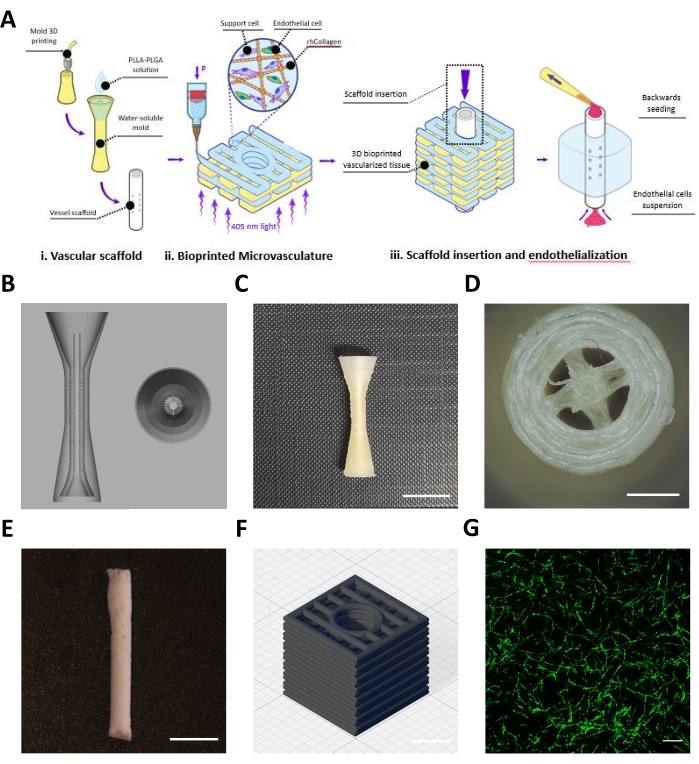
图1:制造的中尺度和微尺度容器的代表性图像。 (A) 协议步骤的示意图概述。经许可转载16.(二)CAD设计为血管支架的牺牲模具。(C)具有代表性的3D打印牺牲模具的侧视图(比例尺= 0.5 mm)。(D) 牺牲模具的俯视图(比例尺 = 0.5 mm) (E) 使用描述协议(比例尺 = 5 mm)制造的代表性血管支架。(F)3D生物打印rhCollMA微血管网络的CAD设计。网格线 = 1 mm. (G) 高度发达的生物打印血管网络的代表性图像,以绿色显示 HAMEC-ZsGreen1。比例尺 = 200 μm。缩写:CAD =计算机辅助设计;rhCollMA =重组人胶原蛋白甲基丙烯酸酯;HAMEC =人脂肪微血管内皮细胞;PLLA = 聚-L-乳酸;PLGA = 聚乳酸-共乙醇酸。 请点击此处查看此图的大图。

图2:组装的血管化皮瓣的代表性图像 (A)生物打印的微脉管系统和血管支架的代表性组装的照片。比例尺 = 1 mm. (B) 在血管支架内皮内膜 4 天后成像的代表性工程皮瓣的侧视图。生物打印的微脉管系统以绿色显示(HAMEC-ZsGreen1),而内皮衬里以红色显示(HAMEC-tdTomato)。(C)绿色生物打印的脉管系统和红色的内皮衬里之间的吻合的代表性图像。比例尺= 200μm.(D)孵育7天后平滑肌肌动蛋白(红色),细胞核(蓝色)和内皮细胞(绿色)的免疫染色的代表性图像。比例尺= 0.1 mm. (E)在钳子移除之前和(F)夹具移除后,工程皮瓣与大鼠股动脉的完全吻合术的代表性图像。缩写:HAMEC =人脂肪微血管内皮细胞;SMA = 平滑肌肌动蛋白;DAPI = 4',6-二脒基-2-苯基吲哚。 请点击此处查看此图的大图。
补充视频S1:用于将血管支架吻合到大鼠股动脉的代表性显微外科手术。请点击此处下载此视频。
讨论
工程血管化组织是组织工程20的主要挑战之一。目前用于创建工程血管组织的方法侧重于创建自组装的微脉管系统21,22,23 或制造中尺度血管支架24,25 ,而不是重建分层脉管系统,该系统可以在植入时立即直接灌注26.在这项工作中,我们描述了一种方案,该协议利用两种3D打印方式来制造由微尺度和中尺度脉管系统组成的分层容器网络。该协议将3D生物打印的自组装微血管网络与中尺度血管支架相结合,实现可植入的血管化皮瓣。此外,本文提出了一种直接吻合该皮瓣到大鼠股动脉的方案。
近年来,3D生物打印因其对传统组织工程技术的多功能性而受到关注。虽然该协议描述了在rhCollMA生物墨水中产生微血管网络,但所使用的方法可以应用于来自大量研究和新型生物墨水和支持浴的许多其他生物墨水27,28。我们选择使用rhCollMA作为生物墨水,因为人类ECM中I型胶原蛋白丰富,为细胞附着提供了合适的环境。此外,它在植物中重组生产并用甲基丙烯酸酯基团进一步修饰,这允许光聚合和形成稳定的3D水凝胶29,30。光交联是通过添加光引发剂LAP来实现的,LAP已被证明是无毒的,并且通过暴露于405nm蓝光而被激活,从而降低了紫外线的可能光毒性。然而,使用光敏生物墨水需要使用无酚红的培养基来制备生物墨水和支持材料。此外,该协议描述了明胶载体材料的使用,该材料能够高保真地挤出生物墨水,例如rhCollMA。因此,确保在制备过程中使用冷介质和冷却打印机床至关重要。由于用于交联的光源或环境温度升高,可能会发生过度加热。
这里已经使用了一种基于挤出的生物打印机来创建生物打印的微血管网络,目前有许多商业上可用的生物打印机可以产生类似的结构。此外,所提出的方法可以很容易地修改并应用于研究不同的几何形状,尺寸和填充模式。在这项工作中,选择了直线填充图案来创建相互连接的孔隙,并且可以相对快速地打印高保真度。
气泡给挤出生物打印带来了重大挑战,尤其是在支撑材料内部。因此,通过使用正位移移液器转移支撑材料,制备生物墨水细胞悬浮液并将其转移到打印墨盒中,最大限度地减少这些气泡的存在和形成至关重要。
在这项工作中,人类脂肪来源的内皮细胞和牙髓干细胞被用作支持细胞,因为它们相对容易地从患者中分离出来。此外,选择总细胞浓度为8 x 106 个细胞/ mL,因为该浓度已被证明可以建立最发达的血管网络16。虽然该方案可用于使用不同的细胞类型和来源以及不同的生物墨水来生成微脉管系统,但必须对细胞浓度进行校准,以便为微血管网络的开发建立最佳条件。此外,组织特异性细胞(即成肌细胞或成骨细胞)可以掺入生物墨水中以实现组织特异性血管化皮瓣。
多孔血管支架的模具是在市售挤出3D打印机上使用3D打印的水溶性材料制造的。这导致基于快速原型平台的具有成本效益的技术,使得可以快速研究和筛选许多不同的几何形状和尺寸的血管支架31。然而,这种方法的局限性是大多数3D打印机32的分辨率限制。然而,随着增材制造行业的快速发展,这些限制有望随着时间的推移而改善。使用有机溶剂进行制造工艺是该协议的另一个局限性,因为大多数有机溶剂对细胞有毒,因此无法将生物打印程序与血管支架制造过程相结合。
所描述的使用抽吸而不是推动细胞悬浮液接种支架腔的方法对接种细胞的定位具有重大影响。使用负压允许支架内腔的内皮化,同时最大限度地减少细胞悬浮液通过支架壁16上的穿孔的任何溢出。
所描述的用于显微外科吻合术的"袖带"方法可以很容易地修改和适应不同的血管支架材料或尺寸,以及各种动物模型中的不同动脉和静脉。对协议的调整将包括不同的聚酰亚胺管尺寸和缝合线尺寸。这种方法不需要脚手架壁的穿孔,这可能会导致缺陷的发展。这项工作提出了一种可以扩展到许多应用程序的协议。该协议的关键方面,包括中尺度和微尺度脉管系统的制造及其组装和植入,代表了用于重建应用以及血管和其他组织工程研究的工程皮瓣的关键方面。
披露声明
作者没有利益冲突需要披露。
致谢
该项目根据欧盟的地平线2020研究与创新计划(赠款协议号818808)获得了欧洲研究理事会(ERC)的资助。rhCollMA由CollPlant(以色列Rehovot)慷慨提供。作者感谢以色列理工学院临床前研究局在动物护理方面的帮助,以及Janette Zavin,Galia Ben David和Idan Redenski。
材料
| Name | Company | Catalog Number | Comments |
| 1,4-Dioxane | Biosolve Chemical | 42405 | |
| 27 G x 0.5" blunt tip dispensing needles | CML supply | 901-27-050 | |
| 3cc amber syringe barrel & piston set | Nordson EFD | 7012085 | Amber syringes used to block light and prevent premature crosslinking |
| 5-0 AssuCryl PGA absorbale suture | Assut Sutures | Absorbable sutures used for skin wound closure | |
| 6-0 polypropelene sutures | Assut Sutures | 9351 | |
| Acland clamps | S&T | B-1V | |
| Adventitia scissors | S&T | SAS-15 | |
| Angled no.3 jeweler's forceps | S&T | JFAL-3-18 | |
| BioAssemblyBot 400 3D Bioprinter | Advanced Solutions | a 6-axis 3D bioprinter | |
| Bovine albumin serum Probumin | Millipore | 82-045-1 | |
| Buprenorphine | vetmarket | B15100 | |
| BVOH filament | Verbatim | 55903 | a water-soluble 1.75 mm diameter filament |
| Clamp applying forceps | S&T | CAF-4 | |
| Dental pulp stem cells | Lonza | PT-5025 | |
| Dietrich bulldog clamps | Fine Science Tools (FST) | 18039-45 | |
| di-Sodium hydrogen phosphate (Na2HPO4) | Carlo Erba Reagents | 480141 | |
| Dissection scissors | S&T | 18039-45 | |
| DMEM, High Glucose, No Phenol Red | Sartorius | 01-053-1A | |
| Duratears | Alcon | DJ03 | |
| ECM media + bullet kit | Sciencell | #1001 | |
| Ethanol 96% | Gadot-Group | 64-17-5 | |
| GlutaMAX | Gibco | 35050061 | glutamine substitute |
| Goat anti-mouse Cy3 antibody | Jackson | 115-166-072 | |
| Heparin Sodium 5,000 I.U./mL | Panpharma | - | |
| Human adipose microvascular cells | Sciencell | #7200 | |
| Human fibronectin | Sigma | F0895-5MG | A stock concentration of 1 mg/mL |
| Isoflurane, USP Terrell | Piramal Critical Care | NDC 66794-011-25 | |
| LifeSupport | Advanced Biomatrix | 5244 | a gelatin support slurry for FRESH 3D bioprinting |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | |
| Low-glucose DMEM | Biological Industries | 01-050-1A | |
| MICROMAN E M1000E, 100-1,000 µL | Gilson | FD10006 | |
| Mouse anti-SMA antibody | Dako | M0851 | |
| NEAA | Gibco | 11140068 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Paraformaldehyde solution 4% in PBS | ChemCruz | SC-281692 | |
| Penicillin-Streptomycin-Nystatin Solution | Biological Industries | 03-032-1B | |
| Phospate buffered saline (PBS) | Sigma | P5368-10PAK | |
| Poly(ethylene oxide), M.W. 250,000 to 400,000 | Acros Organics | 178602500 | |
| Poly(L-lactic acid), IV 5.0 dl/g (PLLA) | Polysciencse, Inc. | 18582-10 | |
| Polyimide tubing, ID: 0.0249", OD: 0.0273" | Cole-Parmer | 95820-05 | A thin-walled tube used to fabricate cuffs for microsurgical anastomoses |
| Prusa I3 MK2.5 3D Printer | Prusa Research | http://www.prusa3d.com/ | a popular commercial 3D printer |
| Resomer RG 503 H, Poly(D,L-lactide-co-glycolide) (PLGA) | Evonik Industries | 719870 | |
| rhCollMA | CollPlant | https://collplant.com/ | generously provided by CollPlant (Rehovot, Israel) |
| round-handled needle holder | S&T | B-15-8 | |
| Scalpel handle - #3 | Fine Science Tools (FST) | 10003-12 | |
| small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Sodium Chloride | Biosolve Chemical | 19030591 | |
| Sodium Phosphate dibasic (NaH2PO4) | Riedel-de Haen | 4276 | |
| Solidworks | Dassault Systems | CAD software | |
| Straight no.3 jeweler's forceps | S&T | JF-3-18 | |
| Straight serrated forceps | Fine Science Tools (FST) | 11050-10 | |
| Surgical Scalpel Blade No.15 | Swann-Morton Limited | 305 | |
| Triton-X 100 | BioLab LTD | 57836 | |
| TSIM | Advanced Solutions | 3D slicing and design software for the BioAssembly Bot | |
| Vessel dilator | S&T | D-5a.1 | |
| Zeiss Tivato 700 surgical microscope | Zeiss |
参考文献
- Wallace, C. G., Wei, F. -C. C. The current status, evolution and future of facial reconstruction. Chang Gung Medical Journal. 31 (5), 441-449 (2008).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), 12(2012).
- Duan, B. State-of-the-art review of 3D bioprinting for cardiovascular tissue engineering. Annals of Biomedical Engineering. 45 (1), 195-209 (2017).
- Kim, J. J., Hou, L., Huang, N. F. Vascularization of three-dimensional engineered tissues for regenerative medicine applications. Acta Biomaterialia. 41, 17-26 (2016).
- Ouyang, L., Armstrong, J. P. K., Chen, Q., Lin, Y., Stevens, M. M. Void-free 3D bioprinting for in situ endothelialization and microfluidic perfusion. Advanced Functional Materials. 30 (1), 1908349(2020).
- Baltazar, T., et al. Three dimensional bioprinting of a vascularized and perfusable skin graft using human keratinocytes, fibroblasts, pericytes, and endothelial cells. Tissue Engineering - Part A. 26 (5-6), 227-238 (2020).
- Chia, H. N., Wu, B. M. Recent advances in 3D printing of biomaterials. Journal of Biological Engineering. 9 (1), 4(2015).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Guillotin, B., et al. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials. 31 (28), 7250-7256 (2010).
- Catros, S., et al. Laser-assisted bioprinting for creating on-demand patterns of human osteoprogenitor cells and nano-hydroxyapatite. Biofabrication. 3 (2), (2011).
- Ronca, A., Ambrosio, L., Grijpma, D. W. Preparation of designed poly(d,l-lactide)/nanosized hydroxyapatite composite structures by stereolithography. Acta Biomaterialia. 9 (4), 5989-5996 (2013).
- Lan, P. X., Lee, J. W., Seol, Y. J., Cho, D. W. Development of 3D PPF/DEF scaffolds using micro-stereolithography and surface modification. Journal of Materials Science: Materials in Medicine. 20 (1), 271-279 (2009).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655(2015).
- Szklanny, A. A., et al. 3D bioprinting of engineered tissue flaps with hierarchical vessel networks (VesselNet) for direct host-to-implant perfusion. Advanced Materials. 33 (42), 2102661(2021).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. Journal of Visualized Experiments JoVE. (69), (2012).
- Sucher, R., et al. Mouse hind limb transplantation: A new composite tissue allotransplantation model using nonsuture supermicrosurgery. Transplantation. 90 (12), 1374-1380 (2010).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), (2014).
- Novosel, E. C., Kleinhans, C., Kluger, P. J. Vascularization is the key challenge in tissue engineering. Advanced Drug Delivery Reviews. 63 (4-5), 300-311 (2011).
- Landau, S., et al. Tropoelastin coated PLLA-PLGA scaffolds promote vascular network formation. Biomaterials. 122, 72-82 (2017).
- Szklanny, A. A., et al. High-throughput scaffold system for studying the effect of local geometry and topology on the development and orientation of sprouting blood vessels. Advanced Functional Materials. 1901335, 1-13 (2019).
- Song, W., et al. Engineering transferrable microvascular meshes for subcutaneous islet transplantation. Nature Communications. 10 (1), 1-12 (2019).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Ying, G. L., et al. Aqueous two-phase emulsion bioink-enabled 3D bioprinting of porous hydrogels. Advanced Materials. 30 (50), 1-9 (2018).
- Rouwkema, J., Khademhosseini, A. Vascularization and angiogenesis in tissue engineering: beyond creating static networks. Trends in Biotechnology. 34 (9), 733-745 (2016).
- Jang, J., Park, J. Y., Gao, G., Cho, D. W. Biomaterials-based 3D cell printing for next-generation therapeutics and diagnostics. Biomaterials. 156, 88-106 (2018).
- Suntornnond, R., An, J., Chua, C. K. Roles of support materials in 3D bioprinting - present and future. International Journal of Bioprinting. 3 (1), 83-86 (2017).
- Shoseyov, O., Posen, Y., Grynspan, F. Human recombinant type I collagen produced in plants. Tissue Engineering - Part A. 19 (13-14), 1527-1533 (2013).
- Stein, H., et al. Production of bioactive, post-translationally modified, heterotrimeric, human recombinant type-I collagen in transgenic tobacco. Biomacromolecules. 10 (9), 2640-2645 (2009).
- Kaplan, B., et al. Rapid prototyping fabrication of precision polyester scaffolds for axonal guidance. Biomaterials. , 120062(2020).
- Karakurt, I., Lin, L. 3D printing technologies: techniques, materials, and post-processing. Current Opinion in Chemical Engineering. 28, 134-143 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。