Method Article
Fabricação de retalhos vasculares projetados usando tecnologias de impressão 3D
Neste Artigo
Resumo
Retalhos projetados requerem uma rede vascular funcional incorporada. Neste protocolo, apresentamos um método de fabricação de um retalho de tecido impresso em 3D contendo uma rede vascular hierárquica e suas anastomosas microcirúrgicas diretas para a artéria femoral de rato.
Resumo
A engenharia implantável, funcional, tecidos grossos requer a concepção de uma rede vascular hierárquica. Bioimpressão 3D é uma tecnologia usada para criar tecidos adicionando camada sobre camada de biomateriais imprimíveis, bioinks chamados e células de forma ordenada e automática, o que permite criar estruturas altamente complexas que as técnicas tradicionais de engenharia de tecidos não podem alcançar. Assim, a bioimpressão 3D é uma abordagem in vitro atraente para imitar a estrutura complexa da vasculatura nativa, que vai desde vasos milimétricos até redes microvasculares.
Os avanços na bioimpressão 3D em hidrogéis granulares permitiram a extrusão de alta resolução de bioinks baseados em matriz extracelular de baixa viscosidade. Este trabalho apresenta uma abordagem combinada de bioimpressão 3D e impressão 3D baseada em moldes sacrificiais para a fabricação de retalhos de tecido vascularizado projetado. Bioimpressão 3D de células endoteliais e de suporte usando bioink de colágeno-metacrilato recombinante dentro de um banho de suporte de gelatina é utilizada para a fabricação de uma rede capilar auto-montada. Esta microvasculatura impressa é montada em torno de um andaime poroso de vaso de mesocala, fabricado usando um molde impresso em 3D sacrificial, e é semeado com células endoteliais.
Esta montagem induz o endotélio do vaso de mesoescala a anastomose com a rede capilar circundante, estabelecendo uma rede vascular hierárquica dentro de uma aba de tecido projetada. A retalho projetada é então implantada diretamente por anastomose cirúrgica em uma artéria femoral de rato usando uma técnica de manguito. Os métodos descritos podem ser expandidos para a fabricação de vários retalhos de tecido vascularizado para uso em estudos de cirurgia de reconstrução e vascularização.
Introdução
Defeitos teciduais graves são causados por lesões traumáticas, defeitos congênitos ou doenças, e o padrão-ouro atual para o tratamento desses defeitos é usando enxertos autólogos, retalhos de tecido vascularizado e retalhos livres de microvasculares como substitutos teciduais. No entanto, essas opções têm as desvantagens do tecido limitado do site do doador e da morbidadedo site do doador 1. Assim, há uma demanda crescente por substitutos alternativos de tecido que podem ser usados para corrigir esses defeitos2. A espessura das construções teciduais projetadas é limitada pela difusão de nutrientes e gases em direção às células, e, portanto, uma rede vascular adequada é essencial para gerar andaimes grandes, grossos e devidamente nutridos.
Diversas abordagens têm sido aplicadas para promover a vascularização de implantes projetados3, incluindo o recrutamento in vivo de apoio vascular do hospedeiro, a entrega de fatores de crescimento e citocinas dentro dos andaimes, a pré-escavação de implantes, a geração de um leito de microvessel de ramificação perfumável utilizando técnicas de micropattersing4, o uso de materiais sacrificiais para formação de canais vasculares/rede5 , bem como a criação de canais dentro de construções bioimpressoras 3D 5,6. A vascularização de tecidos grossos requer a incorporação de uma rede vascular hierárquica composta por vasos em escala macro e microcapilares. Os vasos em macroesculência distribuem sangue efetivamente durante toda a construção e permitem anastomoses microcirúrgicos com os vasos sanguíneos hospedeiros, enquanto os vasos em escala microcapilar permitem a difusão de nutrientes.
A bioimpressão ganhou forte atenção nos últimos anos devido às vantagens que oferece em relação aos métodos convencionais de engenharia de tecidos. Tecidos e órgãos são objetos 3D complexos e intrincados com uma arquitetura específica. A bioimpressão 3D, com sua capacidade de depositar camadas de biomateriais em alta resolução, permite a capacidade de criar complexos substitutos de tecidos e órgãos (por exemplo, rim, pulmão, fígado)7. Várias tecnologias de impressão foram adaptadas para bioimpressão, incluindo a exposição baseada em extrusão, jato de tinta8, deposição assistida a laser 9,10 e bioimpressão baseada em estereolíticos11,12. As tecnologias baseadas em extrusão dependem de extrudamento do material através de um bocal, aplicando pressão sobre a superfície a granel do material em frente ao bocal.
A incorporação reversível de forma livre de hidrogéis suspensos (FRESH) é uma técnica de bioimpressão13,14 que utiliza um material de suporte granular no qual o material extrudado é depositado e fixado no lugar pelo banho de suporte. O banho de suporte dá suporte mecânico para o bioink extrudado e pré-cruzado até o seu crosslinking. A principal vantagem desta técnica é que o banho de suporte permite extruir materiais de baixa viscosidade que não conseguem manter sua forma após a extrusão e antes de cruzar15. Isso expande o pool de materiais disponíveis que podem ser usados como bioinks.
Este artigo apresenta um protocolo para a geração de uma aba vascularizada que combina vasculaturas de microescala e mesoescala. Para isso, redes bioimpressoras, auto-montadas e microvasculares são geradas em hidrogel de coláculato humano recombinante (rhCollMA), que então se conecta ao interior de um andaime vascular maior, implantável e vascular, resultando em um retalho de tecido totalmente projetado16. Para estabelecer a perfusão rápida e direta de tecidos projetados, é necessária uma anastomose microcirúrgica direta aos vasos hospedeiros. O andaime vascular não tem força suficiente de retenção de sutura para ser anastomosado usando sutura tradicional da parede do vaso microcirúrgico. Por isso, descrevemos um método "manguito"17,18,19 para alcançar uma anastomose com artéria femoral comum de um rato. Neste método, as extremidades do vaso são protegidas com suturas circunferenciais, sem a necessidade de perfurar a parede do vaso.
Embora o protocolo proposto tenha sido preparado para estudar vasculatura hierárquica no ambiente rhCollMA, essa abordagem pode ser expandida e aplicada a uma variedade de novas aplicações. O protocolo pode ser aplicado à bioimpressão de várias células específicas do tecido em diferentes bioinks. Além disso, a geometria e o tamanho dos construtos podem ser facilmente modificados para atender a requisitos específicos, como reconstrução de tecidos grandes ou estudos biológicos.
Protocolo
Todos os procedimentos animais foram aprovados e conduzidos sob a supervisão da Autoridade de Pesquisa Pré-Clínica technion (PCRA Technion, aprovação ética nº 058-05-20). Foram utilizados ratos de Sprague-Dawley (275-350 g) para esses estudos. Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais, equipamentos e softwares utilizados neste protocolo.
1. Fabricação de andaimes vasculares
- Crie um modelo de computador 3D da forma de andaime vascular desejada usando o software CAD (Computer-Aided Design, design auxiliado por computador) ou baixe um arquivo 3D de uma estrutura vascular desejada a partir de repositórios on-line.
- Crie um cilindro com diâmetro interno de 0,9 mm, um diâmetro externo de 2 mm e uma altura de 18 mm. Adicione fenestrações radiais com um diâmetro de 0,22 mm ao lado da parede do cilindro.
- Crie um molde para o andaime usando o software de design 3D e exporte-o como um . Arquivo STL. Em seguida, adicione um funil ao design para facilitar o enchimento do molde mais tarde.
- Importar o . Arquivo STL no software de fatiamento para a impressora 3D de modelagem de deposição fundida (FDM). Corte o modelo com uma altura de camada de 0,1 mm e exporte-o como .gcode ou envie-o diretamente para a impressora 3D.
- Imprima o molde em uma impressora FDM 3D equipada com um bocal de 0,25 mm, utilizando um copolímero de álcool buteno-diol solúvel em água (BVOH). Armazene os moldes impressos em uma câmara de vácuo até usar.
ATENÇÃO: Evite manusear o filamento BVOH com as mãos nuas, pois é sensível à umidade. Além disso, recomenda-se armazenar o filamento em uma câmara de vácuo para evitar exposição à umidade. - Prepare uma solução polímera de uma mistura 1:1 de poli-L-láctico-ácido (PLLA) e polilático-coglicílico-ácido (PLGA) em 1,4-dioxano.
- Pese 350 mg de PLLA e 350 mg de PLGA e transfira para um frasco de vidro de 20 mL.
- Meça 10 mL de 1,4-dioxano e transfira para o frasco de vidro usando uma pipeta de vidro. Adicione uma pequena barra de agitação magnética ao frasco de vidro.
ATENÇÃO: 1,4-Dioxano é um solvente orgânico perigoso. Use equipamentos de segurança pessoal adequados e trabalhe dentro de um capô de fumaça. - Coloque o frasco de vidro dentro de um banho de água quente aquecido a 70 °C e misture o conteúdo durante a noite até que todos os polímeros se dissolvam totalmente. Armazene a solução em um recipiente de vidro hermético até usar.
- Encha os moldes BVOH com a solução PLLA:PLGA.
- Utilizando uma pipeta de deslocamento positiva, meça 30 μL da solução de polímero e preencha o molde.
NOTA: O volume necessário para encher o molde mudará de acordo com o volume do vaso projetado. Continue adicionando a solução de polímero até que o funil do molde esteja totalmente preenchido. - Centrifugar o molde a 100 × g por 2 min. Cubra o molde com mais 20 μL da solução de polímero para garantir o enchimento completo.
- Utilizando uma pipeta de deslocamento positiva, meça 30 μL da solução de polímero e preencha o molde.
- Congele os moldes preenchidos a -80 °C por pelo menos 30 minutos para garantir que toda a solução de polímero congele. Remova o solvente dos moldes liofilizando-os durante a noite.
NOTA: A cor do polímero no molde deve passar de clara para branca após o processo de secagem congelante. - Para remover o material de molde sacrificial, transfira os moldes após o processo de secagem congelante para um banho de água deionizado de 5 L sob agitação suave. Substitua a água no banho quando ficar nublado. Quando todo o BVOH se dissolver, seque os andaimes e armazene-os em uma câmara de vácuo até usar.
2. Revestir o andaime vascular com fibronectina
- Desinfete os andaimes vasculares PLLA:PLGA, imergindo-os em 70% de etanol por 30 min.
- Lave os andaimes 3x 5 min com PBS.
- Prepare uma diluição de 50 μg/mL fibronectina humana em PBS e cubra os andaimes.
- Misture 500 μL de solução de fibronectina de estoque (1 mg/mL) com 9,5 mL de PBS.
- Mergulhe os andaimes vasculares desinfetados nesta solução de fibronectina e incuba-os a 37 °C por 60 min para permitir a adsorção de proteínas.
- Após a incubação, enxágue os andaimes com PBS para remover a fibronectina não ligada. Armazene estes andaimes revestidos a 4 °C por até 1 semana.
3. rhCollMA bioink preparação
- Prepare um tampão fosfato para neutralizar o estoque ácido de bioink rhCollMA.
- Prepare um estoque de 10x de tampão fosfato dissolvendo 5.495 g de Na2HPO4, 1,55 g de NaH2PO4 e 30 mg de NaCl em 50 mL de água desionizada.
- Prepare uma diluição de 10 vezes do tampão fosfato de 10x, combinando 1 parte do tampão fosfato de 10x com 9 partes de água desionizada.
- Combine 900 μL de solução rhCollMA de estoque com 100 μL de tampão fosfato de 10x para neutralizar a solução ácida rhCollMA.
- Diluir a solução rhCollMA neutralizada à concentração desejada de 10 mg/mL, misturando-a com a quantidade necessária de 1x tampão fosfato.
NOTA: A concentração de estoque de rhCollMA varia entre os lotes. Portanto, o volume de tampão fosfato de 1x necessário para atingir a concentração desejada irá variar. - Prepare a solução de fotoinicializador porogen-fotoinitiador (PEO-LAP) para ser combinada com o rhCollMA neutro diluído.
- Prepare uma solução de 1,6% (w/v) de poli (óxido de etileno) (PEO) em DMEM sem fenol, dissolvendo 160 mg de PEO em 10 mL de DMEM.
- Adicione 20 mg de fenil de lítio-2,4,6-trimethylbenzoylphosphinate (LAP) a esta solução para obter 0,2% (w/v) LAP na solução. A partir deste ponto, cubra a solução com papel alumínio ou mantenha-a em um lugar escuro para protegê-la da luz.
- Esterilize a solução PEO-LAP passando-a através de um filtro de 0,22 μm. Armazene esta solução a 4 °C por até 1 semana.
- Antes da bioimpressão, misture a solução rhCollMA neutra diluída com a solução PEO-LAP em uma proporção de 1:1 para obter a solução bioink final. Use pipetting, em vez de um vórtice, para misturar as soluções, evitando bolhas de ar.
- Se muitas bolhas forem introduzidas na solução, centrifuse-a a 2.000 × g por 30 s. Após a centrifugação, misture novamente a solução de bioink para garantir a homogeneidade.
4. Preparação para banho de suporte granular
- Prepare o material de suporte granular de gelatina.
- Em um gabinete de segurança biológica, divida o conteúdo de um tubo de 2 g de material de suporte liofilizado em dois tubos cônicos estéreis de 50 mL, cada um contendo aproximadamente 1 g.
- Adicione 40 mL de DMEM livre de fenol-vermelho a cada tubo e vórtice vigorosamente até que todo o material de suporte liofilizado se dissolva.
- Deixe o chorume resultante sentar-se a 4 °C para permitir que o material de suporte se reidrate.
- Degas o material de suporte em uma câmara de vácuo por 30 minutos para reduzir bolhas.
- Centrifugar o material de suporte a 2.000 × g por 5 min. Certifique-se de que o material está na parte inferior do tubo e o sobrenatante está claro.
- Aspire o supernaste, tomando cuidado para não aspirar o material de suporte na parte inferior.
NOTA: O material de suporte não deve fluir enquanto inclina o tubo depois de remover o sobrenatante. Se o material fluir, centrifuá-lo novamente usando as mesmas configurações, mas sem adicionar novo supernatante.
- Transfira aproximadamente 4 mL do material de suporte preparado e compactado para cada poço de uma placa de 12 poços usando uma pipeta de deslocamento positiva. Toque na placa do poço em uma superfície dura para forçar o material de suporte a se espalhar uniformemente no poço.
NOTA: O volume mínimo recomendado de material de suporte é 3x o volume da construção que será impressa nele. - Coloque a placa do poço com o material de suporte em um estágio bioimpressora resfriado, ou a 4 °C, até que seja usada para evitar que as partículas de gelatina derretissem.
5. Incorporação de células endoteliais e células de suporte com o bioink
- Prepare o meio da célula endotelial de acordo com as instruções do fabricante, misturando o meio basal com seu componente de kit médio correspondente, incluindo uma solução antibiótica, soro bovino fetal e suplementos de crescimento de células endoteliais.
- Prepare o meio da célula-tronco da polpa dentária combinando 500 mL de DMEM de baixa glicose, 58 mL de soro bovino fetal, 5,8 mL de aminoácidos não essenciais (NEAA), 5,8 mL de substituto de glutamina, 5,8 mL de 1 M HEPES e 5,8 mL de solução penicilina-estreptomicina-nystatina.
- Prepare uma suspensão contendo 2 × 106 ZsGreen1-expressando células microvasculares microvasculares microvasculares (HAMEC-ZsGreen1) e 6 × 10 6 células-tronco depolpa dental (DPSCs) em 10 mL de meio de células endoteliais.
- Centrifugar a suspensão celular a 200 × g por 4 min para obter uma pelota celular. Aspire o meio supernante.
- Resuspenque a pelota celular em 1 mL de bioink rhCollMA preparado anteriormente (contendo PEO-LAP) para obter um bioink com uma concentração celular total de 8 × 106 células por 1 mL de bioink.
ATENÇÃO: Depois de combinar o bioink com as células, proceda imediatamente para o próximo passo. Se as células forem deixadas na suspensão por um longo tempo, as células afundarão no fundo do tubo, e sua viabilidade se deteriorará. Para experimentos que não envolvam células, pule as etapas 5.1-5.5, ou incorpore contas fluorescentes com o bioink em vez de células para visualização microscópica aprimorada dos construtos impressos. - Transfira a mistura célula-bioink para cartuchos de impressão.
- Coloque uma agulha de diâmetro interno de 0,22 mm em um cartucho de impressão âmbar de 3 mL e coloque o cartucho em um tubo cônico de 50 mL.
- Transfira 1 mL da mistura células-bioink para o cartucho de impressão preenchendo-a a partir do topo, usando uma pipeta de deslocamento positiva para reduzir bolhas.
- Instale o cartucho de impressão na ferramenta apropriada na bioimpressora.
6. Bioimpressão de redes microvasculares usando bioink rhCollMA
- Crie um design CAD 3D para a rede microvascular bioimpressora.
- Esboce um padrão 2D de um quadrado de 4 mm contendo um canal circular de 2 mm de diâmetro em seu centro. Extrude o esboço por 4 mm para obter um cubo de 4 mm x 4 mm x 4 mm com um canal central. Exporte este objeto como um . Arquivo STL.
- Importe uma placa de 12 poços. Modelo STL na guia de modelagem sólida no software de fatiamento de bioimpressora e coloque-o na área designada da cama de impressão virtual.
- Importar o . Arquivo STL da forma do cubo na guia de modelagem sólida no software de corte de bioimpressora. Clique na caixa de seleção de fatiador externo | configurar cortador sob a seção propriedades do objeto . Na janela pop-up, escolha um padrão retilíclear para o padrão de preenchimento e digite 30% na densidade de preenchimento. Clique em aceitar.
- Coloque uma cópia da forma do cubo em cada poço virtual desejado clicando no cubo e movendo-o usando o mouse.
- Crie novas configurações de material para bioink rhCollMA na guia de materiais do software de fatiamento de bioimpressora clicando no botão adicionar material . Escolha as configurações do material para impressão. Para pressão, digite 2 psi na caixa correspondente. Para velocidade, digite 20 mm/s na caixa correspondente.
NOTA: Cada material de bioink tem suas próprias configurações de impressão diferentes que podem ser salvas na lista de materiais na aplicação. - Atribua os valores de largura e altura da linha de linha a 0,24 mm e o valor de aceleração a 400 mm/s2, digitando esses valores nas caixas correspondentes.
- Na guia de modelagem sólida , clique no objeto cubo e clique no material rhCollMA da seção de materiais para atribuí-lo à forma do cubo. Na guia biomontagem , clique no botão enviar trabalho de impressão para enviar o trabalho de impressão para o bioimpressor.
- Carregue o cartucho de impressão carregado com o bioink celular na ferramenta de dispensa pneumática ambiente de 3 mL da bioimpressora à base de extrusão 3D.
- Defina a temperatura da cama de impressão para 4 °C clicando no botão frio sob a guia Control-Heating/Cooling na tela da interface bioimpressora. Carregue a placa com o banho de suporte na cama da impressora.
NOTA: As configurações do material para pressão e velocidade de impressão podem mudar devido a diferenças na temperatura ambiente ou variabilidade do lote de bioink. Por exemplo, em dias mais frios, é necessária uma pressão mais alta ou uma velocidade mais lenta para extrusir a mesma quantidade de material. - Na guia de impressão na tela da interface bioimpressora, clique no trabalho de impressão enviado na Etapa 6.7. e clique em iniciar | ir para começar o trabalho de impressão.
- Após a impressão, exponha a placa de poço a uma fonte de luz de 405 nm com uma intensidade de 3 mW/cm2 para 30 s para iniciar o crosslinking do bioink rhCollMA.
- Após a ligação cruzada, incubar a placa do poço a 37 °C e 5% de CO2 por pelo menos 20 min até que todo o banho de suporte derreta.
- Aspire suavemente o banho de suporte liquefeito e substitua-o por meio de célula endotelial. Incubar as construções a 37 °C e 5% de CO2 até usar em outras etapas.
NOTA: Devido à contração da construção após a impressão, recomenda-se realizar a montagem passo 7 no mesmo dia da Etapa 6.
7. Montagem da rede microvascular bioimpressora com o andaime vascular para obter o retalho vascular projetado
- Imediatamente após a remoção do material de suporte da rede microvascular bioimpressora, coloque um andaime vascular PLLA:PLGA revestido de fibronectina no canal principal da estrutura bioimpressora.
- Incubar as construções montadas a 37 °C e 5% de CO2 por 2 dias.
- Forque o lúmen do andaime vascular com células endoteliais.
- Prepare uma suspensão celular de células endotelias microvasculares que expressam tdTomato (HAMEC-tdTomato) a uma concentração de 1 × 107 células/mL.
- Coloque uma gotícula de 20 μL desta suspensão celular em uma superfície hidrofóbica (ou seja, uma cultura não-tecidual [nãoTC] prato de 10 cm).
- Coloque suavemente os andaimes vasculares em cima da gota, de tal forma que o lúmen do andaime de uma extremidade faça contato com a gota celular.
- Aspire a gota da extremidade oposta do andaime (ou seja, a extremidade que não está entrando em contato com a gotícula), preenchendo seu lúmen com a suspensão da célula.
- Coloque o andaime semeado em um tubo de microcentrifuuge e coloque-o em uma rotadora dentro de uma incubadora umidificada por 60 minutos. Em seguida, transfira o andaime para uma placa de 12 poços e adicione 2 mL de meio de célula endotelial.
- Cultura os retalhos projetados por 7 dias, substituindo o meio a cada 2 dias por meio de célula endotelial fresca.
8. Microscopia confocal e coloração de imunofluorescência dos retalhos projetados
- Após 4 dias e 7 dias de cultura, realize imagens de células vivas dos andaimes montados usando um microscópio de varredura a laser confocal.
- Defina os canais de fluorescência para proteínas fluorescentes ZsGreen1 e tdTomato no software de aquisição de imagens de microscópio.
- Escolha uma lente objetiva 5x/0.16 com zoom de 0,5x (tamanho de pixel 5 μm), e defina uma pilha Z com 22 fatias com uma espessura de 41 μm cada.
- Defina uma varredura de ladrilhos 3 x 2 para a imagem e capture toda a construção.
- Ajuste a intensidade do laser e ganhe valores para obter um sinal fluorescente claro sem saturação e fundo mínimo e adquirir as imagens.
- Realize uma projeção de intensidade máxima da pilha Z adquirida para obter uma única imagem 2D usando o software de aquisição de imagens de microscópio ou software de análise de imagem semelhante.
- Realizar maior ampliação de imagem de uma região de interesse.
- Mude para uma lente objetiva de 10x/0.3 com zoom de 0,5 (tamanho de pixel 1,25 μm) e defina uma pilha Z com 9 fatias de espessuras de 41 μm.
- Execute as etapas 8.2.-8.3.
- Após 7 dias de cultura, conserte os retalhos projetados submergindo-os em 4% de paraformaldeído por 20 min.
- Lave as construções 3x 5 min com PBS.
- Adicione 0,3% (v/v) Triton-X no PBS às construções e incubar por 15 minutos à temperatura ambiente para permeabiliizar as células.
- Lave as construções 3x 5 min com PBS.
- Prepare uma solução de bloqueio dissolvendo 5% (w/v) albumina de soro bovino (BSA) na PBS. Adicione a solução de bloqueio aos retalhos projetados e incubar por 1h à temperatura ambiente.
- Prepare a solução primária de anticorpos diluindo o anticorpo anti-liso do camundongo (anti-SMA) 1:50 na solução BSA de 5% preparada anteriormente para manchar as células de suporte que expressam SMA.
- Incubar os andaimes na solução de anticorpos primários durante a noite a 4 °C.
- Lave 3x 5 min com PBS.
- Prepare a solução secundária de anticorpos diluindo o anticorpo anti-rato de cabra conjugado Cy3 IgG 1:400 e 4',6-diamidino-2-fenilndole (DAPI, 2,5 μg/mL) em PBS.
- Aplique a solução de anticorpos secundários nos andaimes e incubar por 3h à temperatura ambiente.
- Lave 3x 5 min com PBS.
- Armazene os construtos a 4 °C na PBS por até 1 mês.
- Imagem dos andaimes manchados usando um microscópio de varredura a laser confocal.
- Defina os três canais de fluorescência (DAPI, ZsGreen e Cy3) no software de aquisição de imagens de microscópio.
- Defina uma pilha Z com uma espessura de seção de 2 μm abrangendo uma espessura total de 50 μm. Em seguida, defina uma varredura de ladrilhos para imagem de áreas maiores da construção.
- Ajuste os parâmetros de aquisição para obter um sinal fluorescente claro, sem saturação e fundo mínimo.
- Adquira as imagens usando o objetivo 20x/0.8 com zoom de 1,0x (tamanho do pixel 0,31 μm).
- Realize uma projeção de intensidade máxima da pilha Z adquirida para obter uma única imagem 2D usando o software de aquisição de imagens de microscópio ou software de análise de imagem semelhante.
9. Anastomosing a aba projetada diretamente na artéria femoral de um rato usando uma técnica de manguito
- Prepare e esterilize (autoclave) as seguintes ferramentas cirúrgicas: Bisturi nº 15, um par de fórceps de dentes finos e um pequeno par de tesouras manuseadas a anel. Além disso, prepare e esterilize as seguintes ferramentas microcirúrgicas: fórceps de um joalheiro de ponta reta nº 3, fórceps de um joalheiro em ângulo, um suporte de agulha com mandíbulas curvas, um par de dilatadores de vasos, tesouras dissecando, tesouras adventitia, bem como grampos de vaso com seu aplicador.
- Prepare uma solução de 100 salina heparinizada de 100 UI/mL diluindo 5 mL de solução de heparina de estoque com 195 mL de soro fisiológico.
- Corte e esterilize as algemas de poliísida.
- Corte seções de 2,5 mm de um tubo de poliimida sob um microscópio dissecando.
- Em uma extremidade de cada seção, faça uma incisão de 1,25 mm na parede do tubo para obter uma alça de punho. Faça um corte em ângulo na outra extremidade do tubo para aliviar a eversão do vaso.
- Submergir as algemas em 70% de etanol seguido de duas lavagens com soro fisiológico heparinizado.
- Prepare um rato Sprague-Dawley masculino (275-350 g) para cirurgia.
- Sete dias antes da cirurgia, comece a administrar uma dose diária subcutânea de ciclosporina (10 mg kg-1) para alcançar a supressão imunológica.
- Antes da cirurgia, anestesia o animal usando 3% de inalação de isoflurano de acordo com o SOP institucional usando uma câmara de indução. Verifique a anestesia profunda apertando os dois pés e verificando se há reflexos.
- Administre uma dose subcutânea de buprenorfina analgésico (0,03 mg kg-1) e heparina anticoagulativa (200 UI kg-1).
- Aplique uma pomada lubrificante nos olhos do animal para evitar a desidratação.
- Raspe a área cirúrgica do rato e desinfete o local com iodo e depois 70% de etanol. Fixar os membros do animal na mesa usando fita adesiva.
- Exponha e isole a artéria femoral comum.
- Faça uma incisão oblíqua de 2 cm de comprimento através da pele, ao longo da concavidade entre a perna e o abdômen.
- Usando fórceps e tesouras sem corte, solte a pele do tecido subjacente para visualizar a almofada de gordura inguinal.
- Usando tesouras e fórceps, corte através da almofada de gordura ao redor das margens superior, medial e inferior. Preste atenção para não cortar vasos grandes sob a almofada de gordura.
- Reflita a almofada de gordura lateralmente, deixando os vasos epigástricos intactos. Coloque uma gaze molhada na almofada de gordura refletida para evitar a secagem e fixá-la no lugar. Certifique-se de que os vasos femorais comuns sejam visíveis.
NOTA: A almofada de gordura será usada posteriormente para aplicar pressão suave aos anastomoses. - Exponha a artéria femoral do ligamento inguinal proximalmente ao ponto de ramificação da artéria epigástrica, extraindo-a de sua baia.
ATENÇÃO: Geralmente há um ramo da artéria femoral correndo por baixo dela, comumente chamado de ramo de Murphy. Preste atenção para não danificar este ramo difícil de ver. - Divida o ramo de Murphy ligando-o e, em seguida, ligate a artéria femoral com duas ligaduras no meio da artéria espaçada 1 mm de distância. Mantenha uma extremidade da sutura de ligadura longa para usar mais tarde para puxar a extremidade do vaso através da braçadeira.
- Corte a artéria entre as duas ligaduras usando uma tesoura adventitia.
ATENÇÃO: Não deve haver sangramento ao realizar este corte. Se a extremidade arterial sangrar, aperte a artéria e reaplique uma ligadura. - Usando a extremidade longa da sutura de ligadura, insira cada extremidade do vaso em um manguito de poliimida, como preparado na etapa anterior, de tal forma que as alças das duas algemas estejam apontando para longe uma da outra.
- Após a inserção, aplique um grampo simultaneamente na alça do punho e no vaso, fixando a braçadeira no lugar.
- Prepare uma solução salina heparinizada em uma seringa equipada com uma agulha de 27 G.
- Puxe a extremidade do vaso ligado e corte-a perto da ligadura. Lave imediatamente o recipiente com o soro fisiológico heparinizado até que nenhum sangue seja visível no lúmen.
ATENÇÃO: Certifique-se de que a extremidade do vaso é bem lavada, uma vez que qualquer sangue deixado no interior formará um coágulo, que será introduzido na corrente sanguínea ao completar o procedimento. Isso pode levar à oclusão do vaso e perda de perfusão na perna. - Expanda o lúmen do navio segurando-o por sua baia com uma mão e dilatando seu lúmen com o dilatador de vasos com a outra mão.
- Coloque uma sutura circunferencial de polipropileno solta 6-0 ao redor do corpo do manguito. Everta a extremidade do vaso usando dois dilatadores de vaso sobre o corpo do punho e fixá-lo no lugar apertando a sutura circunferencial.
NOTA: Se algum sangue vazar através do vaso preso durante as manipulações, lave o lúmen cuidadosamente com soro fisiológico heparinizado. - Enxágüe a aba projetada com soro fisiológico heparinizado e, em seguida, insira o manguito forrado no lúmen do andaime vascular. Fixar o andaime no lugar colocando uma sutura circunferencial de polipropileno 6-0 ao redor do andaime e do corpo do punho. Faça este passo para ambos os lados do andaime vascular.
- Enrole um filtro de membrana de poliestireno de 0,2 μm ao redor do local dos anastomosos para isolar a aba projetada do tecido circundante.
- Solte o grampo distal primeiro; em seguida, solte o grampo proximal para restabelecer o fluxo sanguíneo através do vaso.
- Para parar qualquer sangramento através dos anastomoses, reflita a almofada de gordura sobre os vasos femorais e aplique pressão suave usando uma gaze estéril por 3 minutos.
- Suturar a almofada de gordura de volta no lugar usando 6-0 polipropileno; em seguida, suturar a pele usando suturas 5-0 PGA absorvíveis.
- Limpe a área da ferida com soro fisiológico e aplique solução de iodo.
- Para dor pós-operatória e manejo animal, prepare 0,1% (v/v) de tramadol na água potável. Além disso, administre uma dose diária de heparina (200 UI kg-1) e ciclosporina (10 mg kg-1).
- Coloque o animal em uma gaiola limpa por si só colocado sob uma lâmpada de aquecimento. Continue monitorando o animal até que ele recupere a consciência suficiente para manter a recumbência severa.
Resultados
Este protocolo descreve a fabricação de um retalho projetado composto por um andaime vascular (Figura 1Ai) e uma microvasculatura bioimpressora (Figura 1Aii), que foram montadas para alcançar vasculaturas de mesoescala e microescala (Figura 1Aiii). Seguindo o protocolo, foram projetados moldes BVOH do andaime vascular e impressos em 3D (Figura 1B,C). As estruturas impressas obtidas foram inspecionadas visualmente para pequenos fios de BVOH, que podem ser encontrados nos espaços vazios dos moldes (Figura 1D). Estes fios geralmente indicam configurações de material incorretas ou que o BVOH absorveu umidade. Estes fios devem ser removidos, pois podem levar ao enchimento incompleto do molde e defeitos estruturais no andaime vascular resultante. Em seguida, os moldes foram preenchidos com solução PLLA:PLGA, seguidos do processo de secagem congelante e das etapas de lavagem, conforme descrito no protocolo. O andaime vascular PLLA:PLGA obtido foi inspecionado visualmente para verificar a integridade da parede do vaso e a patência de lúmen (Figura 1E).
Um bioink rhCollMA neutralizado a uma concentração de 10 mg/mL foi preparado e combinado em uma razão de 1:1 com a solução PEO:LAP. Células endoteliais microvasculares adiposas humanas rotuladas com Zs-Green1 e células-tronco de polpa dentária foram resuspendidas com o bioink rhCollMA, e a solução foi carregada em um cartucho de impressão e na impressora. As formas da caixa com um canal central com padrão retilinear (Figura 1D) foram bioimpressionadas dentro do banho de suporte à gelatina. Após a impressão, as construções foram cruzadas, e o banho de suporte foi dissolvido e lavado. Após 4 dias de cultura, os construtos foram live-imaged para verificar se há auto-montagem da rede microvascular. A Figura 1D mostra um exemplo de uma rede microvascular HAMEC-ZsGreen1 altamente desenvolvida na construção bioimpressora.
Em seguida, um andaime vascular revestido de fibronectina foi inserido no canal central da construção impressa (Figura 2A). As construções montadas foram cultivadas por 2 dias, durante os quais as células contraem o gel, anexando-o firmemente ao andaime vascular. Em seguida, o andaime vascular foi forrado com HAMECs expressando tdTomato, de acordo com o protocolo. Após 7 dias de cultura, as construções foram fixadas e imagens. A Figura 2B mostra uma visão lateral das construções montadas onde as células endoteliais na microvasculatura bioimpressora são retratadas em verde, enquanto o revestimento endotelial do andaime vascular é retratado em vermelho. A imagem mostra um auto-montagem microvascular verde no gel bioimpresso, enquanto o andaime vascular é forrado com células endoteliais vermelhas. Com maior ampliação, brotos originários do forro endotelial vermelho são vistos brotando e anastomos com a rede microvascular bioimpressora (Figura 2C). Em seguida, as construções foram manchadas para actina muscular α-lisa (SMA) como marcador para as células-tronco da polpa dentária. Após a imunostainagem, os construtos foram imagens usando um microscópio confocal de varredura a laser (Figura 2D).
Por fim, após 7 dias de cultura, os retalhos projetados foram microsurgicamente anastomosados à artéria femoral de um rato, como descrito no protocolo. Um vídeo de um procedimento representativo pode ser visto no Vídeo Suplementar S1. A Figura 2E mostra uma imagem representativa de um anastomos completo antes da remoção do grampo, e a Figura 2F mostra uma imagem representativa do local de anastomoses após a remoção do grampo e hemostasia. Não deve haver sangramento visível antes do fechamento da ferida.
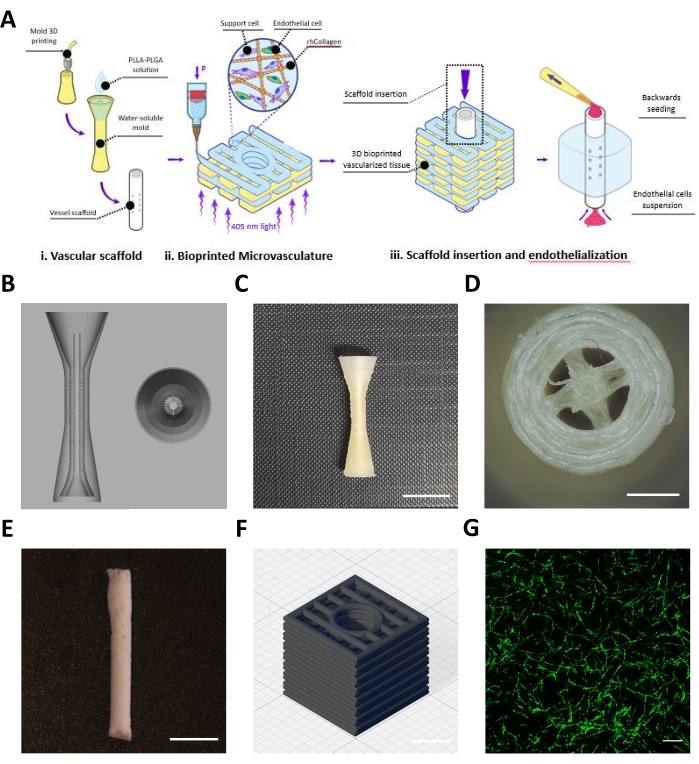
Figura 1: Imagens representativas dos vasos meso e microescala fabricados. (A) Visão geral esquemática dos passos do protocolo. Reproduzido com permissão16. (B) Projeto CAD para o molde sacrificial do andaime vascular. (C) Visão lateral de um molde sacrificial impresso em 3D representativo (barra de escala = 0,5 mm). (D) Visão superior do molde sacrificial (barra de escala = 0,5 mm) (E) Andaime vascular representativo fabricado utilizando o protocolo de descrever (barra de escala = 5 mm). (F) Projeto CAD para a rede microvascular 3D bioimpressora rhCollMA. Linhas de grade = 1 mm. (G) Imagem representativa de uma rede vascular bioimpressora altamente desenvolvida mostrando HAMEC-ZsGreen1 em verde. Barra de escala = 200 μm. Abreviaturas: CAD = design auxiliado por computador; rhCollMA = metacrilato de colágeno humano recombinante; HAMEC = células endotelias microvasculares de adiposo humano; PLLA = ácido poli-L-láctico; PLGA = ácido polilático-coglicólico. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagens representativas do retalho vascularizado montado. (A) Uma fotografia de um conjunto representativo de microvasculatura bioimpressora e do andaime vascular. Barra de escala = 1 mm. (B) Visão lateral de um retalho projetado representativo imagemdo 4 dias após forro endotelial do andaime vascular. A microvasculatura bioimpressora é mostrada em verde (HAMEC-ZsGreen1), enquanto o revestimento endotelial é mostrado em vermelho (HAMEC-tdTomato). Barra de escala = 1 mm. (C) Imagem representativa de anastomoses entre a vasculatura bioimpressora em verde e o forro endotelial em vermelho. Barra de escala = 200 μm. (D) Imagem representativa de imunostaining para actina muscular lisa (vermelho), núcleos (azul) e células endoteliais (verde) após 7 dias de incubação. Barra de escala = 0,1 mm. (E) Imagem representativa de uma anastómosa completa da aba projetada com artéria femoral de um rato antes da remoção do grampo e (F) após a remoção do grampo. Abreviaturas: HAMEC = células endotelias microvasculares adiposasculares humanas; SMA = ato muscular liso; DAPI = 4',6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.
Vídeo suplementar S1: Procedimento microcirúrgico representativo para anastomosar o andaime vascular na artéria femoral de um rato. Clique aqui para baixar este vídeo.
Discussão
A engenharia de tecidos vascularizados é um dos principais desafios da engenharia de tecidos20. Os métodos atuais para criar tecidos vasculares projetados se concentram na criação de microvasculatura auto-montada 21,22,23 ou na fabricação de andaimes vasculares mesoescalados24,25 e não na recriação de um sistema de vasculatura hierárquica, que pode ser perfumado imediatamente e diretamente após a implantação26 . Neste trabalho, descrevemos um protocolo que faz uso de duas modalidades de impressão 3D para fabricar uma rede de embarcações hierárquicas composta por vasculaturas de microescala e mesoescala. O protocolo combina uma rede microvascular auto-montada em 3D com um andaime vascular mesoescalado, alcançando um retap implantável e vascularizado. Além disso, este artigo apresenta um protocolo para anastomosar diretamente este retalho à artéria femoral de um rato.
A bioimpressão 3D ganhou interesse nos últimos anos devido à sua versatilidade em relação às técnicas tradicionais de engenharia de tecidos. Embora este protocolo descreva a geração de uma rede microvascular no bioink rhCollMA, os métodos utilizados podem ser aplicados com poucas modificações a muitas outras bioinks da infinidade de bioinks estudados e novos e banhos de suporte27,28. Optamos por usar o rhCollMA como um bioink devido à abundância de colágeno tipo I no ECM humano, proporcionando um ambiente adequado para o apego celular. Além disso, é produzido recombinantemente em plantas e ainda modificado com grupos de metacrilato, o que permite a fotopolimerização e a formação de hidrogéis 3D estáveis 29,30. O fotocrosslinking foi conseguido pela adição do fotoiniciador LAP, que se mostrou não tóxico e é ativado pela exposição à luz azul de 405 nm, reduzindo a possível fototoxicidade da luz UV. No entanto, o uso de bioinks fotosensitivos requer o uso de um meio de cultura livre de fenol para a preparação do bioink e do material de suporte. Além disso, o protocolo descreve o uso de material de suporte à gelatina, que permite a extrusão de alta fidelidade de bioinks como rhCollMA. Assim, é fundamental garantir o uso do meio frio durante sua preparação e o resfriamento do leito da impressora. O aquecimento excessivo pode ocorrer devido à fonte de luz usada para crosslinking ou de temperaturas ambientais elevadas.
Uma bioimpressora baseada em extrusão foi usada aqui para criar a rede microvascular bioimpressora, e atualmente existem muitos bioimpressores disponíveis comercialmente que podem gerar construções semelhantes. Além disso, os métodos propostos podem ser facilmente modificados e aplicados para estudar diferentes geometrias, tamanhos e padrões de enchimento. Neste trabalho, um padrão de enchimento retilinear foi escolhido para criar poros interconectados, e isso pode ser impresso relativamente rapidamente com alta fidelidade.
As bolhas de ar introduzem um desafio significativo na bioimpressão de extrusão, especialmente materiais de suporte interno. Por isso, é fundamental minimizar a presença e a formação dessas bolhas utilizando pipetas de deslocamento positivas para a transferência do material de suporte, a preparação da suspensão bioink-cell e sua transferência para os cartuchos de impressão.
Neste trabalho, células endoteliais derivadas de adiposos humanos e células-tronco de polpa dentária foram usadas como células de apoio devido ao seu isolamento relativamente fácil dos pacientes. Além disso, foi escolhida uma concentração celular total de 8 x 106 células/mL, uma vez que essa concentração foi demonstrada para estabelecer as redes vasculares mais desenvolvidas16. Embora este protocolo possa ser empregado para gerar microvasculatura utilizando diferentes tipos e fontes celulares, bem como diferentes bioinks, uma calibração da concentração celular deve ser feita para estabelecer as melhores condições para o desenvolvimento da rede microvascular. Além disso, células específicas do tecido (ou seja, míobios ou osteoblastos) podem ser incorporadas dentro do bioink para alcançar retalhos vascularizados específicos do tecido.
O molde para o andaime vascular poroso foi fabricado usando material solúvel em água impressa em 3D em uma impressora 3D de extrusão comercialmente disponível. Isso resulta em uma técnica econômica baseada em plataformas de prototipagem rápida, de modo que muitas geometrias e tamanhos diferentes de andaimes vasculares podem ser estudados e rastreados rapidamente31. No entanto, uma limitação deste método é o limite de resolução da maioria das impressoras3D 32. No entanto, com a indústria em rápida evolução em torno da manufatura aditiva, espera-se que esses limites melhorem com o tempo. O uso de solventes orgânicos para o processo de fabricação é outra limitação do protocolo, uma vez que a maioria dos solventes orgânicos são tóxicos para as células, impedindo a capacidade de combinar o procedimento de bioimpressão com o processo de fabricação de andaimes vasculares.
O método descrito de semear o lúmen do andaime usando aspiração em vez de empurrar a suspensão celular tem grandes efeitos na localização das células semeadas. O uso de pressão negativa permite a endotopelização do lúmen interno do andaime, minimizando qualquer derramamento da suspensão celular através das perfurações na parede16 do andaime.
O método descrito de "manguito" para anastomos microcirúrgicos pode ser facilmente modificado e adaptado a diferentes materiais ou tamanhos de andaimes vasculares, bem como a diferentes artérias e veias em uma ampla escala de modelos animais. As adaptações ao protocolo incluiriam diferentes tamanhos de tubos de poliimida e tamanhos de sutura. Este método não requer a perfuração da parede do andaime, o que pode levar ao desenvolvimento de defeitos. Este trabalho apresenta um protocolo que pode ser expandido para muitas aplicações. Os aspectos críticos deste protocolo, que incluem a fabricação da vasculatura meso e microescala e sua montagem e implantação, representam aspectos críticos de retalhos projetados tanto para aplicações reconstrutivas, quanto para estudos vasculares e outros estudos de engenharia de tecidos.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este projeto recebeu financiamento do Conselho Europeu de Pesquisa (ERC) no âmbito do Programa de Pesquisa e Inovação Horizon 2020 da União Europeia (acordo de concessão nº 818808). rhCollMA foi generosamente fornecido por CollPlant (Rehovot, Israel). Os autores agradecem à Autoridade de Pesquisa Pré-Clínica da Technion pela assistência com os cuidados com animais, bem como Janette Zavin, Galia Ben David e Idan Redenski.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,4-Dioxane | Biosolve Chemical | 42405 | |
| 27 G x 0.5" blunt tip dispensing needles | CML supply | 901-27-050 | |
| 3cc amber syringe barrel & piston set | Nordson EFD | 7012085 | Amber syringes used to block light and prevent premature crosslinking |
| 5-0 AssuCryl PGA absorbale suture | Assut Sutures | Absorbable sutures used for skin wound closure | |
| 6-0 polypropelene sutures | Assut Sutures | 9351 | |
| Acland clamps | S&T | B-1V | |
| Adventitia scissors | S&T | SAS-15 | |
| Angled no.3 jeweler's forceps | S&T | JFAL-3-18 | |
| BioAssemblyBot 400 3D Bioprinter | Advanced Solutions | a 6-axis 3D bioprinter | |
| Bovine albumin serum Probumin | Millipore | 82-045-1 | |
| Buprenorphine | vetmarket | B15100 | |
| BVOH filament | Verbatim | 55903 | a water-soluble 1.75 mm diameter filament |
| Clamp applying forceps | S&T | CAF-4 | |
| Dental pulp stem cells | Lonza | PT-5025 | |
| Dietrich bulldog clamps | Fine Science Tools (FST) | 18039-45 | |
| di-Sodium hydrogen phosphate (Na2HPO4) | Carlo Erba Reagents | 480141 | |
| Dissection scissors | S&T | 18039-45 | |
| DMEM, High Glucose, No Phenol Red | Sartorius | 01-053-1A | |
| Duratears | Alcon | DJ03 | |
| ECM media + bullet kit | Sciencell | #1001 | |
| Ethanol 96% | Gadot-Group | 64-17-5 | |
| GlutaMAX | Gibco | 35050061 | glutamine substitute |
| Goat anti-mouse Cy3 antibody | Jackson | 115-166-072 | |
| Heparin Sodium 5,000 I.U./mL | Panpharma | - | |
| Human adipose microvascular cells | Sciencell | #7200 | |
| Human fibronectin | Sigma | F0895-5MG | A stock concentration of 1 mg/mL |
| Isoflurane, USP Terrell | Piramal Critical Care | NDC 66794-011-25 | |
| LifeSupport | Advanced Biomatrix | 5244 | a gelatin support slurry for FRESH 3D bioprinting |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | |
| Low-glucose DMEM | Biological Industries | 01-050-1A | |
| MICROMAN E M1000E, 100-1,000 µL | Gilson | FD10006 | |
| Mouse anti-SMA antibody | Dako | M0851 | |
| NEAA | Gibco | 11140068 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Paraformaldehyde solution 4% in PBS | ChemCruz | SC-281692 | |
| Penicillin-Streptomycin-Nystatin Solution | Biological Industries | 03-032-1B | |
| Phospate buffered saline (PBS) | Sigma | P5368-10PAK | |
| Poly(ethylene oxide), M.W. 250,000 to 400,000 | Acros Organics | 178602500 | |
| Poly(L-lactic acid), IV 5.0 dl/g (PLLA) | Polysciencse, Inc. | 18582-10 | |
| Polyimide tubing, ID: 0.0249", OD: 0.0273" | Cole-Parmer | 95820-05 | A thin-walled tube used to fabricate cuffs for microsurgical anastomoses |
| Prusa I3 MK2.5 3D Printer | Prusa Research | http://www.prusa3d.com/ | a popular commercial 3D printer |
| Resomer RG 503 H, Poly(D,L-lactide-co-glycolide) (PLGA) | Evonik Industries | 719870 | |
| rhCollMA | CollPlant | https://collplant.com/ | generously provided by CollPlant (Rehovot, Israel) |
| round-handled needle holder | S&T | B-15-8 | |
| Scalpel handle - #3 | Fine Science Tools (FST) | 10003-12 | |
| small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Sodium Chloride | Biosolve Chemical | 19030591 | |
| Sodium Phosphate dibasic (NaH2PO4) | Riedel-de Haen | 4276 | |
| Solidworks | Dassault Systems | CAD software | |
| Straight no.3 jeweler's forceps | S&T | JF-3-18 | |
| Straight serrated forceps | Fine Science Tools (FST) | 11050-10 | |
| Surgical Scalpel Blade No.15 | Swann-Morton Limited | 305 | |
| Triton-X 100 | BioLab LTD | 57836 | |
| TSIM | Advanced Solutions | 3D slicing and design software for the BioAssembly Bot | |
| Vessel dilator | S&T | D-5a.1 | |
| Zeiss Tivato 700 surgical microscope | Zeiss |
Referências
- Wallace, C. G., Wei, F. -C. C. The current status, evolution and future of facial reconstruction. Chang Gung Medical Journal. 31 (5), 441-449 (2008).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), 12(2012).
- Duan, B. State-of-the-art review of 3D bioprinting for cardiovascular tissue engineering. Annals of Biomedical Engineering. 45 (1), 195-209 (2017).
- Kim, J. J., Hou, L., Huang, N. F. Vascularization of three-dimensional engineered tissues for regenerative medicine applications. Acta Biomaterialia. 41, 17-26 (2016).
- Ouyang, L., Armstrong, J. P. K., Chen, Q., Lin, Y., Stevens, M. M. Void-free 3D bioprinting for in situ endothelialization and microfluidic perfusion. Advanced Functional Materials. 30 (1), 1908349(2020).
- Baltazar, T., et al. Three dimensional bioprinting of a vascularized and perfusable skin graft using human keratinocytes, fibroblasts, pericytes, and endothelial cells. Tissue Engineering - Part A. 26 (5-6), 227-238 (2020).
- Chia, H. N., Wu, B. M. Recent advances in 3D printing of biomaterials. Journal of Biological Engineering. 9 (1), 4(2015).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Guillotin, B., et al. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials. 31 (28), 7250-7256 (2010).
- Catros, S., et al. Laser-assisted bioprinting for creating on-demand patterns of human osteoprogenitor cells and nano-hydroxyapatite. Biofabrication. 3 (2), (2011).
- Ronca, A., Ambrosio, L., Grijpma, D. W. Preparation of designed poly(d,l-lactide)/nanosized hydroxyapatite composite structures by stereolithography. Acta Biomaterialia. 9 (4), 5989-5996 (2013).
- Lan, P. X., Lee, J. W., Seol, Y. J., Cho, D. W. Development of 3D PPF/DEF scaffolds using micro-stereolithography and surface modification. Journal of Materials Science: Materials in Medicine. 20 (1), 271-279 (2009).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655(2015).
- Szklanny, A. A., et al. 3D bioprinting of engineered tissue flaps with hierarchical vessel networks (VesselNet) for direct host-to-implant perfusion. Advanced Materials. 33 (42), 2102661(2021).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. Journal of Visualized Experiments JoVE. (69), (2012).
- Sucher, R., et al. Mouse hind limb transplantation: A new composite tissue allotransplantation model using nonsuture supermicrosurgery. Transplantation. 90 (12), 1374-1380 (2010).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), (2014).
- Novosel, E. C., Kleinhans, C., Kluger, P. J. Vascularization is the key challenge in tissue engineering. Advanced Drug Delivery Reviews. 63 (4-5), 300-311 (2011).
- Landau, S., et al. Tropoelastin coated PLLA-PLGA scaffolds promote vascular network formation. Biomaterials. 122, 72-82 (2017).
- Szklanny, A. A., et al. High-throughput scaffold system for studying the effect of local geometry and topology on the development and orientation of sprouting blood vessels. Advanced Functional Materials. 1901335, 1-13 (2019).
- Song, W., et al. Engineering transferrable microvascular meshes for subcutaneous islet transplantation. Nature Communications. 10 (1), 1-12 (2019).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Ying, G. L., et al. Aqueous two-phase emulsion bioink-enabled 3D bioprinting of porous hydrogels. Advanced Materials. 30 (50), 1-9 (2018).
- Rouwkema, J., Khademhosseini, A. Vascularization and angiogenesis in tissue engineering: beyond creating static networks. Trends in Biotechnology. 34 (9), 733-745 (2016).
- Jang, J., Park, J. Y., Gao, G., Cho, D. W. Biomaterials-based 3D cell printing for next-generation therapeutics and diagnostics. Biomaterials. 156, 88-106 (2018).
- Suntornnond, R., An, J., Chua, C. K. Roles of support materials in 3D bioprinting - present and future. International Journal of Bioprinting. 3 (1), 83-86 (2017).
- Shoseyov, O., Posen, Y., Grynspan, F. Human recombinant type I collagen produced in plants. Tissue Engineering - Part A. 19 (13-14), 1527-1533 (2013).
- Stein, H., et al. Production of bioactive, post-translationally modified, heterotrimeric, human recombinant type-I collagen in transgenic tobacco. Biomacromolecules. 10 (9), 2640-2645 (2009).
- Kaplan, B., et al. Rapid prototyping fabrication of precision polyester scaffolds for axonal guidance. Biomaterials. , 120062(2020).
- Karakurt, I., Lin, L. 3D printing technologies: techniques, materials, and post-processing. Current Opinion in Chemical Engineering. 28, 134-143 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados