Method Article
Fabricación de colgajos vasculares de ingeniería utilizando tecnologías de impresión 3D
En este artículo
Resumen
Los colgajos diseñados requieren una red vascular funcional incorporada. En este protocolo, presentamos un método de fabricación de un colgajo de tejido impreso en 3D que contiene una red vascular jerárquica y sus anastomosis microquirúrgicas directas a la arteria femoral de rata.
Resumen
La ingeniería de tejidos implantables, funcionales y gruesos requiere el diseño de una red vascular jerárquica. La bioimpresión 3D es una tecnología utilizada para crear tejidos mediante la adición de capa tras capa de biomateriales imprimibles, denominados biotintas y células de manera ordenada y automática, lo que permite crear estructuras altamente intrincadas que las técnicas tradicionales de ingeniería de tejidos no pueden lograr. Por lo tanto, la bioimpresión 3D es un enfoque in vitro atractivo para imitar la estructura compleja de la vasculatura nativa, que va desde los vasos milimétricos hasta las redes microvasculares.
Los avances en la bioimpresión 3D en hidrogeles granulares permitieron la extrusión de alta resolución de biotintas basadas en matriz extracelular de baja viscosidad. Este trabajo presenta un enfoque combinado de bioimpresión 3D e impresión 3D basada en moldes de sacrificio para fabricar colgajos de tejido vascularizado diseñados. La bioimpresión 3D de células endoteliales y de soporte utilizando biotinta de colágeno-metacrilato recombinante dentro de un baño de soporte de gelatina se utiliza para la fabricación de una red capilar autoensamblada. Esta microvasculatura impresa se ensambla alrededor de un andamio poroso similar a un vaso de mesoescala, fabricado utilizando un molde sacrificial impreso en 3D, y se siembra con células endoteliales.
Este ensamblaje induce al endotelio del vaso de mesoescala a anastomosa con la red capilar circundante, estableciendo una red vascular jerárquica dentro de un colgajo de tejido diseñado. El colgajo diseñado se implanta directamente mediante anastomosis quirúrgica en una arteria femoral de rata utilizando una técnica de manguito. Los métodos descritos se pueden ampliar para la fabricación de varios colgajos de tejido vascularizado para su uso en cirugía de reconstrucción y estudios de vascularización.
Introducción
Los defectos tisulares graves son causados por lesiones traumáticas, defectos congénitos o enfermedades, y el estándar de oro actual para tratar estos defectos es mediante el uso de injertos autólogos, colgajos de tejido vascularizado y colgajos libres microvasculares como sustitutos de tejidos. Sin embargo, estas opciones tienen los inconvenientes de la limitación del tejido del sitio donante y la morbilidad del sitio donante1. Por lo tanto, existe una creciente demanda de sustitutos de tejidos alternativos que se pueden utilizar para corregir estos defectos2. El grosor de las construcciones de tejido diseñado está limitado por la difusión de nutrientes y gases hacia las células y, por lo tanto, una red vascular adecuada es esencial para generar andamios grandes, gruesos y adecuadamente nutridos.
Se han aplicado varios enfoques para promover la vascularización de implantes diseñados3, incluyendo el reclutamiento in vivo de soporte vascular del huésped, la entrega de factores de crecimiento y citoquinas dentro de los andamios, la prevascularización de implantes, la generación de un lecho de microvaso ramificado perfusible utilizando técnicas de micropatronaje4, el uso de materiales de sacrificio para la formación de canales/ redes vasculares5 , así como la creación de canales dentro de construcciones bioimpresas en 3D 5,6. La vascularización de tejidos gruesos requiere la incorporación de una red vascular jerárquica formada por vasos a macroescala y microcapilares. Los vasos a macroescala distribuyen la sangre de manera efectiva a lo largo de la construcción y permiten anastomosis microquirúrgicas con los vasos sanguíneos del huésped, mientras que los vasos de escala microcapilar permiten la difusión de nutrientes.
La bioimpresión ha ganado gran atención en los últimos años debido a las ventajas que ofrece sobre los métodos convencionales de ingeniería de tejidos. Los tejidos y órganos son objetos 3D complejos e intrincados con una arquitectura específica. La bioimpresión 3D, con su capacidad para depositar capas de biomateriales en alta resolución, permite la capacidad de crear tejidos complejos y sustitutos de órganos (por ejemplo, riñón, pulmón, hígado)7. Se han adaptado varias tecnologías de impresión para la bioimpresión, incluida la bioimpresiónbasada en extrusión, inyección de tinta 8, deposición asistida por láser 9,10 y bioimpresión11,12 basada en estereolitografía. Las tecnologías basadas en la extrusión se basan en la extrusión del material a través de una boquilla mediante la aplicación de presión sobre la superficie a granel del material opuesta a la boquilla.
La incrustación reversible de hidrogeles suspendidos (FRESH) de forma libre es una técnica de bioimpresión13,14 que utiliza un material de soporte granular en el que el material extruido se deposita y se fija en su lugar mediante el baño de soporte. El baño de soporte proporciona soporte mecánico para la biotinta extruida y pre-reticulada hasta su reticulación. La principal ventaja de esta técnica es que el baño de soporte permite extruir materiales de baja viscosidad que no pueden mantener su forma después de la extrusión y antes de la reticulación15. Esto amplía el conjunto de materiales disponibles que se pueden utilizar como biotintas.
Este trabajo presenta un protocolo para la generación de un colgajo vascularizado que combina vasculaturas a microescala y mesoescala. Para lograr esto, se generan redes microvasculares bioimpresas, autoensamblables, en hidrogel de metacrilato de colágeno humano recombinante (rhCollMA), que luego se conecta al interior de un andamio vascular implantable más grande, lo que resulta en un colgajo de tejido completamente diseñado16. Para establecer una perfusión rápida y directa de los tejidos modificados, se requiere una anastomosis microquirúrgica directa a los vasos huéspedes. El andamio vascular no tiene suficiente fuerza de retención de sutura para ser anastomosado utilizando la sutura tradicional de la pared del vaso microquirúrgico. Por lo tanto, describimos un método de "manguito"17,18,19 para lograr una anastomosis con la arteria femoral común de una rata. En este método, los extremos del vaso se aseguran con suturas circunferenciales, sin la necesidad de perforar la pared del vaso.
Aunque el protocolo propuesto se ha preparado para estudiar la vasculatura jerárquica en el entorno rhCollMA, este enfoque se puede ampliar y aplicar a una variedad de nuevas aplicaciones. El protocolo se puede aplicar a la bioimpresión de varias células específicas de tejidos en diferentes biotintas. Además, la geometría y el tamaño de las construcciones se pueden modificar fácilmente para adaptarse a requisitos específicos, como la reconstrucción de tejidos grandes o los estudios biológicos.
Protocolo
Todos los procedimientos en animales fueron aprobados y realizados bajo la supervisión de la Autoridad de Investigación Preclínica de Technion (PCRA Technion, aprobación ética no. 058-05-20). Se utilizaron ratas macho Sprague-Dawley (275-350 g) para estos estudios. Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, equipos y software utilizados en este protocolo.
1. Fabricación de andamios vasculares
- Cree un modelo informático 3D de la forma de andamio vascular deseada utilizando el software de diseño asistido por ordenador (CAD) o descargue un archivo 3D de una estructura vascular deseada de repositorios en línea.
- Cree un cilindro con un diámetro interior de 0,9 mm, un diámetro exterior de 2 mm y una altura de 18 mm. Agregue fenestraciones radiales con un diámetro de 0,22 mm junto a la pared del cilindro.
- Cree un molde para el andamio utilizando el software de diseño 3D y expórtelo como un archivo . Archivo STL. A continuación, agregue un embudo al diseño para facilitar el llenado del molde más adelante.
- Importe el archivo . STL en el software de corte para la impresora 3D de modelado por deposición fundida (FDM). Corte el modelo con una altura de capa de 0,1 mm y expórtelo como .gcode o envíelo directamente a la impresora 3D.
- Imprima el molde en 3D en una impresora 3D FDM equipada con una boquilla de 0,25 mm, utilizando filamento de copolímero de alcohol vinílico buteno-diol (BVOH) soluble en agua. Guarde los moldes impresos en una cámara de vacío hasta su uso.
PRECAUCIÓN: Evite manipular el filamento BVOH con las manos desnudas, ya que es sensible a la humedad. Además, se recomienda almacenar el filamento en una cámara de vacío para evitar la exposición a la humedad. - Preparar una solución polimérica de una mezcla 1:1 de ácido poli-L-láctico (PLLA) y ácido poliláctico-co-glicólico (PLGA) en 1,4-dioxano.
- Pesar 350 mg de PLLA y 350 mg de PLGA y transferir a un vial de vidrio de 20 ml.
- Mida 10 ml de 1,4-dioxano y transfiéralo al vial de vidrio con una pipeta de vidrio. Agregue una pequeña barra de agitación magnética al vial de vidrio.
PRECAUCIÓN: El 1,4-dioxano es un disolvente orgánico peligroso. Use el equipo de seguridad personal adecuado y trabaje dentro de una campana extractora de humos. - Coloque el vial de vidrio dentro de un baño de agua caliente calentado a 70 ° C y mezcle el contenido durante la noche hasta que todos los polímeros se disuelvan por completo. Guarde la solución en un recipiente de vidrio hermético hasta su uso.
- Llene los moldes BVOH con la solución PLLA:PLGA.
- Usando una pipeta de desplazamiento positivo, mida 30 μL de la solución de polímero y llene el molde.
NOTA: El volumen necesario para llenar el molde cambiará de acuerdo con el volumen del recipiente diseñado. Siga agregando la solución de polímero hasta que el embudo del molde esté completamente lleno. - Centrifugar el molde a 100 × g durante 2 min. Rellene el molde con otros 20 μL de la solución de polímero para garantizar un llenado completo.
- Usando una pipeta de desplazamiento positivo, mida 30 μL de la solución de polímero y llene el molde.
- Congele los moldes llenos a -80 °C durante al menos 30 minutos para garantizar que toda la solución de polímero se congele. Retire el disolvente de los moldes liofilizándolos durante la noche.
NOTA: El color del polímero en el molde debe cambiar de claro a blanco después del proceso de liofilización. - Para eliminar el material del molde de sacrificio, transfiera los moldes después del proceso de liofilización a un baño de agua desionizada de 5 L bajo una agitación suave. Reemplace el agua en el baño cuando se turbe. Cuando todo el BVOH se disuelva, seque al aire los andamios y guárdelos en una cámara de vacío hasta su uso.
2. Recubrimiento del andamio vascular con fibronectina
- Desinfecte los andamios vasculares PLLA:PLGA sumergiéndolos en etanol al 70% durante 30 min.
- Lavar los andamios 3x 5 min con PBS.
- Preparar una dilución de 50 μg/ml de fibronectina humana en PBS y recubrir los andamios.
- Mezclar 500 μL de solución de fibronectina madre (1 mg/ml) con 9,5 ml de PBS.
- Sumerja los andamios vasculares desinfectados en esta solución de fibronectina e incube a 37 °C durante 60 min para permitir la adsorción de proteínas.
- Después de la incubación, enjuague los andamios con PBS para eliminar la fibronectina no unida. Guarde estos andamios recubiertos a 4 °C durante un máximo de 1 semana.
3. Preparación de biotinta rhCollMA
- Prepare un tampón de fosfato para neutralizar el stock de biotinta ácida rhCollMA.
- Prepare un stock 10x de tampón de fosfato disolviendo 5.495 g de Na2HPO4, 1.55 g de NaH2PO4 y 30 mg de NaCl en 50 ml de agua desionizada.
- Prepare una dilución de 10 veces del tampón de fosfato 10x utilizando 1 parte de 10x tampón de fosfato con 9 partes de agua desionizada.
- Combine 900 μL de solución de rhCollMA madre con 100 μL de tampón de fosfato 10x para neutralizar la solución ácida de rhCollMA.
- Diluya la solución neutralizada de rhCollMA a la concentración deseada de 10 mg/ml mezclándola con la cantidad requerida de 1 tampón de fosfato.
NOTA: La concentración de stock de rhCollMA varía entre lotes. Por lo tanto, el volumen de 1x tampón de fosfato necesario para alcanzar la concentración deseada variará. - Preparar la solución porógena-fotoiniciadora (PEO-LAP) para combinarla con la rhCollMA neutra diluida.
- Preparar una solución al 1,6% (p/v) de poli(óxido de etileno) (PEO) en DMEM libre de fenol sin rojo disolviendo 160 mg de PEO en 10 ml de DMEM.
- Agregue 20 mg de fenil-2,4,6-trimetilbenzoilfosfinato de litio (LAP) a esta solución para obtener 0,2% (p/v) de LAP en la solución. A partir de este punto, cubra la solución con papel de aluminio o manténgala en un lugar oscuro para protegerla de la luz.
- Esterilizar la solución PEO-LAP pasándola a través de un filtro de 0,22 μm. Guarde esta solución a 4 °C durante un máximo de 1 semana.
- Antes de la bioimpresión, mezcle la solución neutra diluida de rhCollMA con la solución PEO-LAP en una proporción de 1:1 para obtener la solución final de biotinta. Use pipeteo, en lugar de un vórtice, para mezclar las soluciones mientras evita las burbujas de aire.
- Si se introducen muchas burbujas en la solución, centrífuga a 2.000 × g durante 30 s. Después de la centrifugación, mezcle la solución de biotinta nuevamente para garantizar la homogeneidad.
4. Preparación del baño de soporte granular
- Prepare el material de soporte granular de gelatina.
- En un gabinete de seguridad biológica, divida el contenido de un tubo de 2 g de material de soporte liofilizado en dos tubos cónicos estériles de 50 ml, cada uno con aproximadamente 1 g.
- Agregue 40 ml de DMEM libre de fenol rojo frío (4 °C) a cada tubo y vórtice vigorosamente hasta que todo el material de soporte liofilizado se disuelva.
- Deje que la suspensión resultante se asiente a 4 °C para permitir que el material de soporte se rehidrate.
- Desgasifica el material de soporte en una cámara de vacío durante 30 minutos para reducir las burbujas.
- Centrifugar el material de soporte a 2.000 × g durante 5 min. Asegúrese de que el material esté en la parte inferior del tubo y que el sobrenadante esté claro.
- Aspire el sobrenadante, teniendo cuidado de no aspirar el material de soporte en la parte inferior.
NOTA: El material de soporte no debe fluir mientras se inclina el tubo después de retirar el sobrenadante. Si el material fluye, centrímelo de nuevo utilizando la misma configuración pero sin agregar un nuevo sobrenadante.
- Transfiera aproximadamente 4 ml del material de soporte preparado y compactado a cada pozo de una placa de 12 pocillos utilizando una pipeta de desplazamiento positivo. Golpee la placa del pozo en una superficie dura para forzar que el material de soporte se extienda uniformemente en el pozo.
NOTA: El volumen mínimo recomendado de material de soporte es 3 veces el volumen de la construcción que se imprimirá en él. - Coloque la placa del pozo con el material de soporte en una etapa de bioimpresora enfriada, o a 4 °C, hasta su uso para evitar que las partículas de gelatina se derritan.
5. Incorporación de células endoteliales y células de apoyo con la biotinta
- Prepare el medio de células endoteliales de acuerdo con las instrucciones del fabricante mezclando el medio basal con su componente de kit de medio correspondiente, incluida una solución antibiótica, suero bovino fetal y suplementos de crecimiento de células endoteliales.
- Prepare el medio de células madre de la pulpa dental combinando 500 ml de DMEM bajo en glucosa, 58 ml de suero fetal bovino, 5,8 ml de aminoácidos no esenciales (NEAA), 5,8 ml de sustituto de glutamina, 5,8 ml de 1 M DE HEPES y 5,8 ml de solución de penicilina-estreptomicina-nistatina.
- Preparar una suspensión que contenga 2 × 106 células endoteliales microvasculares adiposas humanas que expresan ZsGreen1 (HAMEC-ZsGreen1) y 6 × 106 células madre de pulpa dental (DPSC) en 10 ml de medio de células endoteliales.
- Centrifugar la suspensión celular a 200 × g durante 4 min para obtener un pellet celular. Aspirar el medio sobrenadante.
- Resuspend el pellet celular en 1 mL de biotinta rhCollMA preparada previamente (que contiene PEO-LAP) para obtener una biotinta con una concentración celular total de 8 × 106 células por 1 mL de biotinta.
PRECAUCIÓN: Después de combinar la biotinta con las células, proceda inmediatamente al siguiente paso. Si las células se dejan en la suspensión durante mucho tiempo, las células se hundirán en el fondo del tubo y su viabilidad se deteriorará. Para experimentos que no involucren células, omita los pasos 5.1-5.5 o incorpore perlas fluorescentes con la biotinta en lugar de células para una visualización microscópica mejorada de las construcciones impresas. - Transfiera la mezcla de células y biotinta a cartuchos de impresión.
- Coloque una aguja de 0,22 mm de diámetro interno en un cartucho de impresión ámbar de 3 ml y coloque el cartucho en un tubo cónico de 50 ml.
- Transfiera 1 ml de la mezcla de células y biotinta al cartucho de impresión llenándolo desde la parte superior, utilizando una pipeta de desplazamiento positivo para reducir las burbujas.
- Instale el cartucho de impresión en la herramienta adecuada en la bioimpresora.
6. Bioimpresión de redes microvasculares utilizando biotinta rhCollMA
- Crear un diseño CAD 3D para la red microvascular bioimpresa.
- Esboza un patrón 2D de un cuadrado de 4 mm que contiene un canal circular de 2 mm de diámetro en su centro. Extruir el boceto en 4 mm para obtener un cubo de 4 mm x 4 mm x 4 mm con un canal central. Exporte este objeto como un archivo . Archivo STL.
- Importe una placa de 12 pocillos. Plantilla STL en la pestaña de modelado sólido en el software de corte de bioimpresora y colóquela en el área designada de la cama de impresión virtual.
- Importe el archivo . STL de la forma del cubo en la pestaña de modelado sólido en el software de corte de bioimpresora. Haga clic en la casilla de verificación Usar segmentación de datos externa | configure la segmentación de datos en la sección de propiedades del objeto . En la ventana emergente, elija un patrón rectilíneo para el patrón de relleno y escriba 30% en la densidad de relleno. Haga clic en aceptar.
- Coloque una copia de la forma del cubo en cada pozo virtual deseado haciendo clic en el cubo y moviéndolo con el mouse.
- Cree nuevos ajustes de material para la biotinta rhCollMA en la pestaña materiales del software de corte de bioimpresora haciendo clic en el botón Agregar material . Elija la configuración del material para imprimir. Para la presión, escriba 2 psi en el cuadro correspondiente. Para la velocidad, escriba 20 mm/s en el cuadro correspondiente.
NOTA: Cada material de biotinta tiene sus propias configuraciones de impresión diferentes que se pueden guardar en la lista de materiales de la aplicación. - Asigne los valores de ancho de línea y alto de línea a 0,24 mm y el valor de aceleración a 400 mm/s2, escribiendo estos valores en los cuadros correspondientes.
- En la pestaña modelado de sólidos , haga clic en el objeto de cubo y, a continuación, haga clic en el material rhCollMA de la sección de materiales para asignarlo a la forma del cubo. En la pestaña bioensamblaje , haga clic en el botón Enviar trabajo de impresión para enviar el trabajo de impresión a la bioimpresora.
- Cargue el cartucho de impresión cargado con la biotinta celular en la herramienta de dispensación neumática ambiental de 3 ml de la bioimpresora basada en extrusión 3D.
- Ajuste la temperatura de la cama de impresión a 4 °C haciendo clic en el botón de enfriamiento debajo de la pestaña Control-Calentamiento/Enfriamiento en la pantalla de la interfaz de la bioimpresora. Cargue la placa con el baño de soporte en la cama de la impresora.
NOTA: La configuración del material para la presión y la velocidad de impresión pueden cambiar debido a las diferencias en la temperatura ambiente o la variabilidad del lote de biotinta. Por ejemplo, en los días más fríos, se necesita una presión más alta o una velocidad más lenta para extruir la misma cantidad de material. - En la pestaña de impresión de la pantalla de la interfaz de la bioimpresora, haga clic en el trabajo de impresión enviado en el paso 6.7. y haga clic en Iniciar | ir para comenzar el trabajo de impresión.
- Después de imprimir, exponga la placa del pozo a una fuente de luz de 405 nm con una intensidad de 3 mW / cm2 durante 30 s para iniciar la reticulación de la biotinta rhCollMA.
- Después de la reticulación, incube la placa del pozo a 37 ° C y 5% de CO2 durante al menos 20 minutos hasta que todo el baño de soporte se derrita.
- Aspire suavemente el baño de soporte licuado y reemplácelo con un medio de células endoteliales. Incubar las construcciones a 37 °C y 5% de CO2 hasta su uso en pasos posteriores.
NOTA: Debido a la contracción de la construcción después de la impresión, se recomienda realizar el ensamblaje Paso 7 el mismo día que el Paso 6.
7. Montaje de la red microvascular bioimpresa con el andamio vascular para obtener el colgajo vascularizado diseñado
- Inmediatamente después de la extracción del material de soporte de la red microvascular bioimpresa, coloque un andamio vascular PLLA:PLGA recubierto de fibronectina en el canal principal de la estructura bioimpresa.
- Incubar las construcciones ensambladas a 37 °C y 5% de CO2 durante 2 días.
- Revestir la luz del andamio vascular con células endoteliales.
- Preparar una suspensión celular de células endoteliales microvasculares adiposas humanas que expresan tdTomato (HAMEC-tdTomato) a una concentración de 1 × 107 células/ml.
- Coloque una gota de 20 μL de esta suspensión celular sobre una superficie hidrofóbica (es decir, un plato de 10 cm de cultivo no tisular [nonTC]).
- Coloque suavemente los andamios vasculares en la parte superior de la gota, de modo que la luz del andamio en un extremo haga contacto con la gota celular.
- Aspirar la gota desde el extremo opuesto del andamio (es decir, el extremo que no está en contacto con la gota), llenando su luz con la suspensión celular.
- Coloque el andamio sembrado en un tubo de microcentrífuga y colóquelo en un rotador dentro de una incubadora humidificada durante 60 minutos. A continuación, transfiera el andamio a una placa de 12 pocillos y agregue 2 ml de medio de células endoteliales.
- Cultive los colgajos diseñados durante 7 días, mientras reemplaza el medio cada 2 días con un medio de células endoteliales frescas.
8. Microscopía confocal y tinción por inmunofluorescencia de los colgajos diseñados
- Después de 4 días y 7 días de cultivo, realice imágenes de células vivas de los andamios ensamblados utilizando un microscopio de escaneo láser confocal.
- Defina los canales de fluorescencia para las proteínas fluorescentes ZsGreen1 y tdTomato en el software de adquisición de imágenes del microscopio.
- Elija un objetivo 5x/0.16 con zoom de 0.5x (tamaño de píxel 5 μm) y defina una pila Z con 22 cortes con un grosor de 41 μm cada uno.
- Defina un escaneo de mosaico de 3 x 2 para obtener una imagen y capture toda la construcción.
- Ajuste la intensidad del láser y los valores de ganancia para obtener una señal fluorescente clara sin saturación y un fondo mínimo y adquiera las imágenes.
- Realice una proyección de máxima intensidad de la pila Z adquirida para obtener una sola imagen 2D utilizando el software de adquisición de imágenes de microscopio o un software de análisis de imágenes similar.
- Realice imágenes de mayor aumento de una región de interés.
- Cambie a una lente de objetivo 10x/0.3 con zoom de 0.5 (tamaño de píxel 1.25 μm) y defina una pila Z con 9 cortes de grosor de 41 μm.
- Realice los pasos 8.2.-8.3.
- Después de 7 días de cultivo, fije los colgajos diseñados sumergiéndolos en paraformaldehído al 4% durante 20 min.
- Lave las construcciones 3x 5 min con PBS.
- Agregue 0.3% (v / v) Triton-X en PBS a las construcciones e incube durante 15 min a temperatura ambiente para permeabilizar las células.
- Lave las construcciones 3x 5 min con PBS.
- Prepare una solución de bloqueo disolviendo al 5% (p/v) albúmina sérica bovina (BSA) en PBS. Agregue la solución de bloqueo a las solapas de ingeniería e incube durante 1 h a temperatura ambiente.
- Prepare la solución primaria de anticuerpos diluyendo el anticuerpo 1:50 de actina anti-músculo liso (anti-SMA) de ratón en la solución de BSA al 5% preparada previamente para teñir las células de soporte que expresan SMA.
- Incubar los andamios en la solución primaria de anticuerpos durante la noche a 4 °C.
- Lavar 3x 5 min con PBS.
- Preparar la solución secundaria de anticuerpos diluyendo el anticuerpo IgG 1:400 de cabra conjugada con Cy3 y el anticuerpo 4',6-diamidino-2-fenilindol (DAPI, 2,5 μg/mL) en PBS.
- Aplique la solución secundaria de anticuerpos a los andamios e incube durante 3 h a temperatura ambiente.
- Lavar 3x 5 min con PBS.
- Almacene las construcciones a 4 °C en PBS durante un máximo de 1 mes.
- Tome una imagen de los andamios teñidos utilizando un microscopio de barrido láser confocal.
- Defina los tres canales de fluorescencia (DAPI, ZsGreen y Cy3) en el software de adquisición de imágenes del microscopio.
- Defina una pila Z con un espesor de sección de 2 μm que abarque un espesor total de 50 μm. A continuación, defina un escaneo de mosaico para obtener imágenes de áreas más grandes de la construcción.
- Ajuste los parámetros de adquisición para obtener una señal fluorescente clara sin saturación y con un fondo mínimo.
- Adquiera las imágenes utilizando el objetivo 20x/0.8 con zoom 1.0x (tamaño de píxel 0.31 μm).
- Realice una proyección de máxima intensidad de la pila Z adquirida para obtener una sola imagen 2D utilizando el software de adquisición de imágenes de microscopio o un software de análisis de imágenes similar.
9. Anastomosing the engineered flap directly to a rat's femoral artery using a cuff technique
- Prepare y esterilice (autoclave) las siguientes herramientas quirúrgicas: bisturí No. 15, un par de pinzas de dientes finos y un pequeño par de tijeras con mango de anillo. Además, prepare y esterilice las siguientes herramientas microquirúrgicas: un fórceps de joyero No. 3 recto y puntiagudo fino, pinzas de joyero en ángulo, un soporte de aguja de mango redondo con mandíbulas curvas, un par de dilatadores de vasos, tijeras de disección, tijeras adventicias, así como abrazaderas de vasos con su aplicador.
- Preparar una solución de solución salina heparinizada de 100 UI/ml diluyendo 5 ml de solución de heparina madre con 195 ml de solución salina.
- Cortar y esterilizar los puños de poliimida.
- Cortar secciones de 2,5 mm de un tubo de poliimida bajo un microscopio de disección.
- En un extremo de cada sección, haga una incisión longitudinal de 1,25 mm en la pared del tubo para obtener un mango de manguito. Haga un corte en ángulo en el otro extremo del tubo para facilitar la eversión del vaso.
- Sumergir los puños en etanol al 70% seguido de dos lavados con solución salina heparinizada.
- Prepare una rata Sprague-Dawley macho (275-350 g) para la cirugía.
- Siete días antes de la cirugía, comience a administrar una dosis diaria subcutánea de ciclosporina (10 mg kg-1) para lograr la supresión inmune.
- Antes de la cirugía, anestesiar al animal utilizando la inhalación de isoflurano al 3% de acuerdo con el POE institucional utilizando una cámara de inducción. Verifique la anestesia profunda pellizcando ambos pies y verificando si hay reflejos.
- Administrar una dosis subcutánea de buprenorfina analgésica (0,03 mg kg-1) y heparina anticoaguladora (200 UI kg-1).
- Aplique un ungüento lubricante para los ojos del animal para prevenir la deshidratación.
- Afeitar el área quirúrgica de la rata y desinfectar el sitio con yodo y luego etanol al 70%. Asegure las extremidades del animal a la mesa con cinta adhesiva.
- Exponer y aislar la arteria femoral común.
- Haga una incisión oblicua de 2 cm de largo a través de la piel, a lo largo de la concavidad entre la pierna y el abdomen.
- Usando fórceps y tijeras de punta roma, libere la piel del tejido subyacente para visualizar la almohadilla de grasa inguinal.
- Usando tijeras y fórceps, corte a través de la almohadilla de grasa alrededor de los márgenes superior, medial e inferior. Preste atención a no cortar vasos grandes debajo de la almohadilla de grasa.
- Refleje la almohadilla de grasa lateralmente, dejando intactos los vasos epigástricos. Coloque una gasa húmeda en la almohadilla de grasa reflejada para evitar que se seque y colóquela en su lugar. Asegúrese de que los vasos femorales comunes sean visibles.
NOTA: La almohadilla de grasa se utilizará más tarde para aplicar presión suave a las anastomosis. - Exponga la arteria femoral desde el ligamento inguinal proximalmente hasta el punto de ramificación de la arteria epigástrica distalmente extrayéndola de su vaina.
PRECAUCIÓN: Por lo general, hay una rama de la arteria femoral que corre debajo de ella, comúnmente llamada rama de Murphy. Preste atención a no dañar esta rama difícil de ver. - Divida la rama de Murphy ligiéndola y luego ligar la arteria femoral con dos ligaduras en el centro de la arteria espaciadas a 1 mm de distancia. Mantenga un extremo de la sutura de la ligadura largo para usarlo más tarde para tirar del extremo del vaso a través del manguito.
- Corte la arteria entre las dos ligaduras usando tijeras adventicias.
PRECAUCIÓN: No debe haber sangrado al realizar este corte. Si el extremo arterial sangra, pinza la arteria y vuelva a aplicar una ligadura. - Usando el extremo largo de la sutura de ligadura, inserte cada extremo del vaso en un manguito de poliimida, como se preparó en el paso anterior, de modo que los mangos de los dos puños apunten uno lejos del otro.
- Después de la inserción, aplique una abrazadera simultáneamente en el mango del manguito y el recipiente, asegurando el manguito en su lugar.
- Prepare una solución salina heparinizada en una jeringa equipada con una aguja de 27 G.
- Tire del extremo del vaso ligado y córtelo cerca de la ligadura. Lave inmediatamente el extremo del vaso a fondo con la solución salina heparinizada hasta que no se vea sangre en la luz.
PRECAUCIÓN: Asegúrese de que el extremo del vaso se lave bien, ya que cualquier sangre que quede en el interior formará un coágulo, que se introducirá en el torrente sanguíneo al completar el procedimiento. Esto podría conducir a la oclusión del vaso y la pérdida de perfusión en la pierna. - Expanda la luz del recipiente sosteniéndolo por su vaina con una mano y dilatando su luz con el dilatador del vaso con la otra mano.
- Coloque una sutura circunferencial de polipropileno 6-0 suelta alrededor del cuerpo del manguito. El vaso termina usando dos dilatadores de vasos sobre el cuerpo del manguito y lo asegura en su lugar apretando la sutura circunferencial.
NOTA: Si alguna sangre se filtra a través del vaso sujetado durante las manipulaciones, lave bien la luz con solución salina heparinizada. - Enjuague el colgajo diseñado con solución salina heparinizada y luego inserte el manguito forrado de vasos en la luz del andamio vascular. Fije el andamio en su lugar colocando una sutura de polipropileno circunferencial 6-0 alrededor del andamio y el cuerpo del manguito. Haga este paso para ambos lados del andamio vascular.
- Envuelva un filtro de membrana de poliestireno de 0,2 μm alrededor del sitio de las anastomosis para aislar el colgajo diseñado del tejido circundante.
- Suelte primero la abrazadera distal; luego, suelte la pinza proximal para restablecer el flujo sanguíneo a través del vaso.
- Para detener cualquier sangrado a través de las anastomosis, refleje la almohadilla de grasa sobre los vasos femorales y aplique una presión suave con una gasa estéril durante 3 minutos.
- Sutura la almohadilla de grasa en su lugar con polipropileno 6-0; luego, sutura la piel usando suturas absorbibles 5-0 PGA.
- Limpie el área de la herida con solución salina y aplique solución de yodo.
- Para el dolor postoperatorio y el manejo de animales, prepare un 0.1% (v / v) de tramadol en agua potable. Además, administrar una dosis diaria de heparina (200 UI kg-1) y ciclosporina (10 mg kg-1).
- Coloque al animal en una jaula limpia colocada sola debajo de una lámpara de calefacción. Continúe monitoreando al animal hasta que recupere la conciencia suficiente para mantener la reclinación esternal.
Resultados
Este protocolo describe la fabricación de un colgajo diseñado compuesto por un andamio vascular (Figura 1Ai) y una microvasculatura bioimpresa (Figura 1Aii), que se ensamblaron para lograr vasculaturas a mesoescala y microescala (Figura 1Aiii). Siguiendo el protocolo, se diseñaron moldes BVOH del andamio vascular y se imprimieron en 3D (Figura 1B, C). Las estructuras impresas obtenidas fueron inspeccionadas visualmente en busca de pequeñas hebras de BVOH, que podrían encontrarse en los espacios vacíos de los moldes (Figura 1D). Estas hebras generalmente indican configuraciones incorrectas del material o que el BVOH ha absorbido humedad. Estas hebras deben eliminarse, ya que podrían conducir a un llenado incompleto del moho y defectos estructurales en el andamio vascular resultante. A continuación, los moldes se llenaron con la solución PLLA: PLGA, seguido del proceso de liofilización y los pasos de lavado, como se describe en el protocolo. El andamio vascular PLLA:PLGA obtenido fue inspeccionado visualmente para verificar la integridad de la pared del vaso y la permeabilidad de la luz (Figura 1E).
Se preparó una biotinta rhCollMA neutralizada a una concentración de 10 mg/ml y se combinó en una proporción de 1:1 con la solución PEO:LAP. Las células endoteliales microvasculares adiposas humanas marcadas con Zs-Green1 y las células madre de pulpa dental se resuspendieron con la biotinta rhCollMA, y la solución se cargó en un cartucho de impresión y en la impresora. Las formas de caja con un canal central con un patrón rectilíneo (Figura 1D) se bioimprimieron dentro del baño de soporte de gelatina. Después de la impresión, las construcciones se entrecruzaron y el baño de soporte se disolvió y se lavó. Después de 4 días de cultivo, los constructos fueron fotografiados en vivo para verificar el autoensamblaje de la red microvascular. La Figura 1D muestra un ejemplo de una red microvascular HAMEC-ZsGreen1 altamente desarrollada en el constructo bioimpreso.
A continuación, se insertó un andamio vascular recubierto de fibronectina en el canal central del constructo impreso (Figura 2A). Las construcciones ensambladas se cultivaron durante 2 días, durante los cuales las células contraen el gel, uniéndolo firmemente al andamio vascular. Luego, el andamio vascular se forró con HAMECs que expresaban tdTomato, de acuerdo con el protocolo. Después de 7 días de cultivo, las construcciones fueron fijadas e imaginadas. La Figura 2B muestra una vista lateral de las construcciones ensambladas donde las células endoteliales en la microvasculatura bioimpresa se representan en verde, mientras que el revestimiento endotelial del andamio vascular se representa en rojo. La imagen muestra un autoensamblaje microvascular verde en el gel bioimpreso, mientras que el andamio vascular está revestido con células endoteliales rojas. Con mayor aumento, los brotes que se originan en el revestimiento endotelial rojo se ven brotando y anastomosando con la red microvascular bioimpresa (Figura 2C). A continuación, las construcciones se tiñeron para la actina del músculo α liso (AME) como marcador para las células madre de la pulpa dental. Después de la inmunotinción, los constructos fueron fotografiados utilizando un microscopio confocal de barrido láser (Figura 2D).
Por último, después de 7 días de cultivo, los colgajos diseñados fueron anastomosados microquirúrgicamente a la arteria femoral de una rata, como se describe en el protocolo. Se puede ver un video de un procedimiento representativo en el Video Suplementario S1. La Figura 2E muestra una imagen representativa de una anastomosis completada antes de la extracción de la pinza, y la Figura 2F muestra una imagen representativa del sitio de las anastomosis después de la extracción de la pinza y la hemostasia. No debe haber sangrado visible antes del cierre de la herida.
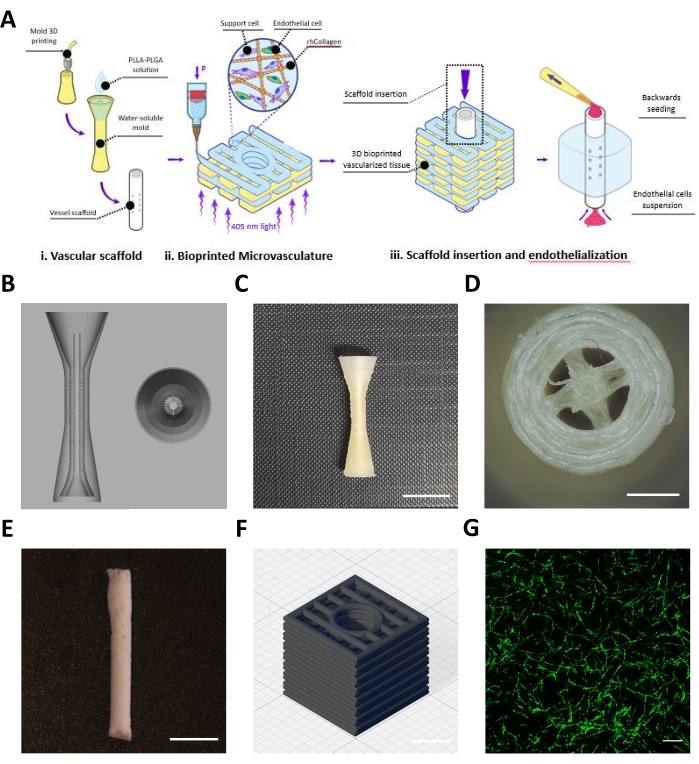
Figura 1: Imágenes representativas de los recipientes fabricados a meso y microescala. (A) Visión general esquemática de los pasos del protocolo. Reproducido con permiso16. (B) Diseño CAD para el molde de sacrificio del andamio vascular. (C) Vista lateral de un molde de sacrificio impreso en 3D representativo (barra de escala = 0,5 mm). (D) Vista superior del molde de sacrificio (barra de escala = 0,5 mm) (E) Andamio vascular representativo fabricado utilizando el protocolo de descripción (barra de escala = 5 mm). (F) Diseño CAD para la red microvascular rhCollMA bioimpresa en 3D. Líneas de cuadrícula = 1 mm. (G) Imagen representativa de una red vascular bioimpresa altamente desarrollada que muestra HAMEC-ZsGreen1 en verde. Barra de escala = 200 μm. Abreviaturas: CAD = diseño asistido por ordenador; rhCollMA = metacrilato de colágeno humano recombinante; HAMEC = células endoteliales microvasculares adiposas humanas; PLLA = ácido poli-L-láctico; PLGA = ácido poliláctico-co-glicólico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imágenes representativas del colgajo vascularizado ensamblado. (A) Una fotografía de un conjunto representativo de microvasculatura bioimpresa y el andamio vascular. Barra de escala = 1 mm. (B) Vista lateral de un colgajo de ingeniería representativo fotografiado 4 días después del revestimiento endotelial del andamio vascular. La microvasculatura bioimpresa se muestra en verde (HAMEC-ZsGreen1), mientras que el revestimiento endotelial se muestra en rojo (HAMEC-tdTomato). Barra de escala = 1 mm. (C) Imagen representativa de anastomosis entre la vasculatura bioimpresa en verde y el revestimiento endotelial en rojo. Barra de escala = 200 μm. (D) Imagen representativa de inmunotinción para actina del músculo liso (rojo), núcleos (azul) y células endoteliales (verde) después de 7 días de incubación. Barra de escala = 0,1 mm. (E) Imagen representativa de una anastomosis completa del colgajo diseñado con la arteria femoral de una rata antes de la extracción de la pinza y (F) después de la extracción de la abrazadera. Abreviaturas: HAMEC = células endoteliales microvasculares adiposas humanas; AME = actina del músculo liso; DAPI = 4',6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
Video Suplementario S1: Procedimiento microquirúrgico representativo para anastomosar el andamio vascular a la arteria femoral de una rata. Haga clic aquí para descargar este video.
Discusión
La ingeniería de tejidos vascularizados es uno de los principales retos de la ingeniería de tejidos20. Los métodos actuales para crear tejido vascular diseñado se centran en la creación de microvasculatura autoensamblada21,22,23 o en la fabricación de andamios vasculares a mesoescala24,25 y no en la recreación de un sistema de vasculatura jerárquica, que se puede perfundir inmediata y directamente después de la implantación26 . En este trabajo, describimos un protocolo que hace uso de dos modalidades de impresión 3D para fabricar una red jerárquica de vasos compuesta por vasculaturas a microescala y mesoescala. El protocolo combina una red microvascular bioimpresa en 3D y autoensamblada con un andamio vascular a mesoescala, logrando un colgajo implantable y vascularizado. Además, este trabajo presenta un protocolo para anastomosar directamente este colgajo a la arteria femoral de una rata.
La bioimpresión 3D ha ganado interés en los últimos años debido a su versatilidad sobre las técnicas tradicionales de ingeniería de tejidos. Si bien este protocolo describe la generación de una red microvascular en la biotinta rhCollMA, los métodos utilizados se pueden aplicar con pocas modificaciones a muchas otras biotintas de la plétora de biotintas estudiadas y novedosas y baños de soporte27,28. Elegimos usar rhCollMA como biotinta debido a la abundancia de colágeno tipo I en la ECM humana, proporcionando un ambiente adecuado para la unión celular. Además, se produce de forma recombinante en plantas y se modifica posteriormente con grupos metacrilato, lo que permite la fotopolimerización y la formación de hidrogeles 3D estables29,30. El fotocrosslinking se logró mediante la adición del fotoiniciador LAP, que ha demostrado no ser tóxico y se activa por exposición a luz azul de 405 nm, reduciendo la posible fototoxicidad de la luz UV. Sin embargo, el uso de biotintas fotosensibles requiere el uso de un medio de cultivo libre de rojo de fenol para la preparación de la biotinta y el material de soporte. Además, el protocolo describe el uso de material de soporte de gelatina, que permite la extrusión de alta fidelidad de biotintas como rhCollMA. Por lo tanto, es fundamental garantizar el uso de medio frío durante su preparación y el enfriamiento de la cama de la impresora. El calentamiento excesivo puede ocurrir debido a la fuente de luz utilizada para la reticulación o a temperaturas ambientales elevadas.
Aquí se ha utilizado una bioimpresora basada en extrusión para crear la red microvascular bioimpresa, y actualmente hay muchas bioimpresoras disponibles comercialmente que pueden generar construcciones similares. Además, los métodos propuestos pueden modificarse y aplicarse fácilmente para estudiar diferentes geometrías, tamaños y patrones de relleno. En este trabajo, se eligió un patrón de relleno rectilíneo para crear poros interconectados, y esto se puede imprimir con relativa rapidez con alta fidelidad.
Las burbujas de aire introducen un desafío significativo en la bioimpresión de extrusión, especialmente en el interior de materiales de soporte. Por lo tanto, es crucial minimizar la presencia y formación de estas burbujas mediante el uso de pipetas de desplazamiento positivo para la transferencia del material de soporte, la preparación de la suspensión de células de biotinta y su transferencia a los cartuchos de impresión.
En este trabajo, las células endoteliales derivadas de tejido adiposo humano y las células madre de la pulpa dental se utilizaron como células de soporte debido a su aislamiento relativamente fácil de los pacientes. Además, se eligió una concentración celular total de 8 x 106 células/ml ya que se ha demostrado que esta concentración establece las redes vasculares más desarrolladas16. Si bien este protocolo se puede emplear para generar microvasculatura utilizando diferentes tipos de células y fuentes, así como diferentes biotintas, se debe realizar una calibración de la concentración celular para establecer las mejores condiciones para el desarrollo de la red microvascular. Además, las células específicas del tejido (es decir, mioblastos u osteoblastos) se pueden incorporar dentro de la biotinta para lograr colgajos vascularizados específicos del tejido.
El molde para el andamio vascular poroso se fabricó utilizando material soluble en agua impreso en 3D en una impresora 3D de extrusión disponible comercialmente. Esto da como resultado una técnica rentable basada en plataformas de prototipado rápido, de modo que se pueden estudiar y examinar rápidamente muchas geometrías y tamaños diferentes de andamios vasculares31. Sin embargo, una limitación de este método es el límite de resolución de la mayoría de las impresoras 3D32. Sin embargo, con la rápida evolución de la industria que rodea a la fabricación aditiva, se espera que estos límites mejoren con el tiempo. El uso de disolventes orgánicos para el proceso de fabricación es otra limitación del protocolo, ya que la mayoría de los disolventes orgánicos son tóxicos para las células, lo que impide la capacidad de combinar el procedimiento de bioimpresión con el proceso de fabricación del andamio vascular.
El método descrito de sembrar la luz del andamio utilizando la aspiración en lugar de empujar la suspensión celular tiene efectos importantes en la localización de las células sembradas. El uso de presión negativa permite la endotelización de la luz interna del andamio al tiempo que minimiza cualquier derrame de la suspensión celular a través de las perforaciones en la pared del andamio16.
El método de "manguito" descrito para las anastomosis microquirúrgicas se puede modificar y adaptar fácilmente a diferentes materiales o tamaños de andamios vasculares, así como a diferentes arterias y venas en una amplia escala de modelos animales. Las adaptaciones al protocolo incluirían diferentes tamaños de tubos de poliimida y tamaños de sutura. Este método no requiere la perforación de la pared del andamio, lo que podría conducir al desarrollo de defectos. Este trabajo presenta un protocolo que se puede ampliar a muchas aplicaciones. Los aspectos críticos de este protocolo, que incluyen la fabricación de vasculaturas a meso y microescala y su ensamblaje e implantación, representan aspectos críticos de los colgajos diseñados tanto para aplicaciones reconstructivas, como para estudios de ingeniería vascular y otros tejidos.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este proyecto recibió financiación del Consejo Europeo de Investigación (CEI) en el marco del Programa de Investigación e Innovación Horizonte 2020 de la Unión Europea (acuerdo de subvención n.º 818808). rhCollMA fue generosamente proporcionado por CollPlant (Rehovot, Israel). Los autores agradecen a la Autoridad de Investigación Preclínica del Technion por la asistencia con el cuidado de los animales, así como a Janette Zavin, Galia Ben David e Idan Redenski.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,4-Dioxane | Biosolve Chemical | 42405 | |
| 27 G x 0.5" blunt tip dispensing needles | CML supply | 901-27-050 | |
| 3cc amber syringe barrel & piston set | Nordson EFD | 7012085 | Amber syringes used to block light and prevent premature crosslinking |
| 5-0 AssuCryl PGA absorbale suture | Assut Sutures | Absorbable sutures used for skin wound closure | |
| 6-0 polypropelene sutures | Assut Sutures | 9351 | |
| Acland clamps | S&T | B-1V | |
| Adventitia scissors | S&T | SAS-15 | |
| Angled no.3 jeweler's forceps | S&T | JFAL-3-18 | |
| BioAssemblyBot 400 3D Bioprinter | Advanced Solutions | a 6-axis 3D bioprinter | |
| Bovine albumin serum Probumin | Millipore | 82-045-1 | |
| Buprenorphine | vetmarket | B15100 | |
| BVOH filament | Verbatim | 55903 | a water-soluble 1.75 mm diameter filament |
| Clamp applying forceps | S&T | CAF-4 | |
| Dental pulp stem cells | Lonza | PT-5025 | |
| Dietrich bulldog clamps | Fine Science Tools (FST) | 18039-45 | |
| di-Sodium hydrogen phosphate (Na2HPO4) | Carlo Erba Reagents | 480141 | |
| Dissection scissors | S&T | 18039-45 | |
| DMEM, High Glucose, No Phenol Red | Sartorius | 01-053-1A | |
| Duratears | Alcon | DJ03 | |
| ECM media + bullet kit | Sciencell | #1001 | |
| Ethanol 96% | Gadot-Group | 64-17-5 | |
| GlutaMAX | Gibco | 35050061 | glutamine substitute |
| Goat anti-mouse Cy3 antibody | Jackson | 115-166-072 | |
| Heparin Sodium 5,000 I.U./mL | Panpharma | - | |
| Human adipose microvascular cells | Sciencell | #7200 | |
| Human fibronectin | Sigma | F0895-5MG | A stock concentration of 1 mg/mL |
| Isoflurane, USP Terrell | Piramal Critical Care | NDC 66794-011-25 | |
| LifeSupport | Advanced Biomatrix | 5244 | a gelatin support slurry for FRESH 3D bioprinting |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | |
| Low-glucose DMEM | Biological Industries | 01-050-1A | |
| MICROMAN E M1000E, 100-1,000 µL | Gilson | FD10006 | |
| Mouse anti-SMA antibody | Dako | M0851 | |
| NEAA | Gibco | 11140068 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Paraformaldehyde solution 4% in PBS | ChemCruz | SC-281692 | |
| Penicillin-Streptomycin-Nystatin Solution | Biological Industries | 03-032-1B | |
| Phospate buffered saline (PBS) | Sigma | P5368-10PAK | |
| Poly(ethylene oxide), M.W. 250,000 to 400,000 | Acros Organics | 178602500 | |
| Poly(L-lactic acid), IV 5.0 dl/g (PLLA) | Polysciencse, Inc. | 18582-10 | |
| Polyimide tubing, ID: 0.0249", OD: 0.0273" | Cole-Parmer | 95820-05 | A thin-walled tube used to fabricate cuffs for microsurgical anastomoses |
| Prusa I3 MK2.5 3D Printer | Prusa Research | http://www.prusa3d.com/ | a popular commercial 3D printer |
| Resomer RG 503 H, Poly(D,L-lactide-co-glycolide) (PLGA) | Evonik Industries | 719870 | |
| rhCollMA | CollPlant | https://collplant.com/ | generously provided by CollPlant (Rehovot, Israel) |
| round-handled needle holder | S&T | B-15-8 | |
| Scalpel handle - #3 | Fine Science Tools (FST) | 10003-12 | |
| small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Sodium Chloride | Biosolve Chemical | 19030591 | |
| Sodium Phosphate dibasic (NaH2PO4) | Riedel-de Haen | 4276 | |
| Solidworks | Dassault Systems | CAD software | |
| Straight no.3 jeweler's forceps | S&T | JF-3-18 | |
| Straight serrated forceps | Fine Science Tools (FST) | 11050-10 | |
| Surgical Scalpel Blade No.15 | Swann-Morton Limited | 305 | |
| Triton-X 100 | BioLab LTD | 57836 | |
| TSIM | Advanced Solutions | 3D slicing and design software for the BioAssembly Bot | |
| Vessel dilator | S&T | D-5a.1 | |
| Zeiss Tivato 700 surgical microscope | Zeiss |
Referencias
- Wallace, C. G., Wei, F. -C. C. The current status, evolution and future of facial reconstruction. Chang Gung Medical Journal. 31 (5), 441-449 (2008).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), 12(2012).
- Duan, B. State-of-the-art review of 3D bioprinting for cardiovascular tissue engineering. Annals of Biomedical Engineering. 45 (1), 195-209 (2017).
- Kim, J. J., Hou, L., Huang, N. F. Vascularization of three-dimensional engineered tissues for regenerative medicine applications. Acta Biomaterialia. 41, 17-26 (2016).
- Ouyang, L., Armstrong, J. P. K., Chen, Q., Lin, Y., Stevens, M. M. Void-free 3D bioprinting for in situ endothelialization and microfluidic perfusion. Advanced Functional Materials. 30 (1), 1908349(2020).
- Baltazar, T., et al. Three dimensional bioprinting of a vascularized and perfusable skin graft using human keratinocytes, fibroblasts, pericytes, and endothelial cells. Tissue Engineering - Part A. 26 (5-6), 227-238 (2020).
- Chia, H. N., Wu, B. M. Recent advances in 3D printing of biomaterials. Journal of Biological Engineering. 9 (1), 4(2015).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Guillotin, B., et al. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials. 31 (28), 7250-7256 (2010).
- Catros, S., et al. Laser-assisted bioprinting for creating on-demand patterns of human osteoprogenitor cells and nano-hydroxyapatite. Biofabrication. 3 (2), (2011).
- Ronca, A., Ambrosio, L., Grijpma, D. W. Preparation of designed poly(d,l-lactide)/nanosized hydroxyapatite composite structures by stereolithography. Acta Biomaterialia. 9 (4), 5989-5996 (2013).
- Lan, P. X., Lee, J. W., Seol, Y. J., Cho, D. W. Development of 3D PPF/DEF scaffolds using micro-stereolithography and surface modification. Journal of Materials Science: Materials in Medicine. 20 (1), 271-279 (2009).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655(2015).
- Szklanny, A. A., et al. 3D bioprinting of engineered tissue flaps with hierarchical vessel networks (VesselNet) for direct host-to-implant perfusion. Advanced Materials. 33 (42), 2102661(2021).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. Journal of Visualized Experiments JoVE. (69), (2012).
- Sucher, R., et al. Mouse hind limb transplantation: A new composite tissue allotransplantation model using nonsuture supermicrosurgery. Transplantation. 90 (12), 1374-1380 (2010).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), (2014).
- Novosel, E. C., Kleinhans, C., Kluger, P. J. Vascularization is the key challenge in tissue engineering. Advanced Drug Delivery Reviews. 63 (4-5), 300-311 (2011).
- Landau, S., et al. Tropoelastin coated PLLA-PLGA scaffolds promote vascular network formation. Biomaterials. 122, 72-82 (2017).
- Szklanny, A. A., et al. High-throughput scaffold system for studying the effect of local geometry and topology on the development and orientation of sprouting blood vessels. Advanced Functional Materials. 1901335, 1-13 (2019).
- Song, W., et al. Engineering transferrable microvascular meshes for subcutaneous islet transplantation. Nature Communications. 10 (1), 1-12 (2019).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Ying, G. L., et al. Aqueous two-phase emulsion bioink-enabled 3D bioprinting of porous hydrogels. Advanced Materials. 30 (50), 1-9 (2018).
- Rouwkema, J., Khademhosseini, A. Vascularization and angiogenesis in tissue engineering: beyond creating static networks. Trends in Biotechnology. 34 (9), 733-745 (2016).
- Jang, J., Park, J. Y., Gao, G., Cho, D. W. Biomaterials-based 3D cell printing for next-generation therapeutics and diagnostics. Biomaterials. 156, 88-106 (2018).
- Suntornnond, R., An, J., Chua, C. K. Roles of support materials in 3D bioprinting - present and future. International Journal of Bioprinting. 3 (1), 83-86 (2017).
- Shoseyov, O., Posen, Y., Grynspan, F. Human recombinant type I collagen produced in plants. Tissue Engineering - Part A. 19 (13-14), 1527-1533 (2013).
- Stein, H., et al. Production of bioactive, post-translationally modified, heterotrimeric, human recombinant type-I collagen in transgenic tobacco. Biomacromolecules. 10 (9), 2640-2645 (2009).
- Kaplan, B., et al. Rapid prototyping fabrication of precision polyester scaffolds for axonal guidance. Biomaterials. , 120062(2020).
- Karakurt, I., Lin, L. 3D printing technologies: techniques, materials, and post-processing. Current Opinion in Chemical Engineering. 28, 134-143 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados