Method Article
Fabbricazione di lembi vascolari ingegnerizzati utilizzando tecnologie di stampa 3D
In questo articolo
Riepilogo
I lembi ingegnerizzati richiedono una rete vascolare funzionale incorporata. In questo protocollo, presentiamo un metodo per fabbricare un lembo di tessuto stampato in 3D contenente una rete vascolare gerarchica e le sue anastomosi microchirurgiche dirette all'arteria femorale di ratto.
Abstract
L'ingegnerizzazione di tessuti impiantabili, funzionali e spessi richiede la progettazione di una rete vascolare gerarchica. Il bioprinting 3D è una tecnologia utilizzata per creare tessuti aggiungendo strato su strato di biomateriali stampabili, denominati bioink e cellule in modo ordinato e automatico, che consente di creare strutture altamente intricate che le tecniche tradizionali di ingegneria tissutale non possono raggiungere. Pertanto, il bioprinting 3D è un approccio in vitro accattivante per imitare la struttura complessa vascolare nativa, che va dai vasi millimetrici alle reti microvascolari.
I progressi nel bioprinting 3D in idrogel granulari hanno permesso l'estrusione ad alta risoluzione di bioink a matrice extracellulare a bassa viscosità. Questo lavoro presenta un approccio combinato di bioprinting 3D e stampa 3D basato su stampi sacrificali per la fabbricazione di lembi di tessuto vascolarizzato ingegnerizzati. La bioprinting 3D di cellule endoteliali e di supporto utilizzando bioink collagene-metacrilato ricombinante all'interno di un bagno di supporto alla gelatina viene utilizzata per la fabbricazione di una rete capillare autoassemblata. Questa microvascolarizzazione stampata è assemblata attorno a un'impalcatura porosa simile a un vaso a mesoscala, fabbricata utilizzando uno stampo stampato in 3D sacrificale ed è seminata con cellule endoteliali.
Questo assemblaggio induce l'endotelio del vaso a mesoscala ad anastomosi con la rete capillare circostante, stabilendo una rete vascolare gerarchica all'interno di un lembo tissutale ingegnerizzato. Il lembo ingegnerizzato viene quindi impiantato direttamente dall'anastomosi chirurgica a un'arteria femorale di ratto utilizzando una tecnica di bracciale. I metodi descritti possono essere ampliati per la fabbricazione di vari lembi di tessuto vascolarizzato per l'uso in chirurgia di ricostruzione e studi di vascolarizzazione.
Introduzione
Gravi difetti tissutali sono causati da lesioni traumatiche, difetti congeniti o malattie, e l'attuale gold standard per il trattamento di questi difetti è l'uso di innesti autologhi, lembi di tessuto vascolarizzato e lembi liberi microvascolari come sostituti tissutali. Tuttavia, queste opzioni presentano gli svantaggi del tessuto del sito donatore limitato e della morbilità del sito donatore1. Pertanto, vi è una crescente domanda di sostituti tissutali alternativi che possono essere utilizzati per correggere questi difetti2. Lo spessore dei costrutti tissutali ingegnerizzati è limitato dalla diffusione di nutrienti e gas verso le cellule e, quindi, una corretta rete vascolare è essenziale per generare impalcature grandi, spesse e adeguatamente nutrite.
Sono stati applicati diversi approcci per promuovere la vascolarizzazione di impianti ingegnerizzati3, tra cui il reclutamento in vivo del supporto vascolare dall'ospite, la consegna di fattori di crescita e citochine all'interno degli scaffold, la prevascolarizzazione degli impianti, la generazione di un letto di microvaso ramificato perfusibile utilizzando tecniche di micropatterning4, l'uso di materiali sacrificali per la formazione di canali/ reti vascolari5 , così come la creazione di canali all'interno di costrutti bioprinted 3D 5,6. La vascolarizzazione dei tessuti spessi richiede l'incorporazione di una rete vascolare gerarchica costituita da vasi su macro-scala e microcapillari. I vasi su macroscala distribuiscono il sangue in modo efficace in tutto il costrutto e consentono anastomosi microchirurgiche con i vasi sanguigni ospiti, mentre i vasi a scala microcapillare consentono la diffusione dei nutrienti.
Il bioprinting ha guadagnato una forte attenzione negli ultimi anni grazie ai vantaggi che offre rispetto ai metodi convenzionali di ingegneria tissutale. Tessuti e organi sono oggetti 3D complessi e intricati con un'architettura specifica. Il bioprinting 3D, con la sua capacità di depositare strati di biomateriali in alta risoluzione, consente la capacità di creare complessi sostituti di tessuti e organi (ad esempio, reni, polmoni, fegato)7. Diverse tecnologie di stampa sono state adattate per la bioprinting, tra cui l'estrusione, il getto d'inchiostro8, la deposizione assistita da laser 9,10 e la bioprinting11,12 basata su stereolitografia. Le tecnologie basate sull'estrusione si basano sull'estrusione del materiale attraverso un ugello applicando una pressione sulla superficie sfusa del materiale opposta all'ugello.
L'incorporamento reversibile a forma libera di idrogel sospesi (FRESH) è una tecnica di bioprinting13,14 che utilizza un materiale di supporto granulare in cui il materiale estruso viene depositato e fissato in posizione dal bagno di supporto. Il bagno di supporto fornisce supporto meccanico per il bioink estruso e pre-reticolato fino alla sua reticolazione. Il vantaggio principale di questa tecnica è che il bagno di supporto consente di estrudere materiali a bassa viscosità che non possono mantenere la loro forma dopo l'estrusione e prima della reticolazione15. Ciò espande il pool di materiali disponibili che possono essere utilizzati come bioink.
Questo documento presenta un protocollo per la generazione di un lembo vascolarizzato che combina vascolarizzazioni su microscala e mesoscala. Per raggiungere questo obiettivo, vengono generate reti microvascolari biostampate, autoassemblanti e in idrogel di collagene metacrilato umano ricombinante (rhCollMA), che si collega quindi all'interno di un'impalcatura vascolare più grande, impiantabile, risultando in un lembo di tessuto completamente ingegnerizzato16. Per stabilire una perfusione rapida e diretta di tessuti ingegnerizzati, è necessaria un'anastomosi microchirurgica diretta ai vasi ospiti. L'impalcatura vascolare non ha una forza di ritenzione della sutura sufficiente per essere anastomosizzata utilizzando la tradizionale sutura microchirurgica della parete del vaso. Pertanto, descriviamo un metodo "cuff"17,18,19 per ottenere un'anastomosi con l'arteria femorale comune di un ratto. In questo metodo, le estremità della nave sono fissate con suture circonferenziali, senza la necessità di perforare la parete della nave.
Sebbene il protocollo proposto sia stato preparato per studiare la vascolarizzazione gerarchica nell'ambiente rhCollMA, questo approccio può essere ampliato e applicato a una varietà di nuove applicazioni. Il protocollo può essere applicato alla biostampa di varie cellule tessuto-specifiche in diversi bioink. Inoltre, la geometria e le dimensioni dei costrutti possono essere facilmente modificate per soddisfare requisiti specifici, come la ricostruzione di tessuti di grandi dimensioni o studi biologici.
Protocollo
Tutte le procedure sugli animali sono state approvate e condotte sotto la supervisione della Technion Pre-Clinical Research Authority (PCRA Technion, approvazione etica n. 058-05-20). Per questi studi sono stati utilizzati ratti maschi Sprague-Dawley (275-350 g). Vedere la Tabella dei materiali per i dettagli relativi a tutti i materiali, le attrezzature e il software utilizzati in questo protocollo.
1. Fabbricazione di impalcature vascolari
- Crea un modello computerizzato 3D della forma dell'impalcatura vascolare desiderata utilizzando il software CAD (computer-aided design) o scarica un file 3D di una struttura vascolare desiderata dai repository online.
- Create un cilindro con un diametro interno di 0,9 mm, un diametro esterno di 2 mm e un'altezza di 18 mm. Aggiungere le fenestrazione radiali con un diametro di 0,22 mm lungo la parete del cilindro.
- Creare uno stampo per l'impalcatura utilizzando il software di progettazione 3D ed esportarlo come file . STL. Quindi, aggiungi un imbuto al design per facilitare il riempimento dello stampo in un secondo momento.
- Importare il file . STL nel software di slicing per la stampante 3D FDM (Fused Deposition Modeling). Taglia il modello con un'altezza del livello di 0,1 mm ed esportalo come .gcode o invialo direttamente alla stampante 3D.
- Stampa 3D dello stampo su una stampante 3D FDM dotata di un ugello da 0,25 mm, utilizzando il filamento di copolimero di alcol vinilico butene-diolo solubile in acqua (BVOH). Conservare gli stampi stampati in una camera a vuoto fino all'uso.
ATTENZIONE: Evitare di maneggiare il filamento BVOH a mani nude in quanto sensibile all'umidità. Inoltre, si consiglia di conservare il filamento in una camera a vuoto per evitare l'esposizione all'umidità. - Preparare una soluzione polimerica di una miscela 1:1 di acido poli-L-lattico (PLLA) e acido polilattico-co-glicolico (PLGA) in 1,4-diossano.
- Pesare 350 mg di PLLA e 350 mg di PLGA e trasferirli in un flaconcino di vetro da 20 ml.
- Misurare 10 mL di 1,4-diossano e trasferirlo nel flaconcino di vetro utilizzando una pipetta di vetro. Aggiungere una piccola barra magnetica al flaconcino di vetro.
ATTENZIONE: il 1,4-diossiano è un solvente organico pericoloso. Utilizzare adeguate attrezzature di sicurezza personale e lavorare all'interno di una cappa aspirante. - Posizionare il flaconcino di vetro all'interno di un bagno di acqua calda riscaldato a 70 °C e mescolare il contenuto durante la notte fino a quando tutti i polimeri si dissolvono completamente. Conservare la soluzione in un contenitore di vetro ermetico fino all'uso.
- Riempire gli stampi BVOH con la soluzione PLLA:PLGA.
- Utilizzando una pipetta a spostamento positivo, misurare 30 μL della soluzione polimerica e riempire lo stampo.
NOTA: il volume necessario per riempire lo stampo cambierà in base al volume del recipiente progettato. Continuare ad aggiungere la soluzione polimerica fino a quando l'imbuto dello stampo non è completamente riempito. - Centrifugare lo stampo a 100 × g per 2 min. Riempire lo stampo con ulteriori 20 μL della soluzione polimerica per garantire un riempimento completo.
- Utilizzando una pipetta a spostamento positivo, misurare 30 μL della soluzione polimerica e riempire lo stampo.
- Congelare gli stampi riempiti a -80 °C per almeno 30 minuti per garantire che tutta la soluzione polimerica si congeli. Rimuovere il solvente dagli stampi liofilizzandoli durante la notte.
NOTA: il colore del polimero nello stampo deve passare da chiaro a bianco dopo il processo di liofilizzazione. - Per rimuovere il materiale dello stampo sacrificale, trasferire gli stampi dopo il processo di liofilizzazione in un bagno d'acqua deionizzato da 5 L a fuoco delicato. Sostituisci l'acqua nella vasca da bagno quando diventa torbida. Quando tutto il BVOH si dissolve, asciugare all'aria gli scaffold e conservarli in una camera a vuoto fino all'uso.
2. Rivestimento dell'impalcatura vascolare con fibronectina
- Disinfettare gli scaffold vascolari PLLA:PLGA immergendoli in etanolo al 70% per 30 min.
- Lavare le impalcature 3x 5 min con PBS.
- Preparare una diluizione di 50 μg/mL di fibronectina umana in PBS e rivestire gli scaffold.
- Miscelare 500 μL di soluzione di fibronectina madre (1 mg/mL) con 9,5 mL di PBS.
- Immergere gli scaffold vascolari disinfettati in questa soluzione di fibronectina e incubarli a 37 °C per 60 minuti per consentire l'adsorbimento proteico.
- Dopo l'incubazione, sciacquare gli scaffold con PBS per rimuovere la fibronectina non legata. Conservare questi ponteggi rivestiti a 4 °C per un massimo di 1 settimana.
3. Preparazione del bioink rhCollMA
- Preparare un tampone fosfato per neutralizzare lo stock acido rhCollMA bioink.
- Preparare una scorta 10x di tampone fosfato sciogliendo 5,495 g di Na2HPO4, 1,55 g di NaH2PO4 e 30 mg di NaCl in 50 ml di acqua deionizzata.
- Preparare una diluizione 10 volte del tampone fosfato 10x stock combinando 1 parte di tampone fosfato 10x con 9 parti di acqua deionizzata.
- Combinare 900 μL di soluzione stock di rhCollMA con 100 μL di tampone fosfato 10x per neutralizzare la soluzione acida di rhCollMA.
- Diluire la soluzione neutralizzata di rhCollMA alla concentrazione desiderata di 10 mg/ml mescolandola con la quantità richiesta di 1x tampone fosfato.
NOTA: La concentrazione di stock di rhCollMA varia tra i lotti. Pertanto, il volume di 1x tampone fosfato necessario per raggiungere la concentrazione desiderata varierà. - Preparare la soluzione porogen-fotoiniziatore (PEO-LAP) da combinare con il rhCollMA neutro diluito.
- Preparare una soluzione all'1,6% (p/v) di poli(ossido di etilene) (PEO) in DMEM privo di fenolo rosso sciogliendo 160 mg di PEO in 10 ml di DMEM.
- Aggiungere 20 mg di litio fenil-2,4,6-trimetilbillifosfinato (LAP) a questa soluzione per ottenere lo 0,2% (p/v) lap nella soluzione. Da questo punto, coprire la soluzione con un foglio di alluminio o tenerla in un luogo buio per proteggerla dalla luce.
- Sterilizzare la soluzione PEO-LAP facendola passare attraverso un filtro da 0,22 μm. Conservare questa soluzione a 4 °C per un massimo di 1 settimana.
- Prima della bioprinting, mescolare la soluzione neutra diluita di rhCollMA con la soluzione PEO-LAP in un rapporto 1:1 per ottenere la soluzione finale di bioink. Utilizzare il pipettaggio, piuttosto che un vortice, per mescolare le soluzioni evitando bolle d'aria.
- Se molte bolle vengono introdotte nella soluzione, centrifugarla a 2.000 × g per 30 s. Dopo la centrifugazione, mescolare nuovamente la soluzione bioink per garantire l'omogeneità.
4. Preparazione del bagno di supporto granulare
- Preparare il materiale di supporto granulare alla gelatina.
- In un armadio di sicurezza biologica, dividere il contenuto di un tubo da 2 g di materiale di supporto liofilizzato in due tubi conici sterili da 50 ml, ciascuno contenente circa 1 g.
- Aggiungere 40 ml di DMEM freddo (4 °C) senza fenolo a ciascun tubo e ruotare vigorosamente fino a quando tutto il materiale di supporto liofilizzato si dissolve.
- Lasciare riposare il liquame risultante a 4 °C per consentire al materiale di supporto di reidratarsi.
- Degassare il materiale di supporto in una camera a vuoto per 30 minuti per ridurre le bolle.
- Centrifugare il materiale di supporto a 2.000 × g per 5 min. Assicurarsi che il materiale si trovi nella parte inferiore del tubo e che il surnatante sia chiaro.
- Aspirare il surnatante, facendo attenzione a non aspirare il materiale di supporto nella parte inferiore.
NOTA: il materiale di supporto non deve scorrere mentre si inclina il tubo dopo aver rimosso il surnatante. Se il materiale scorre, centrifugarlo di nuovo utilizzando le stesse impostazioni ma senza aggiungere nuovo surnatante.
- Trasferire circa 4 mL del materiale di supporto compattato preparato in ciascun pozzetto di una piastra a 12 pozzetti utilizzando una pipetta a spostamento positivo. Toccare la piastra del pozzo su una superficie dura per forzare il materiale di supporto a diffondersi uniformemente nel pozzo.
NOTA: il volume minimo consigliato di materiale di supporto è 3 volte il volume del costrutto che verrà stampato in esso. - Posizionare la piastra del pozzo con il materiale di supporto su uno stadio di bioprinter raffreddato, o a 4 °C, fino al suo utilizzo per evitare che le particelle di gelatina si sciolgano.
5. Incorporazione di cellule endoteliali e cellule di supporto con il bioink
- Preparare il mezzo cellulare endoteliale secondo le istruzioni del produttore mescolando il mezzo basale con il suo corrispondente componente del kit medio, tra cui una soluzione antibiotica, siero bovino fetale e integratori per la crescita delle cellule endoteliali.
- Preparare il mezzo cellulare staminale della polpa dentale combinando 500 mL di DMEM a basso contenuto di glucosio, 58 mL di siero bovino fetale, 5,8 mL di aminoacidi non essenziali (NEAA), 5,8 mL di sostituto della glutammina, 5,8 mL di 1 M HEPES e 5,8 mL di soluzione di penicillina-streptomicina-nistatina.
- Preparare una sospensione contenente 2 × 106 cellule endoteliali microvascolari adipose umane che esprimono ZsGreen1 (HAMEC-ZsGreen1) e 6 × 106 cellule staminali della polpa dentale (DPSC) in 10 ml di mezzo cellulare endoteliale.
- Centrifugare la sospensione cellulare a 200 × g per 4 minuti per ottenere un pellet cellulare. Aspirare il mezzo surnatante.
- Sospendere il pellet cellulare in 1 mL di bioink rhCollMA preparato in precedenza (contenente PEO-LAP) per ottenere un bioink con una concentrazione cellulare totale di 8 × 106 cellule per 1 mL di bioink.
ATTENZIONE: Dopo aver combinato il bioink con le cellule, procedere immediatamente al passaggio successivo. Se le cellule vengono lasciate nella sospensione per lungo tempo, le cellule affonderanno sul fondo del tubo e la loro vitalità si deteriorerà. Per gli esperimenti che non coinvolgono le cellule, saltare i passaggi 5.1-5.5 o incorporare perline fluorescenti con il bioink invece delle celle per una migliore visualizzazione microscopica dei costrutti stampati. - Trasferire la miscela cellule-bioink in cartucce di stampa.
- Montare un ago da 0,22 mm di diametro interno su una cartuccia di stampa ambra da 3 ml e posizionare la cartuccia in un tubo conico da 50 ml.
- Trasferire 1 mL della miscela cellule-bioink alla cartuccia di stampa riempiendola dall'alto, utilizzando una pipetta a spostamento positivo per ridurre le bolle.
- Installare la cartuccia di stampa nello strumento appropriato presso la bioprinter.
6. Bioprinting reti microvascolari utilizzando rhCollMA bioink
- Creare un progetto CAD 3D per la rete microvascolare biostampata.
- Tracciate un motivo 2D di un quadrato di 4 mm contenente un canale circolare di 2 mm di diametro al centro. Estrudere lo sketch di 4 mm per ottenere un cubo di 4 mm x 4 mm x 4 mm con un canale centrale. Esportare questo oggetto come file . STL.
- Importare una piastra da 12 pozzetti. Modello STL nella scheda di modellazione solida nel software di affettatura bioprinter e posizionarlo nell'area designata del piano di stampa virtuale.
- Importare il file . File STL della forma del cubo nella scheda di modellazione solida nel software di affettatura bioprinter. Fare clic sulla casella di controllo Usa filtro dei dati esterno | configurare il filtro dei dati nella sezione delle proprietà dell'oggetto . Nella finestra popup, scegliete un motivo rettilineo per il modello di riempimento e digitate 30% nella densità di riempimento. Fai clic su Accetta.
- Posiziona una copia della forma del cubo in ogni pozzo virtuale desiderato facendo clic sul cubo e spostandolo con il mouse.
- Creare nuove impostazioni del materiale per rhCollMA bioink nella scheda materiali del software di affettatura bioprinter facendo clic sul pulsante Aggiungi materiale . Scegli le impostazioni del materiale per la stampa. Per la pressione, digitare 2 psi nella casella corrispondente. Per la velocità, digitare 20 mm/s nella casella corrispondente.
NOTA: ogni materiale bioink ha le proprie diverse impostazioni di stampa che possono essere salvate nell'elenco dei materiali nell'applicazione. - Assegnare i valori di larghezza e altezza della linea a 0,24 mm e il valore di accelerazione a 400 mm/s2, digitando questi valori nelle caselle corrispondenti.
- Nella scheda Modellazione solida , fare clic sull'oggetto cubo, quindi fare clic sul materiale rhCollMA dalla sezione materiali per assegnarlo alla forma del cubo. Nella scheda Bioassemblaggio , fare clic sul pulsante Invia lavoro di stampa per inviare il lavoro di stampa alla bioprinter.
- Caricare la cartuccia di stampa caricata con il bioink cellulare nello strumento di erogazione pneumatica ambientale da 3 ml della bioprinter basata sull'estrusione 3D.
- Impostare la temperatura del letto di stampa a 4 °C facendo clic sul pulsante di raffreddamento nella scheda Controllo-Riscaldamento/Raffreddamento nella schermata dell'interfaccia della biostampante. Caricare la piastra con il bagno di supporto sul letto della stampante.
NOTA: le impostazioni del materiale per la pressione e la velocità di stampa potrebbero cambiare a causa delle differenze di temperatura ambiente o della variabilità del lotto di bioink. Ad esempio, nei giorni più freddi, è necessaria una pressione più elevata o una velocità più lenta per estrudere la stessa quantità di materiale. - Nella scheda stampa nella schermata dell'interfaccia bioprinter, fare clic sul processo di stampa inviato nel passaggio 6.7. e fare clic su Avvia | vai per iniziare il processo di stampa.
- Dopo la stampa, esporre la piastra del pozzo a una sorgente luminosa a 405 nm con un'intensità di 3 mW/cm2 per 30 s per avviare la reticolazione del bioink rhCollMA.
- Dopo la reticolazione, incubare la piastra del pozzo a 37 °C e 5% di CO2 per almeno 20 minuti fino a quando tutto il bagno di supporto si scioglie.
- Aspirare delicatamente il bagno di supporto liquefatto e sostituirlo con un mezzo cellulare endoteliale. Incubare i costrutti a 37 °C e 5% DI CO2 fino all'uso in fasi successive.
NOTA: a causa della contrazione del costrutto dopo la stampa, si consiglia di eseguire il passaggio 7 dell'assieme lo stesso giorno del passaggio 6.
7. Assemblaggio della rete microvascolare biostampata con l'impalcatura vascolare per ottenere il lembo vascolarizzato ingegnerizzato
- Immediatamente dopo la rimozione del materiale di supporto della rete microvascolare biostampata, posizionare un'impalcatura vascolare PLLA:PLGA rivestita di fibronectina nel canale principale della struttura biostampata.
- Incubare i costrutti assemblati a 37 °C e 5% CO2 per 2 giorni.
- Rivestire il lume dell'impalcatura vascolare con cellule endoteliali.
- Preparare una sospensione cellulare di cellule endoteliali microvascolari umane che esprimono tdTomato (HAMEC-tdTomato) ad una concentrazione di 1 × 107 cellule/ml.
- Posizionare una goccia da 20 μL di questa sospensione cellulare su una superficie idrofoba (cioè una coltura non tissutale [nonTC] piatto da 10 cm).
- Posizionare delicatamente le impalcature vascolari sopra la goccia, in modo tale che il lume dell'impalcatura su un'estremità entri in contatto con la goccia cellulare.
- Aspirare la goccia dall'estremità opposta dell'impalcatura (cioè l'estremità che non sta contattando la goccia), riempiendo il suo lume con la sospensione cellulare.
- Posizionare l'impalcatura seminata in un tubo di microcentrifuga e metterla in un rotatore all'interno in un incubatore umidificato per 60 minuti. Quindi, trasferire l'impalcatura in una piastra a 12 pozzetti e aggiungere 2 ml di mezzo cellulare endoteliale.
- Coltivare i lembi ingegnerizzati per 7 giorni, sostituendo il mezzo ogni 2 giorni con un mezzo cellulare endoteliale fresco.
8. Microscopia confocale e colorazione immunofluorescenza dei lembi ingegnerizzati
- Dopo 4 giorni e 7 giorni di coltura, eseguire l'imaging a cellule vive degli scaffold assemblati utilizzando un microscopio a scansione laser confocale.
- Definire i canali di fluorescenza per le proteine fluorescenti ZsGreen1 e tdTomato sul software di acquisizione delle immagini al microscopio.
- Scegli un obiettivo 5x/0,16 con zoom 0,5x (dimensione dei pixel 5 μm) e definisci uno Z-stack con 22 fette con uno spessore di 41 μm ciascuna.
- Definire una scansione di riquadri 3 x 2 per l'immagine e acquisire l'intero costrutto.
- Regola l'intensità del laser e i valori di guadagno per ottenere un chiaro segnale fluorescente senza saturazione e sfondo minimo e acquisisci le immagini.
- Eseguire una proiezione di massima intensità dello Z-stack acquisito per ottenere una singola immagine 2D utilizzando il software di acquisizione delle immagini al microscopio o un software di analisi delle immagini simile.
- Eseguire immagini con ingrandimento più elevato di una regione di interesse.
- Passare a un obiettivo 10x/0,3 con zoom 0,5 (dimensione dei pixel 1,25 μm) e definire uno Z-stack con 9 fette di spessori di 41 μm.
- Eseguire i passaggi 8.2.-8.3.
- Dopo 7 giorni di coltura, fissare i lembi ingegnerizzati immergendoli in paraformaldeide al 4% per 20 minuti.
- Lavare i costrutti 3x 5 min con PBS.
- Aggiungere lo 0,3% (v/v) di Triton-X in PBS ai costrutti e incubare per 15 minuti a temperatura ambiente per permeabilizzare le cellule.
- Lavare i costrutti 3x 5 min con PBS.
- Preparare una soluzione bloccante sciogliendo il 5% (p/v) di albumina sierica bovina (BSA) in PBS. Aggiungere la soluzione di bloccaggio ai lembi ingegnerizzati e incubare per 1 ora a temperatura ambiente.
- Preparare la soluzione anticorpale primaria diluendo l'anticorpo anti-smooth muscle actin (anti-SMA) 1:50 del topo nella soluzione BSA al 5% preparata in precedenza per macchiare le cellule di supporto che esprimono SMA.
- Incubare gli scaffold nella soluzione anticorpale primaria durante la notte a 4 °C.
- Lavare 3x 5 min con PBS.
- Preparare la soluzione anticorpale secondaria diluendo l'anticorpo IgG 1:400 di capra coniugato Cy3 e l'anticorpo 4',6-diamidino-2-fenilindolo (DAPI, 2,5 μg/mL) in PBS.
- Applicare la soluzione anticorpale secondaria sugli scaffold e incubare per 3 ore a temperatura ambiente.
- Lavare 3x 5 min con PBS.
- Conservare i costrutti a 4 °C in PBS per un massimo di 1 mese.
- Immagina le impalcature macchiate usando un microscopio a scansione laser confocale.
- Definire i tre canali di fluorescenza (DAPI, ZsGreen e Cy3) sul software di acquisizione delle immagini del microscopio.
- Definite una pila Z con uno spessore di sezione di 2 μm che copre uno spessore totale di 50 μm. Quindi, definire una scansione dei riquadri per visualizzare le aree più grandi del costrutto.
- Regolare i parametri di acquisizione per ottenere un chiaro segnale fluorescente senza saturazione e sfondo minimo.
- Acquisisci le immagini utilizzando l'obiettivo 20x/0,8 con zoom 1,0x (dimensione dei pixel 0,31 μm).
- Eseguire una proiezione di massima intensità dello Z-stack acquisito per ottenere una singola immagine 2D utilizzando il software di acquisizione delle immagini al microscopio o un software di analisi delle immagini simile.
9. Anastomosing del lembo ingegnerizzato direttamente sull'arteria femorale di un ratto utilizzando una tecnica di bracciale
- Preparare e sterilizzare (autoclave) i seguenti strumenti chirurgici: n. 15 bisturi, un paio di pinze a denti fini e un piccolo paio di forbici ad anello. Inoltre, preparare e sterilizzare i seguenti strumenti microchirurgici: una pinza da gioielliere n. 3 dritta a punta fine, una pinza da gioielliere angolata, un portaago a manico rotondo con mascelle curve, un paio di dilatatori di vasi, forbici per sezionare, forbici da avventizia e morsetti per vasi con il loro applicatore.
- Preparare una soluzione di 100 UI/mL di soluzione salina eparinizzata diluendo 5 mL di soluzione di eparina madre con 195 mL di soluzione salina.
- Tagliare e sterilizzare i polsini in poliimmide.
- Tagliare sezioni di 2,5 mm di un tubo di poliimmide al microscopio sezionante.
- A un'estremità di ogni sezione, fare un'incisione longitudinale di 1,25 mm nella parete del tubo per ottenere una maniglia del polsino. Effettuare un taglio angolato all'altra estremità del tubo per facilitare l'eversione del vaso.
- Immergere i polsini in etanolo al 70% seguiti da due lavaggi con soluzione salina eparinizzata.
- Preparare un ratto Sprague-Dawley maschio (275-350 g) per la chirurgia.
- Sette giorni prima dell'intervento chirurgico, iniziare a somministrare una dose giornaliera sottocutanea di ciclosporina (10 mg kg-1) per ottenere la soppressione immunitaria.
- Prima dell'intervento chirurgico, anestetizzare l'animale utilizzando il 3% di isoflurano per inalazione secondo sop istituzionale utilizzando una camera di induzione. Verificare l'anestesia profonda pizzicando entrambi i piedi e controllando i riflessi.
- Somministrare una dose sottocutanea di buprenorfina analgesica (0,03 mg kg-1) ed eparina anticoagulativa (200 UI kg-1).
- Applicare un unguento lubrificante per gli occhi agli occhi dell'animale per prevenire la disidratazione.
- Rasare l'area chirurgica del ratto e disinfettare il sito con iodio e quindi etanolo al 70%. Fissare gli arti dell'animale al tavolo usando del nastro adesivo.
- Esporre e isolare l'arteria femorale comune.
- Fai un'incisione obliqua lunga 2 cm attraverso la pelle, lungo la concavità tra la gamba e l'addome.
- Usando pinze e forbici smussate, rilascia la pelle dal tessuto sottostante per visualizzare il cuscinetto di grasso inguinale.
- Usando forbici e pinze, taglia direttamente attraverso il cuscinetto grasso intorno ai margini superiore, mediale e inferiore. Prestare attenzione a non tagliare grandi vasi sotto il cuscinetto di grasso.
- Riflettere il cuscinetto di grasso lateralmente, lasciando intatti i vasi epigastrici. Posizionare una garza bagnata sul cuscinetto di grasso riflesso per evitare l'asciugatura e fissarlo in posizione. Assicurarsi che i vasi femorali comuni siano visibili.
NOTA: Il cuscinetto di grasso verrà successivamente utilizzato per applicare una pressione morbida alle anastomosi. - Esporre l'arteria femorale dal legamento inguinale prossimalmente al punto di ramificazione dell'arteria epigastrica distalmente estraendola dalla sua guaina.
ATTENZIONE: Di solito c'è un ramo dell'arteria femorale che corre sotto di esso, comunemente chiamato ramo di Murphy. Presta attenzione a non danneggiare questo ramo difficile da vedere. - Dividere il ramo di Murphy legandolo, quindi legare l'arteria femorale con due legature al centro dell'arteria distanziate di 1 mm l'una dall'altra. Tenere a lungo un'estremità della sutura della legatura da utilizzare in seguito per tirare l'estremità del vaso attraverso il bracciale.
- Tagliare l'arteria tra le due legature usando le forbici da avventizia.
ATTENZIONE: Non ci dovrebbe essere alcun sanguinamento durante l'esecuzione di questo taglio. Se l'estremità arteriosa sanguina, bloccare l'arteria e riapplicare una legatura. - Utilizzando l'estremità lunga della sutura della legatura, inserire ogni estremità del vaso in un bracciale in poliimmide, come preparato nella fase precedente, in modo tale che le maniglie dei due polsini siano rivolte l'una dall'altra.
- Dopo l'inserimento, applicare un morsetto contemporaneamente sulla maniglia del bracciale e sulla nave, fissando il bracciale in posizione.
- Preparare una soluzione salina eparinizzata in una siringa dotata di un ago da 27 G.
- Tirare l'estremità del vaso legato e tagliarlo vicino alla legatura. Lavare immediatamente il vaso terminare accuratamente con la soluzione salina eparinizzata fino a quando non è visibile sangue nel lume.
ATTENZIONE: Assicurarsi che l'estremità del vaso sia lavata bene poiché qualsiasi sangue lasciato all'interno formerà un coagulo, che verrà introdotto nel flusso sanguigno al termine della procedura. Ciò potrebbe portare all'occlusione della nave e alla perdita di perfusione alla gamba. - Espandi il lume della nave tenendolo per la sua guaina con una mano e dilatando il suo lume con il dilatatore del vaso con l'altra mano.
- Posizionare una sutura circonferenziale in polipropilene 6-0 sciolta attorno al corpo del polsino. Evertire l'estremità del vaso usando due dilatatori del vaso sopra il corpo del bracciale e fissarlo in posizione stringendo la sutura circonferenziale.
NOTA: Se il sangue fuoriesce attraverso il vaso bloccato durante le manipolazioni, lavare accuratamente il lume con soluzione salina eparinizzata. - Risciacquare il lembo ingegnerizzato con soluzione salina eparinizzata, quindi inserire il bracciale rivestito in vaso nel lume dell'impalcatura vascolare. Fissare l'impalcatura in posizione posizionando una sutura circonferenziale in polipropilene 6-0 attorno all'impalcatura e al corpo del polsino. Fai questo passaggio per entrambi i lati dell'impalcatura vascolare.
- Avvolgere un filtro a membrana in polistirene da 0,2 μm attorno al sito di anastomosi per isolare il lembo ingegnerizzato dal tessuto circostante.
- Rilasciare prima il morsetto distale; quindi, rilasciare il morsetto prossimale per ristabilire il flusso sanguigno attraverso la nave.
- Per fermare qualsiasi sanguinamento attraverso le anastomosi, riflettere il cuscinetto di grasso sui vasi femorali e applicare una leggera pressione usando una garza sterile per 3 minuti.
- Suturare il cuscinetto di grasso in posizione utilizzando 6-0 polipropilene; quindi, suturare la pelle utilizzando 5-0 suture riassorbibili PGA.
- Pulire l'area della ferita con soluzione salina e applicare una soluzione di iodio.
- Per il dolore postoperatorio e la gestione degli animali, preparare uno 0,1% (v / v) di tramadolo nell'acqua potabile. Inoltre, somministrare una dose giornaliera di eparina (200 UI kg-1) e ciclosporina (10 mg kg-1).
- Metti l'animale in una gabbia pulita da sola posta sotto una lampada riscaldante. Continuare a monitorare l'animale fino a quando non riacquista sufficiente coscienza per mantenere la reclinazione sternale.
Risultati
Questo protocollo descrive la fabbricazione di un lembo ingegnerizzato composto da un'impalcatura vascolare (Figura 1Ai) e una microvascolarizzazione biostampata (Figura 1Aii), che sono stati assemblati per ottenere vascolarizzazioni a mesoscala e microscala (Figura 1Aiii). Seguendo il protocollo, sono stati progettati stampi BVOH dell'impalcatura vascolare e stampati in 3D (Figura 1B, C). Le strutture stampate ottenute sono state ispezionate visivamente per piccoli fili di BVOH, che potrebbero essere trovati negli spazi vuoti degli stampi (Figura 1D). Questi fili di solito indicano impostazioni errate del materiale o che il BVOH ha assorbito umidità. Questi fili devono essere rimossi in quanto potrebbero portare a un riempimento incompleto dello stampo e a difetti strutturali nell'impalcatura vascolare risultante. Successivamente, gli stampi sono stati riempiti con la soluzione PLLA:PLGA, seguita dal processo di liofilizzazione e dalle fasi di lavaggio, come descritto nel protocollo. L'impalcatura vascolare PLLA:PLGA ottenuta è stata ispezionata visivamente per verificare l'integrità della parete del vaso e la pervietà del lume (Figura 1E).
Un bioink rhCollMA neutralizzato ad una concentrazione di 10 mg/mL è stato preparato e combinato in un rapporto 1:1 con la soluzione PEO:LAP. Le cellule endoteliali microvascolari adipose umane etichettate con Zs-Green1 e le cellule staminali della polpa dentale sono state risospese con il bioink rhCollMA e la soluzione è stata caricata in una cartuccia di stampa e sulla stampante. Le forme di scatola con un canale centrale con un motivo rettilineo (Figura 1D) sono state biostampate all'interno del bagno di supporto alla gelatina. Dopo la stampa, i costrutti sono stati reticolati e il bagno di supporto è stato sciolto e lavato. Dopo 4 giorni di cultura, i costrutti sono stati ripresi dal vivo per verificare l'autoassemblaggio della rete microvascolare. La Figura 1D mostra un esempio di rete microvascolare HAMEC-ZsGreen1 altamente sviluppata nel costrutto bioprinted.
Successivamente, un'impalcatura vascolare rivestita di fibronectina è stata inserita nel canale centrale del costrutto stampato (Figura 2A). I costrutti assemblati sono stati coltivati per 2 giorni, durante i quali le cellule contraggono il gel, attaccandolo saldamente all'impalcatura vascolare. Quindi, l'impalcatura vascolare è stata rivestita con HAMEC che esprimono tdTomato, secondo il protocollo. Dopo 7 giorni di cultura, i costrutti sono stati fissati e ripresi. La Figura 2B mostra una vista laterale dei costrutti assemblati in cui le cellule endoteliali nella microvascolarizzazione biostampata sono raffigurate in verde, mentre il rivestimento endoteliale dell'impalcatura vascolare è raffigurato in rosso. L'immagine mostra un autoassemblaggio microvascolare verde nel gel biostampato, mentre l'impalcatura vascolare è rivestita con cellule endoteliali rosse. Con un ingrandimento più elevato, i germogli provenienti dal rivestimento endoteliale rosso sono visti germogliare e anastomosi con la rete microvascolare biostampata (Figura 2C). Successivamente, i costrutti sono stati colorati per α-liscia actina muscolare (SMA) come marcatore per le cellule staminali della polpa dentale. Dopo l'immunocolorazione, i costrutti sono stati ripresi utilizzando un microscopio confocale a scansione laser (Figura 2D).
Infine, dopo 7 giorni di coltura, i lembi ingegnerizzati sono stati microchirurgicamente anastomosi all'arteria femorale di un ratto, come descritto nel protocollo. Un video di una procedura rappresentativa può essere visto nel video supplementare S1. La Figura 2E mostra un'immagine rappresentativa di un'anastomosi completata prima della rimozione del morsetto e la Figura 2F mostra un'immagine rappresentativa del sito delle anastomosi dopo la rimozione del morsetto e l'emostasi. Non ci dovrebbe essere sanguinamento visibile prima della chiusura della ferita.
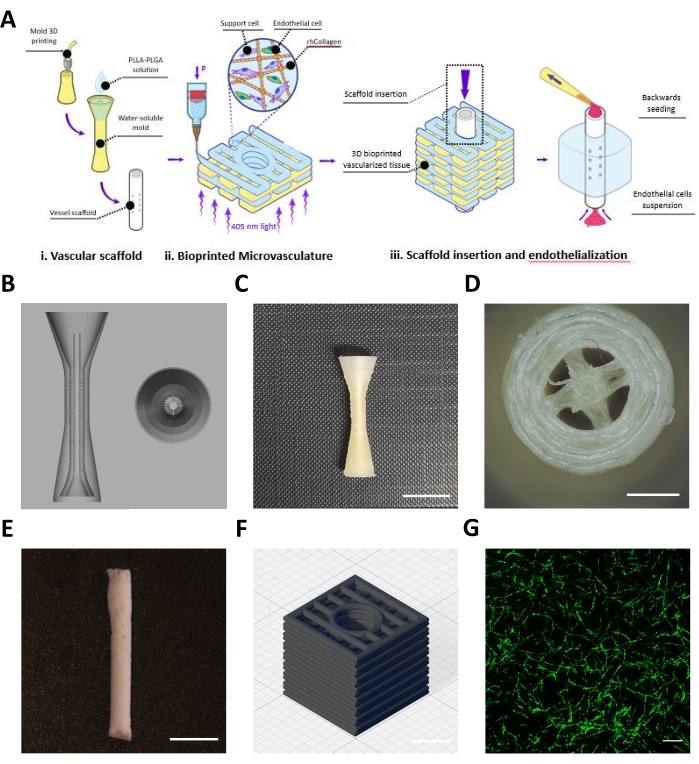
Figura 1: Immagini rappresentative dei vasi in meso e microscala fabbricati. (A) Panoramica schematica dei passaggi del protocollo. Riprodotto con il permesso16. (B) Progettazione CAD per lo stampo sacrificale dell'impalcatura vascolare. (C) Vista laterale di uno stampo sacrificale stampato in 3D rappresentativo (barra della scala = 0,5 mm). (D) Vista dall'alto dello stampo sacrificale (barra della scala = 0,5 mm) (E) Impalcatura vascolare rappresentativa fabbricata utilizzando il protocollo descritto (barra della scala = 5 mm). (F) Progettazione CAD per la rete microvascolare rhCollMA biostampata in 3D. Linee della griglia = 1 mm. (G) Immagine rappresentativa di una rete vascolare biostampata altamente sviluppata che mostra HAMEC-ZsGreen1 in verde. Barra della scala = 200 μm. Abbreviazioni: CAD = computer-aided design; rhCollMA = collagene umano metanrilato ricombinante; HAMEC = cellule endoteliali microvascolari adipose umane; PLLA = acido poli-L-lattico; PLGA = acido polilattico-co-glicolico. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagini rappresentative del lembo vascolarizzato assemblato. (A) Fotografia di un insieme rappresentativo di microvascolarizzazione biostampata e dell'impalcatura vascolare. Barra della scala = 1 mm. (B) Vista laterale di un lembo ingegnerizzato rappresentativo ripreso 4 giorni dopo il rivestimento endoteliale dell'impalcatura vascolare. La microvascolarizzazione biostampata è mostrata in verde (HAMEC-ZsGreen1), mentre il rivestimento endoteliale è mostrato in rosso (HAMEC-tdTomato). Barra della scala = 1 mm. (C) Immagine rappresentativa delle anastomosi tra la vascolarizzazione biostampata in verde e il rivestimento endoteliale in rosso. Barra della scala = 200 μm. (D) Immagine rappresentativa dell'immunocolorazione per actina muscolare liscia (rossa), nuclei (blu) e cellule endoteliali (verde) dopo 7 giorni di incubazione. Barra della scala = 0,1 mm. (E) Immagine rappresentativa di un'anastomosi completata del lembo ingegnerizzato con l'arteria femorale di un ratto prima della rimozione del morsetto e (F) dopo la rimozione del morsetto. Abbreviazioni: HAMEC = cellule endoteliali microvascolari adipose umane; SMA = actina muscolare liscia; DAPI = 4',6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione più grande di questa figura.
Video supplementare S1: Procedura microchirurgica rappresentativa per l'anastomosing dell'impalcatura vascolare all'arteria femorale di un ratto. Clicca qui per scaricare questo video.
Discussione
L'ingegneria dei tessuti vascolarizzati è una delle principali sfide dell'ingegneria tissutale20. I metodi attuali per la creazione di tessuto vascolare ingegnerizzato si concentrano sulla creazione di microvascolarizzazione autoassemblata 21,22,23 o sulla fabbricazione di scaffold vascolari a mesoscala 24,25 e non sulla ricreazione di un sistema di vascolarizzazione gerarchica, che può essere perfuso immediatamente e direttamente dopo l'impianto26 . In questo lavoro, descriviamo un protocollo che utilizza due modalità di stampa 3D per fabbricare una rete navale gerarchica composta da vascolari su microscala e mesoscala. Il protocollo combina una rete microvascolare auto-assemblata biostampata in 3D con un'impalcatura vascolare a mesoscala, ottenendo un lembo impiantabile e vascolarizzato. Inoltre, questo documento presenta un protocollo per anastomosizzare direttamente questo lembo all'arteria femorale di un ratto.
Il bioprinting 3D ha guadagnato interesse negli ultimi anni grazie alla sua versatilità rispetto alle tradizionali tecniche di ingegneria tissutale. Mentre questo protocollo descrive la generazione di una rete microvascolare in rhCollMA bioink, i metodi utilizzati possono essere applicati con poche modifiche a molti altri bioink dalla pletora di bioink studiati e nuovi e bagni di supporto27,28. Abbiamo scelto di utilizzare rhCollMA come bioink a causa dell'abbondanza di collagene di tipo I nell'ECM umano, fornendo un ambiente adatto per l'attaccamento cellulare. Inoltre, viene prodotto in modo ricombinante nelle piante e ulteriormente modificato con gruppi metacrilati, che consente la fotopolimerizzazione e la formazione di idrogel 3D stabili29,30. Il fotocrosslinking è stato ottenuto con l'aggiunta del fotoiniziatore LAP, che ha dimostrato di essere atossico e viene attivato dall'esposizione alla luce blu a 405 nm, riducendo la possibile fototossicità della luce UV. Tuttavia, l'uso di bioink fotosensibili richiede l'uso di un terreno di coltura privo di fenolo rosso per la preparazione del bioink e del materiale di supporto. Inoltre, il protocollo descrive l'uso di materiale di supporto alla gelatina, che consente l'estrusione ad alta fedeltà di bioink come rhCollMA. Pertanto, è fondamentale garantire l'uso di un mezzo freddo durante la sua preparazione e il raffreddamento del letto della stampante. Un riscaldamento eccessivo potrebbe verificarsi a causa della sorgente luminosa utilizzata per la reticolazione o da temperature ambiente elevate.
Una bioprinter basata sull'estrusione è stata utilizzata qui per creare la rete microvascolare bioprinted, e attualmente ci sono molte bioprinter disponibili in commercio che possono generare costrutti simili. Inoltre, i metodi proposti possono essere facilmente modificati e applicati per studiare diverse geometrie, dimensioni e modelli di riempimento. In questo lavoro, è stato scelto un modello di riempimento rettilineo per creare pori interconnessi, e questo può essere stampato relativamente rapidamente con alta fedeltà.
Le bolle d'aria introducono una sfida significativa nella bioprinting dell'estrusione, in particolare all'interno dei materiali di supporto. Pertanto, è fondamentale ridurre al minimo la presenza e la formazione di queste bolle utilizzando pipette a spostamento positivo per il trasferimento del materiale di supporto, la preparazione della sospensione bioink-cell e il loro trasferimento alle cartucce di stampa.
In questo lavoro, le cellule endoteliali di derivazione adiposa umana e le cellule staminali della polpa dentale sono state utilizzate come cellule di supporto a causa del loro isolamento relativamente facile dai pazienti. Inoltre, è stata scelta una concentrazione cellulare totale di 8 x 106 cellule/mL poiché questa concentrazione ha dimostrato di stabilire le reti vascolari più sviluppate16. Mentre questo protocollo può essere impiegato per generare microvascolarizzazione utilizzando diversi tipi di cellule e fonti, nonché diversi bioink, è necessario eseguire una calibrazione della concentrazione cellulare per stabilire le migliori condizioni per lo sviluppo della rete microvascolare. Inoltre, le cellule tessuto-specifiche (cioè mioblasti o osteoblasti) possono essere incorporate all'interno del bioink per ottenere lembi vascolarizzati specifici del tessuto.
Lo stampo per l'impalcatura vascolare porosa è stato fabbricato utilizzando materiale idrosolubile stampato in 3D su una stampante 3D per estrusione disponibile in commercio. Ciò si traduce in una tecnica economica basata su piattaforme di prototipazione rapida, in modo tale che molte geometrie e dimensioni diverse di scaffold vascolari possano essere studiate e vagliate rapidamente31. Tuttavia, una limitazione di questo metodo è il limite di risoluzione della maggior parte delle stampanti 3D32. Tuttavia, con il settore in rapida evoluzione che circonda la produzione additiva, questi limiti dovrebbero migliorare nel tempo. L'uso di solventi organici per il processo di fabbricazione è un'altra limitazione del protocollo, poiché la maggior parte dei solventi organici sono tossici per le cellule, impedendo la possibilità di combinare la procedura di bioprinting con il processo di fabbricazione dell'impalcatura vascolare.
Il metodo descritto di seminare il lume dell'impalcatura usando l'aspirazione invece di spingere la sospensione cellulare ha effetti importanti sulla localizzazione delle cellule seminate. L'uso della pressione negativa consente l'endotelizzazione del lume interno dell'impalcatura riducendo al minimo qualsiasi fuoriuscita della sospensione cellulare attraverso le perforazioni sulla parete dell'impalcatura16.
Il metodo "cuff" descritto per le anastomosi microchirurgiche può essere facilmente modificato e adattato a diversi materiali o dimensioni di scaffold vascolare, nonché a diverse arterie e vene in un'ampia scala di modelli animali. Gli adattamenti al protocollo includerebbero diverse dimensioni del tubo di poliimmide e dimensioni di sutura. Questo metodo non richiede la perforazione della parete dell'impalcatura, che potrebbe portare allo sviluppo di difetti. Questo lavoro presenta un protocollo che può essere esteso a molte applicazioni. Gli aspetti critici di questo protocollo, che includono la fabbricazione di vascolarizzazione meso- e microscala e il loro assemblaggio e impianto, rappresentano aspetti critici dei lembi ingegnerizzati sia per applicazioni ricostruttive, sia per studi vascolari e altri studi di ingegneria tissutale.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Questo progetto ha ricevuto finanziamenti dal Consiglio europeo della ricerca (CER) nell'ambito del programma di ricerca e innovazione Horizon 2020 dell'Unione europea (convenzione di sovvenzione n. 818808). rhCollMA è stato generosamente fornito da CollPlant (Rehovot, Israele). Gli autori ringraziano l'Autorità di ricerca pre-clinica del Technion per l'assistenza con la cura degli animali, così come Janette Zavin, Galia Ben David e Idan Redenski.
Materiali
| Name | Company | Catalog Number | Comments |
| 1,4-Dioxane | Biosolve Chemical | 42405 | |
| 27 G x 0.5" blunt tip dispensing needles | CML supply | 901-27-050 | |
| 3cc amber syringe barrel & piston set | Nordson EFD | 7012085 | Amber syringes used to block light and prevent premature crosslinking |
| 5-0 AssuCryl PGA absorbale suture | Assut Sutures | Absorbable sutures used for skin wound closure | |
| 6-0 polypropelene sutures | Assut Sutures | 9351 | |
| Acland clamps | S&T | B-1V | |
| Adventitia scissors | S&T | SAS-15 | |
| Angled no.3 jeweler's forceps | S&T | JFAL-3-18 | |
| BioAssemblyBot 400 3D Bioprinter | Advanced Solutions | a 6-axis 3D bioprinter | |
| Bovine albumin serum Probumin | Millipore | 82-045-1 | |
| Buprenorphine | vetmarket | B15100 | |
| BVOH filament | Verbatim | 55903 | a water-soluble 1.75 mm diameter filament |
| Clamp applying forceps | S&T | CAF-4 | |
| Dental pulp stem cells | Lonza | PT-5025 | |
| Dietrich bulldog clamps | Fine Science Tools (FST) | 18039-45 | |
| di-Sodium hydrogen phosphate (Na2HPO4) | Carlo Erba Reagents | 480141 | |
| Dissection scissors | S&T | 18039-45 | |
| DMEM, High Glucose, No Phenol Red | Sartorius | 01-053-1A | |
| Duratears | Alcon | DJ03 | |
| ECM media + bullet kit | Sciencell | #1001 | |
| Ethanol 96% | Gadot-Group | 64-17-5 | |
| GlutaMAX | Gibco | 35050061 | glutamine substitute |
| Goat anti-mouse Cy3 antibody | Jackson | 115-166-072 | |
| Heparin Sodium 5,000 I.U./mL | Panpharma | - | |
| Human adipose microvascular cells | Sciencell | #7200 | |
| Human fibronectin | Sigma | F0895-5MG | A stock concentration of 1 mg/mL |
| Isoflurane, USP Terrell | Piramal Critical Care | NDC 66794-011-25 | |
| LifeSupport | Advanced Biomatrix | 5244 | a gelatin support slurry for FRESH 3D bioprinting |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889 | |
| Low-glucose DMEM | Biological Industries | 01-050-1A | |
| MICROMAN E M1000E, 100-1,000 µL | Gilson | FD10006 | |
| Mouse anti-SMA antibody | Dako | M0851 | |
| NEAA | Gibco | 11140068 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Paraformaldehyde solution 4% in PBS | ChemCruz | SC-281692 | |
| Penicillin-Streptomycin-Nystatin Solution | Biological Industries | 03-032-1B | |
| Phospate buffered saline (PBS) | Sigma | P5368-10PAK | |
| Poly(ethylene oxide), M.W. 250,000 to 400,000 | Acros Organics | 178602500 | |
| Poly(L-lactic acid), IV 5.0 dl/g (PLLA) | Polysciencse, Inc. | 18582-10 | |
| Polyimide tubing, ID: 0.0249", OD: 0.0273" | Cole-Parmer | 95820-05 | A thin-walled tube used to fabricate cuffs for microsurgical anastomoses |
| Prusa I3 MK2.5 3D Printer | Prusa Research | http://www.prusa3d.com/ | a popular commercial 3D printer |
| Resomer RG 503 H, Poly(D,L-lactide-co-glycolide) (PLGA) | Evonik Industries | 719870 | |
| rhCollMA | CollPlant | https://collplant.com/ | generously provided by CollPlant (Rehovot, Israel) |
| round-handled needle holder | S&T | B-15-8 | |
| Scalpel handle - #3 | Fine Science Tools (FST) | 10003-12 | |
| small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Sodium Chloride | Biosolve Chemical | 19030591 | |
| Sodium Phosphate dibasic (NaH2PO4) | Riedel-de Haen | 4276 | |
| Solidworks | Dassault Systems | CAD software | |
| Straight no.3 jeweler's forceps | S&T | JF-3-18 | |
| Straight serrated forceps | Fine Science Tools (FST) | 11050-10 | |
| Surgical Scalpel Blade No.15 | Swann-Morton Limited | 305 | |
| Triton-X 100 | BioLab LTD | 57836 | |
| TSIM | Advanced Solutions | 3D slicing and design software for the BioAssembly Bot | |
| Vessel dilator | S&T | D-5a.1 | |
| Zeiss Tivato 700 surgical microscope | Zeiss |
Riferimenti
- Wallace, C. G., Wei, F. -. C. C. The current status, evolution and future of facial reconstruction. Chang Gung Medical Journal. 31 (5), 441-449 (2008).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), 12 (2012).
- Duan, B. State-of-the-art review of 3D bioprinting for cardiovascular tissue engineering. Annals of Biomedical Engineering. 45 (1), 195-209 (2017).
- Kim, J. J., Hou, L., Huang, N. F. Vascularization of three-dimensional engineered tissues for regenerative medicine applications. Acta Biomaterialia. 41, 17-26 (2016).
- Ouyang, L., Armstrong, J. P. K., Chen, Q., Lin, Y., Stevens, M. M. Void-free 3D bioprinting for in situ endothelialization and microfluidic perfusion. Advanced Functional Materials. 30 (1), 1908349 (2020).
- Baltazar, T., et al. Three dimensional bioprinting of a vascularized and perfusable skin graft using human keratinocytes, fibroblasts, pericytes, and endothelial cells. Tissue Engineering - Part A. 26 (5-6), 227-238 (2020).
- Chia, H. N., Wu, B. M. Recent advances in 3D printing of biomaterials. Journal of Biological Engineering. 9 (1), 4 (2015).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Guillotin, B., et al. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials. 31 (28), 7250-7256 (2010).
- Catros, S., et al. Laser-assisted bioprinting for creating on-demand patterns of human osteoprogenitor cells and nano-hydroxyapatite. Biofabrication. 3 (2), (2011).
- Ronca, A., Ambrosio, L., Grijpma, D. W. Preparation of designed poly(d,l-lactide)/nanosized hydroxyapatite composite structures by stereolithography. Acta Biomaterialia. 9 (4), 5989-5996 (2013).
- Lan, P. X., Lee, J. W., Seol, Y. J., Cho, D. W. Development of 3D PPF/DEF scaffolds using micro-stereolithography and surface modification. Journal of Materials Science: Materials in Medicine. 20 (1), 271-279 (2009).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- Bhattacharjee, T., et al. Writing in the granular gel medium. Science Advances. 1 (8), 1500655 (2015).
- Szklanny, A. A., et al. 3D bioprinting of engineered tissue flaps with hierarchical vessel networks (VesselNet) for direct host-to-implant perfusion. Advanced Materials. 33 (42), 2102661 (2021).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. Journal of Visualized Experiments JoVE. (69), (2012).
- Sucher, R., et al. Mouse hind limb transplantation: A new composite tissue allotransplantation model using nonsuture supermicrosurgery. Transplantation. 90 (12), 1374-1380 (2010).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), (2014).
- Novosel, E. C., Kleinhans, C., Kluger, P. J. Vascularization is the key challenge in tissue engineering. Advanced Drug Delivery Reviews. 63 (4-5), 300-311 (2011).
- Landau, S., et al. Tropoelastin coated PLLA-PLGA scaffolds promote vascular network formation. Biomaterials. 122, 72-82 (2017).
- Szklanny, A. A., et al. High-throughput scaffold system for studying the effect of local geometry and topology on the development and orientation of sprouting blood vessels. Advanced Functional Materials. 1901335, 1-13 (2019).
- Song, W., et al. Engineering transferrable microvascular meshes for subcutaneous islet transplantation. Nature Communications. 10 (1), 1-12 (2019).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Ying, G. L., et al. Aqueous two-phase emulsion bioink-enabled 3D bioprinting of porous hydrogels. Advanced Materials. 30 (50), 1-9 (2018).
- Rouwkema, J., Khademhosseini, A. Vascularization and angiogenesis in tissue engineering: beyond creating static networks. Trends in Biotechnology. 34 (9), 733-745 (2016).
- Jang, J., Park, J. Y., Gao, G., Cho, D. W. Biomaterials-based 3D cell printing for next-generation therapeutics and diagnostics. Biomaterials. 156, 88-106 (2018).
- Suntornnond, R., An, J., Chua, C. K. Roles of support materials in 3D bioprinting - present and future. International Journal of Bioprinting. 3 (1), 83-86 (2017).
- Shoseyov, O., Posen, Y., Grynspan, F. Human recombinant type I collagen produced in plants. Tissue Engineering - Part A. 19 (13-14), 1527-1533 (2013).
- Stein, H., et al. Production of bioactive, post-translationally modified, heterotrimeric, human recombinant type-I collagen in transgenic tobacco. Biomacromolecules. 10 (9), 2640-2645 (2009).
- Kaplan, B., et al. Rapid prototyping fabrication of precision polyester scaffolds for axonal guidance. Biomaterials. , 120062 (2020).
- Karakurt, I., Lin, L. 3D printing technologies: techniques, materials, and post-processing. Current Opinion in Chemical Engineering. 28, 134-143 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon