A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توليد نموذج قابل للتكرار للتنشيط المناعي للأم في منتصف الحمل باستخدام Poly (I: C) لدراسة الحساسية والمرونة في النسل
In This Article
Summary
عدوى الأم هي عامل خطر لاضطرابات النمو العصبي. قد توضح نماذج الفئران للتنشيط المناعي للأم (MIA) تأثير العدوى على نمو الدماغ ووظيفته. هنا ، يتم توفير إرشادات عامة وإجراءات لإنتاج ذرية مرنة وحساسة بشكل موثوق بها معرضة ل MIA.
Abstract
يرتبط التنشيط المناعي للأم (MIA) أثناء الحمل باستمرار بزيادة خطر الإصابة باضطرابات النمو العصبي والاضطرابات العصبية والنفسية لدى النسل. تستخدم النماذج الحيوانية ل MIA لاختبار السببية ، والتحقيق في الآليات ، وتطوير التشخيص والعلاج لهذه الاضطرابات. على الرغم من استخدامها على نطاق واسع ، فإن العديد من نماذج MIA تعاني من نقص في التكاثر وتتجاهل جميعها تقريبا جانبين مهمين من عامل الخطر هذا: (i) العديد من النسل مرن ل MIA ، و (ii) يمكن أن يظهر النسل الحساس مجموعات مميزة من الأنماط الظاهرية. لزيادة قابلية التكاثر ونمذجة كل من القابلية والمرونة ل MIA ، يتم استخدام النشاط المناعي الأساسي (BIR) لإناث الفئران قبل الحمل للتنبؤ بحالات الحمل التي ستؤدي إما إلى ذرية مرنة أو ذرية ذات تشوهات سلوكية وجزيئية محددة بعد التعرض ل MIA. هنا ، يتم توفير طريقة مفصلة لتحفيز MIA عن طريق الحقن داخل الصفاق (i.p.) للحمض النووي الريبي المزدوج الذي تقطعت به السبل (dsRNA) الفيروسي المتعدد (I: C) في 12.5 يوما من الحمل. تؤدي هذه الطريقة إلى استجابة التهابية حادة في السد ، مما يؤدي إلى اضطرابات في نمو الدماغ في الفئران التي ترسم خريطة لمجالات متأثرة بالمثل في الاضطرابات النفسية والعصبية النمائية البشرية (NDDs).
Introduction
تربط الأدلة الوبائية عدوى الأمهات بزيادة خطر الإصابة بالأمراض النفسية والأمراض غير المشبعة بالأمراض ، بما في ذلك الفصام (SZ) واضطراب طيف التوحد (ASD) 1،2،3،4،5،6،7. تم تطوير نموذج الماوس MIA لاختبار السببية والدور الميكانيكي ل MIA في مسببات هذه الاضطرابات ، وكذلك لتحديد المؤشرات الحيوية الجزيئية وتطوير كل من الأدوات التشخيصية والعلاجية 4,6. على الرغم من فائدة هذا النموذج وشعبيته المتزايدة ، هناك تباين كبير في بروتوكولات تحريض MIA داخل المجال ، مما يجعل من الصعب مقارنة النتائج عبر الدراسات وتكرار النتائج 8,9. بالإضافة إلى ذلك ، فإن معظم تكرارات النموذج لا تبحث في جانبين متعديين مهمين ل MIA: (i) العديد من النسل مرن ل MIA ، و (ii) يمكن أن يظهر النسل الحساس مجموعات مميزة من الأنماط الظاهرية8.
لتوليد نموذج MIA قابل للتكرار ، يجب على الباحثين الإبلاغ عن مقياس كمي واحد على الأقل لحجم MIA المستحث في السدود. للحث على MIA أثناء الحمل ، يقوم مختبرنا بإجراء حقن داخل الصفاق (i.p.) للحمض النووي الريبي الفيروسي المزدوج الذي تقطعت به السبل الذي يحاكي polyinositic: حمض متعدد الكريات [poly (I: C)]. يحفز Poly (I: C) سلسلة مناعية مشابهة لفيروسات الأنفلونزا حيث يتم التعرف عليها بواسطة المستقبل الشبيه بالرقم 3 (TLR3) 10. نتيجة لذلك ، ينشط poly (I: C) استجابة المرحلة الحادة التي تؤدي إلى ارتفاع سريع للسيتوكينات المسببة للالتهابات8،11،12. أظهرت الدراسات السابقة أن ارتفاع السيتوكينات المسببة للالتهابات ، بما في ذلك إنترلوكين -6 (IL-6) ، ضروري لإنتاج تشوهات سلوكية وأمراض عصبية في النسل نتيجة ل MIA 11،12،13. وبالتالي ، فإن مستوى IL-6 في مصل الأم الذي تم جمعه خلال ذروته عند 2.5 ساعة بعد حقن poly (I: C) هو مقياس كمي مقنع ل MIA يمكن استخدامه لمقارنة النتائج عبر المختبرات داخل الحقل.
من أجل إنشاء نموذج MIA يعالج العناصر الأساسية للترجمة للمرونة والحساسية مع بروتوكول تحريض واحد 8,14 ، يمكن للباحثين الجمع بين مناهج الحث النموذجية مع توصيف النشاط المناعي الأساسي للسد (BIR) قبل الحمل 8. في الآونة الأخيرة ، تم اكتشاف أن الفئران الإناث البكر C57BL / 6 تظهر مجموعة واسعة من استجابات IL-6 للتعرض لجرعة منخفضة من poly (I: C) قبل الحمل8. إنها فقط مجموعة فرعية من هذه الإناث التي تستمر في إنتاج ذرية حساسة ، وفقط بمقادير معينة من التنشيط المناعي كما تمليه تركيبة BIR و poly (I: C)الجرعة 8. MIA يحفز الأنماط الظاهرية في نمط U مقلوب. يظهر النسل أكبر انحرافات سلوكية وجزيئية عندما تكون السدود مناعية معتدلة ، ويصل حجم التهاب الأم ، ولكن لا يتجاوز ، نطاقا حرجا8. هنا ، يتم توفير طريقة مفصلة لكيفية إنشاء نسل مرن وحساس بشكل موثوق مع أنماط ظاهرية سلوكية متباينة نتيجة الحقن في منتصف الحمل من poly (I: C).
Protocol
يتم تنفيذ جميع البروتوكولات بموجب موافقة لجنة رعاية واستخدام الحيوانات المؤسسية بجامعة كاليفورنيا ديفيس (IACUC).
1. إعداد الحيوان
- عند الحصول على الحيوانات ، حافظ على المعلمات التالية متسقة لضمان أقصى قدر من التكاثر.
- موقع البائع والبائع: كما ورد سابقا ، تظهر الفئران البرية من النوع C57BL / 6J استجابات مختلفة لنفس الجرعة من poly (I: C) اعتمادا على البائع8. اختر موردا وسلالة الماوس التي تظهر استجابة متسقة. بالنسبة للتجارب هنا ، أظهرت الفئران C57BL / 6 التي تم الحصول عليها من Charles River تغييرات متسقة في السلوك بعد التعرض ل MIA في منتصف الحمل ، بينما تظهر تلك التي تم شراؤها من Taconic استجابة أكبر حجما ، مع بعض الاختلافات عبر مجموعات العلاج مقارنة بفئران نهرتشارلز 8.
- السلالة: الفئران C57BL / 6J هي الأكثر استخداما ، لكن الفئران BTBR والسلالات الأخرى تظهر استجابات تفاضلية ل MIA9 في منتصف الحمل. لاحظ هذه الاستجابات التفاضلية؛ لأنها تعزز قابلية استنساخ الطريقة، ويمكن أن تكون متغيرا محتملا في المساهمة في النتائج التفاضلية في النسل.
- لضمان الحد الأدنى من التباين ، استخدم الإناث البكر فقط لدراسات MIA8 ولاحظ التفاصيل بوضوح في الأساليب.
- العمر عند الشحن وفترة التأقلم: الفئران التي يتم شحنها قبل 7 أسابيع تظهر أنظمة الغدد الصماء غير المنظمة15. اسمح للحيوانات بالتأقلم لمدة لا تقل عن 48 ساعة16,17. اطلب الفئران ليتم شحنها في 7 أسابيع (± 2 أيام) وحقن BIR في 8 أسابيع (± 2 أيام).
- العمر عند التزاوج: أجهزة المناعة لدى الحيوانات ديناميكية على مدى حياتها. احرص على تقليل التباين عن طريق الحفاظ على العمر عند التزاوج / الحقن متسقا قدر الإمكان18،19،20. زميلة الفئران الإناث في 9 أسابيع (± 2 أيام). لا تستخدم الذكور الذين تزيد أعمارهم عن 6 أشهر للتزاوج.
2. اختبار وإعداد الكثير بولي (I: C)
- تحضير بولي عالي الوزن الجزيئي (I: C) كما هو موضح أدناه.
- الأوتوكلاف 1.5 مل أنابيب الطرد المركزي الدقيقة للتخزين. يمكن تخزين poly (I: C) المعاد تعليقه عند -20 درجة مئوية ، لكن ذوبان الجليد المتكرر يمكن أن يؤثر على الفاعلية. يسخن حمام الماء إلى 70 درجة مئوية.
- باستخدام تقنية معقمة، أضف 10 مل من محلول ملحي فسيولوجي معقم (كلوريد الصوديوم 0.9٪) إلى بولي مجفف بالتجميد (I: C) باستخدام حقنة. يسخن في حمام مائي 70 درجة مئوية لمدة 15 دقيقة للسماح بالتلدين الكامل. ترفع عن النار وتترك لتبرد إلى درجة حرارة الغرفة.
- في غطاء معقم ، أضف 40 مل إضافية من المحلول الملحي الفسيولوجي إلى الزجاجة واقلبها عدة مرات للخلط. قم بإزالة الجزء العلوي من زجاجة poly (I: C) أو استخدم حقنة للقسمة في أنابيب الطرد المركزي الدقيقة سعة 1.5 مل. يحفظ في درجة حرارة -20 درجة مئوية.
- تحضير بولي الوزن الجزيئي المختلط (I: C) كما هو موضح أدناه.
- الأوتوكلاف 1.5 مل أنابيب الطرد المركزي الدقيقة للتخزين. يمكن تخزين بولي المعاد تعليقه (I: C) عند -20 درجة مئوية ولكن ذوبان الجليد المتكرر يمكن أن يؤثر على الفاعلية. اضبط حمام الماء على 50 درجة مئوية.
- باستخدام تقنية معقمة ، أضف 10 مل من كلوريد الصوديوم المعقم 0.9٪ إلى بولي مجفف بالتجميد (I: C) وثبت الغطاء. يسخن في حمام مائي على حرارة 50 درجة مئوية لمدة 25 دقيقة للسماح بالتلدين الكامل. ترفع عن النار وتترك لتبرد إلى درجة حرارة الغرفة.
- باستخدام تقنية معقمة ، قم بالقسمة في أنابيب طرد مركزي دقيقة سعة 1.5 مل وتخزينها في -20 درجة مئوية.
- تطبيق poly(I:C) من خلال الحقن داخل الصفاق (i.p.) كما هو موضح أدناه.
- وزن الماوس لتحديد الجرعات الدقيقة. باستخدام إبرة الأنسولين 0.5 سم مكعب ، قم برسم بولي المعاد تعليقه (I: C). الماوس واقلبه حتى يتعرض البطن.
- باستخدام اليد الأخرى ، أدخل الإبرة على عمق 0.5 سم تقريبا بين الحلمتين الأماميتين بزاوية حوالي 45 درجة.
- ارسم لتحديد عدم دخول الدم أو البول إلى المحقنة قبل الحقن. في حالة حدوث أي منهما ، أعد وضع الإبرة وحاول مرة أخرى. حقن ببطء. إذا خرجت فقاعات poly (I: C) ، فمن المحتمل أن يكون الحقن تحت الجلد. لن يؤدي وضع الحقن الناجح إلى عدم سحب أي شيء بمجرد إدخال الإبرة ، وعدم حدوث تسرب بمجرد إزالتها.
- اختبر قوة اللوت MMW poly (I: C) كما هو موضح أدناه8.
- الحصول على الشكل المطلوب من poly (I: C). ستسمح بعض الشركات المصنعة للباحثين بتعليق الكثير الكامل أو الجزئي بينما يتم اختبار الفاعلية بحيث يمكن الحصول على زجاجات متعددة لاحقا في وقت واحد. عادة ، يمكن تخزينها مجففة بالتجميد عند -20 درجة مئوية لعدة سنوات إذا تم تجنب تجميد الذوبان.
- الحصول على أو تربية 30 سدا حاملا للاختبار. في E12.5 ، قم بإجراء حقن i.p. من 20 و 30 و 40 مجم / كجم في 10 فئران على الأقل لكل جرعة.
- في 2.5 ساعة بعد الحقن ، جمع الدم عن طريق نزيف الذيل. لاحظ أن الدم المحيطي ودم الجذع يمكن أن يختلفا في مستويات السيتوكينات ، لذا حافظ على اتساق طريقة الجمع في الدراسة.
- اترك الدم يتجلط طوال الليل في درجة حرارة الغرفة. بعد 12-24 ساعة ، قم بتدوير عينات الدم عند 3768 × جم عند 4 درجات مئوية لمدة 8 دقائق. اجمع السيروم واحفظه في درجة حرارة -80 درجة مئوية حتى يتم تحليله.
- عزل المصل وقياس مستويات IL-6 عبر ELISA أو Luminex. حافظ على اتساق أدوات القياس نظرا لوجود تباين كبير في التركيز الكلي المقاس بطرائق ومصنعين مختلفين. تحديد حجم استجابة IL-6 اللازمة للحث على الأنماط الظاهرية باستخدام مجموعة تجريبية.
3. اختبار النشاط المناعي الأساسي (BIR)
ملاحظة: يوضح الشكل 1 الرسم التخطيطي للخطوات. استخدم بولي وزن جزيئي مختلف (I: C) لاختبار BIR مقارنة بالحمل لتقليل احتمالية الاستجابات المناعية التكيفية للمركب.
- اطلب شحن إناث الفئران البكر في عمر 7 أسابيع. عند الوصول ، قم بتجميع وإيواء أربعة إلى خمسة فئران في قفص والحفاظ على المجموعة حتى التزاوج. استخدم شق الأذن أو أي نظام تعريف آخر.
- حقن الإناث داخل الصفاق مع 5 ملغ/كغ من بولي (I:C) بعد 1 أسبوع من الوصول. في 2.5 ساعة بعد الحقن ، عندما يكون تعميم IL-6 هو أعلى6 ، اجمع الدم الكامل من الحيوانات المحقونة عن طريق قص الذيل.
- اترك الدم يتجلط طوال الليل في درجة حرارة الغرفة. بعد 12-24 ساعة ، قم بتدوير عينات الدم عند 3768 × جم عند 4 درجات مئوية لمدة 8 دقائق.
- اجمع ما لا يقل عن 32 ميكرولتر من المصل من كل عينة. تجمد عند -80 درجة مئوية حتى تصبح جاهزة لاختبار السيتوكينات. لقياس مستويات IL-6 بشكل أكثر اتساقا ، استخدم مقايسة متعددة الإرسال مثل Luminex. حافظ على اتساق أدوات القياس نظرا لوجود تباين كبير في التركيز الكلي المقاس بطرائق ومصنعين مختلفين.
- للحصول على بروتوكول فحص Luminex ، راجع Bruce et al.21.
- باستخدام مستويات IL-6 النسبية ، قسم الحيوانات إلى مجموعات BIR منخفضة (الربع السفلي) ومتوسطة (الربعين الأوسطين) وعالية (الربع الأعلى).
4. طريقة نزيف الذيل لجمع الدم
ملاحظة: لتجنب استخدام المهدئات التي يحتمل أن تكون مناعية ، استخدم طريقة نزيف الذيل لجمع الدم.
- للإعداد ، ضع حامل لحام وكوب ضبط النفس على سطح على جانب اليد غير المهيمنة. في طبق بتري 35 مم ، أضف 1-2 مل من زيت الطعام الصالح للأكل. قم بإزالة الغطاء من سدادة الدم السريعة وضعها بالقرب من الإعداد.
- ضع بضع طبقات من المنشفة الورقية على حامل اللحام والأنبوب الشعري الأول في مشبك ، وضعه بالقرب من المكان الذي سيتم فيه تثبيت طرف ذيل الماوس وإبقائه موازيا لسطح الطاولة. احصل على شفرة حلاقة في متناول يدك.
- لجمع الدم ، قم بتنفيذ الخطوات التالية.
- في الوقت المطلوب ، أخرج الماوس من القفص وضعه تحت الكأس مع خروج ذيله من الشق في القاعدة. باستخدام شفرة حلاقة جديدة ، قم بقص نهاية الذيل (1-2 مم) واجمع أول قطرة دم في الأنبوب الشعري المثبت بحامل اللحام.
- اغمس أصابع اليد المهيمنة في زيت الطعام واستخدمها للضغط من قاعدة الذيل إلى الطرف ، وتوجيه طرف الذيل إلى الأنبوب الشعري لجمع قطرات الدم الناتجة. استمر حتى ~ 200 ميكرولتر من الدم.
- ضع غطاء نهاية صغير على الطرف المدبب للأنبوب الشعري قبل الغطاء العلوي. إذا تم وضع الغطاء العلوي أولا ، طرد العينة من الطرف المدبب للأنبوب. ضع الأنبوب في الغلاف الخارجي الواقي.
- السماح للتجلط بين عشية وضحاها في درجة حرارة الغرفة. قم بتبريد جهاز طرد مركزي دقيق إلى 4 درجات مئوية وقم بتدوير الدم كما هو مذكور في الخطوة 3.3.

الشكل 1. الجدول الزمني لاختبار النشاط المناعي الأساسي للإناث البكر والتزاوج. اطلب من الفئران الوصول إلى عمر 7 أسابيع والسماح للتأقلم مع المنشأة لمدة 1 أسبوع. حقن الحيوانات مع 5 ملغ / كغ من بولي (I: C) و 2.5 ساعة في وقت لاحق سحب الدم. اترك الدم يتجلط طوال الليل ، ثم استخدم جهاز الطرد المركزي عند 3768 × جم ، 4 درجات مئوية لمدة 8 دقائق. جمع المصل وتقييم مستويات IL-6 النسبية عبر ELISA أو Multiplex. في عمر 9 أسابيع ، قم بإعداد أزواج التزاوج. تم الإنشاء باستخدام BioRender.com الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
5. طريقة الوزن على أساس التزاوج وحقن الحمل E12.5
ملاحظة: يوضح الشكل 2 الرسم التخطيطي للخطوات. يمكن استخدام طريقتين لإعداد أزواج التزاوج وتحديد النقطة الزمنية E12.5. الأول ، التزاوج الموقوت ، موصوف في مكان آخر22. يمكن أيضا استخدام الحسابات القائمة على الوزن لتقييم الحمل E12.523. تتمثل فائدة هذا النهج في أنه يسمح بقفل عمر السد عند التزاوج ، مما يقلل من التباين في الاستجابة المناعية. يستخدم هذا الإجراء هنا.
- ضع الذكور في أقفاص نظيفة واسمح لهم بالتأقلم لمدة لا تقل عن 2 ساعة. هذا يقلل من احتمال عدوان الإناث لأن الذكور سيشكلون بالفعل رائحة مهيمنة في القفص.
- قم بإعداد أزواج تربية من الذكور والإناث العازبة عن طريق إضافة الأنثى إلى قفص الذكر. قبل وضعها في القفص ، قم بوزنها وسجل الوزن. أضف حفنة صغيرة من بذور عباد الشمس إلى كل قفص لزيادة كفاءة التزاوج.
- لتحديد نطاق زيادة الوزن ، قم بتنفيذ الخطوات التالية.
- الحصول على مجموعة اختبار من الإناث وإعداد أزواج التزاوج ، وتسجيل الوزن في وقت التزاوج.
- عندما تبدأ الإناث في الظهور بمظهر الحمل بشكل واضح ، قم بوزنها وتقسيمها إلى مجموعات فرعية من 8.5 جم و 9.5 جم و 10.5 جم و 11.5 جم من الوزن المكتسب. بدأت الأجنة في E12.5 للتو في تطوير أرقام مميزة في أقدامها. استخدم مورفولوجيا الجنين لتحديد متوسط زيادة الوزن للوصول إلى E12.5.
- في 12 يوما بعد التزاوج ، تزن الإناث وتحدد زيادة الوزن. في منشأة الاختبار ، تكتسب الإناث باستمرار 9.5-10.5 جم من وقت التزاوج إلى E12.5. حقن عن طريق i.p. جرعة بولي (I: C) الذوبانية المحددة في الخطوة 2.3.2 عندما تقع زيادة وزن الأنثى ضمن النطاق المحدد مسبقا.
- راقب الاستجابة لمتحف الفن الإسلامي في السدود باستخدام المعلمات التالية.
- السلوك المرضي: اجمع الدرجات الذاتية على مقياس من 1-3 لكيفية نشاط السدود استجابة للتعامل معها ، حيث 1 هي حركة قليلة أو معدومة استجابة للتعامل معها و 3 هي استجابة طبيعية للقبض وضبط النفس. ستظهر الحيوانات ذات الاستجابات المناعية الأكبر مقاومة أقل للتعامل مع8.
- استجابة الحمى: باستخدام مقياس حرارة الأشعة تحت الحمراء ، اجمع درجات حرارة ما قبل الحقن و 2.5 ساعة بعد الحقن. غالبا ما تظهر الحيوانات ذات الاستجابات المناعية الأكبر حجما انخفاض حرارة الجسم استجابة لنشاط مناعي أكبر8.
- تغيير الوزن: وزن الحيوانات بعد 24 ساعة من الحقن. الحيوانات ذات الاستجابات المناعية الأكبر حجما تفقد عموما المزيد من الوزن8.
- قياس مستويات الحمل IL-6 على النحو التالي8.
- في 2.5 ساعة بعد الحقن ، وجمع الدم بالطريقة المفضلة. اترك الدم يتجلط طوال الليل في درجة حرارة الغرفة. بعد 12-24 ساعة ، قم بتدوير عينات الدم عند 3768 × جم عند 4 درجات مئوية لمدة 8 دقائق.
- اجمع السيروم واحفظه في درجة حرارة -80 درجة مئوية حتى يتم تحليله. عزل المصل وقياس مستويات IL-6 عبر ELISA أو Luminex. حافظ على اتساق أدوات القياس نظرا لوجود تباين كبير في التركيز الكلي المقاس بطرائق ومصنعين مختلفين.
- قم بإيواء السد منفردا بعد الحقن مع التخصيب المناسب مثل التعشيش وأجهزة التخصيب. حافظ على اتساق جميع عمليات التخصيب لأن التعديلات في التخصيب يمكن أن يكون لها تأثيرات كبيرة على سلوك القوارض24،25،26،27،28،29.
- يتراوح وقت الحمل للفئران C57 من 18.5-20.5 يوما. قم بإجراء فحوصات القمامة لتحديد ما إذا كانت الحيوانات قد ولدت ضمن هذا النطاق لضمان إجراء الحقن في الوقت الصحيح. عند التحقق من وجود فضلات ، قم بإزعاج القفص بأقل قدر ممكن. الإجهاد مباشرة بعد ولادة القمامة يمكن أن يزيد من خطر أكل لحوم البشر.
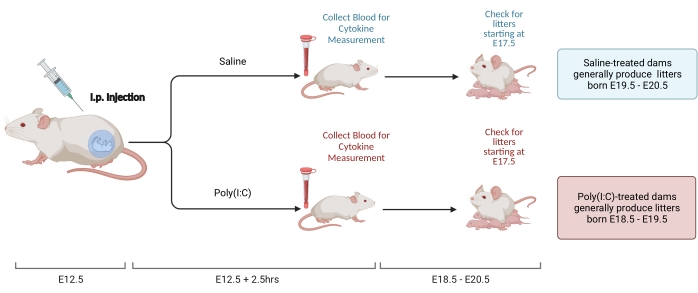
الشكل 2. تحريض متحف الفن الإسلامي. يتطلب تحريض MIA تقييم الحمل ، وحقن بولي (I: C) ، وفحوصات القمامة لضمان التوقيت الصحيح لالتهاب الأم. بعد تقييم يوم الحمل إما عن طريق التزاوج الموقوت أو طريقة زيادة الوزن ، قم بتوصيل حقنة i.p. من poly (I: C) عند E12.5. جمع عينة دم في 2.5 ساعة بعد الحقن لتأكيد التنشيط المناعي وتحديد مستوى تنشيط IL-6. سيولد الفضلات في حوالي E18.5-E20.5. تم الإنشاء باستخدام BioRender.com الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
6. التحقيق في التغيرات في السلوك في MIA البالغين والسيطرة على النسل (اختياري)
- بدءا من P60 وقبل إجراء الاختبارات السلوكية ، تأقلم الحيوانات مع الاتصال البشري بمعالجة لطيفة لمدة 1 دقيقة يوميا لمدة 3 أيام متتالية. تأكد من عدم حدوث أيام تغيير القفص في نفس اليوم الذي يتم فيه إجراء الاختبارات السلوكية.
- اسمح دائما للفئران بالتأقلم مع غرفة الاختبار لمدة 30-60 دقيقة قبل بدء الاختبارات السلوكية. استخدم غرف ذات إضاءة خافتة (15-20 لوكس) لتقليل القلق.
- للعناية المتكررة ، ضع الفئران بمفردها في أقفاص نظيفة وخالية من الفراش مع أغطية. باستخدام الكاميرا ، سجل الفئران في هذه الأقفاص لمدة 20 دقيقة. أول 10 دقائق تعمل كفترة تأقلم ، والأخيرة 10 دقائق هي فترة الاختبار.
- باستخدام مقاطع الفيديو المحفوظة وساعة توقيت ، سجل وقت الاستمالة التراكمي لكل ماوس خلال فترة الاختبار البالغة 10 دقائق. تشمل السلوكيات الأخرى التي يمكن تسجيلها من مقاطع الفيديو هذه التربية (الوقوف على رجليها الخلفيتين) والتجميد والقفز8.
- استخدم اختبارات شائعة أخرى لنموذج MIA مثل تثبيط النبضات (PPI) 14،30،31،32 ، المجال المفتوح 12،33،34 ، النهج الاجتماعي المكون من 3 غرف13،35،36 ، التعرف على الأشياء الجديدة 37 ، y-maze 30 ، مرتفع بالإضافة إلى متاهة33 ، وتكييف الخوف من السياق / الإشارة 38.
- النشاف المناعي بعد الولادة8 (اختياري)
- في P0 ، قم بقطع الرأس بسرعة وتشريح أنسجة المخ الجنينية في HBSS ، وقم بتجميدها في النيتروجين السائل ، وتخزينها عند -80 درجة مئوية.
- قم بتعطيل العينات باستخدام صوتنة مسبار بسعة 20٪ لمدة 5 ثوان في 2x Laemmli buffer ، ثم تشوه عند 85 درجة مئوية لمدة 5 دقائق. تحلل أجهزة الطرد المركزي عند 16000 × جم لمدة 10 دقائق في درجة حرارة الغرفة. اجمع المادة الطافية واحفظها في درجة حرارة -80 درجة مئوية.
- قم بقياس محتوى البروتين الكلي باستخدام مجموعة مقايسة بروتين BCA التجارية ، باتباع تعليمات الشركة المصنعة ، واستخدم ألبومين مصل الأبقار كمعيار للمعايرة.
- أضف ثنائي ثيوثريتول كعامل اختزال للعينات كتركيز نهائي قدره 100 mM. يسخن إلى 85 درجة مئوية لمدة 2 دقيقة قبل التحميل على هلام.
- قم بتشغيل 5 ميكروغرام / حارة من البروتين في ظل ظروف الاختزال على 7.5٪ من المواد الهلامية TGS وانقلها كهربائيا إلى أغشية PVDF. كتلة الأغشية مع حجب العازلة واحتضان مع الأجسام المضادة المختارة.
- اغسل ثلاث مرات باستخدام TBS + 0.05٪ Tween 20 واحتضان الأغشية لمدة 45 دقيقة بأجسام مضادة ثانوية موسومة بالفلورسنت.
- اغسل أربع مرات إضافية في TBS / Tween 20 ونتائج الصورة. توحيد النتائج باستخدام β-توبولين ، المكتشفة باستخدام مضاد β توبولين.
النتائج
ليست كل الحيوانات المعرضة ل 30 ملغم / كغم من بولي (I: C) في E12.5 تنتج ذرية مع تشوهات سلوكية متسقة8،31. على الرغم من أن كلا من 30 مجم / كجم و 40 مجم / كجم من poly (I: C) ينتجان بشكل موثوق سلوكيات مرضية في السدود ، بما في ذلك انخفاض مستويات النشاط ، والاستجابات المنخفضة الحرارة ?...
Discussion
تغير عدوى الأم مسار نمو الدماغ لدى البشر وفي كل من القوارض والرئيسيات غير البشرية4،5،7. هنا ، تم تحديد إجراء لحث MIA في الفئران في نقطة زمنية في منتصف الحمل باستخدام poly (I: C). تتضمن هذه الطريقة تقييم BIR قبل الحمل ، مما يزيد من قابلية التكاثر ويو?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
نشكر الدكتورة ميكا إستس على مثابرتها في معالجة التباين في نموذج MIA للفأر وجميع المساهمين في Estes et al.8 على عملهم الذي أدى إلى تطوير بروتوكول الأساليب الموصوف هنا. تم دعم البحث المذكور هنا من قبل NIMH 2P50 MH106438-06 (AKM) و NIMH T32MH112507 (K.P.).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
References
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3 (2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200 (2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997 (2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859 (2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37 (2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved