É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Gerando um Modelo Reprodutível de Ativação Imune Materna de Gestações Médias usando Poly(I:C) para Estudo de Suscetibilidade e Resiliência em Descendentes
Neste Artigo
Resumo
A infecção materna é um fator de risco para distúrbios do neurodesenvolvimento. Modelos de camundongos de ativação imune materna (MIA) podem elucidar o impacto da infecção no desenvolvimento e função cerebral. Aqui, diretrizes gerais e um procedimento são fornecidos para produzir descendentes confiáveis e suscetíveis expostos ao MIA.
Resumo
A ativação imune materna (MIA) durante a gravidez está consistentemente ligada ao aumento do risco de distúrbios neurodesenvolvimentais e neuropsiquiátricos na prole. Modelos animais de MIA são usados para testar a causalidade, investigar mecanismos e desenvolver diagnósticos e tratamentos para esses distúrbios. Apesar de seu uso generalizado, muitos modelos de MIA sofrem de falta de reprodutibilidade e quase todos ignoram dois aspectos importantes desse fator de risco: (i) muitos descendentes são resilientes ao MIA e (ii) descendentes suscetíveis podem exibir combinações distintas de fenótipos. Para aumentar a reprodutibilidade e modelar a suscetibilidade e a resiliência à AIM, a imunorreatividade basal (BIR) de camundongos fêmeas antes da gravidez é usada para prever quais gestações resultarão em descendentes resilientes ou descendentes com anormalidades comportamentais e moleculares definidas após a exposição à MIA. Aqui, um método detalhado de indução de MIA via injeção intraperitoneal (i.p.) do RNA de fita dupla (dsRNA) viral mimético poli(I:C) aos 12,5 dias de gestação é fornecido. Este método induz uma resposta inflamatória aguda na barragem, o que resulta em perturbações no desenvolvimento do cérebro em camundongos que mapeiam domínios de impacto semelhante em transtornos psiquiátricos e do neurodesenvolvimento (NDDs) humanos.
Introdução
Evidências epidemiológicas ligam a infecção materna ao aumento do risco de doenças psiquiátricas e DDNs, incluindo esquizofrenia (SZ) e transtorno do espectro autista (TEA)1,2,3,4,5,6,7. O modelo de camundongos com AIM foi desenvolvido para testar a causalidade e o papel mecanicista da AIM na etiologia desses distúrbios, bem como para identificar biomarcadores moleculares e desenvolver ferramentas diagnósticas e terapêuticas 4,6. Apesar da utilidade desse modelo e de sua crescente popularidade, há uma variabilidade considerável nos protocolos de indução de AIM dentro do campo, dificultando a comparação dos resultados entre os estudos e a replicação dos achados 8,9. Além disso, a maioria das iterações do modelo não investiga dois importantes aspectos translacionais da AIM: (i) muitos descendentes são resilientes ao MIA e (ii) descendentes suscetíveis podem exibir combinações distintas de fenótipos8.
Para gerar um modelo de MIA reprodutível, os pesquisadores devem relatar pelo menos uma medida quantitativa da magnitude da MIA induzida em barragens. Para induzir a AIM durante a gestação, nosso laboratório realiza injeções intraperitoneais (i.p.) do RNA de fita dupla viral mimetizado poliinosítico: ácido policitidílico [poli(I:C)]. Poly(I:C) induz uma cascata imune semelhante aos vírus influenza, pois é reconhecida pelo receptor toll-like 3 (TLR3)10. Como resultado, a poli(I:C) ativa a resposta de fase aguda que resulta em rápida elevação das citocinas pró-inflamatórias 8,11,12. Estudos prévios demonstraram que a elevação de citocinas pró-inflamatórias, incluindo a interleucina-6 (IL-6), é necessária para produzir anormalidades comportamentais e neuropatologia na prole como resultado da AIM11,12,13. Assim, o nível de IL-6 no soro materno coletado durante seu pico em 2,5 h após a injeção de poli(I:C) é uma medida quantitativa convincente de MIA que pode ser usada para comparar resultados entre laboratórios dentro do campo.
A fim de gerar um modelo de MIA que aborde os elementos translacionalmente essenciais de resiliência e suscetibilidade com um único protocolo de indução 8,14, os pesquisadores podem combinar abordagens típicas de indução com a caracterização da imunorreatividade basal da barragem (BIR) antes da gravidez8. Recentemente, descobriu-se que camundongos C57BL/6 fêmeas virgens mostram uma ampla gama de respostas de IL-6 a uma exposição de baixa dose a poli(I:C) antes da gravidez8. É apenas um subconjunto dessas fêmeas que passam a produzir descendentes suscetíveis, e apenas em certas magnitudes de ativação imunológica, conforme ditado pela combinação de BIR e dose poli(I:C)8. A MIA induz fenótipos em um padrão U invertido; os descendentes apresentam as maiores aberrações comportamentais e moleculares quando as mães são moderadamente imunorreativas, e a magnitude da inflamação materna atinge, mas não excede, uma faixa crítica8. Aqui, um método detalhado de como criar de forma confiável descendentes resilientes e suscetíveis com fenótipos comportamentais divergentes como resultado da injeção gestacional média de poli(I:C) é fornecido.
Protocolo
Todos os protocolos são realizados sob a aprovação do Comitê Institucional de Cuidados e Uso de Animais da Universidade da Califórnia-Davis (IACUC).
1. Preparação animal
- Ao adquirir animais, mantenha os seguintes parâmetros consistentes para garantir a máxima reprodutibilidade.
- Local do fornecedor e do fornecedor: como relatado anteriormente, os camundongos do tipo selvagem C57BL/6J exibem respostas diferentes à mesma dose de poli(I:C), dependendo do fornecedor8. Escolha um fornecedor e uma cepa de mouse que mostrem uma resposta consistente. Para os experimentos aqui, camundongos C57BL/6 obtidos de Charles River exibiram mudanças consistentes no comportamento após a exposição à MIA gestacional média, enquanto aqueles comprados da Taconic mostram uma resposta de maior magnitude, com algumas diferenças entre os grupos de tratamento em comparação com os camundongos Charles River8.
- Tensão: Os camundongos C57BL/6J são os mais utilizados, mas os camundongos BTBR e outras cepas apresentam respostas diferenciais à AIM 9 da gestaçãomédia. Observe essas respostas diferenciais, pois elas aumentam a reprodutibilidade do método e podem ser uma variável potencial em contribuir para resultados diferenciais na prole.
- Para garantir uma variabilidade mínima, use apenas fêmeas virgens para estudos de MIA8 e observe claramente os detalhes nos métodos.
- Idade no momento do envio e período de aclimatação: camundongos enviados antes de 7 semanas apresentam sistemas endócrinos desregulados15. Permitir que os animais se aclimatem por um período mínimo de 48 h16,17. Encomende ratos para serem enviados a 7 semanas (± 2 dias) e injete BIR a 8 semanas (± 2 dias).
- Idade no acasalamento: o sistema imunológico dos animais é dinâmico ao longo de sua vida útil. Tome cuidado para minimizar a variabilidade, mantendo a idade no acasalamento/injeção o mais consistente possível18,19,20. Acasalar camundongos fêmeas às 9 semanas (± 2 dias). Não use machos com mais de 6 meses de idade para acasalamento.
2. Teste e preparação do lote Poly (I:C)
- Prepare poli(I:C) de alto peso molecular conforme descrito abaixo.
- Autoclave 1,5 mL de tubos de microcentrífuga para armazenamento. O poli(I:C) ressuspenso pode ser armazenado a -20 °C, mas descongelamentos repetidos podem afetar a potência. Aqueça o banho-maria a 70 °C.
- Usando a técnica estéril, adicione 10 mL de solução salina fisiológica estéril (NaCl 0,9%) ao poli(I:C) liofilizado usando uma seringa. Aqueça em banho-maria a 70 °C durante 15 minutos para permitir o recozimento completo. Retire e deixe arrefecer até à temperatura ambiente.
- Em um exaustor estéril, adicione mais 40 mL de solução salina fisiológica ao frasco e inverta várias vezes para misturar. Remova a parte superior do frasco de poli(I:C) ou use uma seringa para alíquota em tubos de microcentrífuga de 1,5 mL. Conservar a -20 °C.
- Preparar poli(I:C) de peso molecular misto conforme descrito abaixo.
- Autoclave 1,5 mL de tubos de microcentrífuga para armazenamento. A poli(I:C) ressuspensa pode ser armazenada a -20 °C, mas descongelamentos de congelamento repetidos podem afetar a potência. Ajuste o banho-maria para 50 °C.
- Usando a técnica estéril, adicione 10 mL de NaCl estéril a 0,9% ao poli(I:C) liofilizado e prenda a tampa. Aqueça em banho-maria a 50 °C durante 25 minutos para permitir o recozimento completo. Retire e deixe arrefecer até à temperatura ambiente.
- Usando a técnica estéril, alíquota em tubos de microcentrífuga de 1,5 mL e armazenar a -20 °C.
- Administrar poli(I:C) através de injeções intraperitoneais (i.p.) conforme descrito abaixo.
- Pese o rato para determinar a dosagem precisa. Utilizando uma agulha de insulina de 0,5 cc, elabore poli(I:C) ressuspenso.
- Usando a outra mão, insira a agulha a uma profundidade de aproximadamente 0,5 cm entre os dois mamilos anteriores em um ângulo de cerca de 45°.
- Desenhe para determinar se não há sangue ou urina na seringa antes de injetar. Se ocorrer uma das duas situações, reposicione a agulha e tente novamente. Injete lentamente. Se o poli(I:C) borbulhar, a injeção provavelmente foi subcutânea. Uma colocação de injeção bem-sucedida resultará em nada sendo elaborado uma vez que a agulha é inserida, e nenhum vazamento uma vez que é removido.
- Testar a potência do lote poli(I:C) MMW conforme descrito abaixo8.
- Alguns fabricantes permitirão que os pesquisadores coloquem uma retenção em um lote total ou parcial enquanto a potência é testada para que várias garrafas possam ser obtidas mais tarde simultaneamente. Normalmente, estes podem ser armazenados liofilizados a -20 °C durante vários anos se o congelamento-descongelamento for evitado.
- Obter ou criar 30 barragens grávidas para teste. Em E12.5, realize injeções i.p. de 20, 30 e 40 mg/kg em um mínimo de 10 camundongos por dose.
- Às 2,5 h após a injeção, colete sangue através do sangramento da cauda. Observe que o sangue periférico e o sangue do tronco podem diferir nos níveis de citocinas, portanto, mantenha o método de coleta consistente dentro de um estudo.
- Permita que o sangue coagule durante a noite à temperatura ambiente. Após 12-24 h, girar as amostras de sangue a 3.768 x g a 4 °C durante 8 min. Recolher o soro e conservar a -80 °C até analisar.
- Isole o soro e meça os níveis de IL-6 via ELISA ou Luminex. Mantenha as ferramentas de medição consistentes, pois há uma variabilidade significativa na concentração total medida com diferentes modalidades e fabricantes. Determinar a magnitude da resposta à IL-6 necessária para induzir fenótipos utilizando uma coorte piloto.
3. Teste de imunorreatividade basal (BIR)
Observação : a Figura 1 mostra o esquema das etapas. Use um poli(I:C) de peso molecular diferente para o teste BIR em comparação com o gestacional para diminuir a probabilidade de respostas imunes adaptativas ao composto.
- Encomende ratos fêmeas virgens para serem enviados com 7 semanas de idade. Na chegada, agrupe e abrigue de quatro a cinco ratos em uma gaiola e mantenha o grupo alojado até o acasalamento. Use entalhe auricular ou qualquer outro sistema de identificação.
- Injete fêmeas por via intraperitoneal com 5 mg/kg de poli(I:C) 1 semana após a chegada. Às 2,5 h após a injeção, quando a IL-6 circulante for mais alta6, colete sangue total de animais injetados através de um corte de cauda.
- Permita que o sangue coagule durante a noite à temperatura ambiente. Após 12-24 h, girar as amostras de sangue a 3.768 x g a 4 °C durante 8 min.
- Recolher um mínimo de 32 μL de soro de cada amostra. Congelar a -80 °C até estar pronto para testar citocinas. Para medir os níveis de IL-6 de forma mais consistente, utilize um ensaio multiplex, como o Luminex. Mantenha as ferramentas de medição consistentes, pois há uma variabilidade significativa na concentração total medida com diferentes modalidades e fabricantes.
- Para o protocolo de ensaio de Luminex, consulte Bruce et al.21.
- Usando níveis relativos de IL-6, divida os animais em grupos BIR baixo (quartil inferior), médio (dois quartis médios) e alto (quartil mais alto).
4. Método de sangramento da cauda para coleta de sangue
NOTA: Para evitar o uso de sedativos potencialmente imunomoduladores, use o método de sangramento da cauda da coleta de sangue.
- Para configurar, coloque um suporte de solda e um copo de contenção em uma superfície do lado da mão não dominante. Em uma placa de Petri de 35 mm, adicione 1-2 mL de óleo comestível de grau alimentício. Retire a tampa da rolha de sangue rápida e coloque perto da configuração.
- Coloque algumas camadas de papel toalha no suporte de solda e o primeiro tubo capilar em um clipe, posicionando-o perto de onde a ponta da cauda do mouse será mantida e mantida paralela à superfície da mesa. Tenha uma lâmina de barbear à mão.
- Para coletar o sangue, execute as seguintes etapas.
- No momento necessário, retire o mouse da gaiola e coloque sob o copo com a cauda saindo do entalhe na base. Usando uma lâmina de barbear fresca, prenda a extremidade (1-2 mm) da cauda e colete a primeira gota de sangue no tubo capilar preso ao suporte de solda.
- Mergulhe os dedos da mão dominante no óleo comestível e use para espremer da base da cauda até a ponta, guiando a ponta da cauda para o tubo capilar para coletar gotas resultantes de sangue. Continue até que ~200 μL de sangue tenham sido coletados.
- Coloque uma pequena tampa final na extremidade cônica do tubo capilar antes da tampa superior. Se a tampa superior for colocada primeiro, a amostra será expelida da extremidade cônica do tubo. Coloque o tubo no invólucro externo protetor.
- Deixe coagular durante a noite à temperatura ambiente. Arrefecer uma microcentrífuga a 4 °C e girar o sangue para baixo, tal como indicado no passo 3.3.

Figura 1. A linha do tempo para testar a imunorreatividade basal e o acasalamento de fêmeas virgens. Encomende ratos para chegar a 7 semanas de idade e permitir que se acostumem à instalação por 1 semana. Injetar animais com 5 mg/kg de poli(I:C) e 2,5 h depois extrair sangue. Deixe o sangue coagular durante a noite e, em seguida, centrifugar a 3.768 x g, 4 °C durante 8 min. Coletar soro e avaliar os níveis relativos de IL-6 via ELISA ou Multiplex. Com 9 semanas de idade, configure pares de acasalamento. Criado usando BioRender.com Clique aqui para ver uma versão maior desta figura.
5. Método baseado no peso para acasalamento e injeção gestacional de E12.5
Observação : a Figura 2 mostra o esquema das etapas. Dois métodos podem ser usados para configurar pares de acasalamento e determinar o ponto de tempo E12.5. O primeiro, o acasalamento cronometrado, é descrito em outro lugar22. Cálculos baseados no peso também podem ser usados para avaliar uma gravidez E12.523. O benefício dessa abordagem é que ela permite o bloqueio temporal da idade da barragem no acasalamento, diminuindo a variabilidade na resposta imune. Este procedimento é usado aqui.
- Coloque os machos em gaiolas limpas e deixe-os se aclimatar por um mínimo de 2 h. Isso diminui a probabilidade de agressão feminina, pois os machos já formarão um cheiro dominante na gaiola.
- Configure pares reprodutores machos únicos e fêmeas únicas, adicionando a fêmea à gaiola do macho. Antes de colocá-la na gaiola, pese-a e registre o peso. Adicione um pequeno punhado de sementes de girassol a cada gaiola para aumentar a eficiência do acasalamento.
- Para determinar a faixa de ganho de peso, execute as etapas a seguir.
- Obter um grupo de teste de fêmeas e configurar pares de acasalamento, registrando o peso no momento do acasalamento.
- Quando as fêmeas começarem a aparecer visivelmente grávidas, pese-as e divida em subconjuntos de 8,5 g, 9,5 g, 10,5 g e 11,5 g de peso ganho. Os fetos em E12.5 apenas começaram a desenvolver dígitos distintos em suas patas. Use a morfologia fetal para determinar o ganho de peso médio para atingir E12,5.
- Aos 12 dias após o acasalamento, pesar as fêmeas e determinar o ganho de peso. Em uma instalação de teste, as fêmeas ganham consistentemente 9,5-10,5 g do momento do acasalamento para E12,5. Injectar via i.p. a dose de poli(I:C) solubilizada determinada na etapa 2.3.2 quando o ganho de peso da fêmea se situar dentro do intervalo predeterminado.
- Observe a resposta ao MIA em barragens usando os seguintes parâmetros.
- Comportamento de doença: Coletar pontuações subjetivas em uma escala de 1-3 para como as barragens ativas se tornam em resposta a serem manuseadas, onde 1 é pouco ou nenhum movimento em resposta a ser manuseado e 3 é uma resposta normal à captura e contenção. Animais com maiores respostas imunes apresentarão menor resistência ao manejo8.
- Resposta febril: Usando um termômetro IR, colete as temperaturas pré-injeção e 2,5 h pós-injeção. Animais com respostas imunes de maior magnitude frequentemente apresentam hipotermia em resposta a maior atividade imune8.
- Mudança de peso: Pesar os animais 24 h após a injeção. Animais com respostas imunes de maior magnitude geralmente perdem mais peso8.
- Meça os níveis gestacionais de IL-6 da seguinte forma8.
- Às 2,5 h após a injeção, recolher sangue com o método preferido. Permita que o sangue coagule durante a noite à temperatura ambiente. Após 12-24 h, girar as amostras de sangue a 3.768 x g a 4 °C durante 8 min.
- Recolher o soro e conservar a -80 °C até analisar. Isole o soro e meça os níveis de IL-6 via ELISA ou Luminex. Mantenha as ferramentas de medição consistentes, pois há uma variabilidade significativa na concentração total medida com diferentes modalidades e fabricantes.
- Embale individualmente a barragem após a injeção com enriquecimento apropriado, como ninhos e dispositivos de enriquecimento. Manter todo o enriquecimento consistente, pois alterações no enriquecimento podem ter impactos significativos no comportamento dos roedores 24,25,26,27,28,29.
- O tempo de gestação para camundongos C57 varia de 18,5 a 20,5 dias. Realize verificações de cama para determinar se os animais nasceram dentro desse intervalo para garantir que a injeção foi realizada no ponto de tempo correto. Ao verificar se há ninhadas, perturbe a gaiola o mínimo possível. O estresse imediatamente após o nascimento da ninhada pode aumentar o risco de canibalização.
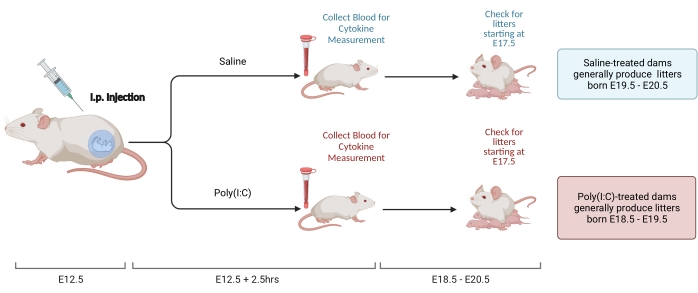
Figura 2. Indução de MIA. A indução da MIA requer avaliação da gravidez, injeção i.p. de poli(I:C) e verificações de ninhada para garantir o momento correto da inflamação materna. Depois de avaliar o dia gestacional, seja através do acasalamento cronometrado ou do método de ganho de peso, administrar uma injeção i.p. de poli(I:C) em E12.5. Recolha uma amostra de sangue às 2,5 h após a injeção para confirmar a ativação imunitária e determinar o nível de ativação da IL-6. As ninhadas nascerão aproximadamente em E18.5-E20.5. Criado usando BioRender.com Clique aqui para ver uma versão maior desta figura.
6. Investigação de alterações de comportamento em MIA adulta e prole controle (opcional)
- A partir do P60 e antes de realizar testes comportamentais, aclimate os animais ao contato humano com manuseio suave por 1 min por dia durante 3 dias consecutivos. Certifique-se de que os dias de mudança de gaiola não ocorram no mesmo dia em que os testes comportamentais são realizados.
- Sempre permita que os ratos se acostumem à sala de testes por 30-60 minutos antes de iniciar os testes comportamentais. Use quartos mal iluminados (15-20 lux) para minimizar a ansiedade.
- Para uma limpeza repetitiva, coloque os ratos sozinhos em gaiolas limpas e sem roupa de cama com tampas. Usando uma câmera, registre os ratos nessas gaiolas por 20 minutos. Os primeiros 10 minutos funcionam como um período de aclimatação, os últimos 10 minutos são o período de teste.
- Usando vídeos salvos e um cronômetro, marque o tempo de preparação cumulativo para cada mouse durante o período de teste de 10 minutos. Outros comportamentos que podem ser pontuados a partir desses vídeos incluem a criação (em pé sobre as patas traseiras), o congelamento e o salto8.
- Use outros testes comuns para o modelo MIA, como inibição de pré-pulso (PPI) 14,30,31,32, campo aberto12,33,34, abordagem social de 3 câmaras 13,35,36, reconhecimento de novos objetos37, y-maze30, labirinto elevado mais 33 e condicionamento de contexto / medosinalizado 38.
- Imunoblotting pós-natal8 (opcional)
- Em P0, decapitar rapidamente e dissecar o tecido cerebral fetal em HBSS, congelar em nitrogênio líquido e armazenar a -80 °C.
- Interromper as amostras usando um sonicator de sonda com uma amplitude de 20% por 5 s em 2x tampão Laemmli, depois desnaturar a 85 °C por 5 min. Centrifugar lisado a 16.000 x g durante 10 min à temperatura ambiente. Recolher o sobrenadante e conservar a -80 °C.
- Meça o teor de proteína total usando um kit comercial de ensaio de proteína BCA, seguindo as instruções do fabricante, e use albumina sérica bovina como padrão de calibração.
- Adicionar o ditiotreitol como agente redutor às amostras como concentração final de 100 mM. Aqueça a 85 °C durante 2 minutos antes de carregar num gel.
- Execute 5 μg/lane de proteína sob condições redutoras em géis TGS a 7,5% e transfira eletroforeticamente para membranas PVDF. Bloqueie as membranas com tampão de bloqueio e incube com os anticorpos escolhidos.
- Lave três vezes com TBS + Tween 20 a 0,05% e incube as membranas por 45 min com anticorpos secundários marcados com fluorescência.
- Lave mais quatro vezes em TBS/Tween 20 e resultados de imagem. Padronizar os resultados usando β-tubulina, detectada usando anti-β-tubulina.
Resultados
Nem todos os animais expostos a 30 mg/kg de poli(I:C) em E12.5 produzem descendentes com anormalidades comportamentais consistentes 8,31. Embora tanto 30 mg/kg quanto 40 mg/kg de poli(I:C) produzam de forma confiável comportamentos de doença em barragens, incluindo diminuição dos níveis de atividade, respostas hipotérmicas e perda de peso, e também causem elevações significativas na IL-6, apenas um subconjunto de ninhadas expostas à IAM continuará a de...
Discussão
A infecção materna altera o curso do desenvolvimento cerebral em humanos e em roedores e primatas não humanos 4,5,7. Aqui, um procedimento para induzir MIA em camundongos em um ponto de tempo médio gestacional usando poli(I:C) é descrito. Esse método incorpora a avaliação da BIR antes da gravidez, o que aumenta a reprodutibilidade e oferece a chance de investigar mecanicamente os mecanismos que levam à resiliência e su...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Agradecemos à Dra. Myka Estes por sua persistência em abordar a variabilidade no modelo MIA de camundongos e a todos os colaboradores em Estes et al.8 por seu trabalho que levou ao desenvolvimento do protocolo de métodos aqui descrito. A pesquisa aqui relatada foi apoiada pelo NIMH 2P50 MH106438-06 (A.K.M.) e NIMH T32MH112507 (K.P.).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
Referências
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3 (2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200 (2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997 (2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859 (2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37 (2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados