A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יצירת מודל ניתן לשחזור של הפעלה חיסונית אימהית באמצע ההריון באמצעות Poly(I:C) לחקר רגישות וחוסן בצאצאים
In This Article
Summary
זיהום אימהי הוא גורם סיכון להפרעות נוירו-התפתחותיות. מודלים עכבריים של הפעלת מערכת החיסון האימהית (MIA) עשויים להבהיר את השפעת הזיהום על התפתחות המוח ותפקודו. כאן, הנחיות כלליות ונוהל ניתנים כדי לייצר צאצאים עמידים ורגישים באופן אמין שנחשפו ל- MIA.
Abstract
הפעלה חיסונית אימהית (MIA) במהלך ההריון קשורה באופן עקבי לסיכון מוגבר להפרעות נוירו-התפתחותיות ונוירופסיכיאטריות בצאצאים. מודלים של MIA בבעלי חיים משמשים לבדיקת סיבתיות, חקירת מנגנונים ופיתוח אבחון וטיפולים להפרעות אלה. למרות השימוש הנרחב בהם, מודלים רבים של MIA סובלים מחוסר יכולת שחזור וכמעט כולם מתעלמים משני היבטים חשובים של גורם סיכון זה: (i) צאצאים רבים עמידים בפני MIA, ו-(ii) צאצאים רגישים יכולים להציג שילובים שונים של פנוטיפים. כדי להגביר את יכולת הרבייה ולדגמן הן את הרגישות והן את החוסן ל-MIA, משתמשים בתגובתיות החיסונית הבסיסית (BIR) של נקבות עכברות לפני ההריון כדי לחזות אילו הריונות יובילו לצאצאים עמידים או צאצאים עם הפרעות התנהגותיות ומולקולריות מוגדרות לאחר חשיפה ל-MIA. כאן, שיטה מפורטת של השראת MIA באמצעות הזרקה intraperitoneal (i.p.) של RNA דו גדילי (dsRNA) נגיפי מחקה poly(I:C) ב 12.5 ימים של הריון מסופק. שיטה זו גורמת לתגובה דלקתית חריפה בסכר, הגורמת להפרעות בהתפתחות המוח בעכברים הממפות תחומים בעלי השפעה דומה בהפרעות פסיכיאטריות ונוירו-התפתחותיות בבני אדם (NDDs).
Introduction
ראיות אפידמיולוגיות קושרות זיהום אימהי לסיכון מוגבר למחלות פסיכיאטריות ומחלות NDD, כולל סכיזופרניה (SZ) והפרעת הספקטרום האוטיסטי (ASD)1,2,3,4,5,6,7. מודל עכברי MIA פותח כדי לבחון סיבתיות ואת התפקיד המכניסטי של MIA באטיולוגיה של הפרעות אלה, כמו גם לזהות סמנים ביולוגיים מולקולריים ולפתח כלים אבחוניים וטיפוליים 4,6. למרות התועלת של מודל זה והפופולריות הגוברת שלו, קיימת שונות רבה בפרוטוקולי האינדוקציה של MIA בתחום, מה שמקשה על השוואת תוצאות בין מחקרים ושכפול ממצאים 8,9. בנוסף, רוב האיטרציות של המודל אינן חוקרות שני היבטים תרגומיים חשובים של MIA: (i) צאצאים רבים עמידים בפני MIA, ו-(ii) צאצאים רגישים יכולים להציג שילובים ברורים של פנוטיפים8.
כדי ליצור מודל MIA הניתן לשחזור, החוקרים צריכים לדווח לפחות על מדד כמותי אחד של גודל MIA המושרה בסכרים. כדי לגרום ל-MIA במהלך ההיריון, המעבדה שלנו מבצעת זריקות תוך-פריטוניאליות (כלומר) של ה-RNA הדו-גדילי המחקה פוליאינוסיטי: חומצה פוליציטידילית [poly(I:C)]. Poly(I:C) משרה מפל חיסוני הדומה לנגיפי שפעת כפי שהוא מוכר על ידי קולטן דמוי אגרה 3 (TLR3)10. כתוצאה מכך, poly(I:C) מפעיל את תגובת השלב החריפה שגורמת לעלייה מהירה של ציטוקינים מעודדי דלקת 8,11,12. מחקרים קודמים הראו כי עלייה של ציטוקינים מעודדי דלקת, כולל אינטרלוקין-6 (IL-6), נחוצה כדי לייצר הפרעות התנהגותיות ונוירופתולוגיה בצאצאים כתוצאה מ-MIA11,12,13. לפיכך, רמת IL-6 בסרום האימהי שנאספה בשיאה ב-2.5 שעות לאחר הזרקת פולי(I:C) היא מדד כמותי משכנע של MIA שניתן להשתמש בו כדי להשוות תוצאות בין מעבדות בתחום.
על מנת ליצור מודל MIA המתייחס למרכיבים החיוניים מבחינה תרגומית של חוסן ורגישות עם פרוטוקול אינדוקציה יחיד 8,14, חוקרים יכולים לשלב גישות אינדוקציה טיפוסיות עם אפיון של תגובתיות חיסונית בסיסית של הסכר (BIR) לפני הריון8. לאחרונה, התגלה כי נקבות בתוליות C57BL/6 עכברות מראות מגוון רחב של תגובות IL-6 לחשיפה במינון נמוך לפולי(I:C) לפני הריון8. רק תת-קבוצה של נקבות אלה ממשיכה לייצר צאצאים רגישים, ורק בסדרי גודל מסוימים של הפעלת מערכת החיסון כפי שמוכתב על ידי השילוב של BIR ומינון פולי(I:C)8. MIA משרה פנוטיפים בתבנית U הפוכה; צאצאים מראים את הסטיות ההתנהגותיות והמולקולריות הגדולות ביותר כאשר הסכרים הם תגובתיים חיסוניים במידה בינונית, ועוצמת הדלקת האימהית מגיעה, אך אינה עולה, לטווח קריטי8. כאן, שיטה מפורטת כיצד ליצור באופן אמין הן צאצאים גמישים רגישים עם פנוטיפים התנהגותיים שונים כתוצאה של הזרקה באמצע ההריון של poly(I:C) מסופק.
Protocol
כל הפרוטוקולים מבוצעים באישור הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת קליפורניה-דייוויס (IACUC).
1. הכנת בעלי חיים
- בעת רכישת בעלי חיים, שמור על עקביות הפרמטרים הבאים כדי להבטיח רבייה מקסימלית.
- מיקום ספק וספק: כפי שדווח בעבר, עכברי בר מסוג C57BL/6J מציגים תגובות שונות לאותו מינון של poly(I:C) בהתאם לספק8. בחר ספק ומתח עכבר המציגים תגובה עקבית. עבור הניסויים כאן, עכברי C57BL/6 שהתקבלו מנהר צ'ארלס הראו שינויים עקביים בהתנהגות לאחר חשיפה ל- MIA באמצע ההריון, בעוד שאלו שנרכשו מטאקוניק הראו תגובת גודל גדולה יותר, עם הבדלים מסוימים בין קבוצות הטיפול בהשוואה לעכברי נהר צ'ארלס8.
- זן: עכברי C57BL/6J הם הנפוצים ביותר, אך עכברי BTBR וזנים אחרים מראים תגובות דיפרנציאליות ל- MIA9 באמצע ההריון. שימו לב לתגובות דיפרנציאליות אלה, שכן הן מגבירות את יכולת השחזור של השיטה ויכולות להיות משתנה פוטנציאלי בתרומה לתוצאות דיפרנציאליות בצאצאים.
- כדי להבטיח שונות מינימלית, השתמש רק בנקבות בתולות למחקרי MIA8 וציין בבירור פרטים בשיטות.
- גיל המשלוח ותקופת ההתאקלמות: עכברים שנשלחו לפני 7 שבועות מראים מערכות אנדוקריניות לא מווסתות15. לאפשר לבעלי חיים להתאקלם במשך מינימום של 48 שעות16,17. להזמין עכברים להישלח ב 7 שבועות (± 2 ימים) ולהזריק עבור BIR ב 8 שבועות (± 2 ימים).
- גיל ההזדווגות: מערכת החיסון של בעלי חיים דינמית לאורך חייהם. דאגו למזער את השונות על ידי שמירה על גיל הזדווגות / הזרקה עקבי ככל האפשר18,19,20. להזדווג עם נקבות עכברים בגיל 9 שבועות (± יומיים). אין להשתמש בזכרים מעל גיל 6 חודשים להזדווגות.
2. בדיקות והכנת לוט Poly(I:C)
- הכן פולי(I:C) בעל משקל מולקולרי גבוה כמתואר להלן.
- Autoclave 1.5 מ"ל צינורות מיקרוצנטריפוגה לאחסון. פולי מרחף (I:C) יכול להיות מאוחסן ב -20 ° C, אבל הפשרות הקפאה חוזרות ונשנות יכולות להשפיע על העוצמה. אמבט מים מחממים ל 70 °C (70 °F).
- באמצעות טכניקה סטרילית, הוסף 10 מ"ל של מלח פיזיולוגי סטרילי (NaCl 0.9%) לפולי ליופילי (I:C) באמצעות מזרק. חממו באמבט מים בטמפרטורה של 70°C למשך 15 דקות כדי לאפשר חישול מלא. מוציאים ומניחים להתקרר לטמפרטורת החדר.
- במכסה מנוע סטרילי, מוסיפים 40 מ"ל נוספים של מלח פיזיולוגי לבקבוק והופכים מספר פעמים כדי לערבב. הסר את החלק העליון של בקבוק poly(I:C) או השתמש מזרק כדי aliquot לתוך צינורות microcentrifuge 1.5 מ"ל. יש לאחסן בטמפרטורה של -20°C.
- הכינו פולי(I:C) במשקל מולקולרי מעורב כמתואר להלן.
- Autoclave 1.5 מ"ל צינורות מיקרוצנטריפוגה לאחסון. ניתן לאחסן פולי(I:C) מרחף בטמפרטורה של -20°C, אך הפשרות חוזרות ונשנות בהקפאה עלולות להשפיע על העוצמה. הגדר אמבט מים ל 50 °C.
- בטכניקה סטרילית, יש להוסיף 10 מ"ל של 0.9% NaCl סטרילי לפולי(I:C) ולאבטח את המכסה. חממו באמבט מים בטמפרטורה של 50°C למשך 25 דקות כדי לאפשר חישול מלא. מוציאים ומניחים להתקרר לטמפרטורת החדר.
- באמצעות טכניקה סטרילית, aliquot לתוך 1.5 מ"ל צינורות microcentrifuge ולאחסן ב -20 ° C.
- מתן פולי(I:C) באמצעות זריקות intraperitoneal (i.p.) כמתואר להלן.
- שקול את העכבר כדי לקבוע מינון מדויק. באמצעות מחט אינסולין 0.5 סמ"ק, צייר פולי מרחף (I:C). שפשפו את העכבר והפכו כך שהבטן חשופה.
- בעזרת היד השנייה, מחדירים את המחט לעומק של כ-0.5 ס"מ בין שתי הפטמות הקדמיות בזווית של כ-45 מעלות.
- צייר כדי לקבוע כי שום דם או שתן לא נכנס מזרק לפני ההזרקה. במקרה כזה, מקם מחדש את המחט ונסה שוב. מזריקים לאט. אם הפולי(I:C) מבעבע החוצה, סביר להניח שההזרקה הייתה תת עורית. מיקום הזרקה מוצלח יגרום לכך ששום דבר לא יימשך ברגע שהמחט מוחדרת, ולא ידלוף ברגע שהיא מוסרת.
- בדוק עוצמת לוט של MMW poly(I:C) כמתואר להלן8.
- השג את הצורה הרצויה של poly(I:C). יצרנים מסוימים יאפשרו לחוקרים להחזיק כמות מלאה או חלקית בזמן בדיקת העוצמה, כך שניתן יהיה להשיג בקבוקים מרובים מאוחר יותר בו זמנית. בדרך כלל, אלה יכולים להיות מאוחסנים lyophilized ב -20 ° C במשך מספר שנים אם הקפאה-הפשרה נמנע.
- להשיג או לגדל 30 סכרים בהריון לבדיקה. ב- E12.5, בצע זריקות i.p. של 20, 30 ו- 40 מ"ג / ק"ג במינימום של 10 עכברים למנה.
- 2.5 שעות לאחר ההזרקה, לאסוף דם באמצעות דימום הזנב. שימו לב שדם היקפי ודם תא מטען יכולים להיות שונים ברמות הציטוקינים, לכן הקפידו על עקביות שיטת האיסוף במחקר.
- יש לאפשר לדם להיקרש במהלך הלילה בטמפרטורת החדר. לאחר 12-24 שעות, יש לסובב דגימות דם בטמפרטורה של 3,768 x גרם בטמפרטורה של 4°C למשך 8 דקות. יש לאסוף את הסרום ולאחסן בטמפרטורה של -80°C עד לניתוח.
- בודדו את הסרום ומדדו רמות IL-6 באמצעות ELISA או Luminex. שמרו על עקביות בכלי המדידה מכיוון שיש שונות משמעותית בריכוז הכולל הנמדד עם שיטות ויצרנים שונים. לקבוע את גודל התגובה IL-6 הדרוש כדי לגרום לפנוטיפים באמצעות קבוצת פיילוט.
3. בדיקת תגובתיות חיסונית בסיסית (BIR)
הערה: איור 1 מציג את סכמת השלבים. השתמש במשקל מולקולרי שונה poly(I:C) לבדיקת BIR בהשוואה להריון כדי להפחית את הסבירות לתגובות חיסוניות נרכשות לתרכובת.
- הזמינו נקבות עכברים בתולות שיישלחו בגיל 7 שבועות. עם ההגעה, קבצו והשכינו ארבעה עד חמישה עכברים בכלוב ושוכנו את הקבוצה עד להזדווגות. השתמש בחריץ באוזן או בכל מערכת זיהוי אחרת.
- יש להזריק לנקבות תוך צפקית 5 מ"ג/ק"ג פולי(I:C) שבוע לאחר ההגעה. ב 2.5 שעות לאחר ההזרקה, כאשר IL-6 במחזור הוא הגבוה ביותר6, לאסוף דם שלם מבעלי חיים מוזרקים באמצעות חיתוך זנב.
- יש לאפשר לדם להיקרש במהלך הלילה בטמפרטורת החדר. לאחר 12-24 שעות, יש לסובב דגימות דם בטמפרטורה של 3,768 x גרם בטמפרטורה של 4°C למשך 8 דקות.
- יש לאסוף לפחות 32 מיקרוליטר של סרום מכל דגימה. יש להקפיא בטמפרטורה של -80°C עד לבדיקת ציטוקינים. כדי למדוד את רמות IL-6 באופן העקבי ביותר, השתמש בבדיקת מולטיפלקס כגון Luminex. שמרו על עקביות בכלי המדידה מכיוון שיש שונות משמעותית בריכוז הכולל הנמדד עם שיטות ויצרנים שונים.
- עבור פרוטוקול בדיקת Luminex, עיין ברוס ואחרים 21.
- באמצעות רמות IL-6 יחסיות, חלק בעלי חיים לקבוצות BIR נמוכות (רביעון תחתון), בינוניות (שני רבעונים אמצעיים) וגבוהות (רביעון עליון).
4. שיטת דימום זנב לאיסוף דם
הערה: כדי להימנע משימוש בתרופות הרגעה שעלולות להיות אימונומודולטוריות, השתמש בשיטת דימום הזנב של איסוף הדם.
- להגדרה, הניחו מעמד הלחמה וכוס ריסון על משטח בצד היד הלא דומיננטית. בצלחת פטרי בקוטר 35 מ"מ מוסיפים 1-2 מ"ל שמן מאכל באיכות מזון. הסירו את הפקק מפקק הדם המהיר והניחו ליד ההתקנה.
- הניחו כמה שכבות של מגבת נייר על מעמד ההלחמה ועל צינור הנימים הראשון בתוך אטב, ומקמו אותו קרוב למקום שבו יוחזק קצה הזנב של העכבר ויישמר במקביל לפני השטח של השולחן. יש סכין גילוח בהישג יד.
- כדי לאסוף את הדם, בצע את השלבים הבאים.
- בזמן הנדרש, הוציאו את העכבר מהכלוב והניחו מתחת לכוס כשהזנב שלו יוצא מהחריץ בבסיס. בעזרת סכין גילוח טרי, חותכים את קצה הזנב (1-2 מ"מ) ואוספים את טיפת הדם הראשונה בצינור הנימי המחובר למעמד ההלחמה.
- טבלו אצבעות של יד דומיננטית בשמן האכיל והשתמשו בסחיטה מבסיס הזנב לקצה, תוך הנחיית קצה הזנב אל צינור הנימים כדי לאסוף טיפות דם שנוצרו. המשך עד ~ 200 μL של דם נאסף.
- שים מכסה קצה קטן על הקצה המחודד של צינור נימי לפני המכסה העליון. אם שמים את הכובע העליון קודם, הדגימה תסולק מהקצה המחודד של הצינור. שים צינור מעטפת חיצונית מגן.
- אפשר להיקרש לילה בטמפרטורת החדר. מצננים מיקרו-צנטריפוגה ל-4°C ומסובבים את הדם כלפי מטה כאמור בשלב 3.3.

איור 1. ציר הזמן לבדיקת התגובה החיסונית הבסיסית של נקבות בתולות והזדווגות. הזמינו עכברים להגיע בגיל 7 שבועות ואפשרו להם להתאקלם במתקן למשך שבוע. הזריקו לבעלי חיים 5 מ"ג/ק"ג פולי(I:C) וכעבור 2.5 שעות שאבו דם. אפשר לדם להיקרש במשך הלילה, ואז צנטריפוגה ב 3,768 x גרם, 4 ° C למשך 8 דקות. יש לאסוף סרום ולהעריך רמות IL-6 יחסיות באמצעות ELISA או Multiplex. בגיל 9 שבועות, הגדירו זוגות הזדווגות. נוצר באמצעות BioRender.com לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. שיטה מבוססת משקל להזדווגות והזרקת E12.5 הריונית
הערה: איור 2 מציג את סכמת השלבים. ניתן להשתמש בשתי שיטות כדי להגדיר זוגות הזדווגות ולקבוע את נקודת הזמן E12.5. הראשונה, הזדווגות מתוזמנת, מתוארת במקום אחר22. חישובים מבוססי משקל יכולים לשמש גם כדי להעריך הריון E12.523. היתרון של גישה זו הוא שהיא מאפשרת נעילת זמן של גיל הסכר בעת ההזדווגות, ומפחיתה את השונות בתגובה החיסונית. הליך זה משמש כאן.
- הכניסו את הזכרים לכלובים נקיים ואפשרו להם להתאקלם במשך שעתיים לפחות. זה מקטין את הסבירות לתוקפנות נשית מכיוון שהזכרים כבר יוצרים ריח דומיננטי בכלוב.
- הגדר זוגות רבייה של זכר יחיד, נקבה אחת על ידי הוספת הנקבה לכלוב הזכר. לפני שמכניסים אותה לכלוב, שוקלים אותה ורושמים את המשקל. הוסיפו חופן קטן של גרעיני חמניות לכל כלוב כדי להגביר את יעילות ההזדווגות.
- כדי לקבוע את טווח העלייה במשקל, בצע את השלבים הבאים.
- השיגו קבוצת בדיקה של נקבות וקבעו זוגות הזדווגות, תוך רישום משקל בזמן ההזדווגות.
- כאשר נקבות מתחילות להופיע בהריון גלוי, לשקול אותם ולחלק תת קבוצות של 8.5 גרם, 9.5 גרם, 10.5 גרם, ו 11.5 גרם של משקל שעלה. עוברים ב-E12.5 רק החלו לפתח ספרות ברורות בכפותיהם. השתמש במורפולוגיה עוברית כדי לקבוע עלייה ממוצעת במשקל כדי להגיע E12.5.
- לאחר 12 יום לאחר ההזדווגות, לשקול נקבות ולקבוע עלייה במשקל. במתקן בדיקה, הנקבות עולות באופן עקבי 9.5-10.5 גרם מרגע ההזדווגות ל-E12.5. יש להזריק באמצעות i.p. את המינון של פולי מסיס (I:C) שנקבע בשלב 2.3.2 כאשר העלייה במשקל של הנקבה נופלת בטווח שנקבע מראש.
- שימו לב לתגובה ל-MIA בסכרים באמצעות הפרמטרים הבאים.
- התנהגות מחלה: אספו ציונים סובייקטיביים בסולם של 1-3 עבור מידת הפעילות של סכרים בתגובה לטיפול, כאשר 1 הוא תנועה מועטה או ללא תנועה כלל בתגובה לטיפול ו-3 הוא תגובה נורמלית ללכידה וריסון. בעלי חיים עם תגובה חיסונית גדולה יותר יראו פחות עמידות לטיפול8.
- תגובת חום: באמצעות מדחום IR, לאסוף טמפרטורות לפני ההזרקה ו 2.5 שעות לאחר ההזרקה. בעלי חיים עם תגובות חיסוניות בעוצמה גבוהה יותר מציגים לעתים קרובות היפותרמיה בתגובה לפעילות חיסונית גדולה יותר8.
- שינוי משקל: יש לשקול בעלי חיים 24 שעות לאחר ההזרקה. בעלי חיים עם תגובות חיסוניות בעוצמה גדולה יותר בדרך כלל מאבדים יותר משקל8.
- מדוד רמות IL-6 הריוניות כדלקמן8.
- ב 2.5 שעות לאחר ההזרקה, לאסוף דם בשיטה המועדפת. יש לאפשר לדם להיקרש במהלך הלילה בטמפרטורת החדר. לאחר 12-24 שעות, יש לסובב דגימות דם בטמפרטורה של 3,768 x גרם בטמפרטורה של 4°C למשך 8 דקות.
- יש לאסוף את הסרום ולאחסן בטמפרטורה של -80°C עד לניתוח. בודדו את הסרום ומדדו רמות IL-6 באמצעות ELISA או Luminex. שמרו על עקביות בכלי המדידה מכיוון שיש שונות משמעותית בריכוז הכולל הנמדד עם שיטות ויצרנים שונים.
- יש לשכן את הסכר לאחר ההזרקה עם העשרה מתאימה כמו קינונים ומכשירי העשרה. שמור על כל העשרה עקבית מכיוון שלשינויים בהעשרה יכולות להיות השפעות משמעותיות על התנהגות המכרסם 24,25,26,27,28,29.
- זמן ההריון עבור עכברי C57 נע בין 18.5-20.5 ימים. בצע בדיקות המלטה כדי לקבוע אם בעלי חיים נולדו בטווח זה כדי לוודא שההזרקה בוצעה בנקודת הזמן הנכונה. בעת בדיקת המלטות, להפריע לכלוב כמה שפחות. מתח מיד לאחר המלטה יכול להגדיל את הסיכון לקניבליזציה.
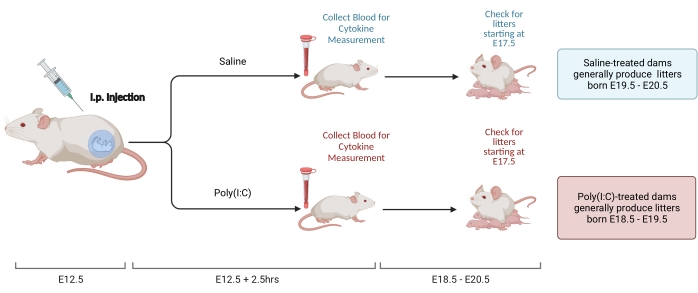
איור 2. אינדוקציה MIA. זירוז MIA דורש הערכה של הריון, כלומר הזרקה של poly(I:C), ובדיקות המלטה כדי להבטיח תזמון נכון של דלקת אימהית. לאחר הערכת יום ההריון באמצעות הזדווגות מתוזמנת או שיטת העלייה במשקל, לספק זריקה i.p. של poly(I:C) ב E12.5. יש לאסוף דגימת דם בשעה 2.5 שעות לאחר ההזרקה כדי לאשר את הפעלת מערכת החיסון ולקבוע את רמת ההפעלה של IL-6. המלטות ייוולדו בסביבות E18.5-E20.5. נוצר באמצעות BioRender.com לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. חקירת שינויים בהתנהגות ב- MIA בוגר וצאצאי ביקורת (אופציונלי)
- החל מ-P60 ולפני ביצוע מבחני התנהגות, יש להרגיל בעלי חיים למגע אנושי עם טיפול עדין למשך דקה אחת ביום במשך 3 ימים רצופים. יש לוודא כי ימי החלפת הכלוב אינם מתרחשים באותו יום בו מבוצעים מבחנים התנהגותיים.
- אפשרו תמיד לעכברים להתאקלם בחדר הבדיקה למשך 30-60 דקות לפני תחילת מבחני התנהגות. השתמשו בחדרים עם תאורה עמומה (15-20 לוקס) כדי למזער חרדה.
- לטיפוח חוזר, הניחו עכברים לבדם בכלובים נקיים ללא מצעים עם מכסים. באמצעות מצלמה, תיעדו את העכברים בכלובים אלה במשך 20 דקות. 10 הדקות הראשונות מתפקדות כתקופת התאקלמות, 10 הדקות האחרונות הן תקופת המבחן.
- באמצעות סרטונים שמורים ושעון עצר, הניקוד את זמן הטיפוח המצטבר עבור כל עכבר במהלך תקופת הבדיקה של 10 דקות. התנהגויות אחרות שניתן להבקיע מסרטונים אלה כוללות הגבהה (עמידה על רגליים אחוריות), קפיאה וקפיצה8.
- השתמש במבחנים נפוצים אחרים עבור מודל MIA כגון עיכוב דחף (PPI) 14,30,31,32, שדה פתוח12,33,34, גישה חברתית תלת-קאמרית 13,35,36, זיהוי אובייקט חדשני 37, מבוך y 30, מבוך מוגבה פלוס33, והתניה של פחד הקשר/רמז 38.
- אימונובלוטינג לאחר הלידה8 (אופציונלי)
- ב-P0, ערפו את ראשיהם במהירות ונתחו את רקמת המוח העוברית ב-HBSS, הקפיאו בחנקן נוזלי ואחסנו בטמפרטורה של -80°C.
- יש לשבש דגימות באמצעות סוניק בדיקה עם משרעת של 20% למשך 5 שניות ב-2x חיץ Laemmli, ולאחר מכן לנטרל ב-85°C למשך 5 דקות. צנטריפוגה ליזט ב 16,000 x גרם במשך 10 דקות בטמפרטורת החדר. לאסוף supernatant ולאחסן ב -80 ° C.
- מדוד את תכולת החלבון הכוללת באמצעות ערכת בדיקת חלבון BCA מסחרית, בהתאם להוראות היצרן, והשתמש באלבומין בסרום בקר כתקן כיול.
- הוסף dithiothreitol כסוכן מחזר לדגימות כריכוז סופי של 100 mM. יש לחמם ל-85°C למשך 2 דקות לפני העמסה על ג'ל.
- יש להפעיל 5 מק"ג/נתיב חלבון בתנאים מחזרים על 7.5% ג'ל TGS ולהעביר אלקטרופורטית לממברנות PVDF. לחסום ממברנות עם חיץ חוסם לדגור עם נוגדנים נבחרים.
- יש לשטוף שלוש פעמים עם TBS + 0.05% Tween 20 ולדגור על ממברנות במשך 45 דקות עם נוגדנים משניים עם תווית פלואורסצנטית.
- שטפו ארבע פעמים נוספות ב-TBS/Tween 20 וקבלו את תוצאות התמונה. סטנדרטיזציה של התוצאות באמצעות β-tubulin, שזוהה באמצעות אנטי-β-tubulin.
תוצאות
לא כל בעלי החיים שנחשפו ל-30 מ"ג/ק"ג של פולי(I:C) ב-E12.5 מעמידים צאצאים עם הפרעות התנהגותיות עקביות 8,31. אף על פי שגם 30 מ"ג/ק"ג וגם 40 מ"ג/ק"ג של פולי(I:C) מייצרים באופן אמין התנהגויות מחלה בסכרים, כולל ירידה ברמות הפעילות, תגובות היפותרמיות וירידה במשקל, וגם גורמות לעליו?...
Discussion
זיהום אימהי משנה את מהלך התפתחות המוח בבני אדם ובמכרסמים ובפרימטים לא אנושיים 4,5,7. כאן, מתואר הליך להשראת MIA בעכברים בנקודת זמן באמצע ההריון באמצעות poly(I:C). שיטה זו משלבת הערכה של BIR לפני ההריון, אשר מגבירה את יכולת השחזור ומציעה הזדמנות לחק?...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לד"ר מיקה אסטס על התמדתה בטיפול בשונות במודל MIA של העכבר ולכל התורמים באסטס ואחרים 8 על עבודתם שהובילה לפיתוח פרוטוקול השיטות המתואר כאן. המחקר המדווח כאן נתמך על ידי NIMH 2P50 MH106438-06 (A.K.M.) ו- NIMH T32MH112507 (K.P).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
References
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3 (2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200 (2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997 (2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859 (2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37 (2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved