需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用聚(I:C)生成妊娠中期母体免疫激活的可重复模型,以研究后代的易感性和恢复力
摘要
母体感染是神经发育障碍的危险因素。母体免疫激活(MIA)小鼠模型可以阐明感染对大脑发育和功能的影响。在这里,提供了一般指南和程序,以产生暴露于MIA的可靠弹性和易感后代。
摘要
怀孕期间的母体免疫激活(MIA)始终与后代神经发育和神经精神疾病的风险增加有关。MIA的动物模型用于测试因果关系,研究机制,并开发这些疾病的诊断和治疗方法。尽管它们被广泛使用,但许多MIA模型缺乏可重复性,并且几乎都忽略了该风险因素的两个重要方面:(i)许多后代对MIA具有弹性,以及(ii)易感后代可以表现出不同的表型组合。为了提高可重复性并模拟对MIA的易感性和恢复力,雌性小鼠在怀孕前的基线免疫反应性(BIR)用于预测哪些怀孕将导致有弹性的后代或暴露于MIA后具有明确行为和分子异常的后代。本文提供了在妊娠12.5天时通过腹膜内(ip)注射双链RNA(dsRNA)病毒模拟物poly(I:C) 诱导 MIA的详细方法。这种方法在大坝中诱导急性炎症反应,导致小鼠大脑发育的扰动,这些扰动映射到人类精神和神经发育障碍(NDD)中类似受影响的结构域。
引言
流行病学证据将母体感染与精神和NDD的风险增加联系起来,包括精神分裂症(SZ)和自闭症谱系障碍(ASD)1,2,3,4,5,6,7。开发MIA小鼠模型是为了测试MIA在这些疾病的病因中的因果关系和机制作用,以及鉴定分子生物标志物并开发诊断和治疗工具4,6。尽管该模型具有实用性并且越来越受欢迎,但该领域内MIA诱导方案存在相当大的差异,因此难以比较研究之间的结果并重复研究结果8,9。此外,该模型的大多数迭代都没有研究MIA的两个重要翻译方面:(i)许多后代对MIA具有弹性,以及(ii)易感后代可以表现出表型8的不同组合。
为了生成可重复的MIA模型,研究人员应报告至少一个关于大坝中诱导的MIA幅度的定量测量。为了在妊娠期间诱导MIA,我们的实验室进行腹膜内(ip)注射双链RNA病毒模拟聚肌醇:聚胞苷酸[poly(I:C)]。 Poly(I:C)诱导类似于流感病毒的免疫级联反应,因为它被toll样受体3(TLR3)10识别。结果,poly(I:C)激活急性期反应,导致促炎细胞因子8,11,12快速升高。先前的研究表明,由于MIA11,12,13,导致后代的行为异常和神经病理学,包括白细胞介素-6(IL-6)的升高是必要的。因此,在注射聚(I:C)后2.5小时达到峰值期间收集的母体血清中IL-6水平是MIA的一种令人信服的定量测量方法,可用于比较该领域内实验室的结果。
为了生成一个MIA模型,通过单一诱导方案解决弹性和易感性的翻译基本要素8,14,研究人员可以将典型的诱导方法与怀孕前大坝基线免疫反应性(BIR)的特征相结合8。最近,发现处女雌性C57BL / 6小鼠在怀孕前对低剂量暴露于poly(I:C)表现出广泛的IL-6反应8。只有这些雌性中的一个子集继续产生易感的后代,并且仅在BIR和poly(I:C)剂量8的组合所决定的一定程度的免疫激活下。MIA 以倒 U 型诱导表型;当DAM具有中等免疫反应性时,后代表现出最大的行为和分子畸变,并且母体炎症的程度达到但不超过临界范围8。本文提供了一种详细的方法,说明如何可靠地创建具有不同行为表型的弹性和易感后代,这些后代是由于妊娠中期注射poly(I:C)的结果。
研究方案
所有方案均在加州大学戴维斯分校机构动物护理和使用委员会(IACUC)的批准下进行。
1. 动物制备
- 采集动物时,请保持以下参数一致,以确保最大的可重复性。
- 供应商和供应商位置:如前所述,野生型C57BL / 6J小鼠对相同剂量的poly(I:C)表现出不同的反应,具体取决于供应商8。选择显示一致响应的供应商和小鼠品系。对于这里的实验,从Charles River获得的C57BL / 6小鼠在暴露于妊娠中期MIA后表现出一致的行为变化,而从Taconic购买的小鼠表现出更大的幅度反应,与CharlesRiver小鼠相比,治疗组之间存在一些差异8。
- 菌株:C57BL / 6J小鼠是最常用的,但BTBR小鼠和其他菌株对妊娠中期MIA9表现出不同的反应。请注意这些差异反应,因为它们增强了方法的可重复性,并且可能是导致后代差异结果的潜在变量。
- 为了确保最小的变异性,MIA研究8 仅使用处女,并清楚地记录方法中的细节。
- 运输和适应期的年龄:7周前运输的小鼠表现出失调的内分泌系统15。让动物适应至少 48 小时16,17。订购小鼠在7周(±2天)发货,并在8周(±2天)注射BIR。
- 交配年龄:动物的免疫系统在其一生中是动态的。注意通过保持交配/注射年龄尽可能一致来尽量减少变异性18,19,20。在9周(±2天)交配雌性小鼠。不要使用6个月以上的雄性进行交配。
2. 聚(I:C)批次测试和准备
- 如下所述制备高分子量聚(I:C)。
- 高压灭菌 1.5 mL 微量离心管进行储存。重悬的聚(I:C)可以储存在-20°C,但反复冻融会影响效力。将水浴加热至70°C。
- 使用无菌技术,使用注射器将 10 mL 无菌生理盐水 (NaCl 0.9%) 加入冻干聚 (I:C) 中。在70°C水浴中加热15分钟,使其完全退火。取出并冷却至室温。
- 在无菌罩中,向瓶中额外添加 40 mL 生理盐水,并倒置数次以混合。取下聚 (I:C) 瓶的顶部或使用注射器将试样分装到 1.5 mL 微量离心管中。储存在-20°C。
- 如下所述制备混合分子量的聚(I:C)。
- 高压灭菌 1.5 mL 微量离心管进行储存。重悬的聚(I:C)可以储存在-20°C,但反复冻融会影响效力。将水浴设置为50°C。
- 使用无菌技术,将 10 mL 无菌 0.9% NaCl 加入冻干聚 (I:C) 中并盖上盖子。在50°C水浴中加热25分钟,使其完全退火。取出并冷却至室温。
- 使用无菌技术,分装到1.5 mL微量离心管中并储存在-20°C。
- 通过腹膜内(ip)注射施用聚(I:C),如下所述。
- 称量小鼠以确定准确的剂量。使用0.5 cc胰岛素针,拉出重悬的poly(I:C)。 揉搓鼠标并翻转,使腹部暴露在外。
- 用另一只手将针头插入前两个之间约 0.5 厘米的深度,角度约为 45°。
- 在注射前绘制以确定没有血液或尿液进入注射器。如果出现任一情况,请重新定位针头并重试。慢慢注射。如果聚(I:C)气泡出来,则注射可能是皮下注射。成功的注射放置将导致针头插入后不会产生任何拉动,一旦取出针头就不会泄漏。
- 测试MMW多(I:C)批次效力,如下所述8.
- 获得所需形式的聚(I:C)。 一些制造商将允许研究人员在测试效力时保留全部或部分批次,以便以后可以同时获得多个瓶子。通常,如果避免冻融,它们可以在-20°C冻干储存数年。
- 获得或繁殖30只怀孕母猪进行测试。在E12.5下,每剂量至少10只小鼠进行20,30和40mg / kg的腹膜注射。
- 在注射后2.5小时,通过尾部出血 收集 血液。请注意,外周血和躯干血的细胞因子水平可能不同,因此在研究中保持收集方法的一致性。
- 让血液在室温下凝结过夜。12-24小时后,在4°C下以3,768× g 旋转血液样品8分钟。收集血清并储存在-80°C直至分析。
- 分离血清并通过ELISA或Luminex 测量 IL-6水平。保持测量工具的一致性,因为使用不同模式和制造商测量的总浓度存在显着差异。确定利用试点队列诱导表型所需的 IL-6 反应幅度。
3. 基线免疫反应性 (BIR) 检测
注: 图 1 显示了这些步骤的示意图。与妊娠相比,使用不同分子量的poly(I:C)进行BIR测试,以降低对该化合物的适应性免疫反应的可能性。
- 订购处女雌性小鼠,在 7 周大时发货。到达后,将四到五只老鼠分组并安置在笼子里,并保持群体直到交配。使用耳口或任何其他识别系统。
- 到达后 1 周腹膜内注射 5 mg/kg 聚(I:C)。在注射后2.5小时,当循环IL-6最高6时,通过尾剪 从 注射的动物中收集全血。
- 让血液在室温下凝结过夜。12-24小时后,在4°C下以3,768× g 旋转血液样品8分钟。
- 从每个样品中收集至少 32 μL 血清。在-80°C冷冻,直到准备测试细胞因子。为了最一致地测量IL-6水平,请使用Luminex等多重检测方法。保持测量工具的一致性,因为使用不同模式和制造商测量的总浓度存在显着差异。
- 对于Luminex测定方案,请参阅Bruce等人21。
- 使用相对IL-6水平,将动物分为低(底部四分位数),中(中间两个四分位数)和高(最高四分位数)BIR组。
4.采血尾部出血法
注意:为避免使用潜在的免疫调节镇静剂,请使用尾部出血方法进行采血。
- 要进行设置,请将焊接支架和约束杯放在非惯用手侧面的表面上。在 35 毫米培养皿中,加入 1-2 mL 食品级食用油。从快速血塞上取下盖子,放在设置附近。
- 将几层纸巾放在焊接架上,将第一个毛细管放在夹子中,将其放置在鼠标尾尖固定的位置附近并保持与桌子表面平行。随身携带剃须刀片。
- 要收集血液,请执行以下步骤。
- 在所需的时间,将鼠标从笼子中取出并放在杯子下面,尾巴从底部的凹口中伸出。使用新鲜的剃须刀片,将尾巴的末端(1-2 毫米)夹掉,并在夹在焊接架上的毛细管中收集第一滴血液。
- 将惯用手的手指浸入食用油中,用于从尾巴根部挤压到尖端,将尾尖引导到毛细管以收集产生的血滴。继续直到收集~200μL血液。
- 在顶盖之前将一个小端盖放在毛细管的锥形端上。如果先戴上顶盖,样品将从管的锥形端排出。将管子放入保护外壳中。
- 在室温下凝结过夜。将微量离心机冷却至4°C并按照步骤3.3所述旋转血液。

图1.测试处女基线免疫反应和交配的时间表。 命令小鼠在 7 周大时到达并适应设施 1 周。给动物注射5mg / kg的聚(I:C),2.5小时后抽血。让血液凝结过夜,然后在3,768× g,4°C下离心8分钟。收集血清并通过 ELISA 或多重检测 评估 相对 IL-6 水平。在 9 周大时,设置交配对。创建使用 BioRender.com 请点击此处查看此图的大图。
5.基于体重的交配和妊娠E12.5注射方法
注: 图 2 显示了这些步骤的示意图。有两种方法可用于设置配对和确定E12.5时间点。第一种是定时交配,在别处有描述22.基于体重的计算也可用于评估E12.5妊娠23。这种方法的好处是它允许在交配时锁定大坝的年龄,减少免疫反应的变异性。此处使用此过程。
- 将雄性放在干净的笼子中,让它们适应至少2小时。这降低了雌性攻击的可能性,因为雄性已经在笼子里形成了一种主导的气味。
- 通过将雌性添加到雄性笼子中来建立单雄性、单雌性繁殖对。在将她放入笼子之前,请称量她的体重并记录重量。在每个笼子上添加一小把葵花籽以提高交配效率。
- 要确定体重增加范围,请执行以下步骤。
- 获得一组雌性并设置交配对,记录交配时的体重。
- 当女性开始明显怀孕时,称量体重并分成增加的 8.5 克、9.5 克、10.5 克和 11.5 克的子集。E12.5的胎儿刚刚开始在爪子上发育出明显的手指。使用胎儿形态来确定平均体重增加以达到E12.5。
- 在交配后 12 天,称雌性体重并确定体重增加。在测试设施中,雌性从交配到E12.5时持续增加9.5-10.5克。当雌性的体重增加落在预定范围内时, 通过 腹膜注射在步骤2.3.2中确定的可溶聚(I:C)的剂量。
- 使用以下参数观察大坝中对 MIA 的响应。
- 疾病行为:以 1-3 分的等级收集主观分数,了解大坝在被处理后变得多么活跃,其中 1 表示对被处理的反应很少或没有运动,3 表示对捕获和约束的正常反应。具有较大免疫反应的动物对处理的抵抗力较小8。
- 发热反应:使用红外温度计,收集注射前和注射后2.5小时的温度。免疫反应程度较大的动物通常表现出体温过低,以应对更大的免疫活动8。
- 体重变化:注射后24小时称量动物。免疫反应幅度较大的动物通常会减轻更多的体重8。
- 测量妊娠期IL-6水平,如下所示8。
- 在注射后2.5小时,用首选方法收集血液。让血液在室温下凝结过夜。12-24小时后,在4°C下以3,768× g 旋转血液样品8分钟。
- 收集血清并储存在-80°C直至分析。分离血清并通过ELISA或Luminex 测量 IL-6水平。保持测量工具的一致性,因为使用不同模式和制造商测量的总浓度存在显着差异。
- 注入后单独安置大坝,并用适当的富集物(如巢穴和浓缩装置)进行。保持所有富集一致,因为富集的改变会对啮齿动物的行为产生重大影响24,25,26,27,28,29。
- C57小鼠的妊娠时间为18.5-20.5天。进行垫料检查以确定动物是否在此范围内出生,以确保在正确的时间点进行注射。检查垃圾时,尽可能少地打扰笼子。窝出生后立即施加压力会增加同类相食的风险。
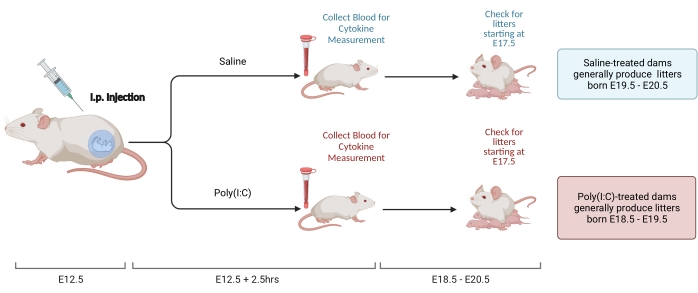
图2.MIA感应。 MIA诱导需要评估妊娠,腹腔注射poly(I:C)和垫料检查,以确保母体炎症的正确时间。通过定时交配或增重法 评估 妊娠日后,在 E12.5 处腹腔注射聚(I:C)。注射后2.5小时收集血液样本以确认免疫激活并确定IL-6激活水平。窝大约在E18.5-E20.5出生。创建使用 BioRender.com 请点击此处查看此图的大图。
6.调查成年MIA和对照后代的行为改变(可选)
- 从P60开始,在进行行为测试之前,每天1分钟,连续3天,使动物适应人类接触,每天轻柔处理1分钟。确保笼子更换日不会发生在进行行为测试的同一天。
- 在开始行为测试之前,始终让小鼠适应测试室30-60分钟。使用光线昏暗(15-20勒克斯)的房间,以尽量减少焦虑。
- 对于重复梳理,将小鼠单独放在带盖的干净、无床上用品的笼子中。使用相机,在这些笼子中记录小鼠20分钟。前 10 分钟作为适应期,后 10 分钟是测试期。
- 使用保存的视频和秒表,在 10 分钟测试期间为每只鼠标的累积梳理时间评分。可以从这些视频中评分的其他行为包括养育(后腿站立)、冻结和跳跃8.
- 对 MIA 模型使用其他常见测试,例如脉冲前抑制 (PPI) 14,30,31,32、开放场地12,33,34、3 室社交方法 13、35、36、新型物体识别 37、y 迷宫 30、升高加迷宫33 和上下文/提示恐惧条件反射 38。
- 产后免疫印迹8 (可选)
- 在P0处,快速斩首并在HBSS中解剖胎儿脑组织,在液氮中冷冻,并储存在-80°C。
- 使用振幅为20%的探针超声仪在2x Laemmli缓冲液中破碎样品5秒,然后在85°C下变性5分钟。在室温下以16,000× g 离心裂解物10分钟。收集上清液并储存在-80°C。
- 按照制造商的说明,使用商业BCA蛋白检测试剂盒测量总蛋白含量,并使用牛血清白蛋白作为校准标准品。
- 向样品中加入二硫苏糖醇作为还原剂,最终浓度为100mM。加热至85°C2分钟,然后加载到凝胶上。
- 在还原条件下,在 7.5% TGS 凝胶上运行 5 μg/泳道的蛋白质,并电泳转印到 PVDF 膜上。用封闭缓冲液封闭膜并与选定的抗体孵育。
- 用TBS + 0.05%吐温20洗涤三次,并用荧光标记的二抗孵育膜45分钟。
- 在TBS/吐温20中再洗涤四次,并得到图像结果。使用β-微管蛋白标准化结果,使用抗β-微管蛋白检测。
结果
并非所有在E12.5暴露于30mg / kg聚(I:C)的动物都会产生具有一致行为异常的后代8,31。尽管 30 mg/kg 和 40 mg/kg 的聚(I:C) 都能可靠地在大坝中产生疾病行为,包括活动水平降低、体温过低和体重减轻,并且还会导致 IL-6 显著升高,但只有一部分暴露于 MIA 的窝产仔会继续在类似于人类精神病学和 NDD 中观察到的领域出现行为异常(图 3A-C
讨论
母体感染会改变人类以及啮齿动物和非人灵长类动物的大脑发育过程4,5,7。在这里,概述了使用poly(I:C)在妊娠中期时间点诱导小鼠MIA的程序。该方法结合了怀孕前对BIR的评估,这增加了可重复性,并提供了机械地研究导致后代对MIA8的弹性和易感性的机制的机会。MIA后,来自中等BIR组的母体(IL-6水平在中...
披露声明
作者没有利益冲突需要披露。
致谢
我们感谢Myka Estes博士坚持不懈地解决小鼠MIA模型中的变异性,并感谢Estes等人8的所有贡献者所做的工作 ,这些工作导致了此处描述的方法方案的开发。这里报告的研究得到了NIMH 2P50 MH106438-06(AKM)和NIMH T32MH112507(K.P.)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
参考文献
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3 (2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200 (2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997 (2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859 (2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37 (2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。