Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Создание воспроизводимой модели иммунной активации матери в середине беременности с использованием Poly (I: C) для изучения восприимчивости и устойчивости у потомства
В этой статье
Резюме
Материнская инфекция является фактором риска развития нервной системы. Мышиные модели материнской иммунной активации (MIA) могут пролить свет на влияние инфекции на развитие и функцию мозга. Здесь представлены общие рекомендации и процедура для получения надежно устойчивого и восприимчивого потомства, подвергшегося воздействию MIA.
Аннотация
Материнская иммунная активация (MIA) во время беременности последовательно связана с повышенным риском нервно-психических расстройств и нервно-психических расстройств у потомства. Животные модели MIA используются для проверки причинно-следственной связи, исследования механизмов и разработки диагностики и лечения этих расстройств. Несмотря на их широкое использование, многие модели MIA страдают от отсутствия воспроизводимости и почти все игнорируют два важных аспекта этого фактора риска: (i) многие потомки устойчивы к MIA, и (ii) восприимчивое потомство может демонстрировать различные комбинации фенотипов. Чтобы повысить воспроизводимость и смоделировать как восприимчивость, так и устойчивость к MIA, базовая иммунореактивность (BIR) самок мышей до беременности используется для прогнозирования того, какие беременности приведут либо к устойчивому потомству, либо к потомству с определенными поведенческими и молекулярными аномалиями после воздействия MIA. Здесь представлен подробный метод индукции MIA путем внутрибрюшинной (в/) инъекции двухцепочечной РНК (дцРНК) вирусной имитирующей поли (I: C) на 12,5 день беременности. Этот метод вызывает острую воспалительную реакцию в плотине, что приводит к возмущениям в развитии мозга у мышей, которые сопоставляются с аналогичными пораженными доменами при психических расстройствах и расстройствах развития нервной системы человека (NDD).
Введение
Эпидемиологические данные связывают материнскую инфекцию с повышенным риском психиатрических и NDD, включая шизофрению (SZ) и расстройство аутистического спектра (ASD)1,2,3,4,5,6,7. Модель мышей MIA была разработана для проверки причинно-следственной связи и механистической роли MIA в этиологии этих расстройств, а также для идентификации молекулярных биомаркеров и разработки как диагностических, так и терапевтических инструментов 4,6. Несмотря на полезность этой модели и ее растущую популярность, существует значительная вариабельность протоколов индукции MIA в полевых условиях, что затрудняет сравнение результатов в разных исследованиях и воспроизведение результатов 8,9. Кроме того, большинство итераций модели не исследуют два важных трансляционных аспекта MIA: (i) многие потомки устойчивы к MIA, и (ii) восприимчивое потомство может демонстрировать различные комбинации фенотипов8.
Чтобы создать воспроизводимую модель MIA, исследователи должны сообщить, по крайней мере, об одной количественной мере величины MIA, индуцированной в плотинах. Чтобы индуцировать MIA во время беременности, наша лаборатория выполняет внутрибрюшинные (внутривенные) инъекции двухцепочечной РНК, имитирующей полиинозитную РНК: полицитидиловую кислоту [поли(I:C)]. Поли (I: C) индуцирует иммунный каскад, подобный вирусам гриппа, поскольку он распознается толл-подобным рецептором 3 (TLR3)10. В результате поли(I:C) активирует реакцию острой фазы, что приводит к быстрому повышению уровня провоспалительных цитокинов 8,11,12. Предыдущие исследования показали, что повышение уровня провоспалительных цитокинов, включая интерлейкин-6 (IL-6), необходимо для возникновения поведенческих аномалий и невропатологии у потомства в результате MIA11,12,13. Таким образом, уровень IL-6 в материнской сыворотке, собранный во время его пика через 2,5 часа после инъекции поли (I: C), является убедительным количественным показателем MIA, который может быть использован для сравнения результатов в разных лабораториях в полевых условиях.
Чтобы создать модель MIA, которая учитывает трансляционно важные элементы устойчивости и восприимчивости с помощью одного протоколаиндукции 8,14, исследователи могут комбинировать типичные индукционные подходы с характеристикой базовой иммунореактивности (BIR) матери до беременности8. Недавно было обнаружено, что девственные самки мышей C57BL / 6 демонстрируют широкий спектр ответов IL-6 на воздействие низких доз поли (I: C) до беременности8. Только подгруппа этих самок продолжает производить восприимчивое потомство и только при определенных величинах иммунной активации, продиктованной комбинацией BIR и поли (I: C) дозы8. MIA индуцирует фенотипы в перевернутом U-образном паттерне; Потомство демонстрирует наибольшие поведенческие и молекулярные аберрации, когда матери умеренно иммунореактивны, а величина материнского воспаления достигает, но не превышает критический диапазон8. Здесь представлен подробный метод того, как надежно создать как упругое, так и восприимчивое потомство с расходящимися поведенческими фенотипами в результате среднегестационной инъекции поли(I:C).
протокол
Все протоколы выполняются с одобрения Комитета по уходу за животными и их использованию (IACUC) Калифорнийского университета в Дэвисе.
1. Подготовка животных
- При приобретении животных соблюдайте следующие параметры, чтобы обеспечить максимальную воспроизводимость.
- Продавец и местонахождение поставщика: как сообщалось ранее, мыши дикого типа C57BL/6J проявляют различную реакцию на одну и ту же дозу поли(I:C) в зависимости от поставщика8. Выберите поставщика и штамм мыши, которые показывают последовательную реакцию. Для экспериментов здесь мыши C57BL / 6, полученные из Чарльз-Ривер, демонстрировали последовательные изменения в поведении после воздействия миа в середине беременности, в то время как мыши, приобретенные у Таконика, показали большую реакцию с большей величиной, с некоторыми различиями в группах лечения по сравнению с мышами Чарльз-Ривер8.
- Штамм: Мыши C57BL / 6J являются наиболее часто используемыми, но мыши BTBR и другие штаммы демонстрируют дифференциальную реакцию на MIA9 в середине беременности. Обратите внимание на эти дифференциальные реакции, так как они повышают воспроизводимость метода и могут быть потенциальной переменной, способствующей дифференциальным результатам у потомства.
- Чтобы обеспечить минимальную вариабельность, используйте только девственниц для исследований MIA8 и четко указывайте детали в методах.
- Возраст на момент доставки и период акклиматизации: мыши, отправленные до 7 недель, демонстрируют дисрегуляцию эндокринной системы15. Дайте животным акклиматизироваться не менее 48 ч16,17. Заказывайте мышей для отправки через 7 недель (± 2 дня) и вводите BIR через 8 недель (± 2 дня).
- Возраст спаривания: иммунная система животных динамична на протяжении всей их жизни. Позаботьтесь о том, чтобы свести к минимуму изменчивость, поддерживая как можно более стабильный возраст при спаривании/инъекции18,19,20. Спаривание самок мышей в 9 недель (± 2 дня). Не используйте для случки самцов старше 6-месячного возраста.
2. Тестирование и подготовка партии Poly (I: C)
- Подготовьте высокомолекулярный поли (I: C), как описано ниже.
- Автоклавные микроцентрифужные пробирки 1,5 мл для хранения. Ресуспендированный поли (I: C) можно хранить при -20 ° C, но повторное замораживание может повлиять на эффективность. Нагрейте водяную баню до 70 °C.
- Используя стерильную технику, добавьте 10 мл стерильного физиологического раствора (NaCl 0,9%) в лиофилизированный поли (I: C) с помощью шприца. Нагрейте на водяной бане 70 °C в течение 15 минут, чтобы обеспечить полный отжиг. Достаньте и дайте остыть до комнатной температуры.
- В стерильном капюшоне добавьте в бутылку дополнительно 40 мл физиологического раствора и несколько раз переверните, чтобы перемешать. Снимите верхнюю часть бутылки из поли (I: C) или используйте шприц для аликвоты в микроцентрифужные пробирки объемом 1,5 мл. Хранить при температуре -20 °C.
- Приготовьте смешанную молекулярную поли (I: C), как описано ниже.
- Автоклавные микроцентрифужные пробирки 1,5 мл для хранения. Ресуспендированный поли (I: C) можно хранить при -20 ° C, но повторное замораживание может повлиять на эффективность. Установите водяную баню на 50 °C.
- Используя стерильную технику, добавьте 10 мл стерильного 0,9% NaCl к лиофилизированному поли (I: C) и закрепите крышку. Нагрейте на водяной бане 50 °C в течение 25 минут, чтобы обеспечить полный отжиг. Достаньте и дайте остыть до комнатной температуры.
- Используя стерильную технику, аликвоту в микроцентрифужные пробирки объемом 1,5 мл и хранить при -20 °C.
- Вводят поли (I: C) через внутрибрюшинные (i.p.) инъекции, как описано ниже.
- Взвесьте мышь, чтобы определить точную дозировку. Используя инсулиновую иглу объемом 0,5 куб. см, нарисуйте ресуспендированный поли (I: C). Почистите мышь и переверните так, чтобы живот был открыт.
- Другой рукой введите иглу на глубину примерно 0,5 см между двумя передними сосками под углом около 45°.
- Перед инъекцией проведите проверку, чтобы определить, что кровь или моча не попадают в шприц. Если это произойдет, переместите иглу и повторите попытку. Вводите медленно. Если поли (I: C) пузырится, инъекция, вероятно, была подкожной. Успешное размещение инъекции приведет к тому, что после введения иглы ничего не будет сделано, а после ее удаления не произойдет утечка.
- Проверьте эффективность партии MMW poly (I: C), как описано ниже8.
- Получите желаемую форму поли(I:C). Некоторые производители позволяют исследователям удерживать полную или частичную партию во время проверки эффективности, чтобы можно было получить несколько бутылок позже одновременно. Как правило, их можно хранить лиофилизированными при -20 ° C в течение нескольких лет, если избежать замораживания-оттаивания.
- Получите или разведите 30 беременных маток для тестирования. При E12.5 выполняйте внутривенные инъекции 20, 30 и 40 мг / кг минимум 10 мышам на дозу.
- Через 2,5 часа после инъекции соберите кровь через хвостовое кровотечение. Обратите внимание, что периферическая кровь и магистральная кровь могут различаться по уровням цитокинов, поэтому сохраняйте последовательность метода сбора в рамках исследования.
- Дайте крови свернуться в течение ночи при комнатной температуре. Через 12-24 ч отжимают образцы крови в дозе 3,768 x g при 4 °C в течение 8 мин. Соберите сыворотку и храните при температуре -80 °C до анализа.
- Выделите сыворотку и измерьте уровень IL-6 с помощью ИФА или Luminex. Поддерживайте согласованность измерительных инструментов, поскольку существует значительная вариабельность общей концентрации, измеренной с помощью различных методов и производителей. Определите величину ответа IL-6, необходимого для индуцирования фенотипов, используя пилотную когорту.
3. Базовое тестирование иммунореактивности (BIR)
ПРИМЕЧАНИЕ: На рисунке 1 показана схема шагов. Используйте другую молекулярную поли (I: C) для тестирования BIR по сравнению с гестационным, чтобы снизить вероятность адаптивного иммунного ответа на соединение.
- Закажите девственных самок мышей, которые будут отправлены в возрасте 7 недель. По прибытии группируйте и размещайте четырех-пять мышей в клетке и держите группу в помещении до спаривания. Используйте ушную выемку или любую другую систему идентификации.
- Через 1 неделю после прибытия женщинам внутрибрюшинно вводят 5 мг/кг поли(I:C). Через 2,5 ч после инъекции, когда циркулирующий IL-6 самый высокий6, собирают цельную кровь у инъецированных животных с помощью хвостового фрагмента.
- Дайте крови свернуться в течение ночи при комнатной температуре. Через 12-24 ч отжимают образцы крови в дозе 3,768 x g при 4 °C в течение 8 мин.
- Соберите не менее 32 мкл сыворотки из каждого образца. Заморозьте при -80 °C до готовности к тестированию на цитокины. Чтобы наиболее последовательно измерять уровни IL-6, используйте мультиплексный анализ, такой как Luminex. Поддерживайте согласованность измерительных инструментов, поскольку существует значительная вариабельность общей концентрации, измеренной с помощью различных методов и производителей.
- Протокол анализа Luminex см. в Bruce et al.21.
- Используя относительные уровни IL-6, разделите животных на группы с низким (нижний квартиль), средним (средние два квартиля) и высоким (высший квартиль) БИР.
4. Метод кровотечения из хвоста для забора крови
ПРИМЕЧАНИЕ: Чтобы избежать использования потенциально иммуномодулирующих седативных средств, используйте метод забора крови с хвостовым кровотечением.
- Для настройки поместите подставку для пайки и удерживающую чашку на поверхность сбоку от недоминантной руки. В чашку Петри диаметром 35 мм добавьте 1-2 мл пищевого пищевого масла. Снимите колпачок с быстрой пробки крови и поместите рядом с установкой.
- Поместите несколько слоев бумажного полотенца на подставку для пайки и первую капиллярную трубку в зажим, расположив ее рядом с тем местом, где будет удерживаться хвостовой конец мыши, и держите его параллельно поверхности стола. Имейте под рукой лезвие бритвы.
- Чтобы собрать кровь, выполните следующие действия.
- В необходимое время выньте мышь из клетки и поместите под чашку так, чтобы ее хвост выходил из выемки у основания. С помощью свежего бритвенного лезвия отрежьте самый конец (1-2 мм) хвоста и соберите первую каплю крови в капиллярную трубку, прикрепленную к паяльнику.
- Окуните пальцы доминирующей руки в пищевое масло и используйте для сжатия от основания хвоста до кончика, направляя кончик хвоста к капиллярной трубке, чтобы собрать полученные капли крови. Продолжайте до тех пор, пока не будет собрано ~ 200 мкл крови.
- Наденьте небольшую торцевую крышку на конический конец капиллярной трубки перед верхней крышкой. Если сначала надеть верхнюю крышку, образец будет вытеснен из конического конца трубки. Поместите трубку в защитную внешнюю оболочку.
- Дайте свернуться на ночь при комнатной температуре. Охладите микроцентрифугу до 4 °C и спустите кровь, как указано на шаге 3.3.

Рисунок 1. График тестирования базовой иммунореактивности и спаривания девственных самок. Прикажите мышам прибыть в возрасте 7 недель и дайте им акклиматизироваться в течение 1 недели. Вводят животным 5 мг/кг поли(I:C) и через 2,5 ч берут кровь. Дайте крови свернуться в течение ночи, затем центрифугу при 3,768 x g, 4 ° C в течение 8 мин. Соберите сыворотку и оцените относительные уровни IL-6 с помощью ИФА или мультиплекса. В 9-недельном возрасте устанавливают брачные пары. Создано с использованием BioRender.com Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Весовой метод спаривания и гестационной инъекции Е12,5
ПРИМЕЧАНИЕ: На рисунке 2 показана схема шагов. Для создания спаривающихся пар и определения временной точки E12.5 можно использовать два метода. Первый, спаривание по времени, описан в другом месте22. Расчеты, основанные на весе, также могут быть использованы для оценки беременности E12.523. Преимущество этого подхода заключается в том, что он позволяет зафиксировать возраст матери при спаривании, уменьшая изменчивость иммунного ответа. Эта процедура используется здесь.
- Поместите самцов в чистые клетки и дайте им акклиматизироваться минимум 2 часа. Это снижает вероятность агрессии самки, так как самцы уже будут формировать доминирующий запах в клетке.
- Создайте размножающиеся пары с одним самцом и одной самкой, добавив самку в клетку самца. Перед тем, как поместить ее в клетку, взвесьте ее и запишите вес. Добавьте небольшую горсть семян подсолнечника в каждую клетку, чтобы повысить эффективность спаривания.
- Чтобы определить диапазон набора веса, выполните следующие действия.
- Получают тестовую группу самок и устанавливают брачные пары, записывая вес на момент спаривания.
- Когда самки начинают казаться явно беременными, взвесьте их и разделите на подгруппы по 8,5 г, 9,5 г, 10,5 г и 11,5 г набранного веса. У плодов E12.5 только начали развиваться отчетливые пальцы на лапах. Используйте морфологию плода, чтобы определить среднюю прибавку в весе для достижения E12,5.
- На 12 день после спаривания взвешивают самок и определяют привесы. В испытательном центре самки стабильно набирают 9,5-10,5 г с момента спаривания до E12,5. Вводят внутримышечно дозу солюбилизированного поли (I: C), определенную на шаге 2.3.2, когда прибавка в весе самки находится в пределах заданного диапазона.
- Наблюдайте за реакцией на MIA в плотинах, используя следующие параметры.
- Поведение при болезни: Соберите субъективные оценки по шкале от 1 до 3 для того, насколько активными становятся плотины в ответ на то, что с ними обращаются, где 1 - это небольшое движение или его отсутствие в ответ на обращение, а 3 - нормальная реакция на захват и ограничение. Животные с более сильным иммунным ответом проявляют меньшую устойчивость к обращению8.
- Лихорадочная реакция: Используя ИК-термометр, соберите температуру до инъекции и через 2,5 часа после инъекции. Животные с большей величиной иммунных реакций часто проявляют гипотермию в ответ на большую иммунную активность8.
- Изменение веса: взвешивание животных через 24 часа после инъекции. Животные с большей величиной иммунных реакций обычно теряют больше веса8.
- Измерьте гестационный уровень IL-6 следующим образом:8.
- Через 2,5 ч после инъекции соберите кровь предпочтительным методом. Дайте крови свернуться в течение ночи при комнатной температуре. Через 12-24 ч отжимают образцы крови в дозе 3,768 x g при 4 °C в течение 8 мин.
- Соберите сыворотку и храните при температуре -80 °C до анализа. Выделите сыворотку и измерьте уровень IL-6 с помощью ИФА или Luminex. Поддерживайте согласованность измерительных инструментов, поскольку существует значительная вариабельность общей концентрации, измеренной с помощью различных методов и производителей.
- Отдельно размещайте плотину после закачки с соответствующим обогащением, таким как гнезда и обогатительные устройства. Сохраняйте все обогащение последовательным, так как изменения в обогащении могут оказать значительное влияние на поведение грызунов 24,25,26,27,28,29.
- Время беременности у мышей C57 колеблется от 18,5 до 20,5 дней. Проведите проверку помета, чтобы определить, родились ли животные в этом диапазоне, чтобы убедиться, что инъекция была выполнена в правильный момент времени. При проверке подстилки старайтесь как можно меньше беспокоить клетку. Стресс сразу после рождения помета может увеличить риск каннибализации.
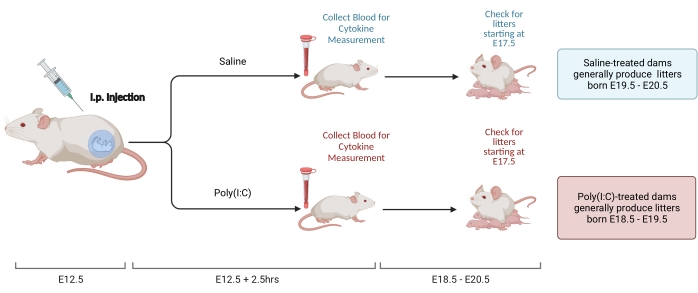
Рисунок 2. Индукция МВД. Индукция MIA требует оценки беременности, внутривенной инъекции поли (I: C) и проверки помета, чтобы обеспечить правильное время воспаления матери. После оценки гестационного дня либо с помощью спаривания по времени, либо с помощью метода набора веса, сделайте внутривенную инъекцию поли (I: C) в E12,5. Соберите образец крови через 2,5 ч после инъекции, чтобы подтвердить иммунную активацию и определить уровень активации IL-6. Пометы рождаются примерно в E18,5-E20,5. Создано с использованием BioRender.com Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Исследование изменений в поведении взрослого МИА и контрольного потомства (по желанию)
- Начиная с P60 и до проведения поведенческих тестов, акклиматизируйте животных к контакту с человеком с помощью бережного обращения в течение 1 минуты в день в течение 3 дней подряд. Убедитесь, что дни смены клетки не происходят в тот же день, когда проводятся поведенческие тесты.
- Всегда позволяйте мышам акклиматизироваться в комнате для тестирования в течение 30-60 минут перед началом поведенческих тестов. Используйте тускло освещенные (15-20 люкс) номера, чтобы свести к минимуму беспокойство.
- Для повторяющегося ухода помещайте мышей в одиночку в чистые клетки без подстилки с крышками. С помощью камеры запишите мышей в этих клетках в течение 20 минут. Первые 10 минут функционируют как период акклиматизации, последние 10 минут являются периодом тестирования.
- Используя сохраненные видео и секундомер, оцените совокупное время ухода за каждой мышью в течение 10-минутного тестового периода. Другие виды поведения, которые можно оценить из этих видео, включают вставание на дыбы (стояние на задних лапах), замораживание и прыжки8.
- Используйте другие распространенные тесты для модели MIA, такие как предимпульсное торможение (PPI) 14,30,31,32, открытое поле12,33,34, 3-камерный социальный подход 13,35,36, распознавание новых объектов37, y-лабиринт 30, приподнятый плюс лабиринт 33 и контекстно-сигнальная обусловливаниестраха 38.
- Послеродовое иммуноблоттинг8 (опционально)
- При P0 быстро обезглавливают и рассекают ткань мозга плода в HBSS, замораживают в жидком азоте и хранят при -80 ° C.
- Разрушайте образцы с помощью зондового ультразвукового аппарата с амплитудой 20% в течение 5 с в 2-кратном буфере Laemmli, затем денатурируйте при 85 ° C в течение 5 минут. Центрифужный лизат в концентрации 16 000 x g в течение 10 мин при комнатной температуре. Соберите надосадочную жидкость и храните при температуре -80 °C.
- Измерьте общее содержание белка с помощью коммерческого набора для анализа белка BCA, следуя инструкциям производителя, и используйте бычий сывороточный альбумин в качестве калибровочного стандарта.
- Добавляют дитиотреитол в качестве восстановителя в образцы в качестве конечной концентрации 100 мМ. Нагрейте до 85 °C в течение 2 минут перед загрузкой на гель.
- Запустите 5 мкг/полосу белка в условиях восстановления на 7,5% гелях TGS и электрофоретически перенесите на мембраны PVDF. Блокируют мембраны блокирующим буфером и инкубируют с выбранными антителами.
- Промыть три раза TBS + 0,05% Tween 20 и инкубировать мембраны в течение 45 мин с вторичными антителами, помеченными флуоресцентной меткой.
- Промойте еще четыре раза в TBS/Tween 20 и получите изображение. Стандартизируют результаты с помощью β-тубулина, выявляемого с помощью анти-β-тубулина.
Результаты
Не все животные, подвергшиеся воздействию 30 мг/кг поли(I:C) при E12.5, производят потомство с последовательными поведенческими отклонениями 8,31. Хотя и 30 мг/кг, и 40 мг/кг поли(I:C) надежно вызывают болезненное поведение у плотин, включая снижение уровня активност...
Обсуждение
Материнская инфекция изменяет ход развития мозга у людей, а также у грызунов и нечеловекообразных приматов 4,5,7. Здесь описана процедура индуцирования MIA у мышей в середине гестационного периода времени с использованием poly (I: C). Этот мет...
Раскрытие информации
У авторов нет конфликтов интересов, которые необходимо раскрывать.
Благодарности
Мы благодарим д-ра Мику Эстес за ее настойчивость в решении проблемы изменчивости в модели MIA мышей и всех участников Estes et al.8 за их работу, которая привела к разработке протокола методов, описанных здесь. Исследование, представленное здесь, было поддержано NIMH 2P50 MH106438-06 (A.K.M.) и NIMH T32MH112507 (K.P.).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
Ссылки
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3 (2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200 (2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997 (2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859 (2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37 (2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены