È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione di un modello riproducibile di attivazione immunitaria materna a metà gestazionale utilizzando poli (I: C) per studiare la suscettibilità e la resilienza nella prole
In questo articolo
Riepilogo
L'infezione materna è un fattore di rischio per i disturbi dello sviluppo neurologico. I modelli murini di attivazione immunitaria materna (MIA) possono chiarire l'impatto dell'infezione sullo sviluppo e sulla funzione del cervello. Qui vengono fornite linee guida generali e una procedura per produrre una prole resiliente e suscettibile esposta a MIA.
Abstract
L'attivazione immunitaria materna (MIA) durante la gravidanza è costantemente legata ad un aumentato rischio di disturbi dello sviluppo neurologico e neuropsichiatrico nella prole. I modelli animali di MIA sono utilizzati per testare la causalità, studiare i meccanismi e sviluppare diagnostica e trattamenti per questi disturbi. Nonostante il loro uso diffuso, molti modelli di MIA soffrono di una mancanza di riproducibilità e quasi tutti ignorano due aspetti importanti di questo fattore di rischio: (i) molti figli sono resilienti al MIA e (ii) la prole suscettibile può mostrare combinazioni distinte di fenotipi. Per aumentare la riproducibilità e modellare sia la suscettibilità che la resilienza alla MIA, l'immunoreattività basale (BIR) dei topi femmina prima della gravidanza viene utilizzata per prevedere quali gravidanze si tradurranno in prole resiliente o prole con anomalie comportamentali e molecolari definite dopo l'esposizione a MIA. Qui, viene fornito un metodo dettagliato per indurre MIA tramite iniezione intraperitoneale (i.p.) del poli(I:C) mimica virale a doppio filamento (dsRNA) a 12,5 giorni di gestazione. Questo metodo induce una risposta infiammatoria acuta nella madre, che si traduce in perturbazioni nello sviluppo del cervello nei topi che mappano domini influenzati in modo simile nei disturbi psichiatrici e dello sviluppo neurologico umano (NDD).
Introduzione
L'evidenza epidemiologica collega l'infezione materna ad un aumentato rischio di malattie psichiatriche e NDD, tra cui la schizofrenia (SZ) e il disturbo dello spettro autistico (ASD)1,2,3,4,5,6,7. Il modello murino MIA è stato sviluppato per testare la causalità e il ruolo meccanicistico del MIA nell'eziologia di questi disturbi, nonché per identificare biomarcatori molecolari esviluppare strumenti diagnostici e terapeutici 4,6. Nonostante l'utilità di questo modello e la sua crescente popolarità, vi è una notevole variabilità nei protocolli di induzione MIA all'interno del campo, rendendo difficile confrontare i risultati tra gli studi e replicare i risultati 8,9. Inoltre, la maggior parte delle iterazioni del modello non indaga due importanti aspetti traslazionali della MIA: (i) molti discendenti sono resilienti al MIA, e (ii) la prole suscettibile può mostrare combinazioni distinte di fenotipi8.
Per generare un modello MIA riproducibile, i ricercatori dovrebbero riportare almeno una misura quantitativa dell'entità del MIA indotto nelle dighe. Per indurre MIA durante la gestazione, il nostro laboratorio esegue iniezioni intraperitoneali (i.p.) del poliinositico mimica virale dell'RNA a doppio filamento: acido policitidilico [poli(I:C)]. Il poli(I:C) induce una cascata immunitaria simile ai virus influenzali in quanto riconosciuto dal recettore toll-like 3 (TLR3)10. Di conseguenza, il poli (I: C) attiva la risposta di fase acuta che si traduce in un rapido aumento delle citochine proinfiammatorie 8,11,12. Studi precedenti hanno dimostrato che l'elevazione delle citochine proinfiammatorie, inclusa l'interleuchina-6 (IL-6), è necessaria per produrre anomalie comportamentali e neuropatologia nella prole a seguito di MIA11,12,13. Pertanto, il livello di IL-6 nel siero materno raccolto durante il suo picco a 2,5 ore dopo l'iniezione di poli (I: C) è una misura quantitativa convincente di MIA che può essere utilizzata per confrontare i risultati tra i laboratori all'interno del campo.
Al fine di generare un modello MIA che affronti gli elementi traslazionalmente essenziali di resilienza e suscettibilità con un singolo protocollo di induzione 8,14, i ricercatori possono combinare approcci tipici di induzione con la caratterizzazione dell'immunoreattività basale (BIR) della madre prima della gravidanza8. Recentemente, è stato scoperto che topi C57BL / 6 femmine vergini mostrano una vasta gamma di risposte IL-6 a un'esposizione a basse dosi di poli (I: C) prima della gravidanza8. È solo un sottogruppo di queste femmine che continua a produrre prole suscettibile, e solo a certe grandezze di attivazione immunitaria come dettato dalla combinazione di BIR e poli (I: C) dose8. La MIA induce fenotipi in un pattern a U invertito; La prole mostra le maggiori aberrazioni comportamentali e molecolari quando le madri sono moderatamente immunoreattive e l'entità dell'infiammazione materna raggiunge, ma non supera, un intervallo critico8. Qui, viene fornito un metodo dettagliato su come creare in modo affidabile sia la prole resiliente che suscettibile con fenotipi comportamentali divergenti a seguito dell'iniezione gestazionale di poli (I: C).
Protocollo
Tutti i protocolli sono eseguiti sotto l'approvazione dell'Università della California-Davis Institutional Animal Care and Use Committee (IACUC).
1. Preparazione degli animali
- Quando si acquisiscono animali, mantenere coerenti i seguenti parametri per garantire la massima riproducibilità.
- Fornitore e posizione del fornitore: come riportato in precedenza, i topi selvatici C57BL / 6J mostrano risposte diverse alla stessa dose di poli (I: C) a seconda del fornitore8. Scegli un fornitore e un ceppo di mouse che mostrino una risposta coerente. Per gli esperimenti qui, i topi C57BL / 6 ottenuti da Charles River hanno mostrato cambiamenti coerenti nel comportamento dopo l'esposizione a MIA a metà gestazione, mentre quelli acquistati da Taconic mostrano una risposta di magnitudo maggiore, con alcune differenze tra i gruppi di trattamento rispetto ai topi Charles River8.
- Ceppo: i topi C57BL / 6J sono i più comunemente utilizzati, ma i topi BTBR e altri ceppi mostrano risposte differenziali al MIA9 a metà gestazione. Si noti queste risposte differenziali, in quanto migliorano la riproducibilità del metodo e possono essere una potenziale variabile nel contribuire agli esiti differenziali nella prole.
- Per garantire una variabilità minima, utilizzare solo femmine vergini per gli studi MIA8 e annotare chiaramente i dettagli nei metodi.
- Età al momento della spedizione e periodo di acclimatazione: i topi spediti prima delle 7 settimane mostrano sistemi endocrini disregolati15. Permettere agli animali di acclimatarsi per un minimo di 48 h16,17. Ordinare i topi da spedire a 7 settimane (± 2 giorni) e iniettare per BIR a 8 settimane (± 2 giorni).
- Età all'accoppiamento: il sistema immunitario degli animali è dinamico nel corso della loro vita. Fare attenzione a ridurre al minimo la variabilità mantenendo l'età all'accoppiamento/iniezione il più coerente possibile18,19,20. Mate femmine di topi a 9 settimane (± 2 giorni). Non usare maschi di età superiore ai 6 mesi per l'accoppiamento.
2. Test e preparazione del lotto di poli (I: C)
- Preparare poli ad alto peso molecolare (I:C) come descritto di seguito.
- Tubi da microcentrifuga da 1,5 mL per autoclave per lo stoccaggio. Il poli(I:C) risospeso può essere conservato a -20 °C, ma ripetuti disgeli congelati possono influire sulla potenza. Riscaldare il bagno d'acqua a 70 °C.
- Utilizzando una tecnica sterile, aggiungere 10 ml di soluzione fisiologica sterile (NaCl 0,9%) al poli(I:C) liofilizzato utilizzando una siringa. Riscaldare a bagnomaria a 70 °C per 15 minuti per consentire la piena ricottura. Rimuovere e lasciare raffreddare a temperatura ambiente.
- In una cappa sterile, aggiungere altri 40 ml di soluzione salina fisiologica al flacone e capovolgere più volte per mescolare. Rimuovere la parte superiore del flacone di poli (I:C) o utilizzare una siringa per aliquote in provette da microcentrifuga da 1,5 ml. Conservare a -20 °C.
- Preparare poli(I:C) a peso molecolare misto come descritto di seguito.
- Tubi da microcentrifuga da 1,5 mL per autoclave per lo stoccaggio. Il poli(I:C) risospeso può essere conservato a -20 °C, ma ripetuti disgeli congelati possono influire sulla potenza. Impostare il bagnomaria a 50 °C.
- Utilizzando una tecnica sterile, aggiungere 10 ml di NaCl sterile allo 0,9% al poli(I:C) liofilizzato e fissare il coperchio. Riscaldare a bagnomaria a 50 °C per 25 minuti per consentire la piena ricottura. Rimuovere e lasciare raffreddare a temperatura ambiente.
- Con tecnica sterile, aliquote in provette da microcentrifuga da 1,5 mL e conservare a -20 °C.
- Somministrare poli(I:C) attraverso iniezioni intraperitoneali (i.p.) come descritto di seguito.
- Pesare il mouse per determinare il dosaggio accurato. Utilizzando un ago da insulina da 0,5 cc, disegnare poli (I: C) risospeso. Collottola e capovolgere in modo che l'addome sia esposto.
- Usando l'altra mano, inserire l'ago ad una profondità di circa 0,5 cm tra i due capezzoli anteriori con un angolo di circa 45°.
- Prelevare per determinare che sangue o urina non entra nella siringa prima dell'iniezione. Se si verifica uno dei due casi, riposizionare l'ago e riprovare. Iniettare lentamente. Se il poli(I:C) bolle, l'iniezione era probabilmente sottocutanea. Un posizionamento corretto dell'iniezione comporterà che non venga estratto nulla una volta inserito l'ago e nessuna perdita una volta rimosso.
- Testare la potenza del lotto di poli (I:C) MMW come descritto di seguito8.
- Ottenere la forma desiderata di poli (I: C). Alcuni produttori consentiranno ai ricercatori di bloccare un lotto completo o parziale mentre la potenza viene testata in modo che più bottiglie possano essere ottenute in seguito contemporaneamente. Tipicamente, questi possono essere conservati liofilizzati a -20 °C per diversi anni se si evita il gelo-disgelo.
- Ottenere o allevare 30 madri gravide per i test. A E12.5, eseguire iniezioni i.p. di 20, 30 e 40 mg / kg in un minimo di 10 topi per dose.
- A 2,5 ore dopo l'iniezione, raccogliere il sangue tramite sanguinamento della coda. Si noti che il sangue periferico e il sangue del tronco possono differire nei livelli di citochine, quindi mantenere il metodo di raccolta coerente all'interno di uno studio.
- Lasciare coagulare il sangue durante la notte a temperatura ambiente. Dopo 12-24 ore, centrifugare i campioni di sangue a 3.768 x g a 4 °C per 8 minuti. Raccogliere il siero e conservare a -80 °C fino all'analisi.
- Isolare il siero e misurare i livelli di IL-6 tramite ELISA o Luminex. Mantenere coerenti gli strumenti di misurazione in quanto vi è una significativa variabilità nella concentrazione totale misurata con diverse modalità e produttori. Determinare l'entità della risposta IL-6 necessaria per indurre fenotipi utilizzando una coorte pilota.
3. Test di immunoreattività al basale (BIR)
Nota : la Figura 1 mostra lo schema dei passaggi. Utilizzare un diverso peso molecolare poli (I: C) per il test BIR rispetto a gestazionale per ridurre la probabilità di risposte immunitarie adattative al composto.
- Ordina topi femmina vergini da spedire a 7 settimane di età. All'arrivo, raggruppa e ospita da quattro a cinque topi in una gabbia e mantieni il gruppo alloggiato fino all'accoppiamento. Utilizzare la tacca auricolare o qualsiasi altro sistema di identificazione.
- Iniettare le femmine per via intraperitoneale con 5 mg/kg di poli (I:C) 1 settimana dopo l'arrivo. A 2,5 ore dopo l'iniezione, quando l'IL-6 circolante è più alta6, raccogliere sangue intero dagli animali iniettati tramite tail snip.
- Lasciare coagulare il sangue durante la notte a temperatura ambiente. Dopo 12-24 ore, centrifugare i campioni di sangue a 3.768 x g a 4 °C per 8 minuti.
- Raccogliere un minimo di 32 μL di siero da ciascun campione. Congelare a -80 °C fino al momento di testare le citochine. Per misurare i livelli di IL-6 in modo più coerente, utilizzare un test multiplex come Luminex. Mantenere coerenti gli strumenti di misurazione in quanto vi è una significativa variabilità nella concentrazione totale misurata con diverse modalità e produttori.
- Per il protocollo di analisi Luminex, fare riferimento a Bruce et al.21.
- Utilizzando i livelli relativi di IL-6, dividere gli animali in gruppi BIR basso (quartile inferiore), medio (due quartili centrali) e alto (quartile più alto).
4. Metodo di sanguinamento della coda per la raccolta del sangue
NOTA: Per evitare l'uso di sedativi potenzialmente immunomodulatori, utilizzare il metodo di sanguinamento della coda per la raccolta del sangue.
- Per installare, posizionare un supporto di saldatura e una tazza di ritenuta su una superficie sul lato della mano non dominante. In una capsula di Petri da 35 mm, aggiungere 1-2 ml di olio commestibile alimentare. Rimuovere il cappuccio dal tappo di sangue rapido e posizionarlo vicino alla configurazione.
- Posizionare alcuni strati di tovagliolo di carta sul supporto di saldatura e sul primo tubo capillare in una clip, posizionandolo vicino a dove verrà tenuta la punta della coda del mouse e tenuto parallelo alla superficie del tavolo. Avere una lama di rasoio a portata di mano.
- Per raccogliere il sangue, eseguire i seguenti passaggi.
- Al momento richiesto, rimuovere il mouse dalla gabbia e posizionarlo sotto la tazza con la coda che esce dalla tacca alla base. Utilizzando una nuova lama di rasoio, tagliare l'estremità (1-2 mm) della coda e raccogliere la prima goccia di sangue nel tubo capillare agganciato al supporto di saldatura.
- Immergere le dita della mano dominante nell'olio commestibile e utilizzare per spremere dalla base della coda alla punta, guidando la punta della coda al tubo capillare per raccogliere le gocce di sangue risultanti. Continuare fino a ~200 μL di sangue è stato raccolto.
- Mettere un piccolo tappo terminale sull'estremità affusolata del tubo capillare prima del tappo superiore. Se il tappo superiore viene applicato per primo, il campione verrà espulso dall'estremità affusolata del tubo. Mettere il tubo nel guscio esterno protettivo.
- Lasciare coagulare per una notte a temperatura ambiente. Raffreddare una microcentrifuga a 4 °C e centrifugare il sangue come indicato al punto 3.3.

Figura 1. La tempistica per testare l'immunoreattività e l'accoppiamento di base delle femmine vergini. Ordina ai topi di arrivare a 7 settimane e consentire di acclimatarsi alla struttura per 1 settimana. Iniettare agli animali 5 mg/kg di poli (I:C) e 2,5 ore dopo prelevare il sangue. Lasciare coagulare il sangue durante la notte, quindi centrifugare a 3.768 x g, 4 °C per 8 minuti. Raccogliere il siero e valutare i livelli relativi di IL-6 tramite ELISA o Multiplex. A 9 settimane, imposta coppie di accoppiamento. Creato utilizzando BioRender.com Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Metodo basato sul peso per l'accoppiamento e l'iniezione gestazionale di E12.5
Nota : la Figura 2 mostra lo schema dei passaggi. È possibile utilizzare due metodi per impostare coppie di accoppiamento e determinare il punto temporale E12.5. Il primo, l'accoppiamento a tempo, è descritto altrove22. I calcoli basati sul peso possono anche essere utilizzati per valutare una gravidanza E12.523. Il vantaggio di questo approccio è che consente il blocco temporale dell'età della diga all'accoppiamento, diminuendo la variabilità della risposta immunitaria. Questa procedura viene utilizzata qui.
- Metti i maschi in gabbie pulite e lascia che si acclimatino per un minimo di 2 ore. Ciò diminuisce la probabilità di aggressione femminile poiché i maschi formeranno già un profumo dominante nella gabbia.
- Crea coppie riproduttive di un singolo maschio e di una singola femmina aggiungendo la femmina alla gabbia del maschio. Prima di metterla nella gabbia, pesarla e registrare il peso. Aggiungi una piccola manciata di semi di girasole a ciascuna gabbia per aumentare l'efficienza dell'accoppiamento.
- Per determinare l'intervallo di aumento di peso, attenersi alla seguente procedura.
- Ottieni un gruppo di prova di femmine e imposta coppie di accoppiamento, registrando il peso al momento dell'accoppiamento.
- Quando le femmine iniziano ad apparire visibilmente incinte, pesarle e dividerle in sottogruppi di 8,5 g, 9,5 g, 10,5 g e 11,5 g di peso guadagnato. I feti a E12.5 hanno appena iniziato a sviluppare cifre distinte nelle loro zampe. Utilizzare la morfologia fetale per determinare l'aumento di peso medio per raggiungere E12.5.
- A 12 giorni dopo l'accoppiamento, pesare le femmine e determinare l'aumento di peso. In una struttura di prova, le femmine guadagnano costantemente 9,5-10,5 g dal momento dell'accoppiamento a E12,5. Iniettare tramite i.p. la dose di poli(I:C) solubilizzato determinata al punto 2.3.2 quando l'aumento di peso della femmina rientra nell'intervallo predeterminato.
- Osservare la risposta al MIA nelle dighe utilizzando i seguenti parametri.
- Comportamento di malattia: raccogliere punteggi soggettivi su una scala da 1 a 3 per come le dighe diventano attive in risposta all'essere gestite, dove 1 è poco o nessun movimento in risposta all'essere maneggiato e 3 è una risposta normale alla cattura e alla contenzione. Gli animali con maggiori risposte immunitarie mostreranno meno resistenza alla manipolazione8.
- Risposta febbrile: utilizzando un termometro IR, raccogliere le temperature pre-iniezione e 2,5 ore dopo l'iniezione. Gli animali con risposte immunitarie di maggiore entità spesso mostrano ipotermia in risposta a una maggiore attività immunitaria8.
- Variazione di peso: pesare gli animali a 24 ore dopo l'iniezione. Gli animali con risposte immunitarie di maggiore entità generalmente perdono più peso8.
- Misurare i livelli gestazionali di IL-6 come segue8.
- A 2,5 ore dopo l'iniezione, raccogliere il sangue con il metodo preferito. Lasciare coagulare il sangue durante la notte a temperatura ambiente. Dopo 12-24 ore, centrifugare i campioni di sangue a 3.768 x g a 4 °C per 8 minuti.
- Raccogliere il siero e conservare a -80 °C fino all'analisi. Isolare il siero e misurare i livelli di IL-6 tramite ELISA o Luminex. Mantenere coerenti gli strumenti di misurazione in quanto vi è una significativa variabilità nella concentrazione totale misurata con diverse modalità e produttori.
- Ospitare singolarmente la diga dopo l'iniezione con un arricchimento appropriato come nidi e dispositivi di arricchimento. Mantenere tutto l'arricchimento coerente in quanto le alterazioni nell'arricchimento possono avere impatti significativi sul comportamento dei roditori 24,25,26,27,28,29.
- Il tempo di gestazione per i topi C57 varia da 18,5 a 20,5 giorni. Eseguire controlli della lettiera per determinare se gli animali sono nati all'interno di questo intervallo per garantire che l'iniezione sia stata eseguita nel momento corretto. Quando si controlla la presenza di cucciolate, disturbare la gabbia il meno possibile. Lo stress immediatamente dopo la nascita della cucciolata può aumentare il rischio di cannibalizzazione.
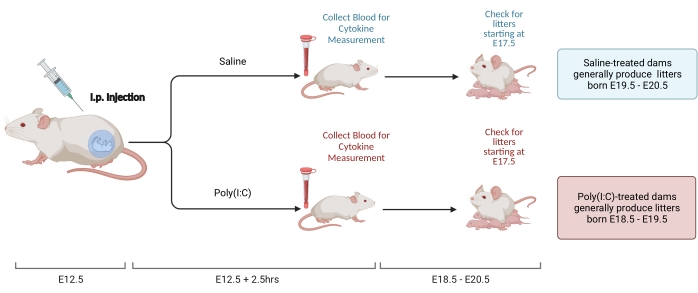
Figura 2. Induzione MIA. L'induzione MIA richiede la valutazione della gravidanza, l'iniezione i.p. di poli (I: C) e controlli della cucciolata per garantire la corretta tempistica dell'infiammazione materna. Dopo aver valutato il giorno gestazionale tramite accoppiamento temporizzato o il metodo di aumento di peso, somministrare un'iniezione i.p. di poli (I: C) a E12.5. Raccogliere un campione di sangue a 2,5 ore dopo l'iniezione per confermare l'attivazione immunitaria e determinare il livello di attivazione di IL-6. Le cucciolate nasceranno approssimativamente a E18.5-E20.5. Creato utilizzando BioRender.com Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Studio delle alterazioni nel comportamento nella MIA adulta e nella prole di controllo (opzionale)
- A partire da P60 e prima di condurre test comportamentali, acclimatare gli animali al contatto umano con una manipolazione delicata per 1 minuto al giorno per 3 giorni consecutivi. Assicurati che i giorni di cambio della gabbia non si verifichino lo stesso giorno in cui vengono eseguiti i test comportamentali.
- Consentire sempre ai topi di acclimatarsi alla sala test per 30-60 minuti prima di iniziare i test comportamentali. Utilizzare camere scarsamente illuminate (15-20 lux) per ridurre al minimo l'ansia.
- Per la toelettatura ripetitiva, metti i topi da soli in gabbie pulite e prive di biancheria da letto con coperchi. Utilizzando una fotocamera, registrare i topi in queste gabbie per 20 minuti. I primi 10 minuti funzionano come periodo di acclimatazione, gli ultimi 10 minuti sono il periodo di prova.
- Utilizzando i video salvati e un cronometro, calcola il tempo di toelettatura cumulativo per ciascun mouse durante il periodo di test di 10 minuti. Altri comportamenti che possono essere valutati da questi video includono l'allevamento (in piedi sulle zampe posteriori), il congelamento e il salto8.
- Utilizzare altri test comuni per il modello MIA come l'inibizione prepulsuale (PPI) 14,30,31,32, campo aperto12,33,34, approccio sociale a 3 camere 13,35,36, riconoscimento di nuovi oggetti37, y-maze30, elevato più labirinto33 e condizionamento della paura del contesto / cued 38.
- Immunoblotting postnatale8 (opzionale)
- A P0, decapitare rapidamente e sezionare il tessuto cerebrale fetale in HBSS, congelare in azoto liquido e conservare a -80 °C.
- Interrompere i campioni utilizzando un sonicatore a sonda con un'ampiezza del 20% per 5 s in 2x tampone Laemmli, quindi denaturare a 85 °C per 5 minuti. Lisato di centrifuga a 16.000 x g per 10 minuti a temperatura ambiente. Raccogliere il surnatante e conservare a -80 °C.
- Misurare il contenuto proteico totale utilizzando un kit commerciale di dosaggio delle proteine BCA, seguendo le istruzioni del produttore, e utilizzare l'albumina sierica bovina come standard di calibrazione.
- Aggiungere ditiotreitolo come agente riducente ai campioni come concentrazione finale di 100 mM. Riscaldare a 85 °C per 2 minuti prima di caricare su un gel.
- Eseguire 5 μg/corsia di proteine in condizioni riducenti su gel TGS al 7,5% e trasferire elettroforeticamente su membrane PVDF. Bloccare le membrane con tampone bloccante e incubare con anticorpi scelti.
- Lavare tre volte con TBS + 0,05% Tween 20 e incubare le membrane per 45 minuti con anticorpi secondari marcati con fluorescenza.
- Lavare altre quattro volte in TBS/Tween 20 e ottenere risultati dell'immagine. Standardizzare i risultati utilizzando β-tubulina, rilevata utilizzando anti-β-tubulina.
Risultati
Non tutti gli animali esposti a 30 mg/kg di poli (I:C) a E12.5 producono prole con anomalie comportamentali costanti 8,31. Sebbene sia 30 mg / kg che 40 mg / kg di poli (I: C) producano in modo affidabile comportamenti di malattia nelle dighe, tra cui diminuzione dei livelli di attività, risposte ipotermiche e perdita di peso, e causino anche aumenti significativi di IL-6, solo un sottogruppo di cucciolate esposte a MIA continuerà a sviluppare anomalie comporta...
Discussione
L'infezione materna altera il corso dello sviluppo cerebrale nell'uomo e sia nei roditori che nei primati non umani 4,5,7. Qui, viene delineata una procedura per indurre MIA nei topi a metà gestazione usando poli (I: C). Questo metodo incorpora la valutazione del BIR prima della gravidanza, che aumenta la riproducibilità e offre la possibilità di studiare meccanicamente i meccanismi che portano alla resilienza e alla suscetti...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Ringraziamo la dott.ssa Myka Estes per la sua persistenza nell'affrontare la variabilità nel modello MIA murino e tutti i contributori in Estes et al.8 per il loro lavoro che ha portato allo sviluppo del protocollo dei metodi qui descritti. La ricerca qui riportata è stata supportata da NIMH 2P50 MH106438-06 (A.K.M.) e NIMH T32MH112507 (K.P.).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
Riferimenti
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3 (2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200 (2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997 (2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859 (2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37 (2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon