Method Article
مراقبة التألق العميق في براعم الأرز عبر تقنية المقاصة
In This Article
Summary
يصف هذا البروتوكول تقنية تطهير لبراعم الأرز ، والتي يصعب إعدادها للملاحظات الهيكلية الداخلية بسبب الطبيعة الصلبة أو السميكة أو الطبقات للأنسجة. تسهل هذه الطريقة ملاحظات التألق المستمرة والعميقة ، حتى في نباتات الأرز البالغة.
Abstract
جعلت تقنية المقاصة التي تم تطويرها مؤخرا والتي تقضي على عدم تطابق معامل الانكسار وتقلل من المواد الفلورية التلقائية من الممكن مراقبة الأنسجة النباتية في ثلاثة أبعاد (3D) مع الحفاظ على هياكلها الداخلية. في الأرز (Oryza sativa L.) ، وهو نبات نموذجي أحادي ومحصول مهم عالميا ، تم الإبلاغ عن تكنولوجيا التطهير في الأعضاء التي يسهل ملاحظتها نسبيا ، مثل الجذور والأوراق. كما تم الإبلاغ عن تطبيقات تكنولوجيا المقاصة في الميرستيم القمي (SAM) والسيقان ، ولكن بدرجة محدودة فقط بسبب ضعف تغلغل محلول المقاصة (CS) في هذه الأنسجة. تعزى الكفاءة المحدودة لحلول التطهير في هذه الأنسجة إلى التألق التلقائي ، وسماكة ، وتصلب الأنسجة في الجذع مع تطور حزم الأوعية الدموية والبشرة وطبقات SAM بأوراق طاردة للماء. يقدم هذا البروتوكول تقارير عن تحسين نهج المقاصة للمراقبة المستمرة و 3D للتعبير الجيني من SAM / الذعر الشاب إلى قاعدة البراعم أثناء التطوير. تم تقليم عينات الأنسجة الثابتة التي تعبر عن مراسل البروتين الفلوري إلى أقسام باستخدام قطاعة دقيقة تهتز. عندما تم تحقيق سمك مناسب ، تم تطبيق CS. من خلال استهداف الأنسجة المركزية على وجه التحديد ، زاد معدل اختراق وتوحيد CS ، وانخفض الوقت اللازم لجعل الأنسجة شفافة. بالإضافة إلى ذلك ، مكن مسح الأقسام المشذبة من مراقبة البنية الداخلية للتصوير بأكمله من منظور ماكرو. هذه الطريقة لها تطبيقات محتملة في التصوير العميق لأنسجة الأنواع النباتية الأخرى التي يصعب إزالتها.
Introduction
جعلت تقنية المقاصة التي تم تطويرها مؤخرا من الممكن مراقبة الأنسجة العميقة للنباتات مع الحفاظ على هيكلها الداخلي1،2،3. في مصنع نموذج الديكوت Arabidopsis ، أجريت العديد من الدراسات حول تصوير البروتين الفلوري باستخدام تقنية المقاصة للقضاء على عدم تطابق مؤشر الانكسار وإزالة المواد الفلورية التلقائية4،5،6. على الرغم من أنه تم الإبلاغ عن استخدام تقنية المقاصة7،8 والتصوير ثلاثي الأبعاد بدقة خلوية9 في الأرز (Oryza sativa L.) ، وهو نبات نموذجي أحادي ومحصول مهم عالميا ، إلا أنها تقتصر على الأعضاء الرقيقة والناعمة نسبيا ، مثل الجذور والأوراق و meristem القمي (SAM) ، والتي يسهل ملاحظتها.
تبادل لاطلاق النار هو العضو الرئيسي الذي يشكل الأجزاء فوق سطح الأرض من النباتات الوعائية. في الأرز ، تتكون البراعم من سلسلة من "phytomers" المكدسة عموديا ، والتي تضم براعم الإبط والأوراق والجذع10. عند طرف اللقطة ، يتكون SAM من خلايا جذعية غير متمايزة في المركز. تتشكل Phytomers من خلال تمايز الخلايا المشتقة من SAM. بعد أن تتحول النباتات من المرحلة الخضرية إلى المرحلة التناسلية ، تستطيل سيقان الأرز وتتمايز SAM إلى عناقيد شابة10. ويرافق هذا التغيير التنموي تقلبات في التعبير عن جينات مختلفة في السيقان و SAM / العناقيد الصغيرة. لفهم الآليات الكامنة وراء تمايز الخلايا إلى أنسجة مختلفة ، من المهم مراقبة مورفولوجيا الخلية والتعبير الجيني هيكليا في أنسجة البراعم الداخلية. ومع ذلك ، فإن التصوير العميق للسيقان (العقد والعقد الداخلية) في التصوير يمثل تحديا بسبب عدم كفاءة حلول التطهير لاختراق الأنسجة. تخضع السيقان على الفور لزيادة سريعة في الحجم من النمو الجانبي بعد التمايز عن SAM. إن تصلب أنسجة عقدة الأرز بسبب سماكة حزم الأوعية الدموية والرابط الأفقي المعقد لمفاغرة الأوعية الدموية العقدية ، بالإضافة إلى الصد العالي لبراعم الأرز ، كلها تساهم في الحد من تغلغل CS في السيقان10.
هدفت هذه الدراسة إلى ملاحظة التغيرات في التعبير الجيني في أنسجة براعم الأرز باستخدام تقنية التألق العميق الهيكلي. يعمل هذا العمل على تحسين بروتوكول تطهير للأرز لمراقبة التعبير الجيني باستمرار من SAM / الذعر الصغير إلى القاعدة في بنية 3D ، بدلا من السطح المستوي ، باستخدام مجهر ليزر متحد البؤرة.
Protocol
1. إعداد الحل المثبت
- انقل 70 مل من الماء المعقم إلى زجاجة زجاجية وأضف 10 غرام من بارافورمالدهيد (PFA).
تحذير: PFA سامة. وبالتالي ، يوصى بارتداء القفازات. - أضف 2 مل من 1 N NaOH لإذابة محلول PFA.
- قم بإذابة محلول PFA مع التحريك المستمر (300-500 دورة في الدقيقة) عند 60 درجة مئوية لمدة 1 ساعة تقريبا حتى يصبح محلول PFA شفافا.
- أضف الماء المعقم لزيادة حجم محلول PFA إلى 100 مل.
ملاحظة: تم تحضير محلول PFA طازجا قبل الاستخدام. علاوة على ذلك ، يمكن استخدام محلول PFA المخزن عند 4 درجات مئوية لمدة 2 أشهر تقريبا. - مباشرة قبل أخذ العينات، أضف 25 مل من 60 مللي متر HEPES (الرقم الهيدروجيني 7.4)، 3 مل من السكروز 1 متر، و 2 مل من الماء المعقم إلى 20 مل من 10٪ PFA لإعداد محلول تثبيت 50 مل.
2. إعداد حل المقاصة (CS)
- وزن وخلط 7.5 غرام من ديوكسيكولات الصوديوم ، 5 غرام من إكسيليتول ، و 12.5 غرام من اليوريا (انظر جدول المواد) في 50 مل من الماء المعقم.
ملاحظة: تم وزن مسحوق ديوكسيكولات الصوديوم في غرفة مسودة المختبر العام لمنع التشتت المحمول جوا. - قم بإذابة المكونات (الخطوة 2.1) باستخدام مقلي مغناطيسي لإعداد CS.
ملاحظة: استخدمت هذه الدراسة حل المقاصة المعد داخليا (CS) ، ولكن يمكن أيضا استخدام حل مقاصة متاح تجاريا ، ClearSee (انظر جدول المواد). - انقل CS إلى أنبوب مخروطي سعة 50 مل وقم بتخزينه في درجة حرارة الغرفة (15-30 درجة مئوية) في الظلام.
ملاحظة: يمكن تخزين CS لأكثر من 1 سنة.
3. أخذ العينات
- قطع الجذور بعناية دون الإضرار بالنباتات. اغسل النباتات بالماء لإزالة الأوساخ.
ملاحظة: درست هذه الطريقة مراقبة الأنسجة من مرحلة الأوراق الثلاث (LS) لوضع علامة LS. استخدمت الدراسة الحالية أصناف الأرز Nipponbare (Nip) و Taichung 65 (T65) في 8-10 LS. - قشر الأوراق الخارجية القديمة باليدين والملقط. كان هناك حوالي 2-3 أوراق متبقية.
- قم بقطع الأنسجة من ذعر SAM / الشباب إلى القاعدة باستخدام ماكينة حلاقة ذات حافة واحدة باستخدام حركة منزلقة لتجنب سحق الخلايا (الشكل 1A-C). إذا كان موضع SAM / الذعر الشاب غير مرئي ، فقم بقصه لفترة أطول.
- نظرا لأن المقطع العرضي للقطة الأرز له شكل بيضاوي (الشكل 1D) ، فقم بحلق جانب واحد من البيضاوي بشكل رقيق في اتجاه محوره الطويل باستخدام ماكينة حلاقة ذات حدين (الشكل 1E-F).
ملاحظة: سهلت هذه الخطوة على الحل المثبت اختراق العينة. يسهل سطح القطع الأفقي الالتصاق بالعينة بدرج قطاعة صغيرة تهتز (انظر جدول المواد). - تأكد من موضع الذعر سام / الشباب من خلال ظهور لون أبيض في العينة (الشكل 1G). تقليم الأنسجة الزائدة.
ملاحظة: يجب ضبط طول العينة إلى الحد الأقصى للطول الذي يمكن قصه باستخدام مقسمات طرق صغيرة تهتز. إذا كانت العينة طويلة جدا ، فقم بتقسيمها إلى عدة قطع.
4. تثبيت العينات
- ماصة 1 مل من المحلول المثبت (أعدت في الخطوة 1.) إلى أنبوب 1.5 مل من أجهزة الطرد المركزي الدقيقة ووضعها على الفور في العينات.
ملاحظة: تأكد من أن كمية العينة لا تتجاوز 20٪ من حجم المحلول المثبت. - قطع قطعة من فيلم البارافين إلى 2.5 سم2. شكل فيلم البارافين إلى كرات وضعها فوق العينات لمنعها من الطفو خارج المحلول المثبت.
- ضع الأنبوب الذي يحتوي على العينة في مجفف. ثم أغلق غطاء المجفف وابدأ تشغيل مضخة التفريغ لتخفيف الضغط من داخل المجفف حتى -0.095 ميجا باسكال ببطء.
- بعد إغلاق المجفف عند -0.095 ميجا باسكال ، قم بإيقاف تشغيل مضخة التفريغ واتركها تقف لمدة 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: كان مستوى الفراغ بحيث ظهرت الفقاعات تدريجيا في العينات. - افتح المجفف قليلا وأعده ببطء إلى الضغط الجوي. قلل ضغط المجفف إلى -0.095 ميجا باسكال ، وأطفئ مضخة التفريغ ، واترك الخليط يقف لمدة 30 دقيقة في درجة حرارة الغرفة.
- افتح المجفف قليلا وأعده ببطء إلى الضغط الجوي. إذا تم إصلاح العينة بشكل صحيح ، فإنها تغرق في الحل المثبت. إذا لم تغرق ، قلل الضغط مرة أخرى.
- قم بإزالة فيلم البارافين ، وأغلق الغطاء ، واحتفظ بالأنابيب طوال الليل عند 4 درجات مئوية.
ملاحظة: تم تثبيت العينات في محلول مثبت لمدة 2 ساعة على الأقل. يمكن تخزينه لمدة ~ 1 أسبوع.
5. تقليم العينة الثابتة
- قم بإزالة محلول التثبيت الزائد من العينة باستخدام مناديل خالية من الوبر.
ملاحظة: يمنع محلول التثبيت الزائد العينة من الالتصاق بشكل صحيح على الدرج. - قم بإصلاح العينة على درج تقطيع دقيق يهتز باستخدام الغراء الفوري. ضعه على صينية مع الجانب المسطح لأسفل ، والذي تم حلقه أثناء أخذ العينات.
ملاحظة: نظرا لهيكل تبادل لاطلاق النار الأرز، يجب تقليمه من القاعدة نحو سام / الشباب الذعر. - اضبط شروط التشذيب وفقا للعينة الثابتة.
ملاحظة: في هذه الدراسة ، تم تعيين التشذيب إلى سميكة ، 130 ميكرومتر. عريضة ، 15 مم ؛ التردد ، 15 ٪ ؛ وسرعة القطع ، 32 ملم. - اضبط موضع العينة باستخدام الزر RVS أو FWD والزر UP أو DOWN . املأ الدرج بالماء منزوع الأيونات حتى يتم غمر جميع العينات. بعد ملء الدرج، اضغط على الزر ابدأ ( START ) . ضع العينات المشذبة على شريحة زجاجية مع قطرة 1x PBS.
ملاحظة: قم بتحويل موضع العينة إلى الجانب الآخر بعد كل عملية تشذيب لأن العينة الصلبة ترتدي شفرة الحلاقة. - بعد فحص العينة التي تحتوي على الموقع المستهدف تحت المجهر المجسم، انقل العينة المشذبة إلى صفيحة متعددة الآبار مع 1 مل من 1x PBS.
ملاحظة: اختر عدد الآبار وفقا لحجم العينة. في هذه الدراسة ، تم استخدام لوحة 12-multiwell.
6. العلاج بمحلول المقاصة
- قم بإزالة 1x PBS من لوحة multiwell وأضف 1x PBS طازجة. دعها تقف لمدة 1 دقيقة.
- إزالة 1x PBS وإضافة CS.
ملاحظة: يجب أن يكون مقدار CS خمسة أضعاف حجم العينة. - ضع الصفيحة متعددة الآبار التي تحتوي على العينة في مجفف. ثم أغلق غطاء المجفف وابدأ تشغيل مضخة التفريغ لتخفيف الضغط من داخل المجفف حتى -0.09 ميجا باسكال ببطء.
- بعد إغلاق المجفف عند -0.09 ميجا باسكال ، قم بإيقاف تشغيل مضخة التفريغ واتركها تقف لمدة 1 ساعة في درجة حرارة الغرفة.
- افتح المجفف قليلا وأعده ببطء إلى الضغط الجوي.
- صب الماء منزوع الأيونات في الفجوة بين الآبار لمنع تبخر CS. تخزين لوحات الآبار المتعددة في درجة حرارة الغرفة في الظلام للتطهير.
ملاحظة: رج الصفيحة متعددة الآبار بلطف كل 1-2 أيام لنشر الكلوروفيل والمكونات الأخرى. - عندما يتحول CS إلى اللون الأخضر ، استبدله بمحلول جديد.
7. تلطيخ جدار الخلية مع صبغة كيميائية
- ضع محلول الكالكوفلور الأبيض (1 مل ، التركيز النهائي: 1 مجم / مل في محلول المقاصة ، انظر جدول المواد) في لوحة متعددة الآبار. ضع العينات في محلول الصبغة واحتضنها لمدة 1 ساعة.
ملاحظة: يجب ألا يتجاوز حجم الصبغة 10٪ من حجم CS. - اغسل العينات الملطخة في صفيحة أخرى متعددة الآبار مع 1 مل من CS لمدة 1 ساعة على الأقل.
8. المراقبة باستخدام مجهر الليزر البؤري
- ضع قطرة من CS على شريحة مجهر وانقل العينات المعالجة (باستخدام CS) إلى الشريحة.
ملاحظة: نظرا لأن العينات المعالجة ناعمة ، يجب التعامل معها بعناية باستخدام ملاقط. - قم بتغطية العينة بغطاء زجاجي لمنع تبخر CS.
ملاحظة: CS يترسب بسهولة. - راقب العينات المعالجة تحت مجهر الليزر البؤري.
ملاحظة: بعد الملاحظة ، يمكن إرجاع العينات المعالجة إلى CS لمزيد من الملاحظات لاحقا.
النتائج
أولا، تم التحقق من مدى شفافية الأنسجة الصلبة والسميكة لنباتات الأرز البالغة من خلال معالجة المقاصة. تم استخدام Nip في 9-10 LS ، وهي مرحلة تكوين الذعر ، والأنسجة التي يبلغ طولها 12-16 مم المقطوعة من الذعر الصغير إلى قاعدة التصوير. تم تثبيت هذه العينات ، بما في ذلك الذعر الصغير ، في المحلول المثبت وتمت ملاحظتها قبل وبعد 1-4 أسابيع من علاج المقاصة (الشكل 2). وظلت العينات غير المشذبة خضراء ولم تصبح شفافة بعد 4 أسابيع أو حتى بعد 3 أشهر من المعالجة بمحلول المقاصة (الشكل 2 ألف). في العينات التي تم تقشيرها من جميع الأوراق ، تحولت العقد الداخلية إلى اللون الأبيض بعد أسبوع 1 من العلاج باستخدام CS ، على الرغم من أن العقد ظلت خضراء. لم تصبح هذه العينة شفافة بعد 4 أسابيع (الشكل 2B). بعد 3 أشهر من العلاج باستخدام CS ، أصبح الذعر الصغير فقط شفافا. تغيرت العينات المشذبة يدويا إلى اللون الأبيض ، باستثناء الأوراق الخارجية وحزم الأوعية الدموية ، بعد أسبوع 1 من العلاج باستخدام CS. أصبحت بعض أجزاء الأوراق ، والذعر الصغير ، والعقد الداخلية شفافة ولكنها لم تصبح شفافة بعد 4 أسابيع (الشكل 2C). بعد 3 أشهر ، أصبحت الأوراق الصغيرة والأوراق الداخلية شفافة فقط. أصبحت العينات التي تم تقليمها إلى سمك 130 ميكرومتر باستخدام القطاعة الدقيقة المهتزة شفافة بعد أسبوع واحد من العلاج باستخدام CS ، مع تحول الأوراق إلى شفافية. بعد أسبوعين ، كانت العينة شفافة تقريبا وبقيت دون تغيير بعد 4 أسابيع (الشكل 2D). بعد 3 أشهر ، أصبحت العينات شفافة تماما.
بعد ذلك ، تم التحقق من صحة العمق الذي سمحت به معالجة المقاصة بملاحظات التعبير الجيني في تصوير T65 في 8 LS. تم استخدام البراعم المعبر عنها UBQpro:: NLS-sGFP-nClover3-mNeonGreen (UBQpro ::NGCN، انظر جدول المواد). تم تثبيت عينات الأنسجة في محلول التثبيت قبل تقليمها إلى سمك 130 ميكرومتر باستخدام قطاعة دقيقة تهتز. ثم لوحظت العينات تحت مجهر ليزر متحد البؤرة (الليزر: 488 نانومتر/13٪، الهدف: 20x، الثقب: 0.93 وحدة فلكية، المتوسط: 16، كسب الكاشف: 800) على فترات 10 ميكرومتر في اتجاه المحور z كل أسبوع من 0-4 أسابيع من العلاج باستخدام CS. وترد النتائج التمثيلية في الشكل 3. تم تعديل جميع الأرقام بنفس المعالجة لمقارنة شدة التألق. في العقدة بدون العلاج ، لوحظت إشارات فلورسنت باهتة على عمق -40 ميكرومتر (الشكل 3A). كان العمق الذي يمكن ملاحظته -60 ميكرومتر بعد أسبوع واحد من علاج CS و -90 ميكرومتر بعد أسبوعين ، لكن التألق التلقائي للسيتوبلازم كان ملحوظا في كلا الأسبوعين على عمق -20 ميكرومتر. أصبح التألق الذاتي أضعف إلى حد ما بعد 3 أسابيع ولم يعد مرئيا بعد 4 أسابيع. لوحظت إشارات الفلورسنت على عمق -80 ميكرومتر في 3 أسابيع وعلى عمق -100 ميكرومتر في 4 أسابيع. في العقدة الداخلية ، لوحظت إشارات الفلورسنت على عمق -60 ميكرومتر دون معالجة CS (الشكل 3B). كان العمق الذي يمكن ملاحظته -90 ميكرومتر بعد أسبوع واحد إلى 3 أسابيع من علاج CS و -100 ميكرومتر بعد 4 أسابيع ، ولكن التألق التلقائي في السيتوبلازم كان ملحوظا على عمق -20 ميكرومتر بعد أسبوع واحد. لم يعد التألق التلقائي مرئيا بعد 2 أسابيع. في الأوراق ، لوحظت إشارات الفلورسنت على عمق -90 ميكرومتر دون معالجة CS (الشكل 3C). لوحظت إشارات الفلورسنت أعمق في الأوراق منها في العقد والعقد الداخلية. ومع ذلك ، كانت إشارات الفلورسنت أضعف. أصبحت إشارات الفلورسنت واضحة بعد أسبوع واحد من علاج CS ولوحظت على عمق -120 ميكرومتر. بعد أسبوعين و 3 أسابيع ، لوحظت إشارات الفلورسنت على عمق -110 ميكرومتر ، وبعد 4 أسابيع ، على عمق -120 ميكرومتر.
وأخيرا ، لوحظ التعبير عن عامل النسخ OsMADS1511 المنصهر مع mOrange 12 ، والذي ينظم انتقال SAM من المرحلة الخضرية إلى المرحلة التناسلية13. تم إصلاح عينات الأنسجة من Nip في 10 LS مع OsMADS15-mOrange ، وتقليمها إلى سمك 130 ميكرومتر ، ومعالجتها باستخدام CS لمدة أسبوعين. يوضح الشكل 4 أنه يمكن استخدام محلول المقاصة في وقت واحد لمراقبة البروتينات الفلورية (OsMADS15-mOrange) للتعبير الجيني الطبيعي وتلطيخ صبغة الفلورسنت (كالكوفلور الأبيض). لوحظت الفلوريت بأكمله على أعماق تتراوح من 0 إلى -130 ميكرومتر ، وأعيد بناء الصورة ثلاثية الأبعاد من 43 صورة z-stack على فترات 3 ميكرومتر (الشكل 4E).

الشكل 1: وضع أخذ العينات ومعالجتها. (أ) قص الشتلات في 8 LS تحت حالة اليوم القصير. (ب) عرض موسع للقاعدة. (ج) قطع عينة من SAM / الذعر الشاب إلى القاعدة. (د) مقطع عرضي بيضاوي من C (مضمن). (ه) الحلاقة الرقيقة من جانب واحد من اللقطة باستخدام شفرة. (و) سطح حليق بشكل رقيق. (ز) عينة تبين استطالة العقدة الداخلية. القسم الأبيض المشار إليه برؤوس الأسهم هو العقد. الجانب العلوي من العقدة العليا لديه الذعر الشباب. أشرطة المقياس: (A) 10 سم ، (B-C ، E-G) 1 سم ، (D) 0.5 سم ، يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: يعتمد تطهير الأنسجة على سمك العينة وفترة علاج CS . (أ) عينات غير مشذبة ذات براعم جزئية بما في ذلك الذعر الصغير. أقصى سمك: 4 مم (ب) جميع الأوراق المقشرة من العينات لفضح الذعر الصغير. أقصى سمك: 2.5 مم. yp: ذعر الشباب ، في: internode ؛ تشير رؤوس الأسهم إلى العقدة. (ج) العينات التي تم تقليمها يدويا إلى سمك 1 مم. (د) العينات المشذبة بقطاعة صغيرة تهتز بسماكة 130 ميكرومتر. شريط الميزان: 5 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
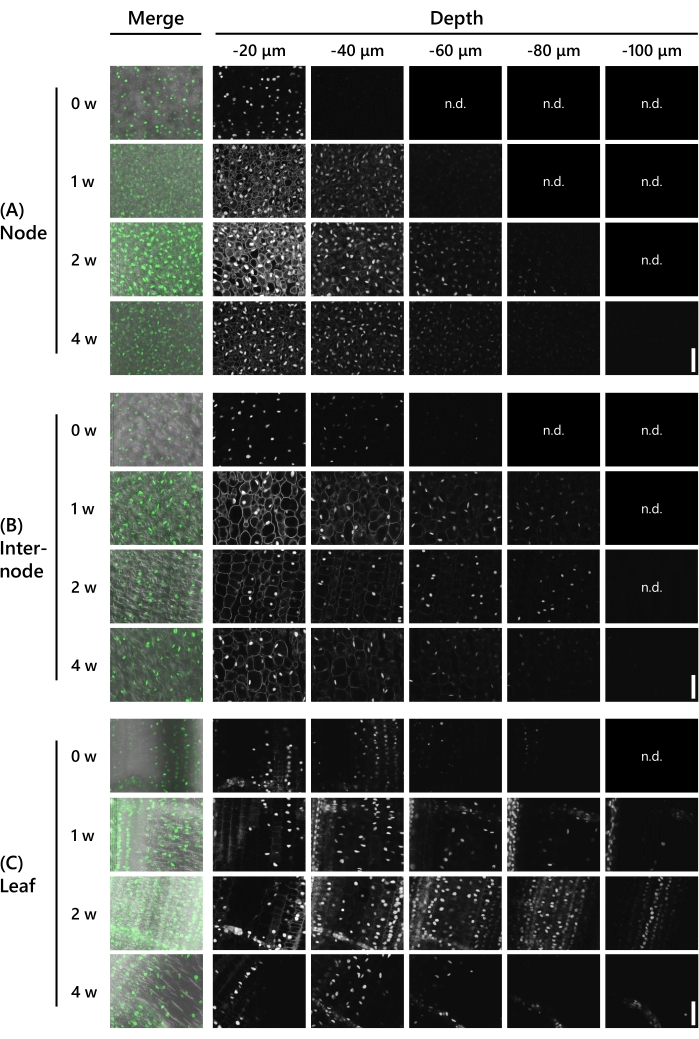
الشكل 3: يعتمد عمق مراقبة التألق على نوع الأنسجة وفترة علاج CS. التصوير العميق ل UBQpro::NGCN في العقدة (A) ، (B) internode ، و (C) ورقة. "دمج" يعني أنه تم دمج الصور مع صورة تباين التداخل التفاضلي (DIC) وجميع صور z-stack. تم وضع علامة على الصور التي لم يلاحظ فيها أي تألق على أنها "n.d". (لم يتم اكتشافه). إعدادات المجهر الليزري البؤري هي كما يلي: الليزر: 488 نانومتر / 13٪ ، الهدف: 20x ، الثقب: 0.93 وحدة فلكية ، المتوسط: 16 ، كسب الكاشف: 800 ، الفاصل الزمني: 10 ميكرومتر. أشرطة المقياس: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
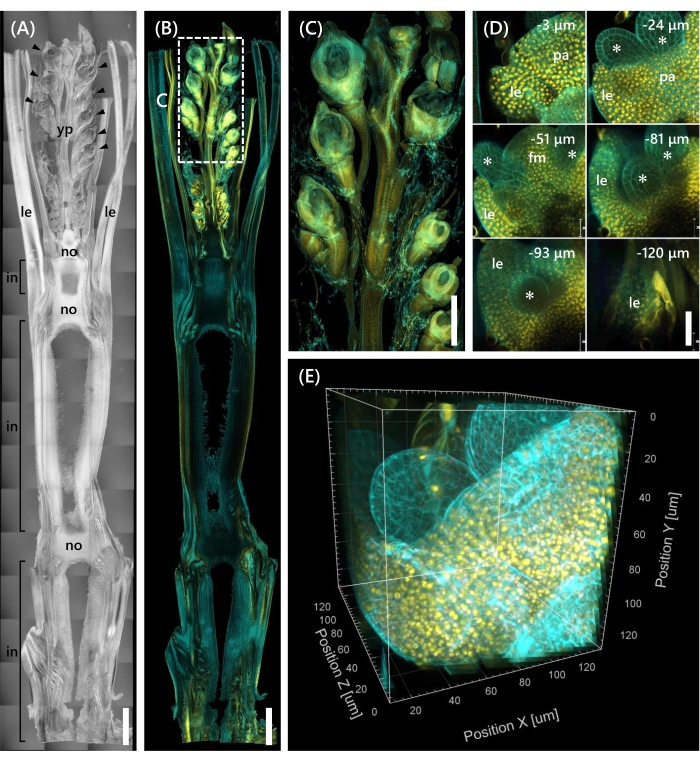
الشكل 4: ملاحظة التألق العميق ل OsMADS15-mOrange. (A) صورة DIC ل Nip عند 10 LS. yp: الذعر الشباب, لي: ورقة, لا: عقدة, في: internode; رؤوس الأسهم تشير إلى الأزهار. (ب) صورة التألق ل OsMADS15-mOrange. تشير النقاط الصفراء إلى البروتينات الفلورية ل OsMADS15-mOrange في النواة. كان جدار الخلية ملطخا باللون السماوي بمحلول كالكوفلور الأبيض. (ج) توسيع نطاق رؤية الذعر الصغير. (د) التصوير العميق للزهرة. pa: palea, le: lemma, fm: meristem الأزهار. تشير العلامات النجمية إلى الأسدية الأولية. تم تعيين مجهر الليزر البؤري على النحو التالي: OsMADS15-mOrange. الليزر: 555 نانومتر / 13٪ ، الهدف: 20x ، الثقب: 0.96 وحدة فلكية ، المتوسط: 16 ، كسب الكاشف: 800 ، الفاصل الزمني: 3 ميكرومتر. كالكوفلور الأبيض. الليزر: 405 نانومتر / 3٪ ، الهدف: 20x ، الثقب: 0.93 وحدة فلكية ، المتوسط: 16 ، كسب الكاشف: 470 ، الفاصل الزمني: 3 ميكرومتر. (E) الصورة ثلاثية الأبعاد للشكل (D) التي تم إنشاؤها من صور z-stack. أشرطة المقياس: (A-B) 1 مم ، (C) 500 ميكرومتر ، (D) 40 ميكرومتر.
Discussion
الخطوات الحاسمة للبروتوكول
الخطوات الحاسمة في هذا البروتوكول هي التثبيت والتشذيب. تحتوي براعم الأرز على أنسجة صلبة أو سميكة أو طبقات تحد من تغلغل المحلول المثبت. لتحسين نفاذية المحلول المثبت ، تم حلق جانب واحد من الأنسجة بشكل رقيق عند أخذ العينات ، كما هو موضح في الشكل 1E-F. بالإضافة إلى ذلك ، تم تكرار علاجات الفراغ مرتين باستخدام ضغط أعلى. علاوة على ذلك ، تم تثبيت العينات بين عشية وضحاها عند 4 درجات مئوية بدلا من التثبيت المعتاد لمدة 2 ساعة عند 4 درجات مئوية.
النقطة الرئيسية في خطوة التشذيب هي تحديد سمك الأنسجة التي يجب إعدادها لمراقبة البروتينات الفلورية مع الحفاظ على بنيتها الداخلية بعد فترة قصيرة من علاج CS. كما هو موضح في الشكل 2C ، أصبحت العينات التي يبلغ سمكها 1 مم ، والتي تم تقليمها يدويا بأكبر قدر ممكن من النحافة ، شفافة في عدد محدود فقط من الأنسجة حتى بعد 3 أشهر من علاج CS. لذلك ، فإن خطوة التشذيب ضرورية لمراقبة التألق العميق لبراعم الأرز البالغة. في هذه الدراسة ، تم تقليم العينات إلى سمك 130 ميكرومتر ، كما هو موضح في الشكل 2D. سمح سمك 130 ميكرومتر بإزالة الأوراق بعد أسبوع واحد من علاج CS والعينة بأكملها بعد أسبوعين . تم استخدام براعم الأرز البالغة في 9-10 LS في هذه الدراسة. يمكن إزالة الأنسجة السميكة ولكن الأكثر ليونة من براعم الأرز الأصغر سنا بشكل أسرع باستخدام علاج CS. يجب ضبط سمك العينات ومدة علاج CS وفقا لنوع الأنسجة وحالتها وسمك بنية 3D التي يجب ملاحظتها.
طرق التعديلات واستكشاف الأخطاء وإصلاحها
ترسب CS بسهولة في درجات حرارة منخفضة. لا يمكن ل CS المترسب الحفاظ على البروتينات الفلورية. وبالتالي ، يجب توخي الحذر عند تخزين العينات في درجة الحرارة المناسبة. بالإضافة إلى ذلك ، ليس لكل من CS والمحلول المثبت أي تأثير مطهر ؛ لذلك ، سوف تتحلل البروتينات الفلورية إذا كانت ملوثة. الأرز المزروع في التربة عرضة للنمو الفطري. وبالتالي، يجب أخذ العينات ومناولتها بعناية لتجنب التلوث.
قد تعطي الأصباغ الفلورية الزائدة في المخزن المؤقت تألقا في الخلفية وتتداخل مع الملاحظات المجهرية. على سبيل المثال ، تم استخدام محلول أبيض كالكوفلور يحتوي على صبغة إيفانز الزرقاء سابقا. بعد تلطيخ لمدة 1 ساعة والغسيل لمدة 1 ساعة ، لوحظت البروتينات الفلورية من OsMADS15-mOrange باستخدام ليزر 555 نانومتر. ومع ذلك ، لا يمكن ملاحظة البروتينات الفلورية بسبب التألق الخلفي المستمد من صبغة إيفانز الزرقاء. تم القضاء على هذا التألق الخلفية تقريبا عن طريق غسل العينات لمدة 2 ساعة. علاوة على ذلك ، كانت البروتينات الفلورية أكثر وضوحا إذا تركت العينات بين عشية وضحاها. لذلك ، تم استخدام محلول أبيض نقي كالكوفلور في هذه الدراسة. يجب التحقق من التألق الخلفي المشتق من صبغة الفلورسنت باستخدام أطوال موجية ليزر مختلفة قبل الملاحظات.
قيود الطريقة
كما هو موضح في الشكل 3 ، لوحظت بروتينات الفلورسنت العميقة في العينات التي كان سمكها 130 ميكرومتر بعد أسبوعين من علاج CS. وهذا يتفق مع النتائج الموضحة في الشكل 2D ، حيث أصبحت العينة التي يبلغ سمكها 130 ميكرومتر شفافة بعد أسبوعين من معالجة CS. ومع ذلك ، كما هو موضح في الشكل 3A ، كان التألق التلقائي للسيتوبلازم لا يزال ملحوظا في العقد بعد 2 أسابيع ولم تتم إزالته بالكامل إلا بعد 4 أسابيع من علاج CS. تحتوي العقد على كثافة خلايا عالية ، وبالتالي ، تتطلب وقتا أطول لإزالة مواد الفلورسنت التلقائي.
كما هو موضح في الشكل 3C ، لوحظت بروتينات الفلورسنت العميقة في الأوراق دون معالجة CS ، لكن السطوع كان أضعف من ذلك الموجود في العقد والعقد الداخلية على نفس عمق 20 ميكرومتر. بعد 1 أسبوع من علاج CS ، كانت البروتينات الفلورية أكثر إشراقا. الكلوروفيل وفير في الأوراق ويمتص 488 نانومتر من ضوء الإثارة. لديهم أيضا التألق التلقائي البرتقالي / الأحمر ، والذي يمكن أن يتداخل مع مراقبة البروتينات الفلورية باستخدام ليزر 555 نانومتر. بعد أسبوع 1 من معالجة CS ، تمت إزالة الكلوروفيل والمواد الفلورية التلقائية الأخرى ، مما أدى إلى صور عالية نسبة الإشارة إلى الضوضاء.
لم تكن الأعماق التي يمكن ملاحظتها في الأنسجة بعد أسبوعين و 4 أسابيع من علاج CS مختلفة بشكل كبير ، على الرغم من أن البروتينات الفلورية بدت أضعف بعد 4 أسابيع (الشكل 3). عادة ، يضعف سطوع البروتينات الفلورية والتألق التلقائي مع مرور الوقت ، مما يؤدي إلى ارتفاع نسبة الإشارة إلى الضوضاء. لذلك ، يمكن ملاحظة البروتينات الفلورية بشكل أكثر وضوحا عن طريق ضبط الظروف المجهرية ومعالجة الصور. بناء على هذه النتائج ، تم التوصل إلى أن 2 أسابيع من علاج CS يمكن أن تسهل مراقبة البروتينات الفلورية العميقة ، بالنظر إلى ظروف عينتنا. ومع ذلك ، هناك حاجة إلى 4 أسابيع لمراقبة صور أكثر وضوحا تستبعد تماما مواد الفلورسنت التلقائي.
لا يمكن مسح الهياكل ذات التألق الذاتي القوي ، مثل حزم الأوعية الدموية والخلايا متعددة الأذرع ، في CS. لمراقبة هذه الهياكل دون التألق الذاتي ، من الضروري استخدام طريقة بوابة الوقت12 أو الحصول على صور عن طريق التحليل الطيفي لطيف الفلوري. قد يكون المجهر ثنائي الفوتون أكثر ملاءمة لمراقبة الأنسجة العميقة إذا لوحظت أنسجة أكثر سمكا.
أهمية الطريقة فيما يتعلق بالطرق الحالية والبديلة
بشكل عام ، لوحظت الهياكل الداخلية لنباتات الأرز باستخدام إما cryostat أو التقسيم الاهتزازي. يعد cryostat مناسبا لإعداد أقسام رقيقة ، مما يسمح بمراقبة أسهل ، ولكن إعداد العينات وتشغيل المعدات يستغرق وقتا طويلا. إعادة بناء هيكل 3D الأصلي من أقسام رقيقة أمر صعب أيضا. الاهتزاز سهل التشغيل نسبيا ومناسب لإنتاج أقسام سميكة. ومع ذلك ، فإن الأجزاء السميكة من الأنسجة المستهدفة تسمح فقط بمراقبة السطح المقطوع وليس الأنسجة العميقة التي لا يمكن للضوء الوصول إليها. لهذه الأسباب ، لا تعد أي من الطريقتين مناسبتين لملاحظات التألق العميق.
تناولت هذه الدراسة التحديات في مراقبة التألق العميق في براعم الأرز ، مثل اختراق الأنسجة المحدود ل CS وضعف دقة الجسم تحت المجهر البؤري ، من خلال الجمع بين الطرق الحالية. كما هو موضح في الشكل 4 ، لاحظنا البروتينات الفلورية (OsMADS15-mOrange) المعبر عنها في الأنسجة العميقة لبراعم الأرز البالغة من الذعر الصغير إلى القاعدة. يركز الشكل 4D على الفلوريت ويظهر البروتينات الفلورية العميقة على فترات 3 ميكرومتر. لوحظت الأنسجة التي يزيد عمقها عن -130 ميكرومتر بعد أسبوعين من علاج CS ، ولكن تم ملاحظة الأنسجة فقط داخل عمق -27 ميكرومتر (البيانات غير معروضة) في الفلوريت بنفس الحجم ومرحلة النمو دون علاج CS. سمح البروتوكول المحسن الحالي بملاحظة ليس فقط الإفراط في التعبير عن الجينات ولكن أيضا التعبير الجيني الطبيعي في الأنسجة العميقة لبراعم الأرز البالغة.
أهمية والتطبيقات المحتملة للطريقة في مجالات بحثية محددة
يتيح هذا البروتوكول ، الذي يحسن مراقبة التألق العميق لبراعم الأرز البالغة ، التطهير الفعال للأنسجة الصلبة أو السميكة أو الطبقات عن طريق تقليم الأنسجة غير الضرورية وزيادة نفاذية CS. بالإضافة إلى ذلك ، تم تحسين سمك العينات للتحليل للسماح بالمراقبة الفلورية العميقة المستمرة والهيكلية باستخدام مجهر ليزر متحد البؤرة ، والذي لا يمكنه عادة حل الأنسجة السميكة أو غير الشفافة.
من الصعب مقارنة عينات الأرز في مراحل نمو مختلفة لأن البروتينات الفلورية تتحلل بمرور الوقت في المحاليل المثبتة و PBS. ومع ذلك ، يمكن تخزين البروتينات الفلورية في CS لأكثر من 5 أشهر1. العمر الافتراضي الطويل ل CS هو ميزة رئيسية لمراقبة التألق العميق في الأرز.
في الآونة الأخيرة ، تم تطوير العديد من تقنيات المقاصة ، مما يجعل من الممكن مراقبة الأنسجة العميقة في 3D مع الحفاظ على هياكلها الداخلية. واستمرت هذه التكنولوجيات في التطور، وتم تطوير حلول جديدة للمقاصة. ومن الأمثلة الجيدة على ذلك iTOMEI14 ، الذي يتيح إزالة الكلوروفيل بكفاءة واكتشاف التألق الأكثر إشراقا. مثال آخر هو ClearSeeAlpha15 ، الذي يمنع تحمير الأنسجة أثناء العلاج الشفاف ويجعلها تبدو شفافة. وقد يتيح الجمع بين حلول المقاصة هذه والطريقة الحالية إجراء مقاصة أكثر كفاءة وفعالية.
ومن المتوقع أن تساعد الطريقة الحالية في اكتساب رؤى جديدة من خلال التصوير العميق ليس فقط للأرز ولكن أيضا للنباتات الأخرى.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان.
Acknowledgements
نشكر الدكتور ر. تيرادا، والدكتور ز. شيماتاني، والدكتور ه. تسوجي على تزويدنا ببذور OsMADS15-mOrange؛ الدكتور د. كوريهارا لتزويدنا ببناء NGCN ؛ والدكتور ر. شيم لتحرير مخطوطتنا. تم تمويل هذا العمل من قبل JSPS KAKENHI (أرقام المنح JP20H05912 و 20H05778 و 20H05779) وبرنامج SATREPS (لا. JPMJSA1706) من JST و JICA.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | BIO-BIK | ST-0150F | |
| 12-multiwell plate | Corning | 353043 | |
| 50 mL conical tube | Corning | 352070 | |
| Calcofluor white solution | Sigma-Aldrich | 910090 | |
| ClearSee | FUJIFILM Wako Pure Chemical | 031-25151 | This can be made or purchased. |
| Confocal laser microscope | Carl Zeiss | LSM700 | |
| Desiccator | SANPLATEC | Custom made of acrylic. 30 cm (L), 30 cm (W), 14.5 cm (H) | |
| Glass coverslip (18 × 18 No.1) | MATSUNAMI | C018181 | |
| HEPES | FUJIFILM Wako Pure Chemical | 342-01375 | |
| Microscope slide (76 × 26) | MATSUNAMI | S2441 | |
| Paraffin film | Bemis | PM-996 | |
| Paraformaldehyde | FUJIFILM Wako Pure Chemical | 162-16065 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | |
| Sucrose | FUJIFILM Wako Pure Chemical | 190-00013 | |
| UBQpro::NLS-sGFP-nClover3-mNeonGreen (UBQpro::NGCN) | provided by Dr. Kurihara | ||
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | AS One | AS-01 | |
| Vibrating micro-slicer | DOSAKA | DTK-3000 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
References
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLoS One. 11 (8), 0161107 (2016).
- Pandey, K. B., et al. Plant roots sense soil compaction through restricted ethylene diffusion. Science. 371 (6526), 276-280 (2021).
- Ejaza, M., Bencivenga, S., Tavaresa, R., Busha, M., Sablowski, R. ARABIDOPSIS THALIANA HOMEOBOX GENE 1 controls plant architecture by locally restricting environmental responses. Proceedings of the National Academy of Sciences of the United States of America. 118 (17), (2021).
- Smetana, O., et al. High levels of auxin signalling define the stem-cell organizer of the vascular cambium. Nature. 565 (7740), 485-489 (2019).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11 (1), 23 (2018).
- Nagaki, K., Yamaji, N., Murata, M. ePro-ClearSee: A simple immunohistochemical method that does not require sectioning of plant samples. Scientific Reports. 7, 42203 (2017).
- Sato, M., Akashi, H., Sakamoto, Y., Matsunaga, S., Tsuji, H. Whole-tissue three-dimensional imaging of rice at single-cell resolution. International Journal of Molecular Sciences. 23 (1), 40 (2022).
- Matsuo, T., Hoshikawa, K. Science of the Rice Plant: Morphology. Food and Agriculture Policy Research Center. , (1993).
- Kobayashi, K., et al. Inflorescence meristem identity in rice is specified by overlapping functions of three AP1/FUL-Like MADS box genes and PAP2, a SEPALLATA MADS box gene. Plant Cell. 24 (5), 1848-1859 (2012).
- Tamaki, S., et al. FT-like proteins induce transposon silencing in the shoot apex during floral induction in rice. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 901-910 (2015).
- Kodama, Y. Time gating of chloroplast autofluorescence allows clearer fluorescence imaging In Planta. PLoS One. 11 (3), 0152484 (2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Communications Biology. 5 (1), 12 (2022).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: Advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved