Method Article
Observação de Fluorescência Profunda em Brotos de Arroz via Tecnologia de Compensação
Neste Artigo
Resumo
O presente protocolo descreve uma técnica de compensação para brotos de arroz, que são difíceis de preparar para observações estruturais internas devido à natureza dura, grossa ou em camadas dos tecidos. Este método facilita observações contínuas e profundas de fluorescência, mesmo em plantas de arroz adultas.
Resumo
A tecnologia de compensação recentemente desenvolvida que elimina incompatibilidades de índices refrativos e diminui o material auto-fluorescente possibilitou observar tecidos vegetais em três dimensões (3D) preservando suas estruturas internas. No arroz (Oryza sativa L.), uma planta modelo monocot e uma cultura globalmente importante, a tecnologia de compensação tem sido relatada em órgãos relativamente fáceis de observar, como as raízes e as folhas. Também foram relatadas aplicações da tecnologia de compensação em meristem apical apical (SAM) e hastes, mas apenas em um grau limitado devido à má penetração da solução de compensação (CS) nesses tecidos. A eficiência limitada das soluções de compensação nesses tecidos tem sido atribuída à auto-fluorescência, espessamento e endurecimento dos tecidos na haste à medida que os feixes vasculares e a epiderme se desenvolvem e camadas do SAM com folhas repelentes à água. O presente protocolo relata a otimização de uma abordagem de compensação para observação contínua e 3D da expressão genética do sam/jovem em pânico até a base das filmagens durante o desenvolvimento. Amostras de tecido fixo expressando um repórter de proteína fluorescente foram aparadas em seções usando um micro-fatiador vibrante. Quando uma espessura apropriada foi alcançada, o CS foi aplicado. Ao direcionar especificamente o tecido central, a taxa de penetração e uniformidade do CS aumentou, e o tempo necessário para tornar o tecido transparente diminuiu. Além disso, a limpeza das seções aparadas possibilitou a observação da estrutura interna de toda a filmagem a partir de uma perspectiva macro. Este método tem aplicações potenciais em imagens profundas de tecidos de outras espécies vegetais que são difíceis de limpar.
Introdução
A tecnologia de limpeza recém-desenvolvida possibilitou observar os tecidos profundos das plantas, preservando sua estrutura interna 1,2,3. Na planta modelo dicot Arabidopsis, muitos estudos sobre imagem de proteína fluorescente têm sido realizados usando tecnologia de compensação para eliminar incompatibilidades de índice refrativo e remover materiais auto-fluorescentes 4,5,6. Embora o uso da tecnologia de compensação 7,8 e 3D de imagem na resoluçãocelular 9 tenha sido relatado no arroz (Oryza sativa L.), uma planta modelo monocot e uma cultura globalmente importante, estes são limitados a órgãos relativamente finos e macios, como raízes, folhas e meristem apical (SAM), que são fáceis de observar.
A filmagem é o principal órgão que constitui as partes acima do solo das plantas vasculares. No arroz, as brotos são compostas por uma série de "fitomers" empilhados verticalmente, compreendendo botões axilares, folhas e a haste10. Na ponta da filmagem, o SAM é composto de células-tronco indiferenciadas no centro. Os fitomeros são formados pela diferenciação de células derivadas do SAM. Após a mudança das plantas da fase vegetativa para a reprodução, o arroz se alonga e o SAM se diferencia em jovenspânicos 10. Esta mudança de desenvolvimento é acompanhada por flutuações na expressão de vários genes nas hastes e sam/jovens pânicos. Para entender os mecanismos de diferenciação celular subjacente em vários tecidos, é importante observar estruturalmente a morfologia celular e a expressão genética nos tecidos internos de tiro. No entanto, a imagem profunda de caules (nódulos e internos) na filmagem apresenta um desafio devido à ineficiência de soluções de compensação para penetrar no tecido. As hastes passam imediatamente por um rápido aumento de volume do crescimento lateral após a diferenciação do SAM. O endurecimento dos tecidos do nó de arroz devido ao espessamento dos feixes vasculares e a ligação complexa horizontal da anastomose vascular nodadal, além da alta repellency dos brotos de arroz, contribuem para limitar a penetração do CS em hastes10.
Este estudo teve como objetivo observar mudanças na expressão genética nos tecidos de tiro de arroz usando uma técnica estrutural de fluorescência profunda. Este trabalho otimiza um protocolo de compensação para que o arroz observe continuamente a expressão genética do SAM/young panicle até a base em uma estrutura 3D, em vez de em uma superfície plana, usando um microscópio a laser confocal.
Protocolo
1. Preparação da solução fixa
- Transfira 70 mL de água estéril em uma garrafa de vidro e adicione 10 g de paraformaldeído (PFA).
ATENÇÃO: A PFA é tóxica; portanto, o uso de luvas é recomendado. - Adicione 2 mL de 1 N NaOH para dissolver a solução PFA.
- Dissolva a solução PFA com agitação contínua (300-500 rpm) a 60 °C por cerca de 1h até que a solução PFA seja transparente.
- Adicione água esterilizada para aumentar o volume da solução PFA para 100 mL.
NOTA: A solução PFA foi preparada recentemente antes do uso. Além disso, uma solução PFA armazenada a 4 °C pode ser usada por aproximadamente 2 meses. - Imediatamente antes da amostragem, adicione 25 mL de 60 mM HEPES (pH 7.4), 3 mL de sacarose de 1 M e 2 mL de água estéril em 20 mL de 10 % PFA para preparar uma solução fixativa de 50 mL.
2. Preparação da solução de compensação (CS)
- Pesar e misturar 7,5 g de desoxicolato de sódio, 5 g de xilitol e 12,5 g de ureia (ver Tabela de Materiais) em 50 mL de água estéril.
NOTA: O pó desoxicorado de sódio foi pesado em uma câmara de rascunho de laboratório geral para evitar a dispersão aérea. - Dissolva os ingredientes (passo 2.1.) usando um agitador magnético para preparar o CS.
NOTA: O presente estudo utilizou solução de compensação preparada internamente (CS), mas uma solução de compensação comercialmente disponível, ClearSee (ver Tabela de Materiais), também pode ser utilizada. - Transfira o CS para um tubo cônico de 50 mL e armazene-o à temperatura ambiente (15-30 °C) no escuro.
NOTA: O CS pode ser armazenado por mais de 1 ano.
3. Amostragem
- Corte as raízes cuidadosamente sem danificar as plantas. Lave as plantas com água para remover a sujeira.
NOTA: Este método estudou a observação de tecidos do estágio de três folhas (SL) para a bandeira LS. O presente estudo utilizou as cultivares de arroz Nipponbare (Nip) e Taichung 65 (T65) no 8-10 LS. - Retire as folhas externas velhas com as mãos e a pinça. Havia cerca de 2-3 folhas esquerdas esquerda.
- Corte o tecido do SAM/young panicle para a base com uma navalha de um único comprimento usando um movimento deslizante para evitar esmagar as células (Figura 1A-C). Se a posição do SAM/jovem panicle não for visível, corte-a por mais tempo.
- Uma vez que a seção transversal do tiro de arroz tem uma forma oval (Figura 1D), raspe um lado do oval finamente na direção de seu eixo longo com uma navalha de dois gumes (Figura 1E-F).
NOTA: Esta etapa facilitou a penetração da amostra na solução fixa. Uma superfície de corte horizontal torna a amostra mais fácil de grudar em uma bandeja de micro-fatiador vibrante (ver Tabela de Materiais). - Confirme a posição do SAM/young panicle pelo aparecimento de uma cor esbranquiçada na amostra (Figura 1G). Corte o excesso de tecido.
NOTA: O comprimento da amostra deve ser ajustado ao comprimento máximo que pode ser aparado usando um micro-fatiador vibrante. Se a amostra for muito longa, divida-a em vários pedaços.
4. Fixação das amostras
- Pipeta 1 mL da solução fixativa (preparada na etapa 1.) para um tubo de microcentrifus de 1,5 mL e imediatamente colocada nas amostras.
NOTA: Certifique-se de que a quantidade de amostra não exceda 20% do volume da solução fixa. - Corte um pedaço de filme de parafina em 2,5 cm2. Modele o filme de parafina em bolas e coloque-os em cima das amostras para evitar que elas flutuam para fora da solução fixa.
- Coloque o tubo contendo a amostra em um desiccador. Em seguida, feche a tampa do dessecator e inicie a bomba de vácuo para despressurizar o interior do dessecador até −0,095 MPa lentamente.
- Depois de fechar o desiccador a -0,095 MPa, desligue a bomba de vácuo e deixe-a ficar por 30 minutos à temperatura ambiente.
NOTA: O nível de vácuo foi tal que as bolhas apareceram gradualmente nas amostras. - Abra o desiccador ligeiramente e lentamente devolva-o à pressão atmosférica. Reduza a pressão do dessecodor para -0,095 MPa, desligue a bomba de vácuo e deixe que a mistura suporte por 30 minutos à temperatura ambiente.
- Abra o desiccador ligeiramente e lentamente devolva-o à pressão atmosférica. Se a amostra estiver corretamente fixada, ela afunda na solução fixa. Se não afundar, reduza a pressão novamente.
- Retire o filme de parafina, feche a tampa e mantenha os tubos durante a noite a 4 °C.
NOTA: As amostras foram fixadas em solução fixativa por pelo menos 2 h. Pode ser armazenado por ~1 semana.
5. Aparar a amostra fixa
- Remova a solução fixativa em excesso da amostra usando lenços sem fiapos.
NOTA: O excesso de solução fixada impede que a amostra grude corretamente na bandeja. - Fixar a amostra em uma bandeja de micro fatiador vibrante com cola instantânea. Coloque-o em uma bandeja com o lado plano para baixo, que foi raspado durante a amostragem.
NOTA: Devido à estrutura do broto de arroz, ele deve ser aparado da base em direção ao sam/jovem em pânico. - Defina as condições de corte de acordo com a amostra fixa.
NOTA: Neste estudo, o aparador foi definido como THICK, 130 μm; WIDE, 15 mm; FREQUÊNCIA, 15%; e VELOCIDADE DE CORTE, 32 mm. - Ajuste a posição da amostra com o botão RVS ou FWD e o botão PARA CIMA ou PARA BAIXO . Encha a bandeja com água deionizada até que todas as amostras estejam imersas. Depois de encher a bandeja, pressione o botão START . Coloque as amostras aparadas em um slide de vidro com uma gota de 1x PBS.
NOTA: Mude a posição da amostra para o outro lado após cada corte, uma vez que a amostra dura desgasta a lâmina de barbear. - Depois de verificar a amostra contendo o local alvo sob um estereoscópio, transfira a amostra aparada para uma placa multiwell com 1 mL de 1x PBS.
NOTA: Escolha o número de poços de acordo com o tamanho da amostra. Neste estudo, foi utilizada uma placa de 12 multiwells.
6. Tratamento com a solução de compensação
- Remova o PBS 1x da placa multiwell e adicione pbs frescos de 1x. Deixe-o ficar por 1 min.
- Remova 1x PBS e adicione o CS.
NOTA: A quantidade de CS deve ser cinco vezes maior que o volume amostral. - Coloque a placa multiwell contendo a amostra em um desiccador. Em seguida, feche a tampa do dessecator e inicie a bomba de vácuo para despressurizar o interior do dessecador até −0,09 MPa lentamente.
- Depois de fechar o desiccador a -0,09 MPa, desligue a bomba de vácuo e deixe-a parada por 1h à temperatura ambiente.
- Abra o desiccador ligeiramente e lentamente devolva-o à pressão atmosférica.
- Despeje água deionizada na abertura entre os poços para evitar a evaporação do CS. Armazene as placas multiwell à temperatura ambiente no escuro para limpeza.
NOTA: Agite suavemente a placa multiwell a cada 1-2 dias para difundir a clorofila e outros componentes. - Quando o CS ficar verde, substitua-o por uma solução fresca.
7. Coloração da parede celular com corante químico
- Pipetar a solução branca de calcofluor (1 mL, concentração final: 1 mg/mL na solução de compensação, ver Tabela de Materiais) em uma placa multiwell. Coloque as amostras na solução de corante e incubar por 1h.
NOTA: O volume do corante não deve exceder 10% do volume do CS. - Lave as amostras manchadas em outra placa multiwell com 1 mL do CS por pelo menos 1 h.
8. Observação com um microscópio a laser confocal
- Coloque uma gota de CS em um slide de microscópio e transfira as amostras tratadas (com CS) para o slide.
NOTA: Como as amostras tratadas são macias, devem ser cuidadosamente manuseadas com pinças. - Cubra a amostra com uma mancha de vidro para evitar a evaporação do CS.
NOTA: O CS precipita facilmente. - Observe as amostras tratadas sob um microscópio a laser confocal.
NOTA: Após observação, as amostras tratadas podem ser devolvidas ao CS para observações posteriores.
Resultados
Em primeiro lugar, foi validado o quanto os tecidos duros e grossos das plantas de arroz adultas poderiam ser transparentes pelo tratamento de compensação foi validado. Nip no 9-10 LS, que é o estágio de formação de pânico, e tecidos longos de 12-16 mm cortados do jovem pânico para a base da filmagem foram usados. Estas amostras, incluindo o jovem panicle, foram fixadas na solução fixativa e observadas antes e depois de 1-4 semanas do tratamento de compensação (Figura 2). As amostras não aparadas permaneceram verdes e não se tornaram transparentes após 4 semanas ou mesmo após 3 meses de tratamento com a solução de compensação (Figura 2A). Em amostras que foram descascadas todas as folhas, os internos ficaram brancos após 1 semana de tratamento com o CS, embora os nós permanecessem verdes. Esta amostra não se tornou transparente após 4 semanas (Figura 2B). Após 3 meses de tratamento com o CS, apenas o jovem panicle tornou-se transparente. As amostras aparadas à mão foram alteradas para brancas, exceto as folhas externas e os feixes vasculares, após 1 semana de tratamento com o CS. Algumas partes das folhas, jovens em pânico e internos tornaram-se translúcidos, mas não se tornaram transparentes após 4 semanas (Figura 2C). Depois de 3 meses, apenas o jovem em pânico e as folhas internas tornaram-se transparentes. As amostras que foram aparadas a 130 μm de espessura com o micro-fatiador vibratório tornaram-se translúcidas após 1 semana de tratamento com o CS, com as folhas ficando transparentes. Após 2 semanas, a amostra foi quase transparente e permaneceu inalterada após 4 semanas (Figura 2D). Após 3 meses, as amostras ficaram completamente transparentes.
Em seguida, a profundidade pela qual o tratamento de compensação permitiu observações de expressão genética na filmagem de T65 no 8 LS foi validada. O UBQpro::NLS-sGFP-nClover3-mNeonGreen (UBQpro::NGCN, ver Tabela de Materiais) foram usados brotos expressos. As amostras de tecido foram fixadas na solução fixativa antes de aparar-as a 130 μm de espessura usando um micro-fatiador vibratório. As amostras foram então observadas sob um microscópio a laser confocal (laser: 488 nm/13%, objetivo: 20x, pinhole: 0,93 UA, média: 16, ganho do detector: 800) em intervalos de 10 μm na direção do eixo z a cada semana de 0-4 semanas de tratamento com a CS. Os resultados representativos são mostrados na Figura 3. Todos os números foram ajustados com o mesmo processamento para comparar a intensidade da fluorescência. No nó sem o tratamento, foram observados sinais fluorescentes fracos a uma profundidade de −40 μm (Figura 3A). A profundidade observável foi de -60 μm após 1 semana de tratamento CS e -90 μm após 2 semanas, mas a auto-fluorescência do citoplasma foi perceptível em ambas as semanas a uma profundidade de −20 μm. A autofluorescência ficou um pouco mais fraca após 3 semanas e não foi mais visível após 4 semanas. Sinais fluorescentes foram observados a uma profundidade de -80 μm em 3 semanas e a uma profundidade de −100 μm a 4 semanas. No interno, foram observados sinais fluorescentes a uma profundidade de −60 μm sem o tratamento CS (Figura 3B). A profundidade observável foi de -90 μm após 1 semana a 3 semanas de tratamento CS e -100 μm após 4 semanas, mas a auto-fluorescência no citoplasma foi perceptível a uma profundidade de −20 μm após 1 semana. A auto-fluorescência não era mais visível após 2 semanas. Nas folhas, foram observados sinais fluorescentes a uma profundidade de −90 μm sem o tratamento CS (Figura 3C). Os sinais fluorescentes foram observados mais profundamente nas folhas do que nos nós e nos internos. No entanto, os sinais fluorescentes eram mais fracos. Os sinais fluorescentes ficaram claros após 1 semana de tratamento de CS e foram observados a uma profundidade de −120 μm. Após 2 semanas e 3 semanas, sinais fluorescentes foram observados a uma profundidade de −110 μm e, após 4 semanas, a uma profundidade de −120 μm.
Finalmente, observou-se a expressão do fator de transcrição OsMADS1511 fundido com mOrange12 , que regula a transição do SAM da fase vegetativa13. Amostras de tecido de Nip no 10 LS com OsMADS15-mOrange foram fixadas, aparadas a 130 μm de espessura, e tratadas com o CS por 2 semanas. A Figura 4 mostra que a solução de compensação poderia ser usada simultaneamente para observar as proteínas fluorescentes (OsMADS15-mOrange) de expressão genética natural e coloração de corante fluorescente (branco calcofluor). Foi observado todo o florete em profundidades de 0 a -130 μm, e a imagem 3D foi reconstruída a partir de imagens de 43 z-stack em intervalos de 3 μm (Figura 4E).

Figura 1: Posição e processamento amostral. (A) Muda de nip na 8 LS sob a condição de curto-dia. (B) Visão ampliada da base. (C) Uma amostra recorrível do SAM/young panicle para a base. (D) Uma seção transversal oval de C (inset). (E) Raspar finamente um lado do tiro com uma lâmina. (F) Superfície finamente raspada. (G) Amostra mostrando alongamento interno. A seção esbranquiçada indicada pelas pontas das flechas são os nódulos. O lado superior do nó superior tem o jovem em pânico. Barras de escala: (A) 10 cm, (B-C,E-G) 1 cm, (D) 0,5 cm. Clique aqui para ver uma versão maior desta figura.

Figura 2: A limpeza tecidual depende da espessura da amostra e do período de tratamento da CS. (A) Amostras não cortadas com brotos parciais, incluindo o jovem panicle. Espessura máxima: 4 mm. (B) Todas as folhas retiradas das amostras para expor o jovem em pânico. Espessura máxima: 2,5 mm. yp: jovem panicle, in: internode; pontas de flecha indicam nó. (C) Amostras que foram aparadas à mão até 1 mm de espessura. (D) Amostras aparadas com o micro-fatiador vibratório a 130 μm de espessura. Barra de escala: 5 mm. Clique aqui para ver uma versão maior desta figura.
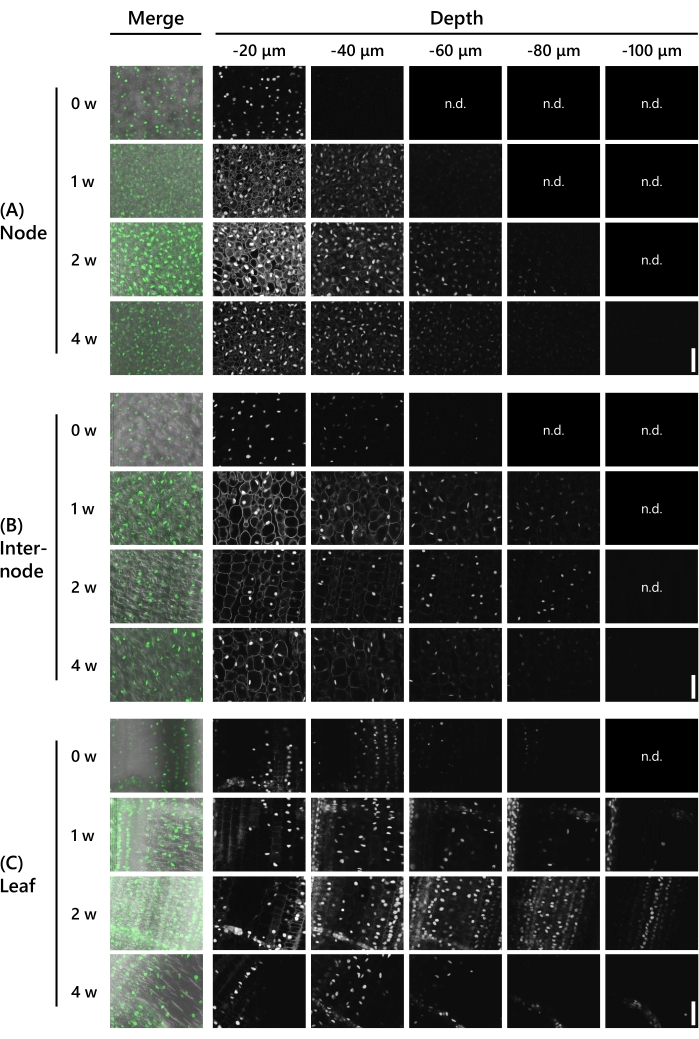
Figura 3: A profundidade da observação da fluorescência depende do tipo de tecido e do período de tratamento da CS. Imagem profunda de UBQpro::NGCN no nó (A), (B) internode e (C) folha. "Mesclagem" significa que as imagens foram fundidas com a imagem de contraste de interferência diferencial (DIC) e todas as imagens de pilha de z. Imagens em que nenhuma fluorescência foi observada foram marcadas como "n.d.". (não detectado). As configurações da microscopia a laser confocal são as seguintes: laser: 488 nm/13%, objetivo: 20x, pinhole: 0,93 UA, média: 16, ganho do detector: 800, intervalo: 10 μm. Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
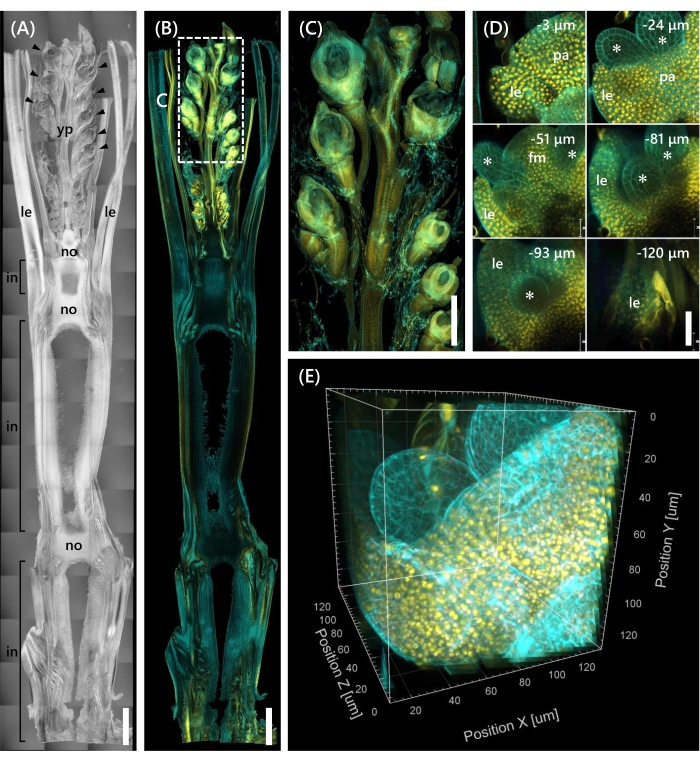
Figura 4: Observação de fluorescência profunda de OsMADS15-mOrange. (A) A imagem DIC de Nip no 10 LS. yp: jovem panicle, le: folha, não: nó, em: internode; pontas de flecha indicam floretas. (B) Imagem de fluorescência de OsMADS15-mOrange. Pontos amarelos indicam as proteínas fluorescentes de OsMADS15-mOrange no núcleo. A parede celular estava manchada de ciano com a solução branca de calcofluor. (C) Visão ampliada do jovem em pânico. (D) Imagem profunda do florete. pa: palea, le: lemma, fm: meristem floral; asteriscos indicam stamen primordia. O microscópio a laser confocal foi definido da seguinte forma: OsMADS15-mOrange; laser: 555 nm/13%, objetivo: 20x, pinhole: 0,96 UA, média: 16, ganho do detector: 800, intervalo: 3 μm. Calcofluor branco; laser: 405 nm/3%, objetivo: 20x, pinhole: 0,93 UA, média: 16, ganho do detector: 470, intervalo: 3 μm. (E) A imagem 3D da figura (D) construída a partir das imagens de pilha z. Barras de escala: (A-B) 1 mm, (C) 500 μm, (D) 40 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Passos críticos do protocolo
Os passos críticos neste protocolo são fixação e corte. Os brotos de arroz têm tecidos duros, grossos ou em camadas que limitam a penetração da solução fixativa. Para melhorar a permeabilidade da solução fixativa, um lado do tecido foi finamente raspado na amostragem, como mostrado na Figura 1E-F. Além disso, os tratamentos a vácuo foram repetidos duas vezes usando maior pressão. Além disso, as amostras foram fixadas durante a noite a 4 °C em vez da fixação usual de 2 h a 4 °C.
O ponto chave na etapa de corte é determinar a espessura dos tecidos a serem preparados para observar as proteínas fluorescentes, preservando sua estrutura interna após um curto período de tratamento de CS. Como mostrado na Figura 2C, as amostras de 1 mm de espessura, aparadas à mão o mais finas possível, tornaram-se transparentes em apenas um número limitado de tecidos mesmo após 3 meses de tratamento de CS. Portanto, o passo de corte é essencial para a observação de fluorescência profunda de brotos de arroz adulto. Neste estudo, as amostras foram aparadas a uma espessura de 130 μm, como mostra a Figura 2D. A espessura de 130 μm permitiu limpar as folhas após 1 semana de tratamento de CS e toda a amostra após 2 semanas. Os brotos de arroz adulto no 9-10 LS foram usados neste estudo. Tecidos grossos, mas mais macios de brotos de arroz mais jovens podem ser limpos mais rapidamente com o tratamento CS. A espessura das amostras e a duração do tratamento de SC devem ser ajustadas de acordo com o tipo de tecido, condição e espessura da estrutura 3D a ser observada.
Modificações e métodos de solução de problemas
O CS precipitado facilmente a baixas temperaturas. A CS precipitada não pode preservar as proteínas fluorescentes; portanto, deve-se tomar cuidado ao armazenar as amostras na temperatura adequada. Além disso, tanto a solução CS quanto a fixação não têm efeito antisséptico; portanto, as proteínas fluorescentes serão degradadas se contaminadas. O arroz cultivado no solo é propenso ao crescimento fúngico; por isso, a amostragem e o manuseio das amostras devem ser realizados com cuidado para evitar contaminação.
O excesso de corantes fluorescentes no buffer pode empacoar fluorescência de fundo e interferir com observações microscópicas. Por exemplo, uma solução branca de calcofluor contendo corante azul Evans foi usada anteriormente. Após a coloração por 1 h e lavagem por 1 h, as proteínas fluorescentes de OsMADS15-mOrange foram observadas utilizando um laser de 555 nm. No entanto, as proteínas fluorescentes não puderam ser observadas devido à fluorescência de fundo derivada do corante azul evans. Esta fluorescência de fundo foi quase eliminada lavando as amostras por 2h. Além disso, as proteínas fluorescentes eram mais claras se as amostras fossem deixadas durante a noite. Por isso, foi utilizada uma solução branca de calcofluor pura neste estudo. A fluorescência de fundo derivada do corante fluorescente deve ser verificada usando diferentes comprimentos de onda laser antes das observações.
Limitações do método
Como mostrado na Figura 3, foram observadas proteínas fluorescentes profundas nas amostras que tinham 130 μm de espessura após 2 semanas de tratamento de CS. Isso é consistente com os resultados mostrados na Figura 2D, onde a amostra de 130 μm de espessura tornou-se transparente após 2 semanas de tratamento de CS. No entanto, como mostrado na Figura 3A, a auto-fluorescência do citoplasma ainda era perceptível nos nódulos após 2 semanas e só foi completamente removida após 4 semanas de tratamento de CS. Os nódulos têm uma alta densidade celular e, portanto, requerem um tempo maior para remover materiais auto-fluorescentes.
Como mostrado na Figura 3C, proteínas fluorescentes profundas foram observadas nas folhas sem tratamento de CS, mas o brilho foi mais fraco do que nos nós e internos na mesma profundidade de 20 μm. Após 1 semana de tratamento de CS, as proteínas fluorescentes foram mais brilhantes. A clorofila é abundante em folhas e absorve 488 nm de luz de excitação. Eles também têm auto-fluorescência laranja/vermelha, que pode interferir com a observação de proteínas fluorescentes usando um laser de 555 nm. Após 1 semana de tratamento de CS, clorofila e outros materiais auto-fluorescentes foram removidos, resultando em imagens de alta relação sinal-ruído.
As profundidades que poderiam ser observadas nos tecidos após 2 semanas e 4 semanas de tratamento de CS não foram significativamente diferentes, embora as proteínas fluorescentes pareceram mais fracas após 4 semanas (Figura 3). Normalmente, o brilho das proteínas fluorescentes e da auto-fluorescência enfraquece com o tempo, resultando em uma maior relação sinal-ruído. Portanto, as proteínas fluorescentes podem ser observadas com mais clareza, ajustando as condições microscópicas e o processamento de imagens. Com base nesses resultados, concluiu-se que 2 semanas de tratamento de CS poderiam facilitar a observação de proteínas fluorescentes profundas, dadas as nossas condições amostrais. No entanto, 4 semanas são necessárias para observar imagens mais claras que excluem completamente os materiais auto-fluorescentes.
Estruturas com forte autofluorescência, como feixes vasculares e células multi-braço, não podem ser limpas no CS. Para observar essas estruturas sem autofluorescência, é necessário utilizar um método de gating de tempo12 ou obter imagens por espectroscopia do espectro da fluorescência. Um microscópio de dois fótons pode ser mais adequado para observar tecidos mais profundos se forem observados tecidos mais espessos.
Significância do método em relação aos métodos existentes e alternativos
Geralmente, as estruturas internas das plantas de arroz têm sido observadas usando criostat ou seção de vibratome. Um criostat é adequado para a preparação de seções finas, que permitem uma observação mais fácil, mas a preparação das amostras e o funcionamento do equipamento são demorados. Reconstruir a estrutura 3D original a partir de seções finas também é difícil. O vibratome é relativamente fácil de operar e adequado para produzir seções grossas. No entanto, seções grossas de tecidos alvo só permitem observações da superfície cortada e não de tecidos profundos que a luz não pode alcançar. Por essas razões, nenhum dos métodos é adequado para observações de fluorescência profunda.
Este estudo abordou desafios na observação de fluorescência profunda em brotos de arroz, como a penetração limitada de tecido do CS e a resolução de objetos pobres sob um microscópio confocal, combinando métodos existentes. Como mostrado na Figura 4, observamos proteínas fluorescentes (OsMADS15-mOrange) expressas nos tecidos profundos de brotos de arroz adulto do jovem panicle até a base. A Figura 4D concentra-se no florete e mostra proteínas fluorescentes profundas em intervalos de 3 μm. Tecidos com mais de −130 μm de profundidade foram observados após 2 semanas de tratamento de CS, mas apenas os tecidos dentro de −27 μm de profundidade foram observados (dados não mostrados) no florete no mesmo tamanho e estágio de crescimento sem tratamento de CS. O protocolo aprimorado atual permitiu a observação não apenas da superexpressão dos genes, mas também da expressão genética natural nos tecidos profundos dos brotos de arroz adultos.
Importância e aplicações potenciais do método em áreas específicas de pesquisa
Este protocolo, que otimiza a observação profunda da fluorescência de brotos de arroz adulto, permite a limpeza eficiente de tecidos duros, grossos ou em camadas, aparando tecidos desnecessários e aumentando a permeabilidade do CS. Além disso, a espessura das amostras para análise foi otimizada para permitir a observação contínua e estrutural de fluorescência profunda utilizando um microscópio a laser confocal, que normalmente não consegue resolver tecidos grossos ou opacos.
É difícil comparar amostras de arroz em diferentes estágios de crescimento porque as proteínas fluorescentes se degradam ao longo do tempo nas soluções fixativas e pbs. No entanto, as proteínas fluorescentes no CS podem ser armazenadas por mais de 5 meses1. A longa vida útil do CS é uma grande vantagem para a observação da fluorescência profunda no arroz.
Recentemente, muitas tecnologias de compensação foram desenvolvidas, possibilitando observar tecidos profundos em 3D, preservando suas estruturas internas. Essas tecnologias continuaram a evoluir, e novas soluções de compensação foram desenvolvidas. Um bom exemplo é o iTOMEI14, que permite uma remoção eficiente de clorofila e detecção de fluorescência mais brilhante. Outro exemplo é o ClearSeeAlpha15, que previne o browning de tecidos durante o tratamento de limpeza e os faz parecer transparentes. A combinação dessas soluções de compensação com o presente método pode permitir uma compensação mais eficiente e eficaz.
Espera-se que o método atual ajude a obter novas percepções através de imagens profundas não apenas de arroz, mas também de outras plantas.
Divulgações
Os autores não têm conflitos de interesse para declarar.
Agradecimentos
Agradecemos ao Dr. R. Terada, Dr. Z. Shimatani e Dr. H. Tsuji por nos fornecerem as sementes OsMADS15-mOrange; Dr. D. Kurihara por nos fornecer a construção do NGCN; e dr. R. Shim para edição de nosso manuscrito. Este trabalho foi financiado pela JSPS KAKENHI (números de subvenção JP20H05912, 20H05778, 20H05779) e pelo programa SATREPS (nº. JPMJSA1706) do JST e JICA.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | BIO-BIK | ST-0150F | |
| 12-multiwell plate | Corning | 353043 | |
| 50 mL conical tube | Corning | 352070 | |
| Calcofluor white solution | Sigma-Aldrich | 910090 | |
| ClearSee | FUJIFILM Wako Pure Chemical | 031-25151 | This can be made or purchased. |
| Confocal laser microscope | Carl Zeiss | LSM700 | |
| Desiccator | SANPLATEC | Custom made of acrylic. 30 cm (L), 30 cm (W), 14.5 cm (H) | |
| Glass coverslip (18 × 18 No.1) | MATSUNAMI | C018181 | |
| HEPES | FUJIFILM Wako Pure Chemical | 342-01375 | |
| Microscope slide (76 × 26) | MATSUNAMI | S2441 | |
| Paraffin film | Bemis | PM-996 | |
| Paraformaldehyde | FUJIFILM Wako Pure Chemical | 162-16065 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | |
| Sucrose | FUJIFILM Wako Pure Chemical | 190-00013 | |
| UBQpro::NLS-sGFP-nClover3-mNeonGreen (UBQpro::NGCN) | provided by Dr. Kurihara | ||
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | AS One | AS-01 | |
| Vibrating micro-slicer | DOSAKA | DTK-3000 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
Referências
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLoS One. 11 (8), 0161107 (2016).
- Pandey, K. B., et al. Plant roots sense soil compaction through restricted ethylene diffusion. Science. 371 (6526), 276-280 (2021).
- Ejaza, M., Bencivenga, S., Tavaresa, R., Busha, M., Sablowski, R. ARABIDOPSIS THALIANA HOMEOBOX GENE 1 controls plant architecture by locally restricting environmental responses. Proceedings of the National Academy of Sciences of the United States of America. 118 (17), (2021).
- Smetana, O., et al. High levels of auxin signalling define the stem-cell organizer of the vascular cambium. Nature. 565 (7740), 485-489 (2019).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11 (1), 23 (2018).
- Nagaki, K., Yamaji, N., Murata, M. ePro-ClearSee: A simple immunohistochemical method that does not require sectioning of plant samples. Scientific Reports. 7, 42203 (2017).
- Sato, M., Akashi, H., Sakamoto, Y., Matsunaga, S., Tsuji, H. Whole-tissue three-dimensional imaging of rice at single-cell resolution. International Journal of Molecular Sciences. 23 (1), 40 (2022).
- Matsuo, T., Hoshikawa, K. Science of the Rice Plant: Morphology. Food and Agriculture Policy Research Center. , (1993).
- Kobayashi, K., et al. Inflorescence meristem identity in rice is specified by overlapping functions of three AP1/FUL-Like MADS box genes and PAP2, a SEPALLATA MADS box gene. Plant Cell. 24 (5), 1848-1859 (2012).
- Tamaki, S., et al. FT-like proteins induce transposon silencing in the shoot apex during floral induction in rice. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 901-910 (2015).
- Kodama, Y. Time gating of chloroplast autofluorescence allows clearer fluorescence imaging In Planta. PLoS One. 11 (3), 0152484 (2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Communications Biology. 5 (1), 12 (2022).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: Advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados