Method Article
클리어링 기술을 통한 라이스 싹의 깊은 형광 관찰
요약
본 프로토콜은 조직의 단단하고 두껍거나 층상 된 특성으로 인해 내부 구조 관찰을 준비하기가 어려운 쌀 싹에 대한 클리어링 기술을 설명합니다. 이 방법은 성인 벼 식물에서도 지속적이고 깊은 형광 관찰을 용이하게합니다.
초록
굴절률 불일치를 제거하고 자동 형광 물질을 감소시키는 최근 개발 된 클리어링 기술은 내부 구조를 보존하면서 식물 조직을 3 차원 (3D)으로 관찰 할 수있게했습니다. 모노코트 모델 식물인 쌀(Oryza sativa L.)에 있어서는 세계적으로 중요한 작물이며, 뿌리나 잎 등 비교적 관찰하기 쉬운 장기에서 청산 기술이 보고되고 있다. 싹 정수리 메리스템(SAM) 및 줄기에서의 클리어링 기술의 응용도 보고되었지만, 이들 조직 내의 클리어링 용액(CS)의 열악한 침투 때문에 제한된 정도에 불과하다. 이러한 조직에서 클리어링 용액의 제한된 효율은 혈관 다발 및 표피가 발달하고 발수성 잎으로 SAM을 층상화함에 따라 줄기 내의 조직의 자동 형광, 두꺼움 및 경화에 기인합니다. 본 프로토콜은 SAM / Young panicle에서 개발 중 싹의 기저부까지 유전자 발현의 지속적이고 3D 관찰을위한 클리어링 접근법의 최적화를보고합니다. 형광 단백질 리포터를 발현하는 고정된 조직 샘플을 진동 마이크로슬라이서를 사용하여 절편으로 트리밍하였다. 적절한 두께가 달성되었을 때, CS가 적용되었다. 구체적으로 중앙 조직을 표적화함으로써, CS의 침투 속도 및 균일성이 증가하고, 조직을 투명하게 만드는 데 필요한 시간이 감소하였다. 또한 트리밍된 부분을 지우면 매크로 관점에서 전체 촬영의 내부 구조를 관찰할 수 있었습니다. 이 방법은 지우기 어려운 다른 식물 종의 조직을 심층적으로 이미징하는 데 잠재적 인 응용 프로그램을 가지고 있습니다.
서문
최근 개발된 클리어링 기술은 식물의 내부 구조를 보존하면서 식물의 깊은 조직을 관찰할 수 있게 해주었다(1,2,3). 디코트 모델 식물 Arabidopsis에서는 굴절률 불일치를 제거하고 자동 형광 물질4,5,6을 제거하기 위해 클리어링 기술을 사용하여 형광 단백질 이미징에 대한 많은 연구가 수행되었습니다. 세포 분해능9에서의 클리어링 기술7,8 및 3D 이미징의 사용이 모노코트 모델 식물 및 세계적으로 중요한 작물인 쌀(Oryza sativa L.)에서 보고되었지만, 이들은 관찰하기 쉬운 뿌리, 잎 및 싹 정점 메리스템(SAM)과 같은 비교적 얇고 부드러운 장기로 제한된다.
싹은 혈관 식물의 지상 부분을 구성하는 주요 기관입니다. 쌀에서 싹은 겨드랑이 새싹, 잎 및 줄기10으로 구성된 일련의 수직으로 쌓인 "phytomers"로 구성됩니다. 싹의 끝에서, SAM은 중앙에 미분화 줄기 세포로 구성되어 있습니다. 피토머는 SAM으로부터 유래된 세포의 분화에 의해 형성된다. 식물이 식물에서 생식 단계로 이동한 후, 벼 줄기는 길쭉해지고 SAM은 어린 패닉(10)으로 분화된다. 이 발달 변화는 줄기와 SAM / 젊은 패닉에서 다양한 유전자의 발현의 변동을 동반합니다. 다양한 조직으로의 세포 분화의 기초가되는 메커니즘을 이해하려면 내부 싹 조직에서 세포 형태 및 유전자 발현을 구조적으로 관찰하는 것이 중요합니다. 그러나 싹에서 줄기 (노드 및 노드)의 깊은 이미징은 조직에 침투하는 용액을 제거하는 비효율성 때문에 도전을 제시합니다. 줄기는 SAM으로부터 분화된 후 측방향 성장으로부터 즉시 급격한 부피 증가를 겪는다. 혈관 다발의 두꺼워짐과 결절 혈관 아나스토마증의 수평 복잡한 링크로 인한 쌀 노드 조직의 경화는 쌀 싹의 높은 기피성 외에도 줄기10에서 CS의 침투를 제한하는 데 기여합니다.
이 연구는 구조적 깊은 형광 기술을 사용하여 벼 싹 조직에서 유전자 발현의 변화를 관찰하는 것을 목표로했습니다. 이 작업은 공초점 레이저 현미경을 사용하여 평평한 표면이 아닌 3D 구조에서 SAM / Young 패닉에서 염기까지의 유전자 발현을 지속적으로 관찰하기 위해 쌀에 대한 클리어링 프로토콜을 최적화합니다.
프로토콜
1. 고정제액의 제조
- 멸균수 70mL를 유리병에 넣고 파라포름알데히드(PFA) 10g을 첨가한다.
주의: PFA는 독성이 있습니다. 따라서 장갑을 착용하는 것이 좋습니다. - 2 mL의 1 N NaOH를 첨가하여 PFA 용액을 용해시킨다.
- PFA 용액이 투명해질 때까지 약 1시간 동안 60°C에서 연속 교반(300-500 rpm)하면서 PFA 용액을 용해시킨다.
- 멸균수를 첨가하여 PFA 용액의 부피를 100 mL로 증가시킨다.
참고: PFA 용액은 사용 전에 신선하게 제조되었다. 더욱이, 4°C에서 저장된 PFA 용액은 대략 2개월 동안 사용될 수 있다. - 샘플링 직전에, 25 mL의 60 mM HEPES (pH 7.4), 3 mL의 1 M 수크로스, 및 2 mL의 멸균수를 첨가하여 20 mL의 10% PFA를 넣고 50 mL 고정 용액을 제조하였다.
2. 청산액(CS)의 제조
- 무게를 재량하고 50 mL의 멸균수에 7.5 g의 소듐 데옥시콜레이트, 5 g의 자일리톨 및 12.5 g의 요소( 물자 표 참조)를 혼합한다.
참고: 나트륨 데옥시콜레이트 분말은 공기 중 분산을 방지하기 위해 일반 실험실 드래프트 챔버에서 칭량되었다. - 성분을 용해시키고(단계 2.1.) 자석 교반기를 이용하여 CS를 제조하였다.
참고 : 본 연구는 사내에서 제조 된 클리어링 용액 (CS)을 사용했지만 상업적으로 이용 가능한 클리어링 솔루션 인 ClearSee ( 재료 표 참조)도 사용할 수 있습니다. - CS를 50 mL 원뿔형 튜브로 옮기고 어둠 속에서 실온 (15-30 °C)에 보관하십시오.
참고: CS는 1년 이상 저장할 수 있습니다.
3. 샘플링
- 식물을 손상시키지 않고 뿌리를 조심스럽게 자르십시오. 먼지를 제거하기 위해 식물을 물로 씻으십시오.
참고 :이 방법은 LS에 플래그를 지정하기 위해 세 잎 단계 (LS)에서 조직의 관찰을 연구했습니다. 본 연구는 8-10 LS에서 쌀 재배종 Nipponbare (Nip) 및 Taichung 65 (T65)를 사용했다. - 손과 핀셋으로 오래된 바깥 쪽 잎을 벗겨냅니다. 약 2-3 개의 잎이 남았습니다.
- SAM/Young 패닉에서 세포가 부서지지 않도록 슬라이딩 모션을 사용하여 단일 모서리 면도기로 조직을 베이스로 자릅니다(그림 1A-C). SAM / Young 패닉의 위치가 보이지 않으면 더 오래 자르십시오.
- 쌀 싹의 단면은 타원형 모양이므로 (그림 1D), 타원형의 한쪽면을 양날의 면도기로 장축 방향으로 얇게 면도합니다 (그림 1E-F).
참고: 이 단계를 통해 고정 용액이 샘플에 쉽게 침투할 수 있습니다. 수평 절단 표면은 샘플이 진동하는 마이크로 슬라이서( 재료 표 참조) 트레이에 쉽게 달라붙을 수 있도록 합니다. - SAM/Young 패닉의 위치를 샘플에서 희끄무레한 색상으로 표시하여 확인합니다(그림 1G). 과도한 조직을 다듬습니다.
참고: 샘플의 길이는 진동 마이크로 슬라이서를 사용하여 트리밍할 수 있는 최대 길이로 조정해야 합니다. 샘플이 너무 길면 여러 조각으로 나눕니다.
4. 샘플의 고정
- 1 mL의 고정액(단계 1에서 제조됨)을 1.5 mL 마이크로원심분리 튜브에 피펫하고 즉시 시료를 넣는다.
참고: 샘플의 양이 고정 용액 부피의 20%를 초과하지 않는지 확인하십시오. - 파라핀 필름 조각을 2.5cm2로 자릅니다. 파라핀 필름을 공으로 만들고 샘플 위에 올려 놓아 고정 용액에서 떠 다니는 것을 방지하십시오.
- 샘플이 들어있는 튜브를 데시케이터에 넣으십시오. 그런 다음 데시케이터의 뚜껑을 닫고 진공 펌프를 시작하여 -0.095 MPa가 될 때까지 데시케이터 내부를 천천히 감압하십시오.
- -0.095 MPa에서 데시케이터를 닫은 후 진공 펌프를 끄고 실온에서 30 분 동안 방치하십시오.
참고 : 진공 수준은 기포가 샘플에 점차적으로 나타나도록했습니다. - 데시케이터를 약간 열고 천천히 대기압으로 되돌립니다. 데시케이터의 압력을 -0.095 MPa로 낮추고 진공 펌프를 끄고 혼합물을 실온에서 30 분 동안 방치하십시오.
- 데시케이터를 약간 열고 천천히 대기압으로 되돌립니다. 샘플이 올바르게 고정되면 고정 솔루션으로 가라 앉습니다. 가라 앉지 않으면 압력을 다시 줄이십시오.
- 파라핀 필름을 제거하고, 뚜껑을 닫고, 튜브를 4°C에서 하룻밤 동안 유지한다.
참고: 샘플은 적어도 2 h 동안 고정 용액으로 고정되었다. ~ 1 주 동안 저장할 수 있습니다.
5. 고정 된 샘플 트리밍
- 보풀이 없는 물티슈를 사용하여 샘플에서 과도한 고정 용액을 제거합니다.
참고: 과도한 고정 용액은 샘플이 트레이에 제대로 달라붙는 것을 방지합니다. - 인스턴트 접착제로 진동하는 마이크로 슬라이서 트레이에 샘플을 고정시킵니다. 샘플링 중에 면도한 평평한 면을 아래로 내려 놓은 트레이에 놓습니다.
참고 : 쌀 싹의 구조로 인해 SAM / 젊은 패닉클쪽으로 바닥에서 다듬어야합니다. - 고정된 샘플에 따라 트리밍 조건을 설정합니다.
참고: 본 연구에서, 트리밍은 THICK, 130 μm로 설정되었다; 넓이, 15 mm; 주파수, 15 %; 절삭 속도, 32mm. - RVS 또는 FWD 버튼과 UP 또는 DOWN 버튼으로 샘플 위치를 조정합니다. 모든 샘플이 침지될 때까지 트레이를 탈이온수로 채웁니다. 트레이를 채운 후 시작 버튼을 누릅니다. 트리밍된 샘플을 1x PBS 한 방울로 유리 슬라이드 위에 놓습니다.
참고: 하드 샘플이 면도날을 마모시키기 때문에 각 트리밍 후에 샘플의 위치를 다른 쪽으로 이동합니다. - 표적 부위를 함유하는 샘플을 입체현미경으로 확인한 후, 트리밍된 샘플을 1 mL의 1x PBS가 있는 멀티웰 플레이트로 옮긴다.
참고: 샘플의 크기에 따라 웰 수를 선택합니다. 이 연구에서, 12-멀티웰 플레이트가 사용되었다.
6. 청산 용액으로 처리
- 멀티웰 플레이트로부터 1x PBS를 제거하고 신선한 1x PBS를 첨가한다. 1 분 동안 그대로 두십시오.
- PBS 1개를 제거하고 CS를 추가합니다.
참고: CS의 양은 샘플 볼륨의 다섯 배여야 합니다. - 샘플을 포함하는 멀티웰 플레이트를 데시케이터에 놓는다. 그런 다음 데시케이터의 뚜껑을 닫고 진공 펌프를 시작하여 -0.09 MPa가 될 때까지 데시케이터 내부를 천천히 감압하십시오.
- -0.09 MPa에서 데시케이터를 닫은 후 진공 펌프를 끄고 실온에서 1 시간 동안 방치하십시오.
- 데시케이터를 약간 열고 천천히 대기압으로 되돌립니다.
- CS의 증발을 방지하기 위해 웰 사이의 틈새에 탈이온수를 붓습니다. 멀티웰 플레이트를 어둠 속에서 실온에서 보관하여 클리어링하십시오.
참고: 엽록소 및 기타 성분을 확산시키기 위해 1-2일마다 멀티웰 플레이트를 부드럽게 흔들어 주십시오. - CS가 녹색으로 바뀌면 새로운 솔루션으로 교체하십시오.
7. 화학 염료로 염색하는 세포벽
- 칼코플루오르 백색 용액(1 mL, 최종 농도: 클리어링 용액 중 1 mg/mL, 재료 표 참조)을 멀티웰 플레이트에 피펫팅합니다. 샘플을 염료 용액에 넣고 1시간 동안 인큐베이션한다.
참고 : 염료의 부피는 CS 부피의 10 %를 초과해서는 안됩니다. - 염색된 샘플을 1 mL의 CS로 다른 멀티웰 플레이트에서 적어도 1시간 동안 세척한다.
8. 공초점 레이저 현미경으로 관찰
- CS 한 방울을 현미경 슬라이드 상에 놓고 처리된(CS로) 샘플을 슬라이드 상으로 옮긴다.
참고 : 처리 된 샘플은 부드럽기 때문에 핀셋으로 조심스럽게 다루어야합니다. - CS의 증발을 방지하기 위해 유리 커버슬립으로 샘플을 덮으십시오.
참고: CS는 쉽게 침전됩니다. - 처리 된 샘플을 공초점 레이저 현미경으로 관찰하십시오.
참고: 관찰 후, 처리된 샘플은 추후 추가 관찰을 위해 CS로 리턴될 수 있다.
결과
첫째, 성충 처리에 의해 성충 벼 식물의 단단하고 두꺼운 조직이 투명하게 될 수있는 정도를 검증했다. 패닉 형성 단계 인 9-10 LS에서 닙 (Nip)과 어린 패닉에서 싹의 기저부까지 잘라낸 12-16 mm 길이의 조직이 사용되었습니다. 젊은 패닉을 포함한 이들 샘플은 고정 용액에 고정되었고, 클리어링 처리의 1-4주 전후에 관찰되었다(도 2). 트리밍되지 않은 샘플은 녹색으로 유지되었고 4주 후 또는 클리어링 용액으로 3개월 처리 후에도 투명해지지 않았다(도 2A). 모든 잎을 벗겨낸 샘플에서, 노드는 녹색으로 유지되었지만 CS로 1 주일 치료 후 인터 노드는 흰색으로 변했습니다. 이 샘플은 4주 후에 투명해지지 않았다(도 2B). CS로 3 개월 치료 한 후, 젊은 패닉 만 투명하게되었습니다. 손으로 손질한 샘플은 CS로 치료한 지 1주일 후에 바깥쪽 잎과 혈관 다발을 제외하고는 흰색으로 바뀌었다. 잎, 어린 패닉 및 인터노드의 일부 부분은 반투명 해졌지만 4 주 후에는 투명하지 않았습니다 (그림 2C). 3 개월 후, 어린 패닉과 내부 잎 만 투명하게되었습니다. 진동하는 마이크로 슬라이서로 130 μm 두께로 트리밍된 샘플은 CS로 1주일간 처리한 후 반투명이 되었고, 잎은 투명하게 변했다. 2주 후, 샘플은 거의 투명하였고, 4주 후에도 변하지 않은 채로 남아있었다(도 2D). 3 개월 후, 샘플은 완전히 투명하게되었습니다.
다음에, 클리어링 처리가 허용된 8 LS에서의 T65의 싹에서 유전자 발현 관찰이 허용된 깊이를 검증하였다. UBQpro:: NLS-sGFP-nClover3-mNeonGreen (UBQpro ::NGCN, Table of Materials) 발현된 싹을 사용하였다. 조직 샘플은 진동 마이크로 슬라이서를 사용하여 이를 130 μm 두께로 트리밍하기 전에 고정 용액에 고정시켰다. 이어서, 샘플을 공초점 레이저 현미경 (레이저: 488 nm/13%, 목표: 20x, 핀홀: 0.93 AU, 평균화: 16, 검출기 이득: 800)으로 CS로 처리한 후 0-4주부터 매주 z축 방향으로 10 μm 간격으로 관찰하였다. 대표적인 결과를 도 3에 나타내었다. 모든 수치는 형광 강도를 비교하기 위해 동일한 처리로 조정되었다. 처리되지 않은 노드에서, -40 μm의 깊이에서 희미한 형광 신호가 관찰되었다 (도 3A). 관찰 가능한 깊이는 CS 처리 1주 후 -60 μm, 2주 후 -90 μm였지만, 세포질의 자동 형광은 -20 μm의 깊이에서 두 주 모두에서 눈에 띄었다. 자가형광은 3주 후에 다소 약해졌고 4주 후에는 더 이상 보이지 않았다. 형광 신호는 3주째에 -80μm의 깊이에서, 4주째에 -100μm의 깊이에서 관찰되었다. 인터노드에서, 형광 신호는 CS 처리 없이 -60 μm의 깊이에서 관찰되었다(도 3B). 관찰 가능한 깊이는 CS 처리 후 1주 내지 3주 후에 -90 μm, 4주 후에 -100 μm였지만, 세포질에서의 자동 형광은 1주 후에 -20 μm의 깊이에서 두드러졌다. 자가형광은 2주 후에 더 이상 보이지 않았다. 잎에서, 형광 신호는 CS 처리 없이 -90 μm의 깊이에서 관찰되었다(도 3C). 형광 신호는 노드 및 노드 간보다 잎에서 더 깊게 관찰되었다. 그러나, 형광 신호는 더 약하였다. 형광 신호는 CS 처리 1주일 후에 명확해졌고, -120 μm의 깊이에서 관찰되었다. 2주 및 3주 후, 형광 신호는 -110 μm의 깊이에서, 그리고 4주 후, -120 μm의 깊이에서 관찰되었다.
마지막으로, mOrange 12와 융합된 전사 인자 OsMADS1511 의 발현이 관찰되었고, 이는 SAM의 전이를 식물로부터 생식기13으로 조절한다. Nip으로부터의 조직 샘플을 OsMADS15-mOrange로 10 LS에서 고정시키고, 130 μm 두께로 트리밍하고, 2주 동안 CS로 처리하였다. 도 4 는 클리어링 용액을 동시에 사용하여 천연 유전자 발현과 형광염료 염색(calcofluor white)의 형광 단백질(OsMADS15-mOrange)을 관찰할 수 있음을 보여준다. 0 내지 -130 μm 깊이에서 전체 플로렛이 관찰되었고, 3D 이미지는 3 μm 간격으로 43 z-스택 이미지로부터 재구성되었다(그림 4E).

그림 1: 샘플링 위치 및 처리. (A) 단일 조건 하에서 8 LS에서의 닙 묘목. (B) 기지의 확대 전망. (C) SAM / Young 패닉에서 기지까지 샘플 컷 아웃. (D) C로부터의 타원형 단면(인셋). (E) 칼날로 싹의 한쪽면을 얇게 면도한다. (F) 얇게 면도한 표면. (g) 노드 간 신장을 보여주는 샘플. 화살촉으로 표시된 희끄무레 한 부분은 노드입니다. 상위 노드의 위쪽에는 젊은 패닉이 있습니다. 스케일 바: (A) 10cm, (B-C, E-G) 1cm, (D) 0.5cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 조직 제거는 샘플 두께 및 CS 치료 기간에 따라 다릅니다 . (A) 어린 패닉을 포함한 부분 싹이 있는 트리밍되지 않은 샘플. 최대 두께 : 4mm. (B) 모든 잎이 샘플에서 벗겨져 어린 패닉을 노출시킵니다. 최대 두께 : 2.5 mm. yp : 젊은 패닉, 인 : 노드 간; 화살표는 노드를 나타냅니다. (c) 1mm 두께로 손으로 손질한 샘플. (d) 진동하는 마이크로슬라이서로 130 μm 두께로 트리밍된 샘플. 스케일 바: 5mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
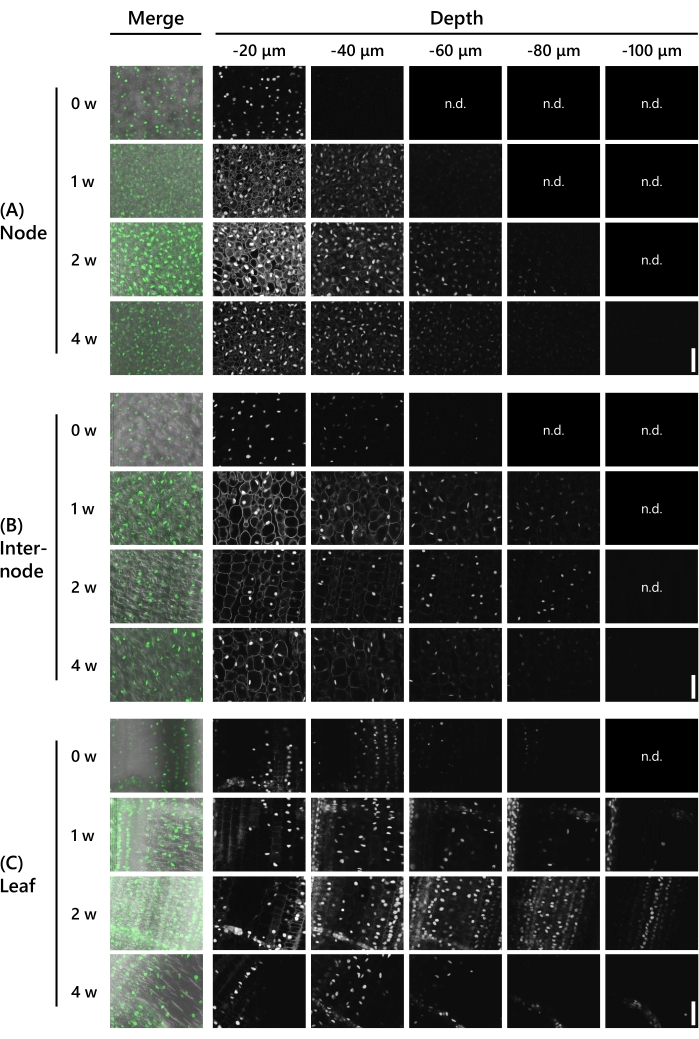
도 3: 형광 관찰의 깊이는 조직 유형 및 CS 치료 기간에 의존한다. UBQpro::NGCN 의 심층 이미징은 (A) 노드, (B) 인터노드 및 (C) 잎에서 이루어집니다. "병합"은 이미지가 차동 간섭 콘트라스트(DIC) 이미지 및 모든 z-스택 이미지와 융합되었음을 의미합니다. 형광이 관찰되지 않은 이미지는 "n.d"로 표시되었다. (감지되지 않음). 공초점 레이저 현미경의 설정은 다음과 같습니다 : 레이저 : 488 nm / 13 %, 목표 : 20x, 핀홀 : 0.93 AU, 평균 : 16, 검출기 이득 : 800, 간격 : 10 μm. 배율 막대: 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
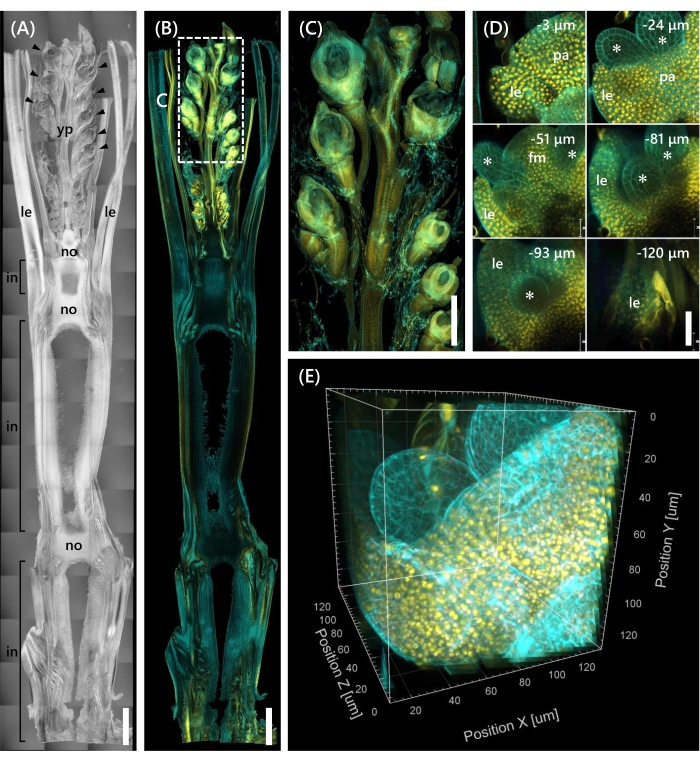
도 4: OsMADS15-mOrange의 깊은 형광 관찰. (A) 10 LS에서의 Nip의 DIC 이미지. yp: 젊은 패닉, le: 잎, 아니오: 노드, 에서: 노드 간; 화살촉은 플로렛을 나타냅니다. (B) OsMADS15-mOrange의 형광 이미지. 노란색 점은 핵에서 OsMADS15-mOrange의 형광 단백질을 나타냅니다. 세포벽을 칼코플루오르 백색 용액으로 시안색으로 염색하였다. (C) 젊은 패닉에 대한 확대 된 견해. (D) 플로렛의 깊은 이미징. pa: palea, le: lemma, fm: floral meristem; 별표는 stamen primordia를 나타냅니다. 공초점 레이저 현미경은 다음과 같이 설정되었다: OsMADS15-mOrange; 레이저: 555 nm/13%, 목표: 20x, 핀홀: 0.96 AU, 평균화: 16, 검출기 이득: 800, 간격: 3 μm. 칼코플루오르 화이트; 레이저: 405nm/3%, 목표: 20x, 핀홀: 0.93 AU, 평균: 16, 검출기 이득: 470, 간격: 3 μm. (E) z-스택 이미지로부터 구성된 그림(D)의 3D 이미지. 스케일 바: (A-B) 1mm, (C) 500μm, (D) 40μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
프로토콜의 중요한 단계
이 프로토콜의 중요한 단계는 고정 및 트리밍입니다. 쌀 싹은 단단하고 두껍거나 겹겹이 쌓인 조직을 가지고있어 고정 용액의 침투를 제한합니다. 고정 용액의 투과성을 향상시키기 위해, 도 1E-F에 도시된 바와 같이, 샘플링에서 조직의 한쪽 면을 얇게 면도하였다. 또한, 진공 처리를 더 높은 압력을 사용하여 두 번 반복하였다. 또한, 샘플을 4°C에서 통상 2시간 고정하는 대신 4°C에서 밤새 고정시켰다.
트리밍 단계의 핵심은 짧은 기간의 CS 처리 후에 그들의 내부 구조를 보존하면서 형광 단백질을 관찰하기 위해 제조되는 조직의 두께를 결정하는 것이다. 도 2C에 도시된 바와 같이, 가능한 한 얇게 손으로 트리밍된 1mm 두께의 샘플은 CS 처리 3개월 후에도 제한된 수의 조직에서만 투명해졌다. 따라서 트리밍 단계는 성인 쌀 싹의 깊은 형광 관찰에 필수적입니다. 본 연구에서, 샘플은 도 2D에 도시된 바와 같이 130 μm의 두께로 트리밍되었다. 130 μm 두께로 CS 처리 1주 후에 잎을 맑게 하고 2주 후에 전체 샘플을 제거하였다. 9-10 LS에서의 성인 쌀 싹이 본 연구에 사용되었다. 젊은 쌀 싹에서 두껍지 만 부드러운 조직은 CS 치료로 더 빨리 제거 될 수 있습니다. 샘플의 두께 및 CS 치료의 지속 기간은 관찰되는 3D 구조물의 조직 유형, 상태 및 두께에 따라 조정되어야 한다.
수정 및 문제 해결 방법
CS는 저온에서 쉽게 침전되었습니다. 침전된 CS는 형광 단백질을 보존할 수 없고; 따라서 샘플을 적절한 온도에서 보관할 때는주의를 기울여야합니다. 또한, CS와 고정 용액 모두 살균 효과가 없습니다. 따라서, 형광 단백질은 오염되면 분해될 것이다. 토양에서 재배 된 쌀은 곰팡이가 자라기 쉽습니다. 따라서 시료의 샘플링 및 취급은 오염을 피하기 위해 신중하게 수행되어야합니다.
완충액 내의 과량의 형광 염료는 배경 형광을 방출하고 현미경 관찰을 방해할 수 있다. 예를 들어, 에반스 블루 염료를 함유하는 칼코플루오르 백색 용액이 이전에 사용되었다. 1 h 동안 염색하고 1 h 동안 세척한 후, 555 nm 레이저를 사용하여 OsMADS15-mOrange의 형광 단백질을 관찰하였다. 그러나, 형광 단백질은 에반스 블루 염료로부터 유래된 배경 형광 때문에 관찰될 수 없었다. 이러한 배경 형광은 샘플을 2시간 동안 세척함으로써 거의 제거되었다. 더욱이, 형광 단백질은 샘플이 하룻밤 사이에 남겨진 경우 더 명확했다. 따라서, 순수한 칼코플루오르 백색 용액이 본 연구에 사용되었다. 형광 염료로부터 유래된 배경 형광은 관찰 전에 상이한 레이저 파장을 사용하여 검사되어야 한다.
방법의 제한 사항
도 3에 나타난 바와 같이, CS 처리 2주 후 130 μm 두께였던 시료에서 깊은 형광 단백질이 관찰되었다. 이는 도 2D에 나타낸 결과와 일치하며, 여기서 130 μm 두께의 샘플은 CS 처리 2주 후에 투명해졌다. 그러나, 도 3A에 나타난 바와 같이, 세포질의 자동 형광은 2주 후에도 노드에서 여전히 눈에 띄었고, CS 처리 4주 후에야 완전히 제거되었다. 노드는 높은 셀 밀도를 가지며, 따라서 자동 형광 물질을 제거하는 데 더 긴 시간이 필요합니다.
도 3C에 나타난 바와 같이, CS 처리가 없는 잎에서 깊은 형광 단백질이 관찰되었으나, 20 μm의 동일한 깊이에서 노드와 인터노드에서의 밝기는 그보다 약하였다. CS 처리 1주 후, 형광 단백질은 더 밝아졌다. 엽록소는 잎에 풍부하며 488nm의 여기 빛을 흡수합니다. 그들은 또한 주황색 / 적색 자동 형광을 가지고있어 555nm 레이저를 사용하여 형광 단백질의 관찰을 방해 할 수 있습니다. CS 처리 1주일 후, 엽록소 및 기타 자동 형광 물질이 제거되어 높은 신호 대 잡음비 이미지가 생성되었다.
CS 처리 2주 및 4주 후 조직에서 관찰할 수 있었던 깊이는 크게 다르지 않았으나, 4주 후에는 형광 단백질이 약하게 나타났다(도 3). 일반적으로 형광 단백질과 자동 형광의 밝기는 시간이 지남에 따라 약해져 신호 대 잡음비가 높아집니다. 따라서, 형광 단백질은 현미경 조건 및 화상 처리를 조정함으로써 보다 명확하게 관찰될 수 있다. 이러한 결과를 바탕으로, CS 처리 2 주가 우리의 샘플 조건을 고려할 때 깊은 형광 단백질의 관찰을 촉진 할 수 있다고 결론지었다. 그러나 자동 형광 물질을 완전히 배제하는보다 선명한 이미지를 관찰하려면 4 주가 필요합니다.
혈관 다발 및 다암 세포와 같은 강한 자기 형광을 가진 구조는 CS에서 제거 될 수 없습니다. 자기 형광 없이 이들 구조를 관찰하기 위해서는, 시간 게이팅 방법(12 )을 사용하거나 형광 스펙트럼의 분광법에 의해 이미지를 얻을 필요가 있다. 이광자 현미경은 두꺼운 조직이 관찰되는 경우 더 깊은 조직을 관찰하는 데 더 적합 할 수 있습니다.
기존 및 대체 방법에 대한 방법의 중요성
일반적으로 벼 식물의 내부 구조는 냉동 또는 비브라톰 단면화를 사용하여 관찰되었습니다. cryostat은 더 쉽게 관찰 할 수있는 얇은 섹션을 준비하는 데 적합하지만 샘플 준비 및 장비 작동에는 시간이 많이 걸립니다. 얇은 단면에서 원래의 3D 구조를 재구성하는 것도 어렵습니다. 비브라톰은 비교적 작동하기 쉽고 두꺼운 단면을 생산하는 데 적합합니다. 그러나 표적 조직의 두꺼운 부분은 절단 표면의 관찰 만 허용하고 빛이 도달 할 수없는 깊은 조직은 관찰하지 못합니다. 이러한 이유로 어느 방법도 깊은 형광 관찰에 적합하지 않습니다.
이 연구는 기존의 방법을 결합하여 CS의 제한된 조직 침투와 공초점 현미경 하에서의 불량한 물체 분해능과 같은 쌀 싹에서의 심층 형광 관찰의 과제를 해결했습니다. 도 4에 나타난 바와 같이, 젊은 패닉에서 기저부까지 성인 벼 싹의 깊은 조직에서 발현되는 형광 단백질(OsMADS15-mOrange)을 관찰하였다. 도 4D는 플로렛에 초점을 맞추고 3 μm 간격으로 깊은 형광 단백질을 보여준다. -130 μm 깊이에 걸친 조직은 CS 처리 2주 후에 관찰되었지만, CS 처리 없이 동일한 크기 및 성장 단계에서 플로렛에서 -27 μm 깊이 내의 조직만이 관찰되었다(데이터는 나타내지 않음). 현재의 개선 된 프로토콜은 유전자의 과발현뿐만 아니라 성인 벼 싹의 깊은 조직에서의 자연 유전자 발현을 관찰 할 수있게했습니다.
특정 연구 분야에서이 방법의 중요성과 잠재적 인 적용
성인 쌀 싹의 깊은 형광 관찰을 최적화하는이 프로토콜은 불필요한 조직을 트리밍하고 CS의 투과성을 증가시킴으로써 단단하고 두껍거나 층상 된 조직을 효율적으로 제거 할 수 있습니다. 또한, 분석을 위한 샘플의 두께는 일반적으로 두껍거나 불투명한 조직을 해결할 수 없는 공초점 레이저 현미경을 사용하여 연속적이고 구조적인 심층 형광 관찰을 허용하도록 최적화되었습니다.
고정제 및 PBS 용액에서 형광 단백질이 시간이 지남에 따라 분해되기 때문에 다른 성장 단계에서 쌀 샘플을 비교하는 것은 어렵습니다. 그러나, CS 내의 형광 단백질은1개월 이상 5개월 이상 저장될 수 있다. CS의 긴 유통 기한은 쌀에서 깊은 형광 관찰을위한 주요 이점입니다.
최근에는 많은 클리어링 기술이 개발되어 내부 구조를 보존하면서 3D로 깊은 조직을 관찰 할 수 있습니다. 이러한 기술은 계속 발전해 왔으며 새로운 청산 솔루션이 개발되었습니다. 좋은 예는 iTOMEI14로, 효율적인 엽록소 제거와 더 밝은 형광 검출을 가능하게 합니다. 또 다른 예는 ClearSeeAlpha15로, 치료 중 조직의 갈변을 방지하고 투명하게 보이게합니다. 이러한 클리어링 솔루션을 본 방법과 결합하면 보다 효율적이고 효과적인 클리어링을 가능하게 할 수 있다.
현재의 방법은 쌀뿐만 아니라 다른 식물에 대한 심층적 인 이미징을 통해 새로운 통찰력을 얻는 데 도움이 될 것으로 예상됩니다.
공개
저자는 선언 할 이해 상충이 없습니다.
감사의 말
우리는 Dr. R. Terada, Dr. Z. Shimatani 및 Dr. H. Tsuji에게 OsMADS15-mOrange 씨앗을 제공해 주신 것에 감사드립니다. Dr. D. Kurihara는 NGCN 구조를 우리에게 제공해주었습니다. 그리고 R. Shim 박사가 원고를 편집했습니다. 이 작품은 JSPS KAKENHI (보조금 번호 JP20H05912, 20H05778, 20H05779)와 SATREPS 프로그램 (아니오. JPMJSA1706)의 JST 및 JICA.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | BIO-BIK | ST-0150F | |
| 12-multiwell plate | Corning | 353043 | |
| 50 mL conical tube | Corning | 352070 | |
| Calcofluor white solution | Sigma-Aldrich | 910090 | |
| ClearSee | FUJIFILM Wako Pure Chemical | 031-25151 | This can be made or purchased. |
| Confocal laser microscope | Carl Zeiss | LSM700 | |
| Desiccator | SANPLATEC | Custom made of acrylic. 30 cm (L), 30 cm (W), 14.5 cm (H) | |
| Glass coverslip (18 × 18 No.1) | MATSUNAMI | C018181 | |
| HEPES | FUJIFILM Wako Pure Chemical | 342-01375 | |
| Microscope slide (76 × 26) | MATSUNAMI | S2441 | |
| Paraffin film | Bemis | PM-996 | |
| Paraformaldehyde | FUJIFILM Wako Pure Chemical | 162-16065 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | |
| Sucrose | FUJIFILM Wako Pure Chemical | 190-00013 | |
| UBQpro::NLS-sGFP-nClover3-mNeonGreen (UBQpro::NGCN) | provided by Dr. Kurihara | ||
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | AS One | AS-01 | |
| Vibrating micro-slicer | DOSAKA | DTK-3000 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
참고문헌
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLoS One. 11 (8), 0161107 (2016).
- Pandey, K. B., et al. Plant roots sense soil compaction through restricted ethylene diffusion. Science. 371 (6526), 276-280 (2021).
- Ejaza, M., Bencivenga, S., Tavaresa, R., Busha, M., Sablowski, R. ARABIDOPSIS THALIANA HOMEOBOX GENE 1 controls plant architecture by locally restricting environmental responses. Proceedings of the National Academy of Sciences of the United States of America. 118 (17), (2021).
- Smetana, O., et al. High levels of auxin signalling define the stem-cell organizer of the vascular cambium. Nature. 565 (7740), 485-489 (2019).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11 (1), 23 (2018).
- Nagaki, K., Yamaji, N., Murata, M. ePro-ClearSee: A simple immunohistochemical method that does not require sectioning of plant samples. Scientific Reports. 7, 42203 (2017).
- Sato, M., Akashi, H., Sakamoto, Y., Matsunaga, S., Tsuji, H. Whole-tissue three-dimensional imaging of rice at single-cell resolution. International Journal of Molecular Sciences. 23 (1), 40 (2022).
- Matsuo, T., Hoshikawa, K. Science of the Rice Plant: Morphology. Food and Agriculture Policy Research Center. , (1993).
- Kobayashi, K., et al. Inflorescence meristem identity in rice is specified by overlapping functions of three AP1/FUL-Like MADS box genes and PAP2, a SEPALLATA MADS box gene. Plant Cell. 24 (5), 1848-1859 (2012).
- Tamaki, S., et al. FT-like proteins induce transposon silencing in the shoot apex during floral induction in rice. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 901-910 (2015).
- Kodama, Y. Time gating of chloroplast autofluorescence allows clearer fluorescence imaging In Planta. PLoS One. 11 (3), 0152484 (2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Communications Biology. 5 (1), 12 (2022).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: Advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유