Method Article
伐採技術 による 稲作の深部蛍光観察
要約
本プロトコールは、組織の硬く、厚い、または層状の性質のために内部構造観察の準備が困難なイネの芽の清算技術を記述する。この方法は、成体のイネ植物においても、連続的かつ深い蛍光観察を容易にする。
要約
最近開発された屈折率の不一致を排除し、自動蛍光材料を減少させるクリアリング技術により、植物組織の内部構造を維持しながら3次元(3D)で観察することが可能になりました。単子葉植物モデル植物であり、世界的に重要な作物であるイネ(Oryza sativa L)では、根や葉など比較的観察しやすい器官の清澄化技術が報告されています。茎頂分裂組織(SAM)および茎における清澄化技術の応用も報告されているが、これらの組織における清澄化溶液(CS)の浸透が乏しいため、限られた程度にすぎない。これらの組織における清澄溶液の限られた効率は、維管束および表皮が発達するにつれて茎内の組織の自己蛍光、肥厚、および硬化、および撥水性葉によるSAMの層状化に起因する。本プロトコールは、SAM/若穂から発生中の苗条の基部までの遺伝子発現を連続的かつ3D観察するためのクリアリングアプローチの最適化を報告する。蛍光タンパク質レポーターを発現する固定組織サンプルを、振動マイクロスライサーを用いて切片にトリミングした。適切な厚さに達したら、CSを適用した。中央組織を特異的に標的とすることにより、CSの浸透速度および均一性が増加し、組織を透明にするのに必要な時間が減少した。さらに、トリミングされた部分をクリアすることで、撮影全体の内部構造をマクロの視点から観察することができました。この方法は、クリアが困難な他の植物種の組織の深いイメージングに応用できる可能性がある。
概要
最近開発されたクリアリング技術により、植物の内部構造を維持しながら植物の深部組織を観察することが可能になりました1,2,3。双子葉植物シロイヌナズナでは、屈折率の不一致を排除し、自動蛍光物質を除去するために、クリアリング技術を用いて蛍光タンパク質イメージングに関する多くの研究が行われてきた4,5,6。単子葉植物であり、世界的に重要な作物であるイネ(Oryza sativa L.)では、細胞分解能9でのクリアリング技術7,8および3Dイメージングの使用が報告されているが、これらは観察しやすい根、葉、茎頂分裂組織(SAM)などの比較的薄くて柔らかい器官に限定されている。
シュートは維管束植物の地上部を構成する主要な器官である。イネにおいて、苗条は、腋窩芽、葉、および茎10を含む一連の垂直に積み重ねられた「フィトマー」から構成される。シュートの先端では、SAMは中心の未分化幹細胞で構成されています。フィトマーは、SAMに由来する細胞の分化によって形成される。植物が栄養期から生殖期に移行すると、イネの茎は細くなり、SAMは若い穂に分化する10。この発生変化は、茎およびSAM/若穂における様々な遺伝子の発現の変動を伴う。様々な組織への細胞分化のメカニズムを理解するためには、シュート組織内部の細胞形態や遺伝子発現を構造的に観察することが重要です。しかし、シュート中のステム(ノードおよびノード間)の深いイメージングは、組織に浸透するための溶液をクリアすることの非効率性のために課題を提示する。茎は、SAMからの分化後、側方成長から直ちに急速な体積増加を受ける。維管束の肥厚および結節血管吻合の水平複合リンクによるイネ節組織の硬化は、イネの芽の高い忌避性に加えて、すべて茎10におけるCSの浸透を制限することに寄与する。
本研究は、構造的深部蛍光法を用いて、イネの茎組織における遺伝子発現の変化を観察することを目指した。この研究は、共焦点レーザー顕微鏡を用いて、SAM/若穂から基部までの遺伝子発現を平らな表面ではなく3D構造で連続的に観察するためのイネのクリアリングプロトコルを最適化します。
プロトコル
1. 固定液の調製
- 70mLの滅菌水をガラス瓶に移し、10gのパラホルムアルデヒド(PFA)を加える。
注意: PFA は有毒です。したがって、手袋を着用することをお勧めします。 - 2 mL の 1 N NaOH を加えて PFA 溶液を溶解します。
- PFA溶液が透明になるまで、60°Cで約1時間連続攪拌(300〜500rpm)しながらPFA溶液を溶解する。
- 滅菌水を加えてPFA溶液の容量を100mLに増やします。
注:PFA溶液は、使用前に新たに調製した。また、4°Cで保存したPFA溶液を約2ヶ月間使用できます。 - サンプリングの直前に、25 mL の 60 mM HEPES (pH 7.4)、3 mL の 1 M スクロース、および 2 mL の滅菌水を 20 mL の 10 % PFA に加え、50 mL の固定液溶液を調製した。
清澄化液(CS)の調製
- 7.5gのデオキシコール酸ナトリウム、5gのキシリトール、および12.5gの尿素( 材料表を参照)を50mLの滅菌水に計量して混合する。
注:デオキシコール酸ナトリウム粉末は、空気中の分散を防ぐために、一般的な実験室ドラフトチャンバーで秤量された。 - 各成分を溶解し(工程2.1.)、マグネチックスターラーを用いて、CSを調製した。
注:本試験では、社内で調製した清澄液(CS)を用いたが、市販の清澄液であるClearsee( 材料表参照)を使用することもできる。 - CSを50mLの円錐形チューブに移し、室温(15〜30°C)で暗所に保管する。
注:CSは1年以上保存できます。
3. サンプリング
- 植物を傷つけることなく根を慎重に切る。汚れを取り除くために水で植物を洗う。
注:この方法は、LSにフラグを立てるために3葉段階(LS)からの組織の観察を研究した。本研究では、イネ品種の日本裸(Nip)と台中65(T65)を8-10LSで用いた。 - 古い外側の葉を手とピンセットで剥がします。2~3枚ほどの葉が残っていました。
- 細胞が押しつぶされないように、スライド運動を使用して片刃のカミソリでSAM/若い穂から基部までの組織を切断します(図1A-C)。SAM/若い穂の位置が見えない場合は、長く切ります。
- イネの茎の断面は楕円形をしていますので(図1D)、両刃のカミソリで楕円形の片側を長軸方向に薄く削ります(図1E-F)。
注:このステップにより、固定液がサンプルに浸透しやすくなりました。水平な切断面により、サンプルを振動マイクロスライサー( 材料表を参照)トレイに貼り付けやすくなります。 - サンプル中の白っぽい色の出現により、SAM/若穂の位置を確認します(図1G)。余分な組織をトリミングします。
メモ:サンプルの長さは、振動マイクロスライサーを使用してトリミングできる最大長に調整する必要があります。サンプルが長すぎる場合は、いくつかの部分に分割します。
4. サンプルの固定
- 固定液溶液(工程1で調製)1 mLを1.5 mL微量遠心チューブにピペットで入れ、直ちに試料を入れた。
注:サンプルの量が固定液の容量の20%を超えないようにしてください。 - パラフィンフィルムを2.5cm2に切り取る。パラフィンフィルムをボールに成形し、固定液から浮遊しないようにサンプルの上に置きます。
- 試料を入れたチューブをデシケーターに入れます。次に、デシケータの蓋を閉め、真空ポンプを起動して、デシケータの内部を−0.095MPaまでゆっくりと減圧します。
- デシケータを−0.095MPaで閉じた後、真空ポンプをオフにし、室温で30分間放置する。
注:真空レベルは、サンプル中に気泡が徐々に現れるようなものでした。 - デシケーターを少し開き、ゆっくりと大気圧に戻します。デシケータの圧力を−0.095MPaまで下げ、真空ポンプをオフにして、混合物を室温で30分間放置する。
- デシケーターを少し開き、ゆっくりと大気圧に戻します。サンプルが正しく固定されると、固定液に沈みます。沈まなかった場合は、もう一度圧力を下げてください。
- パラフィンフィルムを取り出し、蓋を閉め、チューブを4°Cで一晩保った。
注:サンプルは、少なくとも2時間固定液中で固定された。それは〜1週間保存することができます。
5. 固定サンプルのトリミング
- 糸くずの出ないワイプを使用して、サンプルから余分な固定液を除去します。
メモ:過剰な固定液溶液は、サンプルがトレイに正しくくっつくのを妨げます。 - インスタント接着剤で振動マイクロスライサートレイにサンプルを固定します。サンプリング中に剃り落とした平らな面を下にしてトレイの上に置きます。
注:稲作の構造上、ベースからSAM /若穂に向かってトリミングする必要があります。 - 固定サンプルに応じたトリミング条件を設定します。
注:この研究では、トリミングはTHICK、130 μmに設定されました。ワイド, 15 ミリメートル;頻度、15%;切削速度、32ミリメートル。 - RVSまたはFWDボタンとUPまたはDOWNボタンでサンプル位置を調整します。すべてのサンプルが浸漬されるまで、トレイに脱イオン水を入れます。トレイに荷物を詰めたら、スタートボタンを押します。トリミングしたサンプルをスライドガラスに1x PBSを滴下して置きます。
メモ:硬いサンプルはカミソリの刃を磨耗させるため、トリミングのたびにサンプルの位置を反対側にずらしてください。 - 標的部位を含むサンプルを実体顕微鏡で確認した後、トリミングしたサンプルを1mLの1x PBSでマルチウェルプレートに移します。
注:サンプルのサイズに応じてウェルの数を選択してください。本研究では、12-マルチウェルプレートを用いた。
6. 清澄液による処理
- マルチウェルプレートから1x PBSを取り出し、新鮮な1x PBSを追加します。それを1分間放置します。
- 1x PBSを削除し、CSを追加します。
注: CS の量はサンプル量の 5 倍にする必要があります。 - 試料を入れたマルチウェルプレートをデシケーターに入れる。次に、デシケータの蓋を閉め、真空ポンプを起動して、デシケータ内部を−0.09MPaまでゆっくりと減圧します。
- デシケータを−0.09MPaで閉じた後、真空ポンプの電源を切り、室温で1時間放置する。
- デシケーターを少し開き、ゆっくりと大気圧に戻します。
- CSの蒸発を防ぐために、ウェル間の隙間に脱イオン水を注ぎます。
注:マルチウェルプレートを1〜2日ごとに静かに振って、クロロフィルやその他の成分を拡散させます。 - CSが緑色に変わったら、新しいソリューションと交換してください。
7. 化学色素による細胞壁染色
- カルコフルオール白色溶液(1mL、最終濃度:透明化溶液中の1mg/mL、 材料表参照)をマルチウェルプレートにピペッティングする。サンプルを色素溶液に入れ、1時間インキュベートする。
注:染料の体積は、CSの体積の10%を超えてはなりません。 - 染色したサンプルを別のマルチウェルプレートで1mLのCSで少なくとも1時間洗浄します。
8. 共焦点レーザー顕微鏡による観察
- 顕微鏡スライド上にCSの滴を置き、処理した(CSとともに)サンプルをスライド上に移す。
注:処理されたサンプルは柔らかいため、ピンセットで慎重に取り扱う必要があります。 - CSの蒸発を防ぐために、サンプルをガラスカバースリップで覆います。
メモ: CS は容易に析出します。 - 処理したサンプルを共焦点レーザー顕微鏡で観察する。
注:観察後、処理されたサンプルは、後でさらに観察するためにCSに戻すことができます。
結果
まず、清澄処理により成体のイネの硬くて厚い組織をどの程度透明にできるかを検証した。穂形成段階である9〜10LSのニップ、および若い穂からシュートの基部まで切り出した長さ12〜16mmの組織を使用した。若穂を含むこれらのサンプルを固定液に固定し、クリアリング処置の1〜4週間前後に観察した(図2)。トリミングされていないサンプルは緑色のままであり、4週間後、または透明化溶液で3ヶ月後でさえも透明にならなかった(図2A)。すべての葉を剥離したサンプルでは、節間はCSによる1週間後に白色に変わったが、節は緑色のままであった。このサンプルは、4週間後には透明にならなかった(図2B)。CSによる治療の3ヶ月後、若い穂だけが透明になった。手でトリミングされたサンプルは、CSによる治療の1週間後、外側の葉および維管束を除いて白色に変化した。葉の一部、若い穂、および節間は半透明になったが、4週間後には透明にならなかった(図2C)。3ヶ月後、若い穂と内側の葉だけが透明になりました。振動マイクロスライサーで130μmの厚さにトリミングされたサンプルは、CSで1週間処理した後に半透明になり、葉は透明になった。2週間後、サンプルはほぼ透明であり、4週間後も変化しなかった(図2D)。3ヶ月後、サンプルは完全に透明になった。
次に、8LSにおけるT65のシュートにおけるクリアリング処理が許容された遺伝子発現観察の深さを検証した。UBQpro:: NLS-sGFP-nClover3-mNeonGreen (UBQpro::NGCN, Table of Materials参照)で表されるシュートを使用した。組織サンプルを固定液中に固定してから、振動マイクロスライサーを用いて130μm厚にトリミングした。次いで、サンプルを共焦点レーザー顕微鏡(レーザー:488nm/13%、対物レンズ:20倍、ピンホール:0.93AU、平均:16、検出器ゲイン:800)下で、CSによる治療の0~4週間から毎週、z軸方向に10μm間隔で観察した。代表的な結果を 図3に示す。全ての数値を同じ処理で調整し、蛍光強度を比較した。処理を行わなかったノードでは、−40μmの深さでかすかな蛍光シグナルが観察された(図3A)。観察可能な深さは、CS処理の1週間後に−60μm、2週間後に−90μmであったが、−20μmの深さで細胞質の自己蛍光が両週とも顕著であった。自家蛍光は3週間後にやや弱くなり、4週間後には見えなくなった。蛍光シグナルは、3週間で−80μmの深さで、4週間で−100μmの深さで観察された。ノード間において、蛍光シグナルは、CS処理なしで−60μmの深さで観察された(図3B)。観察可能な深さは、CS処理の1週間後〜3週間後に−90μm、4週間後に−100μmであったが、1週間後に−20μmの深さで細胞質内の自己蛍光が顕著であった。自己蛍光は2週間後には見えなくなった。葉では、CS処理を行わずに−90μmの深さで蛍光シグナルが観察された(図3C)。蛍光シグナルは、節および節間よりも葉の深いところで観察された。しかし、蛍光シグナルは弱かった。蛍光シグナルはCS処理の1週間後に明らかになり、−120μmの深さで観察された。2週間後および3週間後、蛍光シグナルは−110μmの深さで観察され、4週間後には−120μmの深さで観察された。
最後に、mOrange 12と融合した転写因子OsMADS15 11の発現が観察され、これはSAMの栄養期から生殖期13への移行を調節する。OsMADS15-mOrangeで10 LSのNipからの組織サンプルを固定し、130 μm厚にトリミングし、CSで2週間処理しました。図4は、透明化溶液を使用して、天然遺伝子発現の蛍光タンパク質(OsMADS15-mOrange)と蛍光色素染色(カルコフルオールホワイト)を同時に観察できることを示しています。0~−130μmの深さで小花全体が観察され、3D画像は3μm間隔で43個のzスタック画像から再構成された(図4E)。

図1:サンプリング位置と処理(A)短日条件下で8LSでニップ苗。(B)基部の拡大図。(C)SAM/若穂からベースまでのサンプルカットアウト。(D)Cからの楕円形の断面(差し込み図)。(E)刃物でシュートの片側を薄く削る。(F)表面を薄く剃る。(g)節間伸びを示す試料。矢印で示される白っぽい部分はノードです。上部節の上側には若い穂があります。スケールバー: (A) 10 cm, (B-C,E-G) 1 cm, (D) 0.5 cm. この図の拡大版を表示するには、ここをクリックしてください。

図2:組織透明化は、サンプルの厚さおよびCS治療期間に依存する 。 (A)若い穂を含む部分的なシュートを有するトリミングされていないサンプル。最大厚さ:4mm(B)すべての葉をサンプルから剥がして若い穂を露出させた。最大厚さ:2.5mmyp:若い穂、内:節間;矢印はノードを示します。(C)1mm厚に手作業でトリミングしたサンプル。(D)振動マイクロスライサーで130μmの厚さにトリミングしたサンプル。スケール バー: 5 mm。 この図の拡大版を表示するには、ここをクリックしてください。
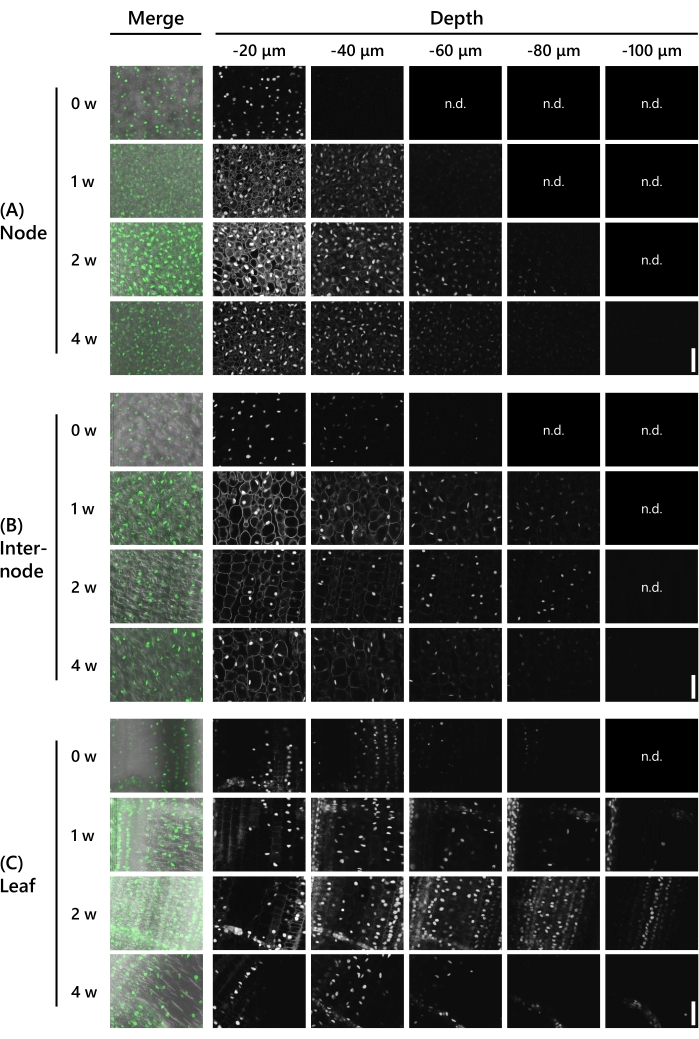
図3:蛍光観察の深さは、組織タイプおよびCS処理期間に依存する。(A)ノード、(B)ノード間、および(C)リーフにおけるUBQpro::NGCNのディープイメージング。「マージ」とは、画像が微分干渉コントラスト(DIC)画像およびすべてのzスタック画像と融合したことを意味する。蛍光が観察されなかった画像は「n.d」とマークされた。(検出されません)。共焦点レーザー顕微鏡の設定は、レーザー:488nm/13%、対物レンズ:20倍、ピンホール:0.93AU、平均:16、検出器ゲイン:800、間隔:10μmです。スケール バー: 50 μm。この図の拡大版を表示するには、ここをクリックしてください。
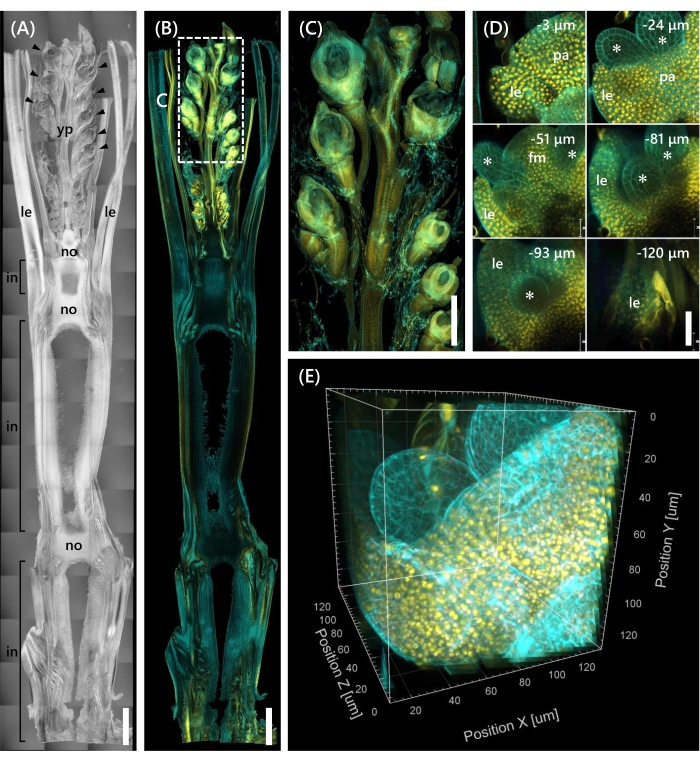
図4:OsMADS15-mOrangeの深部蛍光観察(A)10LSにおけるNipのDIC画像。yp:若い穂、ル:葉、いいえ:ノード、で:ノード間;矢印は花序を示す。(B)OsMADS15-mOrangeの蛍光画像。黄色の点は、核におけるOsMADS15-mOrangeの蛍光タンパク質を示す。細胞壁をカルコフルオール白色溶液でシアンに染色した。(C)若い穂の拡大図。(D)花序の深いイメージング。pa: palea, le: lemma, fm: floral meristem;アスタリスクは雄しべ原基を示す。共焦点レーザー顕微鏡を以下のように設定した:OsMADS15-mOrange;レーザー: 555 nm/13%, 対物レンズ: 20x, ピンホール: 0.96 AU, 平均: 16, 検出器ゲイン: 800, 間隔: 3 μm.カルコフルオールホワイト;レーザー: 405 nm/3%, 対物レンズ: 20x, ピンホール: 0.93 AU, 平均: 16, 検出器ゲイン: 470, 間隔: 3 μm. (E) Zスタック画像から構築された図(D)の3D画像。スケールバー: (A-B) 1 mm、(C) 500 μm、(D) 40 μm。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
プロトコルの重要なステップ
このプロトコルの重要なステップは、固定とトリミングです。イネの芽は、固定液の浸透を制限する硬く、厚い、または層状の組織を有する。固定液の透過性を改善するために、 図1E−Fに示すように、組織の片側をサンプリング時に薄く剃毛した。なお、真空処理は、より高い圧力を用いて2回繰り返した。さらに、サンプルを通常の4°Cで2時間固定に代えて4°Cで一晩固定した。
トリミング工程の重要なポイントは、短期間のCS処理後に蛍光タンパク質の内部構造を維持しながら蛍光タンパク質を観察するために調製される組織の厚さを決定することである。 図2Cに示すように、厚さ1mmのサンプルは、できるだけ薄く手でトリミングされ、CS処理の3ヶ月後でさえも限られた数の組織でのみ透明になった。したがって、トリミング工程は、成体イネの芽の深い蛍光観察に不可欠である。この研究では、 図2Dに示すように、サンプルを130μmの厚さにトリミングしました。130μmの厚さにより、CS処理の1週間後および2週間後にサンプル全体を透明化することができた。9〜10LSでの成米芽をこの研究に使用した。若い稲作からの厚いが柔らかい組織は、CS処理でより速くクリアすることができます。サンプルの厚さとCS処理の期間は、観察する3D構造の組織タイプ、状態、および厚さに応じて調整する必要があります。
変更とトラブルシューティングの方法
このCSは低温で容易に析出する。沈殿したCSは蛍光タンパク質を保存することができません。したがって、サンプルを適切な温度で保存する場合は注意が必要です。さらに、CSおよび固定液はいずれも防腐効果を有さない。したがって、蛍光タンパク質は汚染されると分解されます。土壌で栽培された米は真菌の増殖を起こしやすい。したがって、サンプルのサンプリングと取り扱いは、汚染を避けるために注意して実行する必要があります。
バッファー中の過剰な蛍光色素は、バックグラウンド蛍光を発し、顕微鏡観察を妨げる可能性があります。例えば、エバンスブルー染料を含むカルコフルア白色溶液が以前に使用されていた。1時間染色し、1時間洗浄した後、OsMADS15-mOrangeの蛍光タンパク質を555nmレーザーを用いて観察した。しかし、蛍光タンパク質はエバンスブルー色素に由来するバックグラウンド蛍光のため観察できなかった。このバックグラウンド蛍光は、サンプルを2時間洗浄することによってほぼ排除された。さらに、蛍光タンパク質は、サンプルを一晩放置した場合、より透明であった。したがって、純粋なカルコフルア白色溶液をこの研究に使用した。蛍光色素に由来するバックグラウンド蛍光は、観察前に異なるレーザー波長を使用してチェックする必要があります。
メソッドの制限
図3に示すように、CS処理の2週間後に厚さ130μmであったサンプルにおいて、深い蛍光タンパク質が観察された。これは、130μm厚のサンプルがCS処理の2週間後に透明になった図2Dに示された結果と一致する。しかしながら、図3Aに示すように、細胞質の自己蛍光は、2週間後の節において依然として顕著であり、CS処置の4週間後にのみ完全に除去された。ノードは細胞密度が高いため、自動蛍光物質を除去するのに長い時間が必要です。
図3Cに示すように、CS処理を行わない葉では深い蛍光タンパク質が観察されたが、同じ深さ20μmのノードおよびノード間よりも輝度が弱かった。CS処理の1週間後、蛍光タンパク質はより明るくなった。クロロフィルは葉に豊富に存在し、488nmの励起光を吸収します。また、オレンジ/赤色の自己蛍光があり、555nmレーザーを使用した蛍光タンパク質の観察を妨げる可能性があります。CS処理の1週間後、クロロフィルおよび他の自己蛍光物質を除去し、高いシグナル対ノイズ比画像を得た。
CS処理の2週間後および4週間後の組織で観察できた深さは有意に異ならなかったが、蛍光タンパク質は4週間後に弱く見えた(図3)。通常、蛍光タンパク質および自己蛍光の輝度は時間とともに弱まり、その結果、より高いシグナル対ノイズ比が生じる。そのため、蛍光タンパク質は、顕微鏡条件や画像処理を調整することで、より鮮明に観察することができる。これらの結果から、2週間のCS処理により、我々の試料条件を考えると、深部蛍光タンパク質の観察が容易になる可能性があると結論付けられた。しかし、自動蛍光物質を完全に排除したより鮮明な画像を観察するには4週間が必要です。
維管束やマルチアーム細胞などの強い自己蛍光を有する構造は、CSにおいて除去することができない。これらの構造を自家蛍光なしで観察するためには、時間ゲーティング法12 を用いるか、または蛍光スペクトルの分光法によって画像を得る必要がある。2光子顕微鏡は、より厚い組織が観察される場合、より深い組織を観察するのにより適しているかもしれない。
既存および代替方法に対する本方法の意義
一般に、イネの内部構造は、クライオスタットまたはビブラトーム切片化のいずれかを用いて観察されてきた。クライオスタットは、観察を容易にする薄切片の準備に適していますが、サンプルの準備と装置の操作には時間がかかります。薄肉断面から元の3D構造を再構築することも困難です。ビブラトームは比較的操作が簡単で、厚いセクションの製造に適しています。しかし、標的組織の厚い切片は切断面の観察のみを可能にし、光が到達できない深い組織には許可しない。これらの理由から、いずれの方法も深部蛍光観察には適していない。
本研究では、既存の手法を組み合わせることで、CSの組織浸透が限られていることや共焦点顕微鏡下での物体分解能の悪さなど、イネの芽における深部蛍光観察における課題に取り組んだ。 図4に示すように、若穂から基部までの成体イネ苗条の深部組織に発現する蛍光タンパク質(OsMADS15-mOrange)を観察した。 図4D は、小花に着目し、3μm間隔で深い蛍光タンパク質を示す。CS処理の2週間後に−130μm深さを超える組織が観察されたが、CS処置なしで同じサイズおよび成長段階の花序において−27μm深さ内の組織のみが観察された(データは示さず)。現在の改良されたプロトコールは、遺伝子の過剰発現だけでなく、成体のイネの芽の深部組織における自然な遺伝子発現の観察も可能にした。
特定の研究分野における本方法の重要性と潜在的な応用
成体のイネの芽の深い蛍光観察を最適化するこのプロトコルは、不要な組織を切り取り、CSの透過性を高めることによって、硬い、厚い、または層状の組織の効率的な除去を可能にします。また、分析用試料の厚さを最適化し、通常は厚組織や不透明な組織を解くことができない共焦点レーザー顕微鏡を用いて、連続的かつ構造的な深部蛍光観察を可能にしました。
蛍光タンパク質は固定液およびPBS溶液中で経時的に分解するため、異なる成長段階のイネサンプルを比較することは困難です。しかしながら、CS中の蛍光タンパク質は、5ヶ月以上保存することができる1。CSの貯蔵寿命が長いことは、イネの深い蛍光観察にとって大きな利点である。
近年、多くのクリアリング技術が開発され、内部構造を維持しながら深部組織を3Dで観察することが可能になりました。これらの技術は進化を続けており、新しい清算ソリューションが開発されています。その一例がiTOMEI14で、効率的なクロロフィル除去とより明るい蛍光検出を可能にします。もう1つの例は、クリアリング処理中の組織の褐変を防ぎ、透明に見えるようにするClearSeeAlpha15である。これらの清澄化溶液を本方法と組み合わせることは、より効率的かつ効果的な清算を可能にし得る。
今回の手法は、米だけでなく他の植物も深くイメージングすることで、新たな知見を得ることが期待されます。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
OsMADS15mOrangeの種子を提供してくださった寺田亮博士、島谷Z博士、辻秀樹博士に感謝いたします。栗原博士、NGCN建設を提供してくださった。そして、私たちの原稿を編集してくれたR.シム博士。本研究は、日本学術振興会科学研究費補助金(助成番号JP20H05912, 20H05778, 20H05779)とSATREPSプログラム(no.JPMJSA1706)のJSTおよびJICAの。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | BIO-BIK | ST-0150F | |
| 12-multiwell plate | Corning | 353043 | |
| 50 mL conical tube | Corning | 352070 | |
| Calcofluor white solution | Sigma-Aldrich | 910090 | |
| ClearSee | FUJIFILM Wako Pure Chemical | 031-25151 | This can be made or purchased. |
| Confocal laser microscope | Carl Zeiss | LSM700 | |
| Desiccator | SANPLATEC | Custom made of acrylic. 30 cm (L), 30 cm (W), 14.5 cm (H) | |
| Glass coverslip (18 × 18 No.1) | MATSUNAMI | C018181 | |
| HEPES | FUJIFILM Wako Pure Chemical | 342-01375 | |
| Microscope slide (76 × 26) | MATSUNAMI | S2441 | |
| Paraffin film | Bemis | PM-996 | |
| Paraformaldehyde | FUJIFILM Wako Pure Chemical | 162-16065 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | |
| Sucrose | FUJIFILM Wako Pure Chemical | 190-00013 | |
| UBQpro::NLS-sGFP-nClover3-mNeonGreen (UBQpro::NGCN) | provided by Dr. Kurihara | ||
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | AS One | AS-01 | |
| Vibrating micro-slicer | DOSAKA | DTK-3000 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
参考文献
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLoS One. 11 (8), 0161107 (2016).
- Pandey, K. B., et al. Plant roots sense soil compaction through restricted ethylene diffusion. Science. 371 (6526), 276-280 (2021).
- Ejaza, M., Bencivenga, S., Tavaresa, R., Busha, M., Sablowski, R. ARABIDOPSIS THALIANA HOMEOBOX GENE 1 controls plant architecture by locally restricting environmental responses. Proceedings of the National Academy of Sciences of the United States of America. 118 (17), (2021).
- Smetana, O., et al. High levels of auxin signalling define the stem-cell organizer of the vascular cambium. Nature. 565 (7740), 485-489 (2019).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11 (1), 23 (2018).
- Nagaki, K., Yamaji, N., Murata, M. ePro-ClearSee: A simple immunohistochemical method that does not require sectioning of plant samples. Scientific Reports. 7, 42203 (2017).
- Sato, M., Akashi, H., Sakamoto, Y., Matsunaga, S., Tsuji, H. Whole-tissue three-dimensional imaging of rice at single-cell resolution. International Journal of Molecular Sciences. 23 (1), 40 (2022).
- Matsuo, T., Hoshikawa, K. Science of the Rice Plant: Morphology. Food and Agriculture Policy Research Center. , (1993).
- Kobayashi, K., et al. Inflorescence meristem identity in rice is specified by overlapping functions of three AP1/FUL-Like MADS box genes and PAP2, a SEPALLATA MADS box gene. Plant Cell. 24 (5), 1848-1859 (2012).
- Tamaki, S., et al. FT-like proteins induce transposon silencing in the shoot apex during floral induction in rice. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 901-910 (2015).
- Kodama, Y. Time gating of chloroplast autofluorescence allows clearer fluorescence imaging In Planta. PLoS One. 11 (3), 0152484 (2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Communications Biology. 5 (1), 12 (2022).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: Advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved