A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير بالرنين المغناطيسي للقلب الحساس للأكسجين مع مناورات التنفس النشطة في الأوعية للتقييم غير الجراحي لخلل الأوعية الدموية الدقيقة التاجية
In This Article
Erratum Notice
Summary
يعد تقييم وظيفة الأوعية الدموية الدقيقة عن طريق التصوير بالرنين المغناطيسي القلبي الحساس للأكسجة مع مناورات التنفس النشطة في الأوعية فريدا من نوعه في قدرته على تقييم التغيرات الديناميكية السريعة في أكسجة عضلة القلب في الجسم الحي ، وبالتالي ، قد يكون بمثابة تقنية تشخيصية مهمة للغاية لوظيفة الأوعية الدموية التاجية.
Abstract
التصوير بالرنين المغناطيسي للقلب الحساس للأكسجين (OS-CMR) هو تقنية تشخيصية تستخدم الخصائص البارامغناطيسية المتأصلة في ديوكسي هيموغلوبين كمصدر داخلي لتباين الأنسجة. يستخدم OS-CMR مع مناورات التنفس النشطة في الأوعية القياسية (فرط التنفس وانقطاع النفس) كمحفز حركي وعائي قوي غير دوائي ، ويمكن ل OS-CMR مراقبة التغيرات في أكسجة عضلة القلب. يمكن أن يوفر القياس الكمي لمثل هذه التغييرات أثناء الدورة القلبية وخلال المناورات النشطة في الأوعية الدموية علامات لوظيفة الأوعية الدموية التاجية الكبيرة والدقيقة وبالتالي التحايل على الحاجة إلى أي عوامل إجهاد خارجية أو في الوريد أو دوائية.
يستخدم OS-CMR الحساسية المعروفة للصور المرجحة T2 * لأكسجة الدم. يمكن الحصول على صور حساسة للأكسجة على أي ماسح ضوئي للتصوير بالرنين المغناطيسي للقلب باستخدام تسلسل سينمائي قياسي معدل للحالة المستقرة السريرية (SSFP) ، مما يجعل هذه التقنية محايدة للبائع ويمكن تنفيذها بسهولة. كمناورة تنفس نشطة في الأوعية ، نطبق بروتوكول التنفس لمدة 4 دقائق لمدة 120 ثانية من التنفس الحر ، و 60 ثانية من فرط التنفس ، متبوعا بحبس التنفس الزفيري لمدة 30 ثانية على الأقل. يمكن تقييم الاستجابة الإقليمية والعالمية لأكسجة أنسجة عضلة القلب لهذه المناورة من خلال تتبع تغير شدة الإشارة. تمت دراسة التغيير خلال 30 ثانية الأولى من حبس التنفس بعد فرط التنفس ، والذي يشار إليه باسم احتياطي أكسجة عضلة القلب الناجم عن التنفس (B-MORE) في الأشخاص الأصحاء والأمراض المختلفة. يتم توفير بروتوكول مفصل لإجراء فحوصات CMR الحساسة للأكسجين مع مناورات نشطة في الأوعية.
كما هو موضح في المرضى الذين يعانون من خلل وظيفي في الأوعية الدموية الدقيقة في حالات غير مفهومة تماما ، مثل نقص التروية المستحث مع عدم وجود تضيق الشريان التاجي الانسدادي (INOCA) ، أو فشل القلب مع الكسر القذفي المحفوظ (HFpEF) ، أو ضعف الأوعية الدموية الدقيقة بعد زرع القلب ، يوفر هذا النهج معلومات فريدة ومهمة سريريا وتكميلية عن وظيفة الأوعية التاجية.
Introduction
يستخدم التصوير بالرنين المغناطيسي للقلب الحساس للأكسجة (OS-CMR) الخصائص البارامغناطيسية المتأصلة في ديوكسي هيموغلوبين كمصدر داخلي لتباين MR1،2،3. يستخدم OS-CMR مع مناورات التنفس النشطة في الأوعية القياسية (فرط التنفس وانقطاع النفس) كمحفز حركي وعائي غير دوائي قوي ، ويمكن مراقبة التغيرات في أكسجة عضلة القلب كعلامة لوظيفة الأوعية الدموية ، وبالتالي التحايل على الحاجة إلى أي تباين خارجي أو في الوريد أو عوامل إجهاد دوائية 4،5،6.
تعد مناورات التنفس ، بما في ذلك حبس النفس وفرط التنفس ، تدابير فعالة للغاية في الأوعية لتغيير حركة الأوعية ، وبسبب سلامتها وبساطتها ، فهي مثالية للتحكم في الحركة الوعائية المعتمدة على البطانة كجزء من إجراء تشخيصي. أظهرت الدراسات فعالية إضافية عند الجمع بين فرط التنفس مع التنفس اللاحق 4,7 ، كما هو الحال خلال مثل هذا البروتوكول ، يتبع تضيق الأوعية (من خلالالانخفاض المرتبط بثاني أكسيد الكربون في الدم) توسع الأوعية (زيادة ثاني أكسيد الكربون في الدم) ؛ وبالتالي ، ينتقل نظام الأوعية الدموية الصحي عبر النطاق الكامل من تضيق الأوعية إلى توسع الأوعية مع زيادة قوية في تدفق الدم في عضلة القلب ، مما يؤدي بدوره إلى زيادة أكسجة عضلة القلب ، وبالتالي كثافة الإشارة التي يمكن ملاحظتها في صور OS-CMR. يسمح استخدام الصور السينمائية للاكتساب أيضا بنتائج حل طور القلب مع نسبة إشارة إلى ضوضاء أفضل عند مقارنتها بتسريب الأدينوزين8.
يمكن أن تحل مناورات التنفس محل عوامل الإجهاد الدوائية لإحداث تغييرات نشطة في الأوعية يمكن استخدامها لتقييم وظيفة الأوعية التاجية. هذا لا يقلل فقط من مخاطر المريض والجهود اللوجستية والتكاليف المرتبطة به ولكنه يساعد أيضا في توفير نتائج أكثر جدوى سريريا. تؤدي عوامل الإجهاد الدوائي مثل الأدينوزين إلى استجابة تعتمد على البطانة ، وبالتالي تعكس وظيفة البطانة نفسها. كان هذا التقييم المحدد لوظيفة البطانة حتى الآن ممكنا فقط من خلال إعطاء الأسيتيل كولين داخل الشريان التاجي كموسع للأوعية يعتمد على البطانة. ومع ذلك ، فإن هذا الإجراء شديد التوغل 2,9 ، وبالتالي نادرا ما يتم إجراؤه.
تفتقر إلى الوصول إلى المؤشرات الحيوية المباشرة ، استخدمت العديد من تقنيات التشخيص علامات بديلة مثل امتصاص الأنسجة لعامل تباين خارجي. وهي محدودة بالحاجة إلى واحد أو اثنين من خطوط الوصول عن طريق الوريد ، وموانع مثل مرض الكلى الحاد أو الإحصار الأذيني البطيني ، والحاجة إلى الوجود المادي للموظفين المدربين على إدارة الآثار الجانبية الشديدة المحتملة10,11. ومع ذلك ، فإن أهم قيود التصوير الحالي لوظيفة الشريان التاجي لا يزال هو أن نضح عضلة القلب كعلامة بديلة لا يعكس أكسجة أنسجة عضلة القلب باعتبارها أهم نتيجة لخلل الأوعية الدموية2.
تم استخدام OS-CMR مع مناورات التنفس النشطة في الأوعية لتقييم وظيفة الأوعية الدموية في العديد من السيناريوهات ، بما في ذلك الأفراد الأصحاء ، وأمراض الأوعية الدموية الكبيرة في المرضى الذين يعانون من مرض الشريان التاجي (CAD) ، وكذلك ضعف الأوعية الدموية الدقيقة في المرضى الذين يعانون من انقطاع النفس الانسدادي النومي (OSA) ، نقص التروية مع عدم وجود تضيق الشريان التاجي الانسدادي (INOCA) ، بعد زرع القلب ، وفشل القلب مع الكسر القذفي المحفوظ (HFpEF) 4 ، 7،12،13،14،15،16. في مجموعة CAD ، ثبت أن بروتوكول احتياطي أكسجة عضلة القلب الناجم عن التنفس (B-MORE) المشتق من OS-CMR آمن وممكن وحساس في تحديد استجابة الأوكسجين الضعيفة في مناطق عضلة القلب التي يتخللها الشريان التاجي مع تضيق كبير13.
في ضعف الأوعية الدموية الدقيقة ، أظهر OS-CMR استجابة متأخرة لأكسجة عضلة القلب في المرضى الذين يعانون من انقطاع النفس الانسدادي النومي ، وتم العثور على B-MORE ضعيف في المرضى الذين يعانون من HFpEF وبعد زرع القلب12،14،16. في النساء المصابات ب INOCA ، أدت مناورة التنفس إلى استجابة غير متجانسة بشكل غير طبيعي لأكسجة عضلة القلب ، مما يسلط الضوء على ميزة الدقة المكانية العالية ل OS-CMR15. تستعرض هذه الورقة الأساس المنطقي والمنهجية لأداء OS-CMR مع مناورات التنفس النشطة في الأوعية وتناقش فائدتها السريرية في تقييم الفيزيولوجيا المرضية الوعائية في مجموعات المرضى الذين يعانون من خلل وظيفي في الأوعية الدموية الدقيقة ، وتحديدا من حيث صلتها بالخلل البطاني.
السياق الفسيولوجي للتصوير بالرنين المغناطيسي الحساس للأكسجة المعزز بالتنفس
في ظل الظروف الفسيولوجية العادية ، تقابل الزيادة في الطلب على الأكسجين زيادة مكافئة في إمدادات الأكسجين من خلال زيادة تدفق الدم ، مما يؤدي إلى عدم حدوث تغيير في تركيز الديوكسي هيموغلوبين المحلي. في المقابل ، يؤدي توسع الأوعية المستحث إلى تدفق "زائد" للدم المؤكسج دون تغيير في الطلب على الأكسجين. وبالتالي ، يتم أكسجة المزيد من الهيموغلوبين النسيجي ، وبالتالي ، هناك كمية أقل من deoxyhemoglobin ، مما يؤدي إلى زيادة نسبية في شدة إشارة OS-CMR 4,17. إذا تعرضت وظيفة الأوعية الدموية للخطر ، فلن تتمكن من الاستجابة بشكل صحيح للطلب الأيضي المتغير أو التحفيز لزيادة تدفق الدم في عضلة القلب.
في وضع حافز لاستنباط حركة الأوعية ، مثل فرط التنفس الذي يثير تضيق الأوعية أو حبس النفس الطويل الذي يثير توسع الأوعية بوساطة ثاني أكسيد الكربون ، فإن ضعف النشاط الحركي الوعائي سيؤدي إلى زيادة نسبية في تركيز الديوكسي هيموغلوبين المحلي مقارنة بالمناطق الأخرى ، وبالتالي انخفاض التغير في شدة إشارة OS-CMR. في وضع نقص التروية المستحث ، سيؤدي ضعف وظيفة الأوعية الدموية إلى زيادة الطلب المحلي الذي لا تلبيه زيادة محلية في تدفق الدم في عضلة القلب حتى في حالة عدم وجود تضيق الشريان التاجي النخابي. في صور OS-CMR ، تؤدي الزيادة المحلية الصافية في تركيز الديوكسي هيموغلوبين إلى انخفاض في شدة الإشارة المحلية2،18،19،20.
تم إثبات استرخاء العضلات الملساء الوعائية الموهنة استجابة لموسعات الأوعية المعتمدة على البطانة والمستقلة (بما في ذلك الأدينوزين) في المرضى الذين يعانون من خلل وظيفي في الأوعية الدموية الدقيقة التاجية 21،22،23،24،25،26،27. يعتقد أن الخلل الوظيفي المستقل البطاني يرجع إلى تشوهات هيكلية من تضخم الأوعية الدموية الدقيقة أو أمراض عضلة القلب المحيطة. في المقابل ، يؤدي الخلل البطاني إلى عدم كفاية تضيق الأوعية وضعف استرخاء الأوعية (المعتمد على البطانة) ، والذي يحدث عادة بسبب فقدان النشاط الحيوي لأكسيد النيتريك في جدار الوعاء الدموي21،28. وقد تورط الخلل البطاني في التسبب في عدد من أمراض القلب والأوعية الدموية ، بما في ذلك فرط كوليسترول الدم وارتفاع ضغط الدم والسكري و CAD وانقطاع النفس الانسدادي النومي و ENOCA و HF23،24،28،29،30،31،32. في الواقع ، الخلل البطاني هو أول مظهر من مظاهر تصلب الشرايين التاجية33. يتمتع تصوير الوظيفة البطانية بإمكانات قوية للغاية ، نظرا لدوره كمؤشر مهم للأحداث القلبية الوعائية الضارة والنتائج طويلة المدى ، مع آثار تنبؤية عميقة في حالات أمراض القلب والأوعية الدموية23،29،30،31،34،35.
على عكس تصوير التروية ، فإن احتياطي أكسجة عضلة القلب الناجم عن التنفس (B-MORE) ، والذي يعرف بأنه الزيادة النسبية في أكسجة عضلة القلب أثناء حبس التنفس بعد فرط التنفس يسمح بتصور عواقب مثل هذا الزناد النشط في الأوعية على الأوكسجين العالمي أو الإقليمي نفسه 2,36. كعلامة دقيقة في اتجاه مجرى النهر لوظيفة الأوعية الدموية ، لا يمكن ل B-MORE تحديد الخلل الوظيفي في الأوعية الدموية فحسب ، بل أيضا نقص التروية المحرض الفعلي ، مما يشير إلى وجود مشكلة نضح موضعي أو أكسجة أكثر حدة18،19،37. ويتحقق ذلك من خلال قدرة OS-CMR على تصور الانخفاض النسبي في الهيموغلوبين غير المؤكسج ، وهو وفير في النظام الشعري لعضلة القلب ، والذي يمثل في حد ذاته نسبة كبيرة من أنسجة عضلة القلب24.
تسلسل OS-CMR
تسلسل التصوير بالرنين المغناطيسي (MRI) المستخدم في تصوير OS-CMR هو تسلسل مستقبلي ، معدل ، متوازن ، حالة مستقرة ، حر (bSSFP) تم الحصول عليه في شريحتين قصيرتي المحور. تسلسل bSSFP هذا هو تسلسل سريري قياسي متاح (وقابل للتعديل) على جميع ماسحات التصوير بالرنين المغناطيسي التي تقوم بإجراء التصوير بالرنين المغناطيسي للقلب ، مما يجعل هذه التقنية محايدة للبائع ويمكن تنفيذها بسهولة. في تسلسل سينمائي bSSFP منتظم ، يتم تعديل وقت الصدى ووقت التكرار وزاوية الوجه لتوعية شدة الإشارة الناتجة بتأثير BOLD ، وبالتالي إنشاء تسلسل حساس للأكسجين. وقد ثبت سابقا أن هذا النهج ، وهو قراءات bSSFP المعدة من T2 ، مناسب للحصول على صور حساسة للأكسجين مع نسبة إشارة إلى ضوضاء أعلى ، وجودة صورة أعلى ، وأوقات مسح أسرع عند مقارنتها بتقنيات صدى التدرج السابقة المستخدمة في تصويرBOLD 38. يمكن تطبيق أداء OS-CMR المعزز للتنفس باستخدام هذا النهج مع عدد قليل جدا من الآثار الجانبية الخفيفة (الجدول 1). من الجدير بالذكر أن أكثر من 90٪ من المشاركين يكملون هذا البروتوكول بأوقات حبس أنفاس طويلة بما فيه الكفاية4،12،13،16.
Access restricted. Please log in or start a trial to view this content.
Protocol
يجب إجراء جميع فحوصات التصوير بالرنين المغناطيسي باستخدام OS-CMR مع مناورات التنفس النشطة في الأوعية وفقا للإرشادات المؤسسية المحلية. تم استخدام البروتوكول الموضح أدناه في الدراسات المعتمدة من قبل العديد من لجان أخلاقيات البحوث البشرية المؤسسية. تم الحصول على موافقة خطية لجميع بيانات المشاركين البشريين والنتائج الموضحة في هذا البروتوكول والمخطوطة.
1. نظرة عامة واسعة
- تختلف معايير التضمين والاستبعاد اعتمادا على مجتمع الدراسة محل الاهتمام. استخدم معايير الاستبعاد العامة والشائعة التالية ل OS-CMR مع بروتوكول مناورات التنفس النشط في الأوعية: موانع التصوير بالرنين المغناطيسي العامة (على سبيل المثال ، الأجهزة غير المتوافقة مع التصوير بالرنين المغناطيسي مثل أجهزة تنظيم ضربات القلب أو أجهزة تنظيم ضربات القلب أو المواد المزروعة أو الأجسام الغريبة) ، واستهلاك الكافيين أو الأدوية الفعالة في الأوعية في 12 ساعة قبل التصوير بالرنين المغناطيسي ، والعمر < 18 عاما.
- أولا ، احصل على الكشافة السريرية القياسية والبنية البطينية وصور الوظائف قبل الحصول على عمليات الاستحواذ على نظام التشغيل. استخدم الصور السينمائية طويلة المحور bSSFP لتخطيط موضع شريحة عمليات الاستحواذ على نظام التشغيل.
ملاحظة: تم وصف مراجعة بروتوكولات CMR السريرية الموحدة في مكان آخر39. - خط الأساس لحبس النفس
- احصل على أول سلسلة OS-CMR كاكتساب قصير أساسي لحبس النفس لتقييم جودة الصورة وموقع الشريحة ، والتحقق من القطع الأثرية ، بالإضافة إلى العمل كخط أساس لشدة الإشارة.
- قم بإجراء اكتساب دورة قلبية قصيرة (~ 10 ثوان) بعد أن يتنفس المشارك بشكل طبيعي. تأكد من أن حبس النفس يتم عند انتهاء الصلاحية.
- اكتساب مستمر مع مناورة التنفس النشط في الأوعية
- احصل على سلسلة OS-CMR الثانية كاكتساب مستمر لمدة 4 دقائق يتكون من 2 دقيقة من التنفس الحر و 1 دقيقة من فرط التنفس ، متبوعا بحبس التنفس الأقصى الطوعي (~ 1 دقيقة). نظرا لأن الاكتساب المستمر يحصل على دورات قلبية متعددة تزيد عن 4 دقائق ، قم بتعديل معلمة إضافية واحدة (عدد دورات القلب المكتسبة من خلال الاستحواذ) لجعل هذه السلسلة عملية اكتساب ذات مقاييس متكررة
ملاحظة: الحد الأدنى المطلوب لطول حبس النفس هو 30 ثانية ، على الرغم من أن حبس النفس البالغ 60 ثانية يعتبر المعيار. - نقل التعليمات الخاصة بمناورة التنفس النشط في الأوعية إلى المشاركين في ماسح التصوير بالرنين المغناطيسي عن طريق توجيه المشارك يدويا طوال مناورة التنفس من خلال ميكروفون متصل بنظام مكبر صوت التصوير بالرنين المغناطيسي أو من خلال ملف .mp3 مسجل مسبقا (الملف التكميلي 1) يمكن تشغيله للمشارك من خلال نظام مكبر صوت التصوير بالرنين المغناطيسي.
- ابدأ مناورة التنفس النشط في الأوعية بالتنفس الحر (بعد 120 ثانية من التنفس الحر ، يبدأ فرط التنفس). قم بتوجيه المشارك من خلال التنفس المنظم باستخدام أصوات تنبيه مسموعة من بندول الإيقاع بتردد 30 نفسا / دقيقة (يشير صوت تنبيه واحد إلى الزفير ، ويشير صوت تنبيه واحد إلى الزفير). عند علامة 55 ثانية من فرط التنفس ، أعط أمرا صوتيا أخيرا "خذ نفسا عميقا ثم تنفس وحبس أنفاسك" لضمان إجراء حبس النفس عند مستوى انتهاء الصلاحية.
ملاحظة: يكون التغير في CO 2 في الدم أكثر وضوحا مع حبس النفس عند نهاية الزفير (يكون سطح الرئة أصغر ، مما يقلل من الانتشار المتبقي ل CO2 في الحويصلات الهوائية).
- احصل على سلسلة OS-CMR الثانية كاكتساب مستمر لمدة 4 دقائق يتكون من 2 دقيقة من التنفس الحر و 1 دقيقة من فرط التنفس ، متبوعا بحبس التنفس الأقصى الطوعي (~ 1 دقيقة). نظرا لأن الاكتساب المستمر يحصل على دورات قلبية متعددة تزيد عن 4 دقائق ، قم بتعديل معلمة إضافية واحدة (عدد دورات القلب المكتسبة من خلال الاستحواذ) لجعل هذه السلسلة عملية اكتساب ذات مقاييس متكررة
- تحليل الصور
- لقياس B-MORE ، ضع في اعتبارك أول صورة انقباضية للنهاية أثناء حبس النفس كوقت 0 s. قارن قيم شدة الإشارة العالمية أو الإقليمية للصورة الانقباضية النهائية المكتسبة الأقرب إلى النقطة الزمنية 30 s لحبس النفس إلى شدة إشارة الصورة عند النقطة الزمنية 0 s. أبلغ عن BMORE كنسبة مئوية من التغير في شدة الإشارة عند 30 ثانية مقارنة بالوقت 0 ثانية من حبس النفس.
2. إجراء ما قبل المسح
- تأكد من أن كل مشارك يجتاز استبيان سلامة وتوافق التصوير بالرنين المغناطيسي للمؤسسة المحلية (نموذج موانع التصوير بالرنين المغناطيسي) ، والذي يجب أن يتضمن أسئلة حول التاريخ الطبي والجراحي السابق وتحديد وجود أي غرسة أو جهاز أو جسم غريب معدني داخل أو في موقع الجراحة للمشارك40.
- الحصول على اختبار الحمل ، إن أمكن.
- تحقق من أن المريض قد امتنع عن تناول الأدوية الفعالة في الأوعية والكافيين في 12 ساعة قبل فحص التصوير بالرنين المغناطيسي.
- اعرض على المشارك فيديو مناورة التنفس التعليمي (الفيديو التكميلي ج1).
- قم بإجراء جلسة تدريب لمدة 60 ثانية من فرط التنفس يسير بخطى متبوعة بحبس النفس الطوعي الأقصى مع كل مشارك خارج غرفة مسح التصوير بالرنين المغناطيسي وتقديم ملاحظات حول أداء فرط التنفس.
- اطلب من المشاركين أنه يمكنهم ببساطة استئناف التنفس عندما يكون لديهم رغبة قوية في القيام بذلك.
ملاحظة: راجع المناقشة للحصول على نقاط يجب ملاحظتها وتقديم ملاحظات بشأنها للمشاركين.
3. اكتساب التصوير بالرنين المغناطيسي للتسلسلات الحساسة للأكسجين
- قم بتعديل ثلاث معلمات من تسلسل bSSFP القياسي على وحدة تحكم التصوير بالرنين المغناطيسي: زيادة وقت التكرار (TR) ، وزيادة وقت الصدى (TE) ، وتقليل زاوية الوجه (FA).
ملاحظة: تعتمد القيم المعدلة على شدة مجال ماسح التصوير بالرنين المغناطيسي (الجدول 2). تؤدي زيادة TR و TE وتقليل FA إلى زيادة T2 * أو حساسية الأوكسجين لتسلسل التصوير بالرنين المغناطيسي. ستؤدي هذه التعديلات بعد ذلك إلى زيادة في عرض النطاق الترددي والدقة الأساسية للتسلسل. - قم بإنشاء سلسلتين من نظام التشغيل ، خط الأساس (المسمى OS_base) والاستحواذ المستمر الذي يتم خلاله تنفيذ مناورة التنفس (المسمى: OS_cont_acq). اترك تسلسل نظام التشغيل الأساسي دون تغيير. في الاكتساب المستمر لنظام التشغيل ، قم بزيادة التدابير المتكررة من 1 إلى ~ 25-40 (حسب نوع الماسح الضوئي). زيادة عدد دورات القلب (التدابير) حتى وقت الاستحواذ ~ 4.5 دقيقة.
ملاحظة: هناك حاجة إلى تسلسلين OS-CMR: اكتساب خط الأساس لنظام التشغيل والاكتساب المستمر لنظام التشغيل مع مناورات التنفس النشطة للأوعية. تصف الأقسام التالية هذه الخطوات.
4. الحصول على خط الأساس لنظام التشغيل
- للحصول على وصفة شريحة ، خطط في إطار ثابت انقباضي نهائي لعرض محور طويل (صورة من غرفتين أو أربع غرف). يصف شريحتين قصيرتي المحور - واحدة في منتصف إلى القاعدية والأخرى على مستوى البطين من منتصف إلى قمي. راجع المناقشة للحصول على نقاط يجب مراعاتها فيما يتعلق بموقع الشريحة.
- تعديلات معلمات التسلسل
- اضبط معلمات التسلسل حسب الحاجة لمشارك معين. انظر الجدول 3 لمعرفة معلمات التسلسل التي يمكن أو لا يمكن تغييرها.
- اضبط متوسط الفجوة / التباعد بين الشرائح بناء على حجم قلب المشارك وتأكد من موقع الشريحة المناسب.
- اضبط مجال الرؤية لتجنب التفاف القطع الأثرية إذا لزم الأمر. ابذل قصارى جهدك للحفاظ على مجال الرؤية بين 360 مم و 400 مم.
- حجم الرقاقة
- اضبط مستوى صوت الرقاقة ليكون ضيقا حول البطين الأيسر في كل من طرق عرض المحور الطويل والقصير.
- اكتساب التسلسل
- وافق على التسلسل وقم بتشغيله أثناء حبس النفس في نهاية الزفير. تأكد من أن تسلسل نظام التشغيل الأساسي هذا يستمر ~ 10 ثوان ، بناء على معدل ضربات القلب وماسح التصوير بالرنين المغناطيسي.
- فحص جودة الصورة
- تحقق من كلتا الشريحتين من السلسلة المكتسبة - ابحث عن أي حركة تنفسية أو موقع شريحة سيئ أو وجود قطع أثرية. كرر تسلسل نظام التشغيل الأساسي حتى يتم الحصول على جودة صورة مناسبة.
- لاستكشاف الأخطاء وإصلاحها ، إذا كان موقع الشريحة قاعديا جدا أو قميا جدا ، فاضبط موقع الشريحة الموصوف ليكون أقرب إلى مستوى منتصف البطين. إذا كانت هناك قطعة أثرية موجودة ، فاتبع الخطوات أدناه:
- تحقق من اتجاه ترميز المرحلة.
- اجعل مجال الرؤية أكبر.
- اضبط مستوى صوت الرقاقة حول البطين الأيسر.
5. اكتساب نظام التشغيل المستمر مع مناورات التنفس النشطة في الأوعية
ملاحظة: تأكد من أن كل مشارك قد تم إرشاده حول الأداء السليم لمناورة التنفس قبل أن يكون في ماسح التصوير بالرنين المغناطيسي (انظر القسم 2).
- تخطيط التسلسل
- إذا أمكن ، انسخ موضع الشريحة واضبط مستوى الصوت من صورة خط الأساس لنظام التشغيل أو قم بتكرار تسلسل نظام التشغيل الأساسي ، وفي القياسات المتكررة ، قم بالزيادة من 1 إلى ~ 25-40 (أو ما يقرب من 4.5 دقيقة من وقت الاستحواذ).
- تحقق من موضع الصورة والشريحة، ثم دورة الالتقاط.
- افتح نافذة البث المباشر إن أمكن.
- في غرفة التحكم ، قم بتوصيل جهاز بتعليمات مناورة التنفس .mp3 الملف بالإدخال الإضافي أو استعد لتثبيته فوق الميكروفون المسقط في ماسح التصوير بالرنين المغناطيسي. بدلا من ذلك ، قم بتوجيه المشارك يدويا خلال مناورة التنفس باستخدام ساعة توقيت للتوقيت وتقديم التعليمات شفهيا من خلال الميكروفون المتصل بنظام مكبر صوت التصوير بالرنين المغناطيسي.
- اكتساب التسلسل
- اضغط في نفس الوقت على تشغيل لتسلسل الاكتساب المستمر لنظام التشغيل على ماسح التصوير بالرنين المغناطيسي وتشغيل ملف تعليمات التنفس .mp3 أو ابدأ ساعة الإيقاف إذا تم توجيه المشارك يدويا.
- إذا قمت بتوجيه المشارك يدويا خلال مناورات التنفس ، فاطلب منه الزفير والزفير ، ثم احبس أنفاسه لمدة 10 ثوان ، وابدأ في التنفس المفرط بمجرد سماع صوت بندول الإيقاع.
- قم بإخطار المشارك عند علامة 40 ثانية من فرط التنفس (2:40 على ساعة التوقيت).
- في النقطة الزمنية 55 ثانية من فرط التنفس (2:55 على ساعة الإيقاف) ، اطلب من المشارك "أخذ نفس عميق ، والزفير ، وحبس أنفاسك".
ملاحظة: ستحتوي صور التنفس الحر وفرط التنفس على قطع أثرية للحركة. هذا متوقع. ومع ذلك ، لا ينبغي أن يكون هناك أي قطع أثرية متحركة أثناء حبس النفس. من المهم للغاية أن يتم الحصول على الصور التي تحبس الأنفاس بعد الزفير (وضع الزفير النهائي المريح). فقط حبس النفس بعد الزفير يؤدي إلى زيادة سريعة في الدم CO2 خلال أول 30 ثانية من حبس النفس اللاحق ، مع التغيير المرتبط بتدفق الدم التاجي وأكسجة عضلة القلب. - راقب أداء المشارك لفرط التنفس من خلال نافذة غرفة التحكم أو كاميرا ماسح التصوير بالرنين المغناطيسي لضمان الأداء المناسب للتنفس العميق. إذا تم استخدام المنفاخ ، فقم بمراقبة قمم السعة على عارض بوابات التنفس. إذا لم يتم إجراء فرط التنفس بشكل كاف بعد التوجيه الأولي ، فقم بإجهاض الاستحواذ وكرر تسلسل الاستحواذ المستمر لنظام التشغيل.
- راقب أي أنفاس صغيرة يأخذها المشاركون طوال فترة التنفس. قم بذلك عن طريق مراقبة تتبع حزام التنفس على وحدة التحكم في التصوير بالرنين المغناطيسي أو بصريا من خلال النافذة / الكاميرا.
- بمجرد أن يبدأ المشارك في التنفس في نهاية التنفس ، توقف عن الاستحواذ.
- بعد انتهاء عملية الاستحواذ ، اسأل المشارك عما إذا كان قد عانى من أي آثار ضارة واسمح للمشارك بالتنفس بشكل طبيعي لمدة 3 دقائق.
- استكشاف الأخطاء وإصلاحها: تكرار الاستحواذ
- إذا كانت هناك حاجة إلى تكرار مناورات التنفس ، كرر تسلسل نظام التشغيل الأساسي.
ملاحظة: مطلوب فترة 2-3 دقائق قبل تكرار الاستحواذ للسماح لعلم وظائف الأعضاء بالعودة إلى خط الأساس. أظهرت البيانات السابقة أن علم وظائف الأعضاء لا يعود إلى خط الأساس بعد 1 دقيقة41. - إذا كانت جودة الصورة لتسلسل خط الأساس لنظام التشغيل كافية ، كرر الاستحواذ المستمر لنظام التشغيل وأداء مناورات التنفس.
- إذا كانت هناك حاجة إلى تكرار مناورات التنفس ، كرر تسلسل نظام التشغيل الأساسي.
6. تحليل الصور
- قم باستيراد مجموعات بيانات صور OS-CMR إلى عارض DICOM مع إمكانات تحديد الصورة ، والأفضل مع وظائف لتحليل تغييرات شدة الإشارة الحساسة للأكسجين تلقائيا.
- علامات وقياسها
- احصل على صورة أساسية أثناء اكتساب التنفس الأساسي القصير قبل فرط التنفس (الراحة). قارن الصورة الأولى لحبس النفس (الذي يمثل نهاية حافز "الإجهاد") بالصورة الأساسية.
ملاحظة: فرط التنفس هو محفز مضيق للأوعية يقلل من أكسجة عضلة القلب (صحي: ٪ ΔSI ≈−5٪ إلى -10٪ 13). - الحصول على العديد من الصور (ودورات القلب) أثناء حبس النفس. استخدم الصورة الأولى لحبس النفس كخط أساس وقارن جميع الصور التالية بهذه الصورة.
ملاحظة: حبس النفس هو محفز توسع للأوعية يزيد من أكسجة عضلة القلب (٪ ΔSI ≈ + 5٪ -15٪ 12،13،14،16). - ملامح عضلة القلب
للتحليل اليدوي: اختيار مرحلة القلب- نظرا لأن حبس النفس يمكن أن يحتوي على أكثر من 400 صورة ، فقم بتحليل مرحلة واحدة فقط من كل دورة قلبية. نتيجة لذلك ، ركز التحليل على صور نهاية الانقباض لكل دورة قلبية.
- التعرف على صور نهاية الانقباض لكل دورة قلبية.
- ارسم ملامح النخاب والشغاف حول عضلة القلب.
- نافذة الصورة للبحث عن القطع الأثرية ، والتي ستظهر إما مظلمة (حساسية) أو مناطق مشرقة بسبب ضعف البوابة في عضلة القلب.
ملاحظة: تجنب تضمين وحدات البكسل ذات تأثيرات الحجم الجزئي من تجمعات دم البطين الأيسر والأيمن. تحدث معظم أخطاء الكنتوري من محيط الشغاف ، بما في ذلك وحدات البكسل ذات تأثيرات الحجم الجزئي وما ينتج عنها من شدة إشارة مرتفعة بشكل مصطنع من تجمع دم البطين الأيسر. لتجنب ذلك ، ارسم محيط الشغاف بكسل واحد كامل داخل عضلة القلب. وبالمثل ، تأكد من أن محيط النخاب هو بكسل واحد كامل داخل عضلة القلب لتجنب تأثيرات الحجم الجزئي من تجمع دم البطين الأيمن أو الدهون النخابية أو واجهة الهواء والرئة. - انسخ والصق ملامح الشغاف والنخاب من الصورة الانقباضية الأولى للدورة القلبية إلى صورة نهاية الانقباض للدورة القلبية التالية. اضبط الخطوط حسب الحاجة.
للتحليل الآلي:
ملاحظة: مع قدرات الكنتوري الآلي ، إذا رغبت في ذلك ، يمكن تحديد جميع مراحل الدورة القلبية وتحليلها. - تحقق من جميع الصور لضمان تحديد دقيق.
ملاحظة: تم تدريب بعض قدرات الكنتوري الآلي المتاحة تجاريا على مجموعات البيانات التي تم تحديدها للتحليل الحجمي. هذه الخطوط عرضة لتأثيرات الحجم الجزئي لأنها تهدف إلى الحد من تجمع الدم وعضلة القلب. يجب أن تكون ملامح OS-CMR داخل عضلة القلب بالكامل.
- احصل على صورة أساسية أثناء اكتساب التنفس الأساسي القصير قبل فرط التنفس (الراحة). قارن الصورة الأولى لحبس النفس (الذي يمثل نهاية حافز "الإجهاد") بالصورة الأساسية.
7. التجزئة للتحليل الإقليمي
- للحصول على معلومات إقليمية ، حدد الإدخال الأمامي والداخلي للبطين الأيمن لتقسيم عضلة القلب إلى تجزئة جمعية القلب الأمريكية (AHA)42.
8. حساب B-MORE
- عبر عن B-MORE كنسبة مئوية من التغير في شدة الإشارة من خط الأساس إلى توسع الأوعية (انظر المعادلة 1):
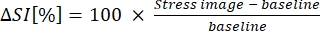 (1)
(1) - احسب B-MORE العالمي باعتباره المتوسط العالمي لشدة إشارة عضلة القلب للصور الانقباضية النهائية عند 30 ثانية مقارنة ب 0 s من حبس النفس8 (انظر المعادلة 2):
 (2)
(2)
Access restricted. Please log in or start a trial to view this content.
النتائج
الترجمة الفورية B-MORE
في الدراسات المنشورة سابقا باستخدام OS-CMR مع مناورات التنفس النشطة في الأوعية ، تم حساب B-MORE العالمي أو الإقليمي من خلال مقارنة الصورة الانقباضية النهائية الأولى لحبس التنفس بالصورة الانقباضية النهائية الأقرب إلى 15 ثانية ، 30 ثانية ، 45 ثانية ، وما إلى ذلك من حب?...
Access restricted. Please log in or start a trial to view this content.
Discussion
إن إضافة اكتساب OS-CMR مع مناورات التنفس الموحدة والنشطة في الأوعية إلى بروتوكول بحث أو تصوير بالرنين المغناطيسي السريري المعمول به بالفعل يضيف القليل من الوقت إلى الفحص الشامل. مع هذه الإضافة القصيرة ، يمكن الحصول على معلومات حول وظيفة الأوعية الدموية الكبيرة والدقيقة الأساسية (
Access restricted. Please log in or start a trial to view this content.
Disclosures
تم إدراج MGF كحامل لبراءة الاختراع الأمريكية رقم 14/419,877: إحداث وقياس تغيرات أكسجة عضلة القلب كعلامة لأمراض القلب. براءة اختراع الولايات المتحدة رقم 15/483,712: قياس تغيرات الأوكسجين في الأنسجة كعلامة لوظيفة الأوعية الدموية؛ براءة الاختراع الأمريكية رقم 10,653,394: قياس تغيرات الأوكسجين في الأنسجة كعلامة لوظيفة الأوعية الدموية - استمرارها ؛ وبراءة الاختراع الكندية CA2020 / 051776: طريقة وجهاز لتحديد المؤشرات الحيوية لوظيفة الأوعية الدموية باستخدام صور CMR الجريئة. تم إدراج EH كحامل لبراءة الاختراع الدولية CA2020 / 051776: طريقة وجهاز لتحديد المؤشرات الحيوية لوظيفة الأوعية الدموية باستخدام صور CMR الجريئة.
Acknowledgements
تم إجراء هذه الورقة ومراجعة المنهجية من قبل الفريق بأكمله لمجموعة أبحاث كورتوا CMR في المركز الصحي بجامعة ماكجيل. شكر خاص لتقنيي التصوير بالرنين المغناطيسي لدينا ماجي ليو وسيلفي جيلينو لمسح المشاركين لدينا وردود الفعل على هذه المخطوطة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| balanced SSFP MRI sequence | Any | To modify to create the OS-CMR sequence | |
| DICOM/ Imaging Viewer | Any | Best if the viewer has the ability for quantitative measurements (i.e., Area19 prototype software) | |
| Magnetic Resonance Imaging scanner | Any | 3 Tesla or 1.5 Tesla | |
| Metronome | Any | Set to 30 breaths per minute. To use if manually communicating breathing maneuver instructions to participants. | |
| Speaker system | Any | To communicate breathing maneuver instrucitons to participants through | |
| Stopwatch | Any | To use if manually communicating breathing maneuver instructions to participants |
References
- Ogawa, S., Lee, T. M., Kay, A. R., Tank, D. W. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proceedings of the National Academy of Sciences of the United States of America. 87 (24), 9868-9872 (1990).
- Friedrich, M. G., Karamitsos, T. D. Oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15, 43(2013).
- Guensch, D. P., et al. The blood oxygen level dependent (BOLD) effect of in-vitro myoglobin and hemoglobin. Scientific Reports. 11 (1), 11464(2021).
- Guensch, D. P., et al. Breathing manoeuvre-dependent changes in myocardial oxygenation in healthy humans. European Heart Journal - Cardiovascular Imaging. 15 (4), 409-414 (2014).
- Fischer, K., Guensch, D. P., Shie, N., Lebel, J., Friedrich, M. G. Breathing maneuvers as a vasoactive stimulus for detecting inducible myocardial ischemia - An experimental cardiovascular magnetic resonance study. PloS One. 11 (10), 0164524(2016).
- Friedrich, M. G. Tracking myocardial oxygenation over a breath hold with blood oxygen level−dependent MRI: A radically different approach to study ischemia. Radiology. 294 (3), 546-547 (2020).
- Teixeira, T., Nadeshalingam, G., Fischer, K., Marcotte, F., Friedrich, M. G. Breathing maneuvers as a coronary vasodilator for myocardial perfusion imaging. Journal of Magnetic Resonance Imaging. 44 (4), 947-955 (2016).
- Fischer, K., Guensch, D. P., Friedrich, M. G. Response of myocardial oxygenation to breathing manoeuvres and adenosine infusion. European Heart Journal Cardiovascular Imaging. 16 (4), 395-401 (2015).
- Ong, P., Athanasiadis, A., Sechtem, U. Intracoronary acetylcholine provocation testing for assessment of coronary vasomotor disorders. Journal of Visualized Experiments. (114), e54295(2016).
- Voigtländer, T., et al. The adverse events and hemodynamic effects of adenosine-based cardiac MRI. Korean Journal of Radiology. 12 (4), 424-430 (2011).
- Tsang, K. H., Chan, W. S. W., Shiu, C. K., Chan, M. K. The safety and tolerability of adenosine as a pharmacological stressor in stress perfusion cardiac magnetic resonance imaging in the Chinese population. Hong Kong Medical Journal. 21 (6), 524-527 (2015).
- Roubille, F., Fischer, K., Guensch, D. P., Tardif, J. -C., Friedrich, M. G. Impact of hyperventilation and apnea on myocardial oxygenation in patients with obstructive sleep apnea - An oxygenation-sensitive CMR study. Journal of Cardiology. 69 (2), 489-494 (2017).
- Fischer, K., et al. Feasibility of cardiovascular magnetic resonance to detect oxygenation deficits in patients with multi-vessel coronary artery disease triggered by breathing maneuvers. Journal of Cardiovascular Magnetic Resonance. 20 (1), 31(2018).
- Iannino, N., et al. Myocardial vascular function assessed by dynamic oxygenation-sensitive cardiac magnetic resonance imaging long-term following cardiac transplantation. Transplantation. 105 (6), 1347-1355 (2021).
- Elharram, M., et al. Regional heterogeneity in the coronary vascular response in women with chest pain and nonobstructive coronary artery disease. Circulation. 143 (7), 764-766 (2021).
- Fischer, K., et al. Insights into myocardial oxygenation and cardiovascular magnetic resonance tissue biomarkers in heart failure with preserved ejection fraction. Circulation: Heart Failure. 15 (4), 008903(2022).
- Li, D., Dhawale, P., Rubin, P. J., Haacke, E. M., Gropler, R. J. Myocardial signal response to dipyridamole and dobutamine: demonstration of the BOLD effect using a double-echo gradient-echo sequence. Magnetic Resonance in Medicine. 36 (1), 16-20 (1996).
- Arnold, J. R., et al. Myocardial oxygenation in coronary artery disease: insights from blood oxygen level-dependent magnetic resonance imaging at 3 tesla. Journal of the American College of Cardiology. 59 (22), 1954-1964 (2012).
- Karamitsos, T. D., et al. Relationship between regional myocardial oxygenation and perfusion in patients with coronary artery disease: Insights from cardiovascular magnetic resonance and positron emission tomography. Circulation: Cardiovascular Imaging. 3 (1), 32-40 (2010).
- Friedrich, M. G., Niendorf, T., Schulz-Menger, J., Gross, C. M., Dietz, R. Blood oxygen level-dependent magnetic resonance imaging in patients with stress-induced angina. Circulation. 108 (18), 2219-2223 (2003).
- Cai, H., Harrison, D. G. Endothelial dysfunction in cardiovascular diseases: The role of oxidant stress. Circulation Research. 87 (10), 840-844 (2000).
- Kothawade, K., Bairey Merz, C. N. Microvascular coronary dysfunction in women: Pathophysiology, diagnosis, and management. Current Problems in Cardiology. 36 (8), 291-318 (2011).
- Gimbrone, M. A., García-Cardeña, G. Endothelial cell dysfunction and the pathobiology of atherosclerosis. Circulation Research. 118 (4), 620-636 (2016).
- Vancheri, F., Longo, G., Vancheri, S., Henein, M. Coronary microvascular dysfunction. Journal of Clinical Medicine. 9 (9), 2880(2020).
- Camici, P. G., Crea, F. Coronary microvascular dysfunction. The New England Journal of Medicine. 356 (8), 830-840 (2007).
- Ford, T. J., et al. Assessment of vascular dysfunction in patients without obstructive coronary artery disease: Why, how, and when. JACC: Cardiovascular Interventions. 13 (16), 1847-1864 (2020).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Budhiraja, R., Parthasarathy, S., Quan, S. F. Endothelial dysfunction in obstructive sleep apnea. Journal of Clinical Sleep Medicine. 3 (4), 409-415 (2007).
- Sena, C. M., Pereira, A. M., Seiça, R. Endothelial dysfunction - A major mediator of diabetic vascular disease. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1832 (12), 2216-2231 (2013).
- Vanhoutte, P. M., Shimokawa, H., Feletou, M., Tang, E. H. C. Endothelial dysfunction and vascular disease - A 30th anniversary update. Acta Physiologica. 219 (1), 22-96 (2017).
- Juni, R. P., Duckers, H. J., Vanhoutte, P. M., Virmani, R., Moens, A. L. Oxidative stress and pathological changes after coronary artery interventions. Journal of the American College of Cardiology. 61 (14), 1471-1481 (2013).
- Simsek, E. C., et al. Endothelial dysfunction in patients with myocardial ischemia or infarction and nonobstructive coronary arteries. Journal of Clinical Ultrasound. 49 (4), 334-340 (2021).
- Stillman, A. E., et al. Imaging the myocardial ischemic cascade. The International Journal of Cardiovascular Imaging. 34 (8), 1249-1263 (2018).
- Fischer, D., et al. Endothelial dysfunction in patients with chronic heart failure is independently associated with increased incidence of hospitalization, cardiac transplantation, or death. European Heart Journal. 26 (1), 65-69 (2005).
- Hurst, T., Olson, T. H., Olson, L. E., Appleton, C. P. Cardiac syndrome X and endothelial dysfunction: New concepts in prognosis and treatment. The American Journal of Medicine. 119 (7), 560-566 (2006).
- Bauer, W. R., et al. Theory of the BOLD effect in the capillary region: An analytical approach for the determination of T*2 in the capillary network of myocardium. Magnetic Resonance in Medicine. 41 (1), 51-62 (1999).
- Manka, R., et al. BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia. Journal of Cardiovascular Magnetic Resonance. 12 (1), 54(2010).
- Dharmakumar, R., Qi, X., Hong, J., Wright, G. A. Detecting microcirculatory changes in blood oxygen state with steady-state free precession imaging. Magnetic Resonance in Medicine. 55 (6), 1372-1380 (2006).
- Kramer, C. M., et al. Standardized cardiovascular magnetic resonance imaging (CMR) protocols: 2020 update. Journal of Cardiovascular Magnetic Resonance. 22 (1), 17(2020).
- Expert Panel on MR Safety et al. ACR guidance document on MR safe practices: 2013. Journal of Magnetic Resonance Imaging: JMRI. 37 (3), 501-530 (2013).
- Macey, P. M., Kumar, R., Ogren, J. A., Woo, M. A., Harper, R. M. Global brain blood-oxygen level responses to autonomic challenges in obstructive sleep apnea. PLoS One. 9 (8), 105261(2014).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. Circulation. 105 (4), 539-542 (2002).
- Hayoz, D., et al. Flow-mediated arterial dilation is abnormal in congestive heart failure. Circulation. 87 (6), 92-96 (1993).
- Hillier, E., Friedrich, M. G. The potential of oxygenation-sensitive CMR in heart failure. Current Heart Failure Reports. 18 (5), 304-314 (2021).
- Hawkins, S. M., et al. Hyperventilation-induced heart rate response as a potential marker for cardiovascular disease. Scientific Reports. 9 (1), 17887(2019).
- Dass, S., et al. No evidence of myocardial oxygen deprivation in nonischemic heart failure. Circulation: Heart Failure. 8 (6), 1088-1093 (2015).
- Endemann, D. H., Schiffrin, E. L. Endothelial dysfunction. Journal of the American Society of Nephrology. 15 (8), 1983-1992 (2004).
- Costanzo, M. R., et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. The Journal of Heart and Lung Transplantation. 29 (8), 914-956 (2010).
- Lanza, G. A. Cardiac syndrome X: A critical overview and future perspectives. Heart. 93 (2), 159-166 (2007).
- Gould, K. L., Johnson, N. P. Coronary physiology beyond coronary flow reserve in microvascular angina: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2642-2662 (2018).
- Guensch, D. P., Nadeshalingam, G., Fischer, K., Stalder, A. F., Friedrich, M. G. The impact of hematocrit on oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 18 (1), 42(2016).
- Dharmakumar, R., et al. Assessment of regional myocardial oxygenation changes in the presence of coronary artery stenosis with balanced SSFP imaging at 3.0T: Theory and experimental evaluation in canines. Journal of Magnetic Resonance Imaging. 27 (5), 1037-1045 (2008).
- Hillier, E., Benovoy, M., Friedrich, M. A fully automated post-processing tool identifies a reduced global myocardial oxygenation reserve in patients with ischemia and no obstructive coronary artery stenosis when compared to patients with significant CAD. SCMR 25th Annual Scientific Sessions. , (2022).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Oxygenation-sensitive Cardiac MRI with Vasoactive Breathing Maneuvers for the Non-invasive Assessment of Coronary Microvascular Dysfunction
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/64149
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved