JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
관상 동맥 미세혈관 기능 장애의 비침습적 평가를 위한 혈관 활성 호흡 기동을 사용한 산소 민감성 심장 MRI
Erratum Notice
요약
혈관 활성 호흡 조작과 결합된 산소 민감성 심장 자기 공명 영상에 의한 미세혈관 기능 평가는 생체 내 심근 산소화의 급격한 동적 변화를 평가할 수 있는 능력에서 독보적이며, 따라서 관상 동맥 혈관 기능에 매우 중요한 진단 기법이 될 수 있습니다.
초록
산소 민감성 심장 자기 공명 영상(OS-CMR)은 조직 조영제의 내인성 소스로 디옥시헤모글로빈의 고유한 상자성 특성을 사용하는 진단 기술입니다. OS-CMR은 표준화된 혈관 활성 호흡 조작(과호흡 및 무호흡)과 함께 강력한 비약물적 혈관 운동 자극으로 사용되어 심근 산소 공급의 변화를 모니터링할 수 있습니다. 심장 주기 동안 및 혈관 활성 기동 전반에 걸쳐 이러한 변화를 정량화하면 관상 동맥 거대 혈관 및 미세 혈관 기능에 대한 마커를 제공할 수 있으므로 외인성, 정맥 내 조영제 또는 약리학적 스트레스 작용제의 필요성을 피할 수 있습니다.
OS-CMR은 혈액 산소화에 대한 T2* 가중 이미지의 잘 알려진 감도를 사용합니다. 수정된 표준 SSFP(Clinical Steady-State Free Precession) 시네 시퀀스를 사용하여 모든 심장 MRI 스캐너에서 산소 공급에 민감한 이미지를 획득할 수 있으므로 이 기술은 공급업체에 구애받지 않고 쉽게 구현할 수 있습니다. 혈관 활성 호흡 기동으로 우리는 120초의 자유 호흡, 60초의 페이스 과호흡, 최소 30초의 호기 호흡 참기로 구성된 4분 호흡 프로토콜을 적용합니다. 이 기동에 대한 심근 조직 산소화의 지역 및 전체 반응은 신호 강도 변화를 추적하여 평가할 수 있습니다. 호흡 유도 심근 산소 예비력(B-MORE)이라고 하는 과호흡 후 숨 참기의 초기 30초 동안의 변화는 건강한 사람과 다양한 병리학에서 연구되었습니다. 혈관 활성 조작으로 산소에 민감한 CMR 스캔을 수행하기 위한 자세한 프로토콜이 제공됩니다.
폐쇄성 관상동맥 협착증(INOCA)이 없는 유도성 허혈, 박출률이 보존된 심부전(HFpEF) 또는 심장 이식 후 미세혈관 기능 장애와 같이 아직 완전히 이해되지 않은 상태에서 미세혈관 기능 장애가 있는 환자에서 입증된 바와 같이, 이 접근법은 관상동맥 혈관 기능에 대한 독특하고 임상적으로 중요하며 보완적인 정보를 제공합니다.
서문
산소화에 민감한 심장 자기 공명 영상(OS-CMR)은 MR 조영제의 내인성 소스로 디옥시헤모글로빈의 고유한 상자성 특성을 사용합니다 1,2,3. 강력한 비약물적 혈관 운동 자극제로서 표준화된 혈관 활성 호흡 조작(과호흡 및 무호흡)과 함께 사용되는 OS-CMR은 혈관 기능의 표지자로서 심근 산소화의 변화를 모니터링할 수 있으므로 외인성, 정맥 조영제 또는 약리학적 스트레스 제제의 필요성을 피할 수 있습니다 4,5,6.
숨 참기 및 과호흡을 포함한 호흡 조작은 혈관 운동을 변화시키는 매우 효과적인 혈관 활성 조치이며, 안전성과 단순성으로 인해 진단 절차의 일부로 제어된 내피 의존성 혈관 운동에 이상적입니다. 연구에 따르면 과호흡과 후속 호흡 참기를 결합할 때 추가 효과가 있는 것으로 나타났습니다4,7, 이러한 프로토콜 동안 혈관 수축(관련 혈액 이산화탄소 감소를 통해) 후 혈관 확장(혈액 이산화탄소 증가)이 뒤따릅니다. 따라서 건강한 혈관계는 심근 혈류의 강력한 증가와 함께 혈관 수축에서 혈관 확장에 이르기까지 전체 범위로 전환되며, 이는 다시 심근 산소 공급을 증가시켜 OS-CMR 이미지에서 관찰 가능한 신호 강도를 증가시킵니다. 또한 획득을 위해 cine 이미지를 사용하면 아데노신 주입과 비교할 때 더 나은 신호 대 잡음비로 심장 위상 분해 결과를 얻을 수 있습니다8.
호흡 조작은 관상 동맥 혈관 기능을 평가하는 데 사용할 수 있는 혈관 활성 변화를 유도하기 위한 약리학적 스트레스 인자를 대체할 수 있습니다. 이는 환자의 위험, 물류 노력 및 관련 비용을 줄일 뿐만 아니라 임상적으로 더 의미 있는 결과를 제공하는 데 도움이 됩니다. 아데노신과 같은 약리학적 스트레스 물질은 내피 의존성 반응을 유발하여 내피 기능 자체를 반영합니다. 지금까지 내피 기능에 대한 이러한 특이적 평가는 내피 의존성 혈관 확장제로서 아세틸콜린의 관상동맥 내 투여에 의해서만 가능했습니다. 그러나 이 시술은 매우 침습적이어서(2,9) 거의 시행되지 않는다.
직접적인 바이오마커에 대한 접근이 부족하기 때문에 여러 진단 기술은 외인성 조영제의 조직 흡수와 같은 대리 마커를 사용했습니다. 하나 또는 두 개의 정맥 주사 액세스 라인의 필요성, 중증 신장 질환 또는 방실 차단과 같은 금기 사항, 잠재적으로 심각한 부작용 관리 교육을 받은 직원의 물리적 존재의 필요성에 의해 제한됩니다10,11. 그러나 현재 관상동맥 기능 영상의 가장 중요한 한계는 대리표지자로서의 심근 관류가 혈관 기능 장애의 가장 중요한 다운스트림 결과인 심근 조직 산소화를 반영하지 않는다는 점이다2.
혈관 활성 호흡 기동을 통한 OS-CMR은 건강한 개인, 관상 동맥 질환(CAD) 환자의 대혈관 질환, 폐쇄성 수면 무호흡증(OSA) 환자의 미세혈관 기능 장애, 폐쇄성 수면 무호흡증(OSA), 폐쇄성 관상동맥 협착증(INOCA), 심장 이식 후 폐쇄성 관상동맥 협착증이 없는 허혈, 박출률이 보존된 심부전(HFpEF)4을 포함한 다양한 시나리오에서 혈관 기능을 평가하는 데 활용되었습니다. 7,12,13,14,15,16입니다. CAD 모집단에서, OS-CMR에서 유래한 호흡 유도 심근 산소화 예비력(B-MORE)에 대한 프로토콜은 심각한 협착증이 있는 관상동맥에 의해 관류되는 심근 영역에서 손상된 산소화 반응을 식별하는 데 안전하고 실현 가능하며 민감한 것으로 입증되었습니다13.
미세혈관 기능 장애에서 OS-CMR은 폐쇄성 수면 무호흡증 환자에서 지연된 심근 산소화 반응을 보여주었고, HFpEF 환자와 심장 이식 후 무딘 B-MORE가 발견되었다12,14,16. INOCA를 앓고 있는 여성의 경우, 호흡 조작이 비정상적으로 이질적인 심근 산소화 반응을 일으켜 OS-CMR15의 높은 공간 분해능의 이점을 강조합니다. 이 논문은 혈관 활성 호흡 조작으로 OS-CMR을 수행하기 위한 이론적 근거와 방법론을 검토하고 특히 내피 기능 장애와 관련된 미세혈관 기능 장애가 있는 환자 집단의 혈관 병태생리학 평가에서 OS-CMR의 임상적 유용성에 대해 논의합니다.
호흡 강화 산소 민감 MRI의 생리학적 맥락
정상적인 생리적 조건에서 산소 요구량의 증가는 혈류량 증가를 통한 산소 공급의 증가와 일치하여 국소 디옥시헤모글로빈 농도의 변화가 없습니다. 대조적으로, 유도된 혈관 확장은 산소 요구량의 변화 없이 산소가 공급된 혈액의 "과도한" 유입을 초래합니다. 결과적으로, 더 많은 조직 헤모글로빈에 산소가 공급되고, 따라서 디옥시헤모글로빈이 적어지고, OS-CMR 신호 강도가 상대적으로 증가한다 4,17. 혈관 기능이 저하되면 심근 혈류를 증가시키기 위해 변화된 신진대사 요구나 자극에 적절하게 반응할 수 없습니다.
혈관 수축을 유발하는 과호흡 속도 또는 이산화탄소 매개 혈관 확장을 유도하는 긴 호흡 참기와 같이 혈관 운동을 유도하는 자극의 설정에서 손상된 혈관 운동 활동은 다른 영역에 비해 국소 디옥시헤모글로빈 농도의 상대적 증가를 초래하고 결과적으로 OS-CMR 신호 강도의 변화를 감소시킵니다. 유발성 허혈의 설정에서, 손상된 혈관 기능은 심외막 관상동맥 협착증이 없는 경우에도 심근 혈류의 국소적 증가에 의해 충족되지 않는 국소 수요 증가를 초래할 것입니다. OS-CMR 이미지에서 디옥시헤모글로빈 농도의 순 국소 증가는 국소 신호 강도 2,18,19,20의 감소로 이어집니다.
관상동맥 미세혈관 기능 장애 환자에서 내피 의존성 및 비의존성 혈관 확장제(아데노신 포함)에 대한 반응으로 약화된 혈관 평활근 이완이 입증되었습니다 21,22,23,24,25,26,27. 내피 독립적 기능 장애는 미세혈관 비대 또는 주변 심근 병리로 인한 구조적 이상으로 인해 발생하는 것으로 생각됩니다. 대조적으로, 내피 기능 장애는 부적절한 혈관 수축 및 손상된(내피 의존성) 혈관 이완을 초래하며, 이는 전형적으로 혈관 벽에서 산화질소 생체 활성의 손실에 의해 야기된다(21,28). 내피 기능 장애는 고콜레스테롤혈증, 고혈압, 당뇨병, CAD, 폐쇄성 수면 무호흡증, INOCA 및 HF 23,24,28,29,30,31,32를 포함한 여러 심혈관 질환의 발병과 관련이 있습니다. 사실, 내피 기능 장애는 관상동맥 죽상동맥경화증의 가장 초기 증상이다33. 내피 기능의 이미징은 심혈관 질환 상태 23,29,30,31,34,35에서 심오한 예후를 나타내는 심혈관 부작용 및 장기 결과의 중요한 예측 인자로서의 역할을 감안할 때 매우 강력한 잠재력을 가지고 있습니다.
관류 영상과 달리, 과호흡 후 숨 참기 동안 심근 산소화의 상대적 증가로 정의되는 호흡 유도 심근 산소화 예비력(B-MORE)은 이러한 혈관 활성 유발 요인이 전역 또는 지역 산소화 자체에 미치는 결과를 시각화할 수 있습니다 2,36. 따라서 혈관 기능의 정확한 다운스트림 마커로서, B-MORE는 혈관 기능 장애뿐만 아니라 실제 유도성 허혈도 식별할 수 있으며, 이는 더 심각한 국소 관류 또는 산소화 문제를 나타낸다18,19,37. 이는 OS-CMR이 심근 조직의 상당 부분을 차지하는 심근의 모세관계에 풍부한 탈산소화된 헤모글로빈의 상대적 감소를 시각화하는 능력을 통해 달성된다(24).
OS-CMR 시퀀스
OS-CMR 영상에 사용되는 자기공명영상(MRI) 시퀀스는 두 개의 단축 슬라이스에서 획득된 전향적 게이트, 수정, 균형, 정상 상태, 자유 세차운동(bSSFP) 시퀀스입니다. 이 bSSFP 염기서열은 심장 MRI를 수행하는 모든 MRI 스캐너에서 사용할 수 있는(수정 가능한) 표준 임상 염기서열로, 이 기술은 공급업체에 구애받지 않고 쉽게 구현할 수 있습니다. 일반 bSSFP 시네 시퀀스에서 에코 시간, 반복 시간 및 플립 각도를 수정하여 결과 신호 강도를 BOLD 효과에 민감하게 하여 산소화에 민감한 시퀀스를 생성합니다. T2-준비된 bSSFP 판독인 이 접근법은 BOLD 이미징(38)에 사용된 이전의 그래디언트 에코 기술과 비교할 때 더 높은 신호 대 노이즈 비율, 더 높은 이미지 품질 및 더 빠른 스캔 시간으로 산소화에 민감한 이미지를 획득하는 데 적합한 것으로 이전에 나타났습니다. 이 접근법으로 호흡 강화 OS-CMR을 수행하면 매우 경미한 부작용과 함께 적용할 수 있습니다(표 1). 주목할 점은 참가자의 90% 이상이 충분히 긴 호흡 참기 시간 4,12,13,16으로 이 프로토콜을 완료한다는 것입니다.
프로토콜
혈관 활성 호흡 조작과 함께 OS-CMR을 사용하는 모든 MRI 스캔은 현지 기관 지침에 따라 수행해야 합니다. 아래에 요약된 프로토콜은 여러 기관 인간 연구 윤리 위원회에서 승인한 연구에서 사용되었습니다. 이 프로토콜과 원고에 설명된 모든 인간 참가자 데이터 및 결과에 대해 서면 동의를 얻었습니다.
1. 광범위한 개요
- 관심 있는 연구 모집단에 따라 포함 및 제외 기준을 변경합니다. 혈관 활성 호흡 기동 프로토콜이 있는 OS-CMR에 대해 다음과 같은 일반적이고 일반적인 제외 기준을 사용하십시오: 일반적인 MRI 금기 사항(예: 심박 조율기 또는 제세동기와 같은 MRI 호환 부적합 장치, 이식된 재료 또는 이물질), MRI 전 12시간 동안 카페인 또는 혈관 활성 약물 섭취 및 연령<18세).
- 먼저, OS 획득을 획득하기 전에 표준 임상 로컬라이저 스카우트와 심실 구조 및 기능 이미지를 획득합니다. bSSFP 장축 시네 이미지를 사용하여 OS 획득의 슬라이스 위치 지정을 계획합니다.
참고: 표준화된 임상 CMR 프로토콜에 대한 검토는 다른 곳에 설명되어 있습니다39. - 기준선 숨 참기
- 첫 번째 OS-CMR 시리즈를 짧은 베이스라인 숨 참기 획득으로 획득하여 이미지 품질과 슬라이스 위치를 평가하고, 아티팩트를 확인하고, 신호 강도 베이스라인 역할을 합니다.
- 참가자가 정상적으로 호흡한 후 짧은(~10초) 단일 심장 주기 획득을 수행합니다. 숨 참기가 종료 시 수행되는지 확인합니다.
- 혈관 활성 호흡 조작을 통한 지속적인 획득
- 두 번째 OS-CMR 시리즈는 2분의 자유 호흡과 1분의 페이스 과호흡으로 구성된 4분 연속 획득과 자발적인 최대 호흡 참기(~1분)로 구성됩니다. 연속 수집이 4분 동안 여러 심장 주기를 얻으면 하나의 추가 매개 변수(수집에 의해 수집된 심장 주기 수)를 수정하여 이 계열을 반복 측정 수집으로 만듭니다
알림: 필요한 최소 숨참기 길이는 30초이지만 60초의 숨참기가 표준으로 간주됩니다. - MRI 스피커 시스템에 연결된 마이크를 통해 또는 MRI 스피커 시스템을 통해 참가자를 위해 재생할 수 있는 사전 녹음된 .mp3 파일(보충 파일 1)을 통해 호흡 조작 전반에 걸쳐 참가자를 수동으로 지시하여 MRI 스캐너의 참가자에게 혈관 활성 호흡 기동에 대한 지침을 전달합니다.
- 자유 호흡으로 혈관 활성 호흡 기동을 시작합니다(120초 동안 자유 호흡을 한 후 과호흡이 시작됨). 30회 호흡/분의 빈도로 메트로놈의 가청 신호음을 사용하여 참가자를 속도있는 호흡으로 안내합니다(한 번의 경고음은 숨을 들이쉬고 한 번의 경고음은 숨을 내쉬는 것을 나타냄). 과호흡 55초 표시에서 "숨을 깊이 들이마신 다음 내쉬고 숨을 참으십시오"라는 마지막 음성 명령을 내려 숨참기가 최종 호기 수준에서 수행되도록 합니다.
참고 : 혈액 CO 2 의 변화는 기말 호흡 참기에서 훨씬 더 두드러집니다 (폐 표면이 더 작아 CO2 가 폐포로 잔류 확산되는 것을 최소화합니다).
- 두 번째 OS-CMR 시리즈는 2분의 자유 호흡과 1분의 페이스 과호흡으로 구성된 4분 연속 획득과 자발적인 최대 호흡 참기(~1분)로 구성됩니다. 연속 수집이 4분 동안 여러 심장 주기를 얻으면 하나의 추가 매개 변수(수집에 의해 수집된 심장 주기 수)를 수정하여 이 계열을 반복 측정 수집으로 만듭니다
- 이미지 분석
- B-MORE를 측정하려면 숨을 참는 동안 첫 번째 수축기 말단 이미지를 시간 0초로 간주합니다. 숨 참기의 30초 시점에 가장 가깝게 획득한 수축기 말단 이미지의 전역 또는 지역 신호 강도 값을 0초 시점의 이미지 신호 강도와 비교합니다. BMORE를 숨 참기의 시간 30초와 비교하여 0초에서 신호 강도의 백분율 변화로 보고합니다.
2. 사전 스캔 절차
- 모든 참가자가 지역 기관의 MRI 안전성 및 적합성 설문지(MRI 일반 금기 양식)를 통과하도록 보장하며, 여기에는 과거 의료 및 수술 이력에 대한 질문이 포함되어야 하며 참가자의 수술 부위 내부 또는 수술 부위에 임플란트, 장치 또는 금속 이물질의 존재를 식별해야 합니다(40).
- 해당되는 경우 임신 테스트기를 받으십시오.
- 환자가 MRI 스캔 전 12시간 동안 혈관 활성 약물과 카페인을 삼갔는지 확인합니다.
- 참가자에게 호흡 조작 지침(보충 비디오 S1)을 보여줍니다.
- MRI 스캔실 외부의 모든 참가자와 함께 60초 동안 과호흡을 한 후 자발적으로 숨을 최대한 참는 연습 세션을 수행하고 과호흡 성능에 대한 피드백을 제공합니다.
- 참가자들에게 호흡을 하고 싶은 강한 충동이 있을 때 간단히 호흡을 재개할 수 있다고 지시합니다.
참고: 참가자에게 메모하고 피드백을 제공할 사항에 대해서는 토론을 참조하십시오.
3. 산소에 민감한 염기서열의 MRI 획득
- MRI 콘솔의 표준 bSSFP 시퀀스에서 반복 시간(TR) 증가, 에코 시간(TE) 증가, 플립 각도(FA) 감소의 세 가지 매개변수를 수정합니다.
알림: 수정된 값은 MRI 스캐너 전계 강도에 따라 다릅니다(표 2). TR 및 TE를 증가시키고 FA를 감소시키면 MRI 시퀀스의 T2* 또는 산소화 민감도가 증가합니다. 이러한 수정은 시퀀스의 대역폭과 기본 해상도를 증가시킵니다. - 두 개의 OS 시리즈, 즉 기준선(레이블: OS_base)과 호흡 조작이 수행되는 연속 획득(레이블: OS_cont_acq)을 만듭니다. 기준 OS 시퀀스를 변경하지 않고 그대로 둡니다. OS 연속 획득에서 반복되는 측정값을 1에서 ~25-40으로 늘립니다(스캐너 유형에 따라 다름). 획득 시간이 ~4.5분이 될 때까지 심장 주기(측정) 수를 늘립니다.
참고: 두 가지 OS-CMR 시퀀스가 필요합니다: OS 기준선 획득 및 혈관 활성 호흡 조작을 통한 OS 연속 획득. 다음 섹션에서는 이러한 단계에 대해 설명합니다.
4. OS 기준 획득
- 절편 처방의 경우, 긴 축 보기의 수축기 말단 스틸 프레임(2챔버 또는 4챔버 이미지)에서 계획합니다. 두 개의 짧은 축 절편을 처방하는데, 하나는 중간에서 기저에, 다른 하나는 중간에서 정점까지의 심실 수준에 있습니다. 슬라이스 위치와 관련하여 고려해야 할 사항에 대해서는 토론을 참조하십시오.
- 시퀀스 파라미터 조정
- 지정된 참가자에 대해 필요에 따라 시퀀스 매개 변수를 조정합니다. 변경할 수 있거나 변경할 수 없는 시퀀스 매개변수에 대해서는 표 3 을 참조하십시오.
- 참가자의 심장 크기에 따라 슬라이스 사이의 평균 간격/간격을 조정하고 적절한 슬라이스 위치를 확인합니다.
- 필요한 경우 래핑 아티팩트를 피하기 위해 시야를 조정합니다. 시야를 360mm에서 400mm 사이로 유지하기 위해 모든 노력을 기울이십시오.
- 심 볼륨
- 장축 및 단축 모두에서 좌심실 주위가 꽉 조여지도록 심 부피를 조정합니다.
- 염기서열 수집
- 시퀀스를 승인하고 만료 종료 숨 참기 중에 실행합니다. 이 기준 OS 시퀀스가 심박수 및 MRI 스캐너에 따라 ~10초 동안 지속되는지 확인합니다.
- 화질 확인
- 획득한 시리즈의 두 슬라이스를 모두 확인하여 호흡 동작, 슬라이스 위치 불량 또는 아티팩트가 있는지 확인합니다. 적절한 이미지 품질을 얻을 때까지 기준 OS 시퀀스를 반복합니다.
- 문제 해결을 위해 슬라이스 위치가 너무 기초적이거나 너무 정점인 경우 처방된 슬라이스 위치를 중간 심실 수준에 더 가깝게 조정합니다. 아티팩트가 있는 경우 아래 단계를 수행합니다.
- 위상 인코딩 방향을 확인합니다.
- 시야를 더 크게 만듭니다.
- 좌심실 주변의 심 볼륨을 조정합니다.
5. 혈관 능동 호흡 기동을 통한 OS 연속 획득
알림: 모든 참가자가 MRI 스캐너에 들어가기 전에 호흡 조작의 적절한 수행에 대해 교육을 받았는지 확인하십시오(섹션 2 참조).
- 시퀀스 계획
- 가능하면 OS 기준 이미지에서 슬라이스 위치를 복사하고 볼륨을 조정하거나 기준 OS 시퀀스를 복제하고 반복 측정에서 1에서 ~25-40(또는 4.5분 획득 시간에 가까움)으로 늘립니다.
- 이미지와 슬라이스 위치를 확인한 다음 주기를 캡처합니다.
- 가능하면 라이브 스트림 창을 엽니다.
- 제어실에서 호흡 기동 지침 .mp3 파일이 있는 장치를 보조 입력에 연결하거나 MRI 스캐너에 투사되는 마이크 위에 고정할 준비를 합니다. 또는 타이밍을 위해 스톱워치를 사용하여 호흡 조작을 통해 참가자를 수동으로 안내하고 MRI 스피커 시스템에 연결된 마이크를 통해 구두로 지침을 제공합니다.
- 염기서열 수집
- MRI 스캐너에서 OS 연속 획득 시퀀스에 대해 재생 을 동시에 누르고 .mp3 호흡 지침에 대해 재생 합니다.
- 참가자에게 호흡 조작을 수동으로 안내하는 경우 숨을 들이쉬고 내쉬도록 지시한 다음 10초 동안 숨을 참았다가 메트로놈 신호음이 들리는 즉시 과호흡을 시작합니다.
- 과호흡 40초 표시(스톱워치 2:40)에서 참가자에게 알립니다.
- 과호흡 시점 55초(스톱워치 기준 2:55)에서 참가자에게 "숨을 깊이 들이쉬고, 내쉬고, 숨을 참으라"고 지시합니다.
참고: 자유 호흡 및 과호흡 이미지에는 모션 아티팩트가 있습니다. 이는 예상된 동작입니다. 그러나 숨 참기 중에는 모션 아티팩트가 없어야 합니다. 숨을 참는 이미지는 날숨 후에 획득하는 것이 매우 중요합니다(편안한 호기말 위치). 숨을 내쉰 후 숨을 참는 것만이 후속 숨 참기의 처음 30초 동안 혈중 CO2 의 급격한 증가로 이어지며 관상 동맥 혈류 및 심근 산소화의 관련 변화와 관련이 있습니다. - 제어실 창문 또는 MRI 스캐너 카메라를 통해 참가자의 과호흡 속도를 모니터링하여 심호흡의 적절한 수행을 보장합니다. 벨로우즈를 사용하는 경우 호흡 게이팅 뷰어에서 진폭 피크를 모니터링합니다. 초기 유도 후 과호흡이 적절하게 수행되지 않으면 획득을 중단하고 OS 연속 수집 시퀀스를 반복하십시오.
- 숨을 참는 동안 참가자가 취한 작은 호흡을 모니터링합니다. MRI 콘솔에서 호흡 벨트의 추적을 모니터링하거나 창/카메라를 통해 시각적으로 모니터링하여 이를 수행합니다.
- 참가자가 숨 참기가 끝날 때 숨을 쉬기 시작하면 획득을 중지합니다.
- 획득이 끝난 후 참가자에게 부작용을 경험했는지 묻고 참가자가 3분 동안 정상적으로 호흡할 수 있도록 합니다.
- 문제 해결: 반복 획득
- 호흡 조작을 반복해야 하는 경우 기준 OS 시퀀스를 반복합니다.
알림: 생리학이 기준선으로 돌아갈 수 있도록 획득을 반복하기 전에 2-3분의 시간이 필요합니다. 이전 데이터에 따르면 생리학은 1분41 후에 기준선으로 돌아가지 않습니다. - OS 기준선 시퀀스의 이미지 품질이 적절하면 호흡 조작의 OS 연속 획득 및 수행을 반복합니다.
- 호흡 조작을 반복해야 하는 경우 기준 OS 시퀀스를 반복합니다.
6. 이미지 분석
- OS-CMR 이미지 데이터 세트를 이미지 컨투어링 기능이 있는 DICOM 뷰어로 가져오며, 산소화에 민감한 신호 강도 변화를 자동으로 분석하는 기능이 가장 적합합니다.
- 마커 및 측정
- 과호흡(휴식) 전에 짧은 기준선 숨참기 획득 중에 기준선 이미지를 획득합니다. 숨 참기의 첫 번째 이미지("스트레스" 자극의 끝을 나타냄)를 기준 이미지와 비교합니다.
참고: 과호흡 은 심근 산소 공급을 감소시키는 혈관 수축 자극입니다(건강: %ΔSI ≈−5% to -10%13). - 숨을 참는 동안 많은 이미지(및 심장 주기)를 얻습니다. 숨 참기의 첫 번째 이미지를 기준선으로 사용하고 다음 모든 이미지를 이 이미지와 비교합니다.
참고: 숨 참기는 심근 산소 공급을 증가시키는 혈관 확장 자극입니다(%ΔSI ≈ +5%-15%12,13,14,16). - 심근 윤곽
수동 분석의 경우: 심장 단계 선택- 숨 참기에는 400개 이상의 이미지가 포함될 수 있으므로 각 심장 주기의 단일 단계만 분석합니다. 결과적으로 각 심장 주기의 수축기 말단 이미지에 분석을 집중합니다.
- 각 심장 주기의 수축기 말단 이미지를 식별합니다.
- 심근 주위의 심외막 및 심내막 윤곽을 그립니다.
- 이미지에 윈도우를 적용하여 심근의 게이트 불량으로 인해 어둡거나(민감성) 밝은 영역으로 나타나는 아티팩트를 찾습니다.
알림: 좌심실 및 우심실 혈액 풀의 부분적인 볼륨 효과가 있는 픽셀을 포함하지 마십시오. 대부분의 윤곽 오류는 부분적인 부피 효과가 있는 픽셀과 결과적으로 좌심실 혈액 풀에서 인위적으로 상승된 신호 강도를 포함하여 심내막 윤곽에서 발생합니다. 이를 방지하려면 심내막 안쪽에 한 픽셀 정도 심내막 윤곽을 그립니다. 마찬가지로, 심외막 윤곽이 심근 내부의 전체 픽셀이 되도록 하여 우심실 혈액 풀, 심외막 지방 또는 공기-폐 계면의 부분적인 부피 효과를 피하십시오. - 심장 주기의 첫 번째 수축기 말단 이미지에서 다음 심장 주기의 수축기 말단 이미지로 심내막 및 심외막 윤곽을 복사하여 붙여넣습니다. 필요에 따라 윤곽을 조정합니다.
자동 분석의 경우:
알림: 원하는 경우 자동 윤곽 조정 기능을 사용하여 심장 주기의 모든 단계를 윤곽을 잡고 분석할 수 있습니다. - 정확한 윤곽을 보장하기 위해 모든 이미지를 확인하십시오.
참고: 상업적으로 이용 가능한 일부 자동 윤곽 기능은 체적 분석을 위해 윤곽이 지정된 데이터 세트에 대해 학습되었습니다. 이러한 윤곽은 혈액 풀과 심근의 경계를 이루기 위한 것이므로 부분적인 부피 효과가 발생하기 쉽습니다. OS-CMR 윤곽은 심근 내부에 완전히 있어야 합니다.
- 과호흡(휴식) 전에 짧은 기준선 숨참기 획득 중에 기준선 이미지를 획득합니다. 숨 참기의 첫 번째 이미지("스트레스" 자극의 끝을 나타냄)를 기준 이미지와 비교합니다.
7. 지역 분석을 위한 세분화
- 국소 정보를 얻기 위해, 심근을 미국심장협회(AHA) 분할로 나누기 위해 우심실의 전중격 및 하중격 삽입을 확인한다42.
8. B-MORE 계산
- B-MORE를 기준선에서 혈관 확장까지의 신호 강도 변화율로 표현합니다(방정식 1 참조).
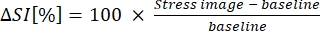 (1)
(1) - 전체 B-MORE를 30초에서 수축기 말단 이미지의 전체 평균 심근 신호 강도로 계산하고 호흡 참기8 의 0초와 비교합니다(방정식 2 참조).
 (2)
(2)
결과
B-MORE 해석
혈관 활성 호흡 기동과 함께 OS-CMR을 활용한 이전에 발표된 연구에서, 전체 또는 지역 B-MORE는 호흡 참기의 첫 번째 수축기 말단 이미지를 15초, 30초, 45초 등에 가장 가까운 수축기 말기 이미지와 비교하여 계산되었습니다. 심장 주기의 수축기 말기는 여러 가지 이유로 선택되었습니다. 수축기 말기 영상은 판독기 간에 식별되는 가장 일관된 단계로, 심근에 가장 많은 수의 ?...
토론
이미 확립된 연구 또는 임상 MRI 프로토콜에 표준화된 혈관 활성 호흡 조작을 통한 OS-CMR 획득을 추가하면 전체 스캔에 시간이 거의 추가되지 않습니다. 이 짧은 추가를 통해 근본적인 거대 및 미세 혈관 기능에 대한 정보를 얻을 수 있습니다(그림 2). 내피 기능 장애의 중요한 결과는 혈관이 생리적 자극에 반응할 수 없다는 것인데, 이는 심장의 비정상적인 흐름 매개 이완을 ?...
공개
MGF는 미국 특허 번호 14/419,877: 심장 질환 마커로서의 심근 산소화 변화 유도 및 측정; 미국 특허 제15/483,712호: 혈관 기능에 대한 마커로서 조직 내의 산소화 변화를 측정하는 단계; 미국 특허 제10,653,394호: 혈관 기능 - 지속을 위한 마커로서 조직에서의 산소화 변화를 측정하는 단계; 및 캐나다 특허 CA2020/051776: 대담한 CMR 이미지를 활용한 혈관 기능의 바이오마커를 결정하기 위한 방법 및 장치. EH는 국제 특허 CA2020/051776: 굵은 CMR 이미지를 활용한 혈관 기능의 바이오마커 결정 방법 및 장치(Method and apparatus for determining biomarkers of vascular function using bold CMR images)의 보유자로 등재되어 있습니다.
감사의 말
이 논문 및 방법론 검토는 McGill University Health Centre의 Courtois CMR Research Group 전체 팀에 의해 가능했습니다. 이 원고에 대한 참가자의 스캔과 피드백에 대해 MRI 기술자인 Maggie Leo와 Sylvie Gelineau에게 특별한 감사를 드립니다.
자료
| Name | Company | Catalog Number | Comments |
| balanced SSFP MRI sequence | Any | To modify to create the OS-CMR sequence | |
| DICOM/ Imaging Viewer | Any | Best if the viewer has the ability for quantitative measurements (i.e., Area19 prototype software) | |
| Magnetic Resonance Imaging scanner | Any | 3 Tesla or 1.5 Tesla | |
| Metronome | Any | Set to 30 breaths per minute. To use if manually communicating breathing maneuver instructions to participants. | |
| Speaker system | Any | To communicate breathing maneuver instrucitons to participants through | |
| Stopwatch | Any | To use if manually communicating breathing maneuver instructions to participants |
참고문헌
- Ogawa, S., Lee, T. M., Kay, A. R., Tank, D. W. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proceedings of the National Academy of Sciences of the United States of America. 87 (24), 9868-9872 (1990).
- Friedrich, M. G., Karamitsos, T. D. Oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15, 43 (2013).
- Guensch, D. P., et al. The blood oxygen level dependent (BOLD) effect of in-vitro myoglobin and hemoglobin. Scientific Reports. 11 (1), 11464 (2021).
- Guensch, D. P., et al. Breathing manoeuvre-dependent changes in myocardial oxygenation in healthy humans. European Heart Journal - Cardiovascular Imaging. 15 (4), 409-414 (2014).
- Fischer, K., Guensch, D. P., Shie, N., Lebel, J., Friedrich, M. G. Breathing maneuvers as a vasoactive stimulus for detecting inducible myocardial ischemia - An experimental cardiovascular magnetic resonance study. PloS One. 11 (10), 0164524 (2016).
- Friedrich, M. G. Tracking myocardial oxygenation over a breath hold with blood oxygen level−dependent MRI: A radically different approach to study ischemia. Radiology. 294 (3), 546-547 (2020).
- Teixeira, T., Nadeshalingam, G., Fischer, K., Marcotte, F., Friedrich, M. G. Breathing maneuvers as a coronary vasodilator for myocardial perfusion imaging. Journal of Magnetic Resonance Imaging. 44 (4), 947-955 (2016).
- Fischer, K., Guensch, D. P., Friedrich, M. G. Response of myocardial oxygenation to breathing manoeuvres and adenosine infusion. European Heart Journal Cardiovascular Imaging. 16 (4), 395-401 (2015).
- Ong, P., Athanasiadis, A., Sechtem, U. Intracoronary acetylcholine provocation testing for assessment of coronary vasomotor disorders. Journal of Visualized Experiments. (114), e54295 (2016).
- Voigtländer, T., et al. The adverse events and hemodynamic effects of adenosine-based cardiac MRI. Korean Journal of Radiology. 12 (4), 424-430 (2011).
- Tsang, K. H., Chan, W. S. W., Shiu, C. K., Chan, M. K. The safety and tolerability of adenosine as a pharmacological stressor in stress perfusion cardiac magnetic resonance imaging in the Chinese population. Hong Kong Medical Journal. 21 (6), 524-527 (2015).
- Roubille, F., Fischer, K., Guensch, D. P., Tardif, J. -. C., Friedrich, M. G. Impact of hyperventilation and apnea on myocardial oxygenation in patients with obstructive sleep apnea - An oxygenation-sensitive CMR study. Journal of Cardiology. 69 (2), 489-494 (2017).
- Fischer, K., et al. Feasibility of cardiovascular magnetic resonance to detect oxygenation deficits in patients with multi-vessel coronary artery disease triggered by breathing maneuvers. Journal of Cardiovascular Magnetic Resonance. 20 (1), 31 (2018).
- Iannino, N., et al. Myocardial vascular function assessed by dynamic oxygenation-sensitive cardiac magnetic resonance imaging long-term following cardiac transplantation. Transplantation. 105 (6), 1347-1355 (2021).
- Elharram, M., et al. Regional heterogeneity in the coronary vascular response in women with chest pain and nonobstructive coronary artery disease. Circulation. 143 (7), 764-766 (2021).
- Fischer, K., et al. Insights into myocardial oxygenation and cardiovascular magnetic resonance tissue biomarkers in heart failure with preserved ejection fraction. Circulation: Heart Failure. 15 (4), 008903 (2022).
- Li, D., Dhawale, P., Rubin, P. J., Haacke, E. M., Gropler, R. J. Myocardial signal response to dipyridamole and dobutamine: demonstration of the BOLD effect using a double-echo gradient-echo sequence. Magnetic Resonance in Medicine. 36 (1), 16-20 (1996).
- Arnold, J. R., et al. Myocardial oxygenation in coronary artery disease: insights from blood oxygen level-dependent magnetic resonance imaging at 3 tesla. Journal of the American College of Cardiology. 59 (22), 1954-1964 (2012).
- Karamitsos, T. D., et al. Relationship between regional myocardial oxygenation and perfusion in patients with coronary artery disease: Insights from cardiovascular magnetic resonance and positron emission tomography. Circulation: Cardiovascular Imaging. 3 (1), 32-40 (2010).
- Friedrich, M. G., Niendorf, T., Schulz-Menger, J., Gross, C. M., Dietz, R. Blood oxygen level-dependent magnetic resonance imaging in patients with stress-induced angina. Circulation. 108 (18), 2219-2223 (2003).
- Cai, H., Harrison, D. G. Endothelial dysfunction in cardiovascular diseases: The role of oxidant stress. Circulation Research. 87 (10), 840-844 (2000).
- Kothawade, K., Bairey Merz, C. N. Microvascular coronary dysfunction in women: Pathophysiology, diagnosis, and management. Current Problems in Cardiology. 36 (8), 291-318 (2011).
- Gimbrone, M. A., García-Cardeña, G. Endothelial cell dysfunction and the pathobiology of atherosclerosis. Circulation Research. 118 (4), 620-636 (2016).
- Vancheri, F., Longo, G., Vancheri, S., Henein, M. Coronary microvascular dysfunction. Journal of Clinical Medicine. 9 (9), 2880 (2020).
- Camici, P. G., Crea, F. Coronary microvascular dysfunction. The New England Journal of Medicine. 356 (8), 830-840 (2007).
- Ford, T. J., et al. Assessment of vascular dysfunction in patients without obstructive coronary artery disease: Why, how, and when. JACC: Cardiovascular Interventions. 13 (16), 1847-1864 (2020).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Budhiraja, R., Parthasarathy, S., Quan, S. F. Endothelial dysfunction in obstructive sleep apnea. Journal of Clinical Sleep Medicine. 3 (4), 409-415 (2007).
- Sena, C. M., Pereira, A. M., Seiça, R. Endothelial dysfunction - A major mediator of diabetic vascular disease. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1832 (12), 2216-2231 (2013).
- Vanhoutte, P. M., Shimokawa, H., Feletou, M., Tang, E. H. C. Endothelial dysfunction and vascular disease - A 30th anniversary update. Acta Physiologica. 219 (1), 22-96 (2017).
- Juni, R. P., Duckers, H. J., Vanhoutte, P. M., Virmani, R., Moens, A. L. Oxidative stress and pathological changes after coronary artery interventions. Journal of the American College of Cardiology. 61 (14), 1471-1481 (2013).
- Simsek, E. C., et al. Endothelial dysfunction in patients with myocardial ischemia or infarction and nonobstructive coronary arteries. Journal of Clinical Ultrasound. 49 (4), 334-340 (2021).
- Stillman, A. E., et al. Imaging the myocardial ischemic cascade. The International Journal of Cardiovascular Imaging. 34 (8), 1249-1263 (2018).
- Fischer, D., et al. Endothelial dysfunction in patients with chronic heart failure is independently associated with increased incidence of hospitalization, cardiac transplantation, or death. European Heart Journal. 26 (1), 65-69 (2005).
- Hurst, T., Olson, T. H., Olson, L. E., Appleton, C. P. Cardiac syndrome X and endothelial dysfunction: New concepts in prognosis and treatment. The American Journal of Medicine. 119 (7), 560-566 (2006).
- Bauer, W. R., et al. Theory of the BOLD effect in the capillary region: An analytical approach for the determination of T*2 in the capillary network of myocardium. Magnetic Resonance in Medicine. 41 (1), 51-62 (1999).
- Manka, R., et al. BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia. Journal of Cardiovascular Magnetic Resonance. 12 (1), 54 (2010).
- Dharmakumar, R., Qi, X., Hong, J., Wright, G. A. Detecting microcirculatory changes in blood oxygen state with steady-state free precession imaging. Magnetic Resonance in Medicine. 55 (6), 1372-1380 (2006).
- Kramer, C. M., et al. Standardized cardiovascular magnetic resonance imaging (CMR) protocols: 2020 update. Journal of Cardiovascular Magnetic Resonance. 22 (1), 17 (2020).
- Expert Panel on MR Safety et al. ACR guidance document on MR safe practices: 2013. Journal of Magnetic Resonance Imaging: JMRI. 37 (3), 501-530 (2013).
- Macey, P. M., Kumar, R., Ogren, J. A., Woo, M. A., Harper, R. M. Global brain blood-oxygen level responses to autonomic challenges in obstructive sleep apnea. PLoS One. 9 (8), 105261 (2014).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. Circulation. 105 (4), 539-542 (2002).
- Hayoz, D., et al. Flow-mediated arterial dilation is abnormal in congestive heart failure. Circulation. 87 (6), 92-96 (1993).
- Hillier, E., Friedrich, M. G. The potential of oxygenation-sensitive CMR in heart failure. Current Heart Failure Reports. 18 (5), 304-314 (2021).
- Hawkins, S. M., et al. Hyperventilation-induced heart rate response as a potential marker for cardiovascular disease. Scientific Reports. 9 (1), 17887 (2019).
- Dass, S., et al. No evidence of myocardial oxygen deprivation in nonischemic heart failure. Circulation: Heart Failure. 8 (6), 1088-1093 (2015).
- Endemann, D. H., Schiffrin, E. L. Endothelial dysfunction. Journal of the American Society of Nephrology. 15 (8), 1983-1992 (2004).
- Costanzo, M. R., et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. The Journal of Heart and Lung Transplantation. 29 (8), 914-956 (2010).
- Lanza, G. A. Cardiac syndrome X: A critical overview and future perspectives. Heart. 93 (2), 159-166 (2007).
- Gould, K. L., Johnson, N. P. Coronary physiology beyond coronary flow reserve in microvascular angina: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2642-2662 (2018).
- Guensch, D. P., Nadeshalingam, G., Fischer, K., Stalder, A. F., Friedrich, M. G. The impact of hematocrit on oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 18 (1), 42 (2016).
- Dharmakumar, R., et al. Assessment of regional myocardial oxygenation changes in the presence of coronary artery stenosis with balanced SSFP imaging at 3.0T: Theory and experimental evaluation in canines. Journal of Magnetic Resonance Imaging. 27 (5), 1037-1045 (2008).
- Hillier, E., Benovoy, M., Friedrich, M. A fully automated post-processing tool identifies a reduced global myocardial oxygenation reserve in patients with ischemia and no obstructive coronary artery stenosis when compared to patients with significant CAD. SCMR 25th Annual Scientific Sessions. , (2022).
Erratum
Formal Correction: Erratum: Oxygenation-sensitive Cardiac MRI with Vasoactive Breathing Maneuvers for the Non-invasive Assessment of Coronary Microvascular Dysfunction
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/64149
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유