Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
IRM cardiaque sensible à l’oxygénation avec manœuvres respiratoires vasoactives pour l’évaluation non invasive de la dysfonction microvasculaire coronarienne
Dans cet article
Erratum Notice
Résumé
L’évaluation de la fonction microvasculaire par imagerie par résonance magnétique cardiaque sensible à l’oxygénation en combinaison avec des manœuvres respiratoires vasoactives est unique dans sa capacité à évaluer les changements dynamiques rapides de l’oxygénation myocardique in vivo et, par conséquent, peut servir de technique de diagnostic d’une importance cruciale pour la fonction vasculaire coronarienne.
Résumé
L’imagerie par résonance magnétique cardiaque sensible à l’oxygénation (OS-CMR) est une technique de diagnostic qui utilise les propriétés paramagnétiques inhérentes à la désoxyhémoglobine comme source endogène de contraste tissulaire. Utilisé en combinaison avec des manœuvres respiratoires vasoactives standardisées (hyperventilation et apnée) en tant que puissant stimulus vasomoteur non pharmacologique, l’OS-CMR peut surveiller les changements dans l’oxygénation du myocarde. La quantification de ces changements au cours du cycle cardiaque et tout au long des manœuvres vasoactives peut fournir des marqueurs de la fonction macro et microvasculaire coronaire et ainsi contourner le besoin d’agents de contraste extrinsèques, intraveineux ou de stress pharmacologique.
OS-CMR utilise la sensibilité bien connue des images pondérées en T2* à l’oxygénation du sang. Les images sensibles à l’oxygénation peuvent être acquises sur n’importe quel scanner IRM cardiaque à l’aide d’une séquence ciné clinique standard modifiée de précession libre à l’état d’équilibre (SSFP), ce qui rend cette technique indépendante du fournisseur et facile à mettre en œuvre. En tant que manœuvre de respiration vasoactive, nous appliquons un protocole respiratoire de 4 min de 120 s de respiration libre, 60 s d’hyperventilation rythmée, suivis d’une apnée expiratoire d’au moins 30 s. La réponse régionale et globale de l’oxygénation du tissu myocardique à cette manœuvre peut être évaluée en suivant le changement d’intensité du signal. L’évolution au cours des 30 premières secondes de l’apnée post-hyperventilation, appelée réserve d’oxygénation myocardique induite par la respiration (B-MORE), a été étudiée chez des personnes en bonne santé et diverses pathologies. Un protocole détaillé pour effectuer des examens CMR sensibles à l’oxygène avec des manœuvres vasoactives est fourni.
Comme cela a été démontré chez les patients présentant un dysfonctionnement microvasculaire dans des conditions encore incomplètement comprises, telles que l’ischémie inductible sans sténose obstructive de l’artère coronaire (INOCA), l’insuffisance cardiaque avec fraction d’éjection préservée (HFpEF) ou le dysfonctionnement microvasculaire après transplantation cardiaque, cette approche fournit des informations uniques, cliniquement importantes et complémentaires sur la fonction vasculaire coronarienne.
Introduction
L’imagerie par résonance magnétique cardiaque sensible à l’oxygénation (OS-CMR) utilise les propriétés paramagnétiques inhérentes à la désoxyhémoglobine comme source endogène de contraste IRM 1,2,3. Utilisé en combinaison avec des manœuvres respiratoires vasoactives standardisées (hyperventilation et apnée) en tant que puissant stimulus vasomoteur non pharmacologique, l’OS-CMR peut surveiller les changements dans l’oxygénation du myocarde en tant que marqueur de la fonction vasculaire, contournant ainsi le besoin de tout produit de contraste extrinsèque, intraveineux ou d’agents de stress pharmacologiques 4,5,6.
Les manœuvres respiratoires, y compris l’apnée et l’hyperventilation, sont des mesures vasoactives très efficaces pour modifier la vasomotion et, en raison de leur sécurité et de leur simplicité, sont idéales pour contrôler la vasomotion endothéliale dépendante dans le cadre d’une procédure de diagnostic. Des études ont montré une efficacité accrue lors de l’association de l’hyperventilation avec une apnée subséquente4,7, car au cours d’un tel protocole, la vasoconstriction (par la diminution associée du dioxyde de carbone dans le sang) est suivie d’une vasodilatation (augmentation du dioxyde de carbone dans le sang) ; ainsi, un système vasculaire sain passe par toute la gamme de la vasoconstriction à la vasodilatation avec une forte augmentation du flux sanguin myocardique, ce qui augmente à son tour l’oxygénation myocardique et, par conséquent, l’intensité du signal observable dans les images OS-CMR. L’utilisation d’images cinématographiques pour l’acquisition permet également d’obtenir des résultats de résolution de phase cardiaque avec un meilleur rapport signal/bruit par rapport à la perfusion d’adénosine8.
Les manœuvres respiratoires peuvent remplacer les agents de stress pharmacologiques pour induire des changements vasoactifs qui peuvent être utilisés pour évaluer la fonction vasculaire coronarienne. Cela permet non seulement de réduire les risques pour les patients, les efforts logistiques et les coûts associés, mais aussi d’obtenir des résultats cliniquement plus significatifs. Les agents de stress pharmacologiques tels que l’adénosine déclenchent une réponse dépendante de l’endothélium et, par conséquent, reflètent la fonction endothéliale elle-même. Jusqu’à présent, une telle évaluation spécifique de la fonction endothéliale n’a été possible que par l’administration intracoronaire d’acétylcholine en tant que vasodilatateur endothélial dépendant. Cette procédure, cependant, est très invasive2,9 et, par conséquent, rarement pratiquée.
En l’absence de biomarqueurs directs, plusieurs techniques de diagnostic ont utilisé des marqueurs de substitution tels que l’absorption tissulaire d’un agent de contraste exogène. Ils sont limités par la nécessité d’une ou deux voies d’accès intraveineuses, des contre-indications telles qu’une maladie rénale grave ou un bloc auriculo-ventriculaire, et la nécessité de la présence physique d’un personnel formé à la prise en charge des effets secondaires potentiellement graves10,11. La limitation la plus importante de l’imagerie actuelle de la fonction coronaire reste cependant que la perfusion myocardique en tant que marqueur de substitution ne reflète pas l’oxygénation du tissu myocardique comme la conséquence la plus importante en aval de la dysfonction vasculaire2.
L’OS-CMR avec des manœuvres respiratoires vasoactives a été utilisée pour évaluer la fonction vasculaire dans de nombreux scénarios, y compris les personnes en bonne santé, la maladie macrovasculaire chez les patients atteints de maladie coronarienne (coronaropathie), ainsi que le dysfonctionnement microvasculaire chez les patients souffrant d’apnée obstructive du sommeil (AOS), d’ischémie sans sténose obstructive de l’artère coronaire (INOCA), après une transplantation cardiaque et d’insuffisance cardiaque avec fraction d’éjection préservée (HFpEF)4, 7,12,13,14,15,16. Dans une population coronarienne, le protocole de la réserve d’oxygénation myocardique induite par la respiration (B-MORE) dérivé de l’OS-CMR s’est avéré sûr, réalisable et sensible pour identifier une réponse d’oxygénation altérée dans les territoires myocardiques perfusés par une artère coronaire avec une sténose significative13.
Dans le cas d’un dysfonctionnement microvasculaire, l’OS-CMR a démontré un retard de la réponse d’oxygénation myocardique chez les patients souffrant d’apnée obstructive du sommeil, et un B-MORE émoussé a été trouvé chez les patients atteints d’HFpEF et après transplantation cardiaque12,14,16. Chez les femmes atteintes d’INOCA, la manœuvre respiratoire a conduit à une réponse d’oxygénation myocardique anormalement hétérogène, soulignant l’avantage de la haute résolution spatiale de l’OS-CMR15. Cet article passe en revue la raison d’être et la méthodologie de la réalisation de l’OS-CMR avec des manœuvres respiratoires vasoactives et discute de son utilité clinique dans l’évaluation de la physiopathologie vasculaire dans les populations de patients présentant un dysfonctionnement microvasculaire, en particulier en ce qui concerne le dysfonctionnement endothélial.
Le contexte physiologique de l’IRM sensible à l’oxygénation assistée par la respiration
Dans des conditions physiologiques normales, une augmentation de la demande en oxygène s’accompagne d’une augmentation équivalente de l’apport en oxygène par l’augmentation du flux sanguin, ce qui n’entraîne aucun changement de la concentration locale de désoxyhémoglobine. En revanche, la vasodilatation induite conduit à un afflux « excessif » de sang oxygéné sans modification de la demande en oxygène. Par conséquent, une plus grande partie de l’hémoglobine tissulaire est oxygénée et, par conséquent, il y a moins de désoxyhémoglobine, ce qui entraîne une augmentation relative de l’intensité du signal OS-CMR 4,17. Si la fonction vasculaire est compromise, elle ne peut pas répondre correctement à une demande métabolique modifiée ou à un stimulus pour augmenter le flux sanguin myocardique.
Dans le cadre d’un stimulus pour provoquer une vasomotion, tel qu’une hyperventilation rythmée provoquant une vasoconstriction ou une longue apnée provoquant une vasodilatation médiée par le dioxyde de carbone, l’altération de l’activité vasomotrice entraînerait une augmentation relative de la concentration locale de désoxyhémoglobine par rapport à d’autres régions et, par conséquent, une modification réduite de l’intensité du signal OS-CMR. Dans le cadre d’une ischémie inductible, une altération de la fonction vasculaire entraînerait une augmentation de la demande locale non satisfaite par une augmentation locale du débit sanguin du myocarde, même en l’absence de sténose de l’artère coronaire épicardique. Dans les images OS-CMR, l’augmentation locale nette de la concentration de désoxyhémoglobine conduit à une diminution de l’intensité du signal local 2,18,19,20.
Une relaxation atténuée des muscles lisses vasculaires en réponse à des vasodilatateurs dépendants et indépendants de l’endothélium (y compris l’adénosine) a été démontrée chez des patients présentant une dysfonction microvasculaire coronarienne 21,22,23,24,25,26,27 . On pense que le dysfonctionnement endothélial indépendant est dû à des anomalies structurelles dues à une hypertrophie microvasculaire ou à une pathologie myocardique environnante. En revanche, le dysfonctionnement endothélial se traduit à la fois par une vasoconstriction inadéquate et une vasorelaxation altérée (dépendante de l’endothélium), généralement causée par une perte de bioactivité de l’oxyde nitrique dans la paroi vasculaire21,28. Le dysfonctionnement endothélial a été impliqué dans la pathogenèse d’un certain nombre de maladies cardiovasculaires, notamment l’hypercholestérolémie, l’hypertension, le diabète, la coronaropathie, l’apnée obstructive du sommeil, l’inoca et l’HF 23,24,28,29,30,31,32. En fait, le dysfonctionnement endothélial est la manifestation la plus précoce de l’athérosclérose coronarienne33. L’imagerie de la fonction endothéliale a un très fort potentiel, compte tenu de son rôle en tant que prédicteur significatif des événements cardiovasculaires indésirables et des résultats à long terme, avec de profondes implications pronostiques dans les états de maladie cardiovasculaire 23,29,30,31,34,35.
Contrairement à l’imagerie de perfusion, la réserve d’oxygénation myocardique induite par la respiration (B-MORE), définie comme l’augmentation relative de l’oxygénation myocardique lors d’une apnée post-hyperventilation, permet de visualiser les conséquences d’un tel déclencheur vasoactif sur l’oxygénation globale ou régionale elle-même 2,36. En tant que marqueur précis en aval de la fonction vasculaire, B-MORE peut donc non seulement identifier un dysfonctionnement vasculaire, mais aussi une ischémie inductible réelle, indiquant un problème local de perfusion ou d’oxygénation plus sévère18,19,37. Ceci est réalisé grâce à la capacité de l’OS-CMR à visualiser la diminution relative de l’hémoglobine désoxygénée, qui est abondante dans le système capillaire du myocarde, qui représente lui-même une proportion importante du tissu myocardique24.
Séquence OS-CMR
La séquence d’imagerie par résonance magnétique (IRM) utilisée pour l’imagerie OS-CMR est une séquence de précession libre (bSSFP) à l’état stationnaire (bSSFP) obtenue en deux coupes à axe court. Cette séquence bSSFP est une séquence clinique standard disponible (et modifiable) sur tous les scanners IRM qui effectuent une IRM cardiaque, ce qui rend cette technique indépendante du fournisseur et facile à mettre en œuvre. Dans une séquence ciné bSSFP régulière, le temps d’écho, le temps de répétition et l’angle de retournement sont modifiés pour sensibiliser l’intensité du signal résultant à l’effet BOLD et, ainsi, créer une séquence sensible à l’oxygénation. Cette approche, une lecture bSSFP préparée par T2, s’est déjà avérée adaptée à l’acquisition d’images sensibles à l’oxygénation avec un rapport signal/bruit plus élevé, une qualité d’image supérieure et des temps de balayage plus rapides par rapport aux techniques d’écho de gradient précédentes utilisées pour l’imagerie BOLD38. Cette approche permet d’appliquer la SG-CMR avec une amélioration de la respiration avec très peu d’effets secondaires légers (tableau 1). Il est à noter que plus de 90 % des participants terminent ce protocole avec des temps d’apnée suffisamment longs 4,12,13,16.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les IRM utilisant l’OS-CMR avec des manœuvres respiratoires vasoactives doivent être effectuées conformément aux directives de l’établissement local. Le protocole décrit ci-dessous a été utilisé dans des études approuvées par plusieurs comités institutionnels d’éthique de la recherche sur des êtres humains. Un consentement écrit a été obtenu pour toutes les données et tous les résultats des participants humains décrits dans ce protocole et ce manuscrit.
1. Vue d’ensemble
- Variez les critères d’inclusion et d’exclusion en fonction de la population d’étude d’intérêt. Utiliser les critères d’exclusion généraux et courants suivants pour un protocole de SG-CMR avec manœuvres respiratoires vasoactives : contre-indications générales à l’IRM (p. ex., dispositifs incompatibles avec l’IRM tels que stimulateurs cardiaques ou défibrillateurs, matériel implanté ou corps étrangers), consommation de caféine ou de médicaments vasoactifs dans les 12 heures précédant l’IRM, et âge <18 ans.
- Tout d’abord, acquérez les images standard de l’éclaireur d’alignement de piste clinique et de la structure et de la fonction ventriculaire avant d’acquérir les acquisitions de la SG. Utilisez les images cinéma grand axe bSSFP pour planifier le positionnement des tranches des acquisitions du système d’exploitation.
NOTA : Un examen des protocoles cliniques normalisés de CMR est décrit ailleurs39. - Apnée de base
- Acquérir la première série OS-CMR en tant qu’acquisition courte et de base en apnée pour évaluer la qualité de l’image et l’emplacement des coupes, vérifier les artefacts, ainsi que servir de référence de l’intensité du signal.
- Effectuez une acquisition courte (~10 s) d’un seul cycle cardiaque après que le participant ait respiré normalement. Assurez-vous que l’apnée est effectuée à la fin de l’expiration.
- Acquisition continue avec manœuvre de respiration vasoactive
- Acquérir la deuxième série OS-CMR sous la forme d’une acquisition continue de 4 minutes comprenant 2 minutes de respiration libre et 1 minute d’hyperventilation rythmée, suivies d’une apnée volontaire et maximale (~1 min). Comme l’acquisition continue permet d’obtenir plusieurs cycles cardiaques sur 4 min, modifiez un paramètre supplémentaire (le nombre de cycles cardiaques acquis par l’acquisition) pour faire de cette série une acquisition à mesures répétées
REMARQUE : La durée minimale requise de l’apnée est de 30 s, bien qu’une apnée de 60 s soit considérée comme la norme. - Transmettez les instructions pour la manœuvre de respiration vasoactive aux participants dans le scanner IRM en dirigeant manuellement le participant tout au long de la manœuvre respiratoire à travers un microphone connecté au système de haut-parleurs IRM ou via un fichier .mp3 préenregistré (fichier supplémentaire 1) qui peut être lu pour le participant via le système de haut-parleurs IRM.
- Commencez la manœuvre de respiration vasoactive avec la respiration libre (après 120 s de respiration libre, l’hyperventilation commence). Guidez le participant à travers une respiration rythmée à l’aide de bips sonores provenant d’un métronome à une fréquence de 30 respirations/min (un bip indique l’inspiration, un bip indique l’expiration). À 55 s d’hyperventilation, donnez un dernier ordre vocal pour « inspirer profondément, puis expirer et retenir votre souffle » pour vous assurer que l’apnée est effectuée à un niveau de fin d’expiration.
REMARQUE : La variation du CO 2 sanguin est beaucoup plus prononcée avec l’apnée à la fin de l’expiration (la surface pulmonaire est plus petite, ce qui minimise la diffusion résiduelle du CO2 dans les alvéoles).
- Acquérir la deuxième série OS-CMR sous la forme d’une acquisition continue de 4 minutes comprenant 2 minutes de respiration libre et 1 minute d’hyperventilation rythmée, suivies d’une apnée volontaire et maximale (~1 min). Comme l’acquisition continue permet d’obtenir plusieurs cycles cardiaques sur 4 min, modifiez un paramètre supplémentaire (le nombre de cycles cardiaques acquis par l’acquisition) pour faire de cette série une acquisition à mesures répétées
- Analyse d’images
- Pour mesurer le B-MORE, considérons la première image systolique terminale pendant l’apnée comme étant le temps 0 s. Comparez les valeurs globales ou régionales de l’intensité du signal de fin de systolique acquise le plus près du point de temps de 30 s de l’apnée à l’intensité du signal d’image au point de temps de 0 s. Indiquez BMORE sous forme de variation en pourcentage de l’intensité du signal à 30 s par rapport au temps 0 s de l’apnée.
2. Procédure de pré-scan
- S’assurer que chaque participant réussit le questionnaire de sécurité et de compatibilité de l’IRM de l’établissement local (formulaire de contre-indication générale de l’IRM), qui doit inclure des questions sur les antécédents médicaux et chirurgicaux et identifier la présence de tout implant, dispositif ou corps étranger métallique à l’intérieur ou au site chirurgical du participant40.
- Obtenez un test de grossesse, s’il y a lieu.
- Vérifier que le patient s’est abstenu de prendre des médicaments vasoactifs et de la caféine dans les 12 heures précédant l’IRM.
- Montrez au participant la vidéo d’instruction sur la manœuvre respiratoire (vidéo supplémentaire S1).
- Effectuez une séance d’entraînement de 60 s d’hyperventilation rythmée suivie d’une apnée volontaire maximale avec chaque participant à l’extérieur de la salle d’IRM et fournissez un retour d’information sur la performance de l’hyperventilation.
- Dites aux participants qu’ils peuvent simplement reprendre leur respiration lorsqu’ils en ont une forte envie.
REMARQUE : Voir la discussion pour les points à noter et fournir des commentaires aux participants.
3. Acquisition par IRM de séquences sensibles à l’oxygénation
- Modifiez trois paramètres à partir de la séquence bSSFP standard sur la console IRM : augmenter le temps de répétition (TR), augmenter le temps d’écho (TE), diminuer l’angle de retournement (FA).
REMARQUE : Les valeurs modifiées dépendent de l’intensité du champ de l’appareil IRM (Tableau 2). L’augmentation du TR et de l’ET, ainsi que la diminution de l’AF, entraînent une augmentation de la sensibilité à la T2* ou à l’oxygénation de la séquence IRM. Ces modifications se traduiront alors par une augmentation de la bande passante et de la résolution de base de la séquence. - Créez deux séries de systèmes d’exploitation, une ligne de base (étiquetée : OS_base) et l’acquisition continue au cours de laquelle la manœuvre respiratoire est effectuée (étiquetée : OS_cont_acq). Laissez la séquence du système d’exploitation de base inchangée. Dans l’acquisition continue du système d’exploitation, augmentez les mesures répétées de 1 à ~25-40 (selon le type de scanner). Augmentez le nombre de cycles cardiaques (mesures) jusqu’à ce que le temps d’acquisition soit de ~4,5 min.
REMARQUE : Deux séquences OS-CMR sont nécessaires : l’acquisition de base de l’OS et l’acquisition continue de l’OS avec des manœuvres respiratoires vasoactives. Les sections suivantes décrivent ces étapes.
4. Acquisition de la base de référence du système d’exploitation
- Pour la prescription de coupes, planifiez dans un cadre fixe systolique de fin d’une vue à grand axe (image à deux ou quatre chambres). Prescrire deux tranches à axe court, l’une au niveau ventriculaire médio-basal et l’autre au niveau ventriculaire médio-apical. Reportez-vous à la discussion pour connaître les points à prendre en compte concernant l’emplacement de la tranche.
- Réglages des paramètres de séquence
- Ajustez les paramètres de séquence selon vos besoins pour un participant donné. Voir le tableau 3 pour les paramètres de séquence qui peuvent ou ne peuvent pas être modifiés.
- Ajustez l’espacement moyen entre les tranches en fonction de la taille du cœur du participant et assurez-vous que les tranches sont bien situées.
- Ajustez le champ de vision pour éviter les artefacts d’enveloppement si nécessaire. Efforcez-vous de maintenir le champ de vision entre 360 mm et 400 mm.
- Volume de cale
- Ajustez le volume de la cale pour qu’il soit serré autour du ventricule gauche dans les vues à grand et à court axe.
- Acquisition de séquences
- Approuvez la séquence et exécutez-la pendant l’apnée de fin d’expiration. Assurez-vous que cette séquence de base du système d’exploitation dure ~10 s, en fonction de la fréquence cardiaque et de l’IRM.
- Contrôle de la qualité de l’image
- Vérifiez les deux tranches de la série acquise pour détecter tout mouvement respiratoire, un mauvais emplacement de la tranche ou la présence d’artefacts. Répétez la séquence de base du système d’exploitation jusqu’à ce que la qualité d’image adéquate soit obtenue.
- Pour le dépannage, si l’emplacement de la tranche est trop basal ou trop apical, ajustez l’emplacement de la tranche prescrit pour qu’il soit plus proche du niveau du ventricule moyen. S’il y a un artefact, suivez les étapes ci-dessous :
- Vérifiez le sens de codage de phase.
- Agrandissez le champ de vision.
- Ajustez le volume de la cale autour du ventricule gauche.
5. Acquisition continue de l’OS avec manœuvres respiratoires vasoactives
REMARQUE : Assurez-vous que chaque participant a reçu des instructions sur l’exécution correcte de la manœuvre respiratoire avant d’être dans le scanner IRM (voir section 2).
- Planification des séquences
- Si possible, copiez la position de la tranche et ajustez le volume à partir de l’image de référence du système d’exploitation ou dupliquez la séquence de référence du système d’exploitation et, lors de mesures répétées, augmentez de 1 à ~25-40 (ou près de 4,5 min de temps d’acquisition).
- Vérifiez le positionnement de l’image et de la tranche, puis capturez le cycle.
- Si possible, ouvrez la fenêtre de diffusion en direct.
- Dans la salle de contrôle, branchez un appareil avec le fichier .mp3 des instructions de manœuvre respiratoire dans l’entrée auxiliaire ou préparez-vous à le tenir au-dessus du microphone projeté dans le scanner IRM. Vous pouvez également guider manuellement le participant à travers la manœuvre respiratoire à l’aide d’un chronomètre pour le chronométrage et fournir verbalement des instructions via le microphone connecté au système de haut-parleur IRM.
- Acquisition de séquences
- Appuyez simultanément sur play pour la séquence d’acquisition continue OS sur le scanner IRM et lisez pour le fichier d’instructions de respiration .mp3 ou démarrez le chronomètre si le participant reçoit des instructions manuelles.
- Si vous guidez manuellement le participant à travers les manœuvres respiratoires, demandez-lui d’inspirer et d’expirer, puis retenez sa respiration pendant 10 secondes et commencez à hyperventiler dès qu’il entend le bip du métronome.
- Avertir le participant au bout de 40 s d’hyperventilation (2h40 sur le chronomètre).
- Au point de temps d’hyperventilation de 55 s (2 :55 sur le chronomètre), demandez au participant de « prendre une profonde inspiration, d’expirer et de retenir sa respiration ».
REMARQUE : Les images de respiration libre et d’hyperventilation auront des artefacts de mouvement. C’est normal. Cependant, il ne devrait pas y avoir d’artefacts de mouvement pendant l’apnée. Il est d’une importance cruciale que les images de respiration soient acquises après l’expiration (position confortable en fin d’expiration). Seule une apnée après l’expiration entraîne une augmentation rapide du CO2 sanguin pendant les 30 premières secondes de l’apnée suivante, avec la modification associée du flux sanguin coronaire et de l’oxygénation myocardique. - Surveillez la performance du participant en matière d’hyperventilation à travers la fenêtre de la salle de contrôle ou la caméra du scanner IRM pour assurer une performance adéquate de la respiration profonde. Si des soufflets sont utilisés, surveillez les pics d’amplitude sur la visionneuse de contrôle respiratoire. Si l’hyperventilation n’est pas effectuée de manière adéquate après le guidage initial, interrompez l’acquisition et répétez la séquence d’acquisition continue du système d’exploitation.
- Surveillez les petites respirations prises par les participants tout au long de l’apnée. Pour ce faire, surveillez le traçage d’une ceinture respiratoire sur la console d’IRM ou visuellement à travers la fenêtre/la caméra.
- Une fois que le participant commence à respirer à la fin de l’apnée, arrêtez l’acquisition.
- Après la fin de l’acquisition, demandez au participant s’il a ressenti des effets indésirables et laissez-le respirer normalement pendant 3 minutes.
- Dépannage : acquisition répétée
- Si les manœuvres respiratoires doivent être répétées, répétez la séquence de base du système d’exploitation.
REMARQUE : Une période de 2 à 3 minutes avant de répéter l’acquisition est nécessaire pour permettre à la physiologie de revenir à la ligne de base. Des données antérieures ont montré que la physiologie ne revient pas à la ligne de base après 1 min41. - Si la qualité d’image de la séquence de référence du système d’exploitation est adéquate, répétez l’acquisition continue du système d’exploitation et l’exécution des manœuvres respiratoires.
- Si les manœuvres respiratoires doivent être répétées, répétez la séquence de base du système d’exploitation.
6. Analyse d’images
- Importez les ensembles de données d’images OS-CMR dans une visionneuse DICOM dotée de capacités de contournage d’image, de préférence avec une fonctionnalité permettant d’analyser automatiquement les changements d’intensité du signal sensibles à l’oxygénation.
- Les marqueurs et leur mesure
- Acquérir une image de base lors d’une courte acquisition d’apnée de base avant l’hyperventilation (repos). Comparez la première image de l’apnée (représentant la fin du stimulus « stress ») à l’image de base.
REMARQUE : L’hyperventilation est un stimulus vasoconstricteur qui réduit l’oxygénation du myocarde (sain : %ΔSI ≈−5 % à −10 %13). - Obtenir de nombreuses images (et cycles cardiaques) pendant l’apnée. Utilisez la première image de l’apnée comme ligne de base et comparez toutes les images suivantes à cette image.
REMARQUE : L’apnée est un stimulus vasodilatateur qui augmente l’oxygénation du myocarde (%ΔSI ≈ +5 %-15 %12,13,14,16). - Contours du myocarde
Pour l’analyse manuelle : sélection de la phase cardiaque- Comme l’apnée peut contenir plus de 400 images, n’analysez qu’une seule phase de chaque cycle cardiaque. Par conséquent, concentrez l’analyse sur les images de fin de systolique de chaque cycle cardiaque.
- Identifiez les images de fin de systolique de chaque cycle cardiaque.
- Dessinez les contours épicardiques et endocardiques autour du myocarde.
- Affichez une fenêtre sur l’image pour rechercher des artefacts, qui apparaîtront sous forme de zones sombres (susceptibilité) ou claires en raison d’une mauvaise barrière dans le myocarde.
REMARQUE : Évitez d’inclure des pixels avec des effets de volume partiels provenant des flaques de sang ventriculaires gauche et droit. La plupart des erreurs de contouring se produisent à partir du contour endocardique, y compris les pixels avec des effets de volume partiels et l’intensité artificiellement élevée du signal résultant du pool sanguin ventriculaire gauche. Pour éviter cela, dessinez le contour endocardique d’un pixel complet à l’intérieur du myocarde. De même, assurez-vous que le contour épicardique est d’un pixel complet à l’intérieur du myocarde pour éviter les effets de volume partiels du pool sanguin ventriculaire droit, de la graisse épicardique ou de l’interface air-poumon. - Copiez et collez les contours endocardiques et épicardiques de la première image systolique terminale du cycle cardiaque à l’image systolique terminale du cycle cardiaque suivant. Ajustez les contours au besoin.
Pour l’analyse automatisée :
REMARQUE : Avec les capacités de contouring automatisées, si vous le souhaitez, toutes les phases du cycle cardiaque peuvent être profilées et analysées. - Vérifiez toutes les images pour vous assurer que le contour est précis.
REMARQUE : Certaines capacités de contournage automatisé disponibles dans le commerce ont été entraînées sur des ensembles de données qui ont été profilés pour l’analyse volumétrique. Ces contours sont sujets à des effets de volume partiels car ils sont censés border le pool sanguin et le myocarde. Les contours de l’OS-CMR doivent être entièrement à l’intérieur du myocarde.
- Acquérir une image de base lors d’une courte acquisition d’apnée de base avant l’hyperventilation (repos). Comparez la première image de l’apnée (représentant la fin du stimulus « stress ») à l’image de base.
7. Segmentation pour l’analyse régionale
- Pour obtenir des informations régionales, identifiez l’insertion antéroseptale et inféroseptale du ventricule droit pour diviser le myocarde en segmentation42 de l’American Heart Association (AHA).
8. Calcul de B-MORE
- Exprimez B-MORE en pourcentage de variation de l’intensité du signal entre la ligne de base et la vasodilatation (voir l’équation 1) :
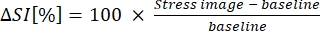 (1)
(1) - Calculer le B-MORE global comme l’intensité moyenne globale du signal myocardique des images de fin de systolique à 30 s par rapport à 0 s de l’apnée8 (voir équation 2) :
 (2)
(2)
Access restricted. Please log in or start a trial to view this content.
Résultats
Interprétation B-MORE
Dans des études publiées précédemment utilisant l’OS-CMR avec des manœuvres respiratoires vasoactives, le B-MORE global ou régional a été calculé en comparant la première image systolique de fin de l’apnée à l’image de fin de systolique la plus proche de 15 s, 30 s, 45 s, etc. de l’apnée. La phase systolique de fin de cycle cardiaque a été choisie pour plusieurs raisons. L’image de fin de systolique est la phase la plus cohérente identifiée entre et en...
Access restricted. Please log in or start a trial to view this content.
Discussion
L’ajout d’une acquisition OS-CMR avec des manœuvres respiratoires normalisées et vasoactives à un protocole d’IRM clinique ou de recherche déjà établi ajoute peu de temps à l’examen global. Grâce à ce bref ajout, il est possible d’obtenir des informations sur les fonctions macro et microvasculaires sous-jacentes (Figure 2). Une conséquence importante du dysfonctionnement endothélial est l’incapacité du système vasculaire à répondre aux stimuli physiologiques, comme...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
MGF est titulaire du brevet américain n° 14/419 877 : Induire et mesurer les changements d’oxygénation du myocarde en tant que marqueur des maladies cardiaques ; Brevet des États-Unis n° 15/483,712 : Mesure des changements d’oxygénation dans les tissus en tant que marqueur de la fonction vasculaire ; Brevet des États-Unis n° 10 653 394 : Mesure des changements d’oxygénation dans les tissus en tant que marqueur de la fonction vasculaire - suite ; et le brevet canadien CA2020/051776 : Procédé et appareil pour déterminer des biomarqueurs de la fonction vasculaire à l’aide d’images CMR en gras. EH est titulaire du brevet international CA2020/051776 : Méthode et appareil pour déterminer les biomarqueurs de la fonction vasculaire à l’aide d’images CMR en gras.
Remerciements
Cet article et cette revue méthodologique ont été rendus possibles grâce à toute l’équipe du Groupe de recherche CMR Courtois du Centre universitaire de santé McGill. Un merci spécial à nos technologues en IRM, Maggie Leo et Sylvie Gelineau, pour la numérisation de nos participants et leurs commentaires sur ce manuscrit.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| balanced SSFP MRI sequence | Any | To modify to create the OS-CMR sequence | |
| DICOM/ Imaging Viewer | Any | Best if the viewer has the ability for quantitative measurements (i.e., Area19 prototype software) | |
| Magnetic Resonance Imaging scanner | Any | 3 Tesla or 1.5 Tesla | |
| Metronome | Any | Set to 30 breaths per minute. To use if manually communicating breathing maneuver instructions to participants. | |
| Speaker system | Any | To communicate breathing maneuver instrucitons to participants through | |
| Stopwatch | Any | To use if manually communicating breathing maneuver instructions to participants |
Références
- Ogawa, S., Lee, T. M., Kay, A. R., Tank, D. W. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proceedings of the National Academy of Sciences of the United States of America. 87 (24), 9868-9872 (1990).
- Friedrich, M. G., Karamitsos, T. D. Oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15, 43(2013).
- Guensch, D. P., et al. The blood oxygen level dependent (BOLD) effect of in-vitro myoglobin and hemoglobin. Scientific Reports. 11 (1), 11464(2021).
- Guensch, D. P., et al. Breathing manoeuvre-dependent changes in myocardial oxygenation in healthy humans. European Heart Journal - Cardiovascular Imaging. 15 (4), 409-414 (2014).
- Fischer, K., Guensch, D. P., Shie, N., Lebel, J., Friedrich, M. G. Breathing maneuvers as a vasoactive stimulus for detecting inducible myocardial ischemia - An experimental cardiovascular magnetic resonance study. PloS One. 11 (10), 0164524(2016).
- Friedrich, M. G. Tracking myocardial oxygenation over a breath hold with blood oxygen level−dependent MRI: A radically different approach to study ischemia. Radiology. 294 (3), 546-547 (2020).
- Teixeira, T., Nadeshalingam, G., Fischer, K., Marcotte, F., Friedrich, M. G. Breathing maneuvers as a coronary vasodilator for myocardial perfusion imaging. Journal of Magnetic Resonance Imaging. 44 (4), 947-955 (2016).
- Fischer, K., Guensch, D. P., Friedrich, M. G. Response of myocardial oxygenation to breathing manoeuvres and adenosine infusion. European Heart Journal Cardiovascular Imaging. 16 (4), 395-401 (2015).
- Ong, P., Athanasiadis, A., Sechtem, U. Intracoronary acetylcholine provocation testing for assessment of coronary vasomotor disorders. Journal of Visualized Experiments. (114), e54295(2016).
- Voigtländer, T., et al. The adverse events and hemodynamic effects of adenosine-based cardiac MRI. Korean Journal of Radiology. 12 (4), 424-430 (2011).
- Tsang, K. H., Chan, W. S. W., Shiu, C. K., Chan, M. K. The safety and tolerability of adenosine as a pharmacological stressor in stress perfusion cardiac magnetic resonance imaging in the Chinese population. Hong Kong Medical Journal. 21 (6), 524-527 (2015).
- Roubille, F., Fischer, K., Guensch, D. P., Tardif, J. -C., Friedrich, M. G. Impact of hyperventilation and apnea on myocardial oxygenation in patients with obstructive sleep apnea - An oxygenation-sensitive CMR study. Journal of Cardiology. 69 (2), 489-494 (2017).
- Fischer, K., et al. Feasibility of cardiovascular magnetic resonance to detect oxygenation deficits in patients with multi-vessel coronary artery disease triggered by breathing maneuvers. Journal of Cardiovascular Magnetic Resonance. 20 (1), 31(2018).
- Iannino, N., et al. Myocardial vascular function assessed by dynamic oxygenation-sensitive cardiac magnetic resonance imaging long-term following cardiac transplantation. Transplantation. 105 (6), 1347-1355 (2021).
- Elharram, M., et al. Regional heterogeneity in the coronary vascular response in women with chest pain and nonobstructive coronary artery disease. Circulation. 143 (7), 764-766 (2021).
- Fischer, K., et al. Insights into myocardial oxygenation and cardiovascular magnetic resonance tissue biomarkers in heart failure with preserved ejection fraction. Circulation: Heart Failure. 15 (4), 008903(2022).
- Li, D., Dhawale, P., Rubin, P. J., Haacke, E. M., Gropler, R. J. Myocardial signal response to dipyridamole and dobutamine: demonstration of the BOLD effect using a double-echo gradient-echo sequence. Magnetic Resonance in Medicine. 36 (1), 16-20 (1996).
- Arnold, J. R., et al. Myocardial oxygenation in coronary artery disease: insights from blood oxygen level-dependent magnetic resonance imaging at 3 tesla. Journal of the American College of Cardiology. 59 (22), 1954-1964 (2012).
- Karamitsos, T. D., et al. Relationship between regional myocardial oxygenation and perfusion in patients with coronary artery disease: Insights from cardiovascular magnetic resonance and positron emission tomography. Circulation: Cardiovascular Imaging. 3 (1), 32-40 (2010).
- Friedrich, M. G., Niendorf, T., Schulz-Menger, J., Gross, C. M., Dietz, R. Blood oxygen level-dependent magnetic resonance imaging in patients with stress-induced angina. Circulation. 108 (18), 2219-2223 (2003).
- Cai, H., Harrison, D. G. Endothelial dysfunction in cardiovascular diseases: The role of oxidant stress. Circulation Research. 87 (10), 840-844 (2000).
- Kothawade, K., Bairey Merz, C. N. Microvascular coronary dysfunction in women: Pathophysiology, diagnosis, and management. Current Problems in Cardiology. 36 (8), 291-318 (2011).
- Gimbrone, M. A., García-Cardeña, G. Endothelial cell dysfunction and the pathobiology of atherosclerosis. Circulation Research. 118 (4), 620-636 (2016).
- Vancheri, F., Longo, G., Vancheri, S., Henein, M. Coronary microvascular dysfunction. Journal of Clinical Medicine. 9 (9), 2880(2020).
- Camici, P. G., Crea, F. Coronary microvascular dysfunction. The New England Journal of Medicine. 356 (8), 830-840 (2007).
- Ford, T. J., et al. Assessment of vascular dysfunction in patients without obstructive coronary artery disease: Why, how, and when. JACC: Cardiovascular Interventions. 13 (16), 1847-1864 (2020).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Budhiraja, R., Parthasarathy, S., Quan, S. F. Endothelial dysfunction in obstructive sleep apnea. Journal of Clinical Sleep Medicine. 3 (4), 409-415 (2007).
- Sena, C. M., Pereira, A. M., Seiça, R. Endothelial dysfunction - A major mediator of diabetic vascular disease. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1832 (12), 2216-2231 (2013).
- Vanhoutte, P. M., Shimokawa, H., Feletou, M., Tang, E. H. C. Endothelial dysfunction and vascular disease - A 30th anniversary update. Acta Physiologica. 219 (1), 22-96 (2017).
- Juni, R. P., Duckers, H. J., Vanhoutte, P. M., Virmani, R., Moens, A. L. Oxidative stress and pathological changes after coronary artery interventions. Journal of the American College of Cardiology. 61 (14), 1471-1481 (2013).
- Simsek, E. C., et al. Endothelial dysfunction in patients with myocardial ischemia or infarction and nonobstructive coronary arteries. Journal of Clinical Ultrasound. 49 (4), 334-340 (2021).
- Stillman, A. E., et al. Imaging the myocardial ischemic cascade. The International Journal of Cardiovascular Imaging. 34 (8), 1249-1263 (2018).
- Fischer, D., et al. Endothelial dysfunction in patients with chronic heart failure is independently associated with increased incidence of hospitalization, cardiac transplantation, or death. European Heart Journal. 26 (1), 65-69 (2005).
- Hurst, T., Olson, T. H., Olson, L. E., Appleton, C. P. Cardiac syndrome X and endothelial dysfunction: New concepts in prognosis and treatment. The American Journal of Medicine. 119 (7), 560-566 (2006).
- Bauer, W. R., et al. Theory of the BOLD effect in the capillary region: An analytical approach for the determination of T*2 in the capillary network of myocardium. Magnetic Resonance in Medicine. 41 (1), 51-62 (1999).
- Manka, R., et al. BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia. Journal of Cardiovascular Magnetic Resonance. 12 (1), 54(2010).
- Dharmakumar, R., Qi, X., Hong, J., Wright, G. A. Detecting microcirculatory changes in blood oxygen state with steady-state free precession imaging. Magnetic Resonance in Medicine. 55 (6), 1372-1380 (2006).
- Kramer, C. M., et al. Standardized cardiovascular magnetic resonance imaging (CMR) protocols: 2020 update. Journal of Cardiovascular Magnetic Resonance. 22 (1), 17(2020).
- Expert Panel on MR Safety et al. ACR guidance document on MR safe practices: 2013. Journal of Magnetic Resonance Imaging: JMRI. 37 (3), 501-530 (2013).
- Macey, P. M., Kumar, R., Ogren, J. A., Woo, M. A., Harper, R. M. Global brain blood-oxygen level responses to autonomic challenges in obstructive sleep apnea. PLoS One. 9 (8), 105261(2014).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. Circulation. 105 (4), 539-542 (2002).
- Hayoz, D., et al. Flow-mediated arterial dilation is abnormal in congestive heart failure. Circulation. 87 (6), 92-96 (1993).
- Hillier, E., Friedrich, M. G. The potential of oxygenation-sensitive CMR in heart failure. Current Heart Failure Reports. 18 (5), 304-314 (2021).
- Hawkins, S. M., et al. Hyperventilation-induced heart rate response as a potential marker for cardiovascular disease. Scientific Reports. 9 (1), 17887(2019).
- Dass, S., et al. No evidence of myocardial oxygen deprivation in nonischemic heart failure. Circulation: Heart Failure. 8 (6), 1088-1093 (2015).
- Endemann, D. H., Schiffrin, E. L. Endothelial dysfunction. Journal of the American Society of Nephrology. 15 (8), 1983-1992 (2004).
- Costanzo, M. R., et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. The Journal of Heart and Lung Transplantation. 29 (8), 914-956 (2010).
- Lanza, G. A. Cardiac syndrome X: A critical overview and future perspectives. Heart. 93 (2), 159-166 (2007).
- Gould, K. L., Johnson, N. P. Coronary physiology beyond coronary flow reserve in microvascular angina: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2642-2662 (2018).
- Guensch, D. P., Nadeshalingam, G., Fischer, K., Stalder, A. F., Friedrich, M. G. The impact of hematocrit on oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 18 (1), 42(2016).
- Dharmakumar, R., et al. Assessment of regional myocardial oxygenation changes in the presence of coronary artery stenosis with balanced SSFP imaging at 3.0T: Theory and experimental evaluation in canines. Journal of Magnetic Resonance Imaging. 27 (5), 1037-1045 (2008).
- Hillier, E., Benovoy, M., Friedrich, M. A fully automated post-processing tool identifies a reduced global myocardial oxygenation reserve in patients with ischemia and no obstructive coronary artery stenosis when compared to patients with significant CAD. SCMR 25th Annual Scientific Sessions. , (2022).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Oxygenation-sensitive Cardiac MRI with Vasoactive Breathing Maneuvers for the Non-invasive Assessment of Coronary Microvascular Dysfunction
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/64149
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon