É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
RMC Sensível à Oxigenação com Manobras Respiratórias Vasoativas para Avaliação Não Invasiva da Disfunção Microvascular Coronariana
Neste Artigo
Erratum Notice
Resumo
A avaliação da função microvascular por ressonância magnética cardíaca sensível à oxigenação em combinação com manobras respiratórias vasoativas é única em sua capacidade de avaliar mudanças dinâmicas rápidas na oxigenação miocárdica in vivo e, portanto, pode servir como uma técnica diagnóstica de importância crítica para a função vascular coronariana.
Resumo
A ressonância magnética cardíaca sensível à oxigenação (RMC-OS) é uma técnica diagnóstica que utiliza as propriedades paramagnéticas inerentes da desoxihemoglobina como fonte endógena de contraste tecidual. Usada em combinação com manobras respiratórias vasoativas padronizadas (hiperventilação e apneia) como um potente estímulo vasomotor não farmacológico, a RMC-OS pode monitorar alterações na oxigenação miocárdica. A quantificação dessas alterações durante o ciclo cardíaco e ao longo das manobras vasoativas pode fornecer marcadores para a função macro e microvascular coronariana e, assim, contornar a necessidade de quaisquer agentes de estresse extrínseco, intravenoso ou farmacológico.
O OS-CMR usa a conhecida sensibilidade das imagens ponderadas em T2* à oxigenação sanguínea. Imagens sensíveis à oxigenação podem ser adquiridas em qualquer scanner de RM cardíaca usando uma sequência de cine de precessão livre clínica modificada (SSFP) padrão, tornando essa técnica independente do fornecedor e facilmente implementada. Como manobra de respiração vasoativa, aplicamos um protocolo respiratório de 4 min de 120 s de respiração livre, 60 s de hiperventilação cadenciada, seguido de uma pausa expiratória de pelo menos 30 s. A resposta regional e global da oxigenação do tecido miocárdico a essa manobra pode ser avaliada pelo rastreamento da mudança de intensidade de sinal. A mudança ao longo dos 30 s iniciais da pausa respiratória pós-hiperventilação, conhecida como reserva de oxigenação miocárdica induzida pela respiração (B-MORE), tem sido estudada em pessoas saudáveis e em várias patologias. Um protocolo detalhado para a realização de exames de RMC sensíveis ao oxigênio com manobras vasoativas é fornecido.
Como demonstrado em pacientes com disfunção microvascular em condições ainda não completamente compreendidas, como isquemia induzível sem estenose obstrutiva da artéria coronária (INOCA), insuficiência cardíaca com fração de ejeção preservada (ICFEP) ou disfunção microvascular após transplante cardíaco, essa abordagem fornece informações únicas, clinicamente importantes e complementares sobre a função vascular coronariana.
Introdução
A ressonância magnética cardíaca sensível à oxigenação (RMC-OS) utiliza as propriedades paramagnéticas inerentes à desoxihemoglobina como fonte endógena de contraste RM1,2,3. Utilizada em combinação com manobras respiratórias vasoativas padronizadas (hiperventilação e apneia) como potente estímulo vasomotor não farmacológico, a RMC-OS pode monitorar alterações na oxigenação miocárdica como marcador da função vascular, contornando a necessidade de qualquer agente de estresse extrínseco, intravenoso ou estressante farmacológico 4,5,6.
As manobras respiratórias, incluindo apneia e hiperventilação, são medidas vasoativas altamente eficazes para alterar o vasomovimento e, devido à sua segurança e simplicidade, são ideais para a vasomoção dependente do endotélio controlada como parte de um procedimento diagnóstico. Estudos têm demonstrado uma efetividade adicional ao combinar hiperventilação com uma subsequente apneia4,7, pois durante tal protocolo, a vasoconstrição (através da diminuição associada de dióxido de carbono no sangue) é seguida por vasodilatação (aumento do dióxido de carbono no sangue); assim, um sistema vascular saudável transita por toda a faixa de vasoconstrição para vasodilatação com um forte aumento do fluxo sanguíneo miocárdico, o que, por sua vez, aumenta a oxigenação miocárdica e, portanto, a intensidade de sinal observável nas imagens de OS-RMC. O uso de cine images para a aquisição também permite resultados de resolução de fase cardíaca, com melhor relação sinal-ruído quando comparada à infusão de adenosina8.
As manobras respiratórias podem substituir os agentes estressores farmacológicos para induzir alterações vasoativas que podem ser utilizadas na avaliação da função vascular coronariana. Isso não apenas reduz o risco do paciente, os esforços logísticos e os custos associados, mas também ajuda a fornecer resultados clinicamente mais significativos. Os agentes estressores farmacológicos, como a adenosina, desencadeiam uma resposta endotélio-dependente e, portanto, refletem a própria função endotelial. Essa avaliação específica da função endotelial até o momento só foi possível pela administração intracoronária de acetilcolina como vasodilatador endotelial-dependente. Esse procedimento, entretanto, é altamente invasivo2,9 e, portanto, raramente realizado.
Na falta de acesso a biomarcadores diretos, várias técnicas diagnósticas têm utilizado marcadores substitutos, como a captação tecidual de um meio de contraste exógeno. São limitados pela necessidade de uma ou duas vias de acesso intravenoso, contraindicações como doença renal grave ou bloqueio atrioventricular e pela necessidade da presença física de pessoal com treinamento no manejo de efeitos colaterais potencialmente graves10,11. A limitação mais significativa das imagens atuais da função coronariana, no entanto, continua sendo que a perfusão miocárdica como marcador substituto não reflete a oxigenação do tecido miocárdico como a consequência mais importante a jusante da disfunção vascular2.
OS-CMR com manobras respiratórias vasoativas tem sido utilizada para avaliar a função vascular em vários cenários, incluindo indivíduos saudáveis, doença macrovascular em pacientes com doença arterial coronariana (DAC), bem como disfunção microvascular em pacientes com apneia obstrutiva do sono (AOS), isquemia sem estenose coronariana obstrutiva (INOCA), após transplante cardíaco, e insuficiência cardíaca com fração de ejeção preservada (ICFEP)4, 7,12,13,14,15,16. Em uma população com DAC, o protocolo de reserva de oxigenação miocárdica induzida pela respiração (B-MORE) derivado da RMC-OS mostrou-se seguro, viável e sensível na identificação de uma resposta de oxigenação prejudicada em territórios miocárdicos perfundidos por uma artéria coronária com estenose significativa13.
Na disfunção microvascular, a RMC-OS demonstrou uma resposta retardada da oxigenação miocárdica em pacientes com apneia obstrutiva do sono, e um B-MORE embotado foi encontrado em pacientes com ICFEP e após transplante cardíaco12,14,16. Em mulheres com INOCA, a manobra respiratória levou a uma resposta de oxigenação miocárdica anormalmente heterogênea, destacando a vantagem da alta resolução espacial da RMC-OS15. Este artigo revisa o raciocínio e a metodologia para a realização de OS-RMC com manobras respiratórias vasoativas e discute sua utilidade clínica na avaliação da fisiopatologia vascular em populações de pacientes com disfunção microvascular, especificamente no que se refere à disfunção endotelial.
O contexto fisiológico da RM sensível à oxigenação reforçada pela respiração
Em condições fisiológicas normais, um aumento na demanda de oxigênio é acompanhado por um aumento equivalente na oferta de oxigênio através do aumento do fluxo sanguíneo, resultando em nenhuma alteração na concentração local de desoxihemoglobina. Em contraste, a vasodilatação induzida leva ao "excesso" de influxo de sangue oxigenado sem alteração na demanda de oxigênio. Consequentemente, maior parte da hemoglobina tecidual é oxigenada e, portanto, há menos desoxihemoglobina, levando a um aumento relativo da intensidade de sinal OS-CMR 4,17. Se a função vascular está comprometida, ela não pode responder adequadamente a uma demanda metabólica alterada ou estímulo para aumentar o fluxo sanguíneo miocárdico.
No contexto de um estímulo para provocar vasomovimento, como hiperventilação cadenciada provocando vasoconstrição ou uma longa pausa respiratória provocando vasodilatação mediada por dióxido de carbono, a atividade vasomotora prejudicada resultaria em um aumento relativo na concentração local de desoxihemoglobina em comparação com outras regiões e, subsequentemente, uma mudança reduzida na intensidade do sinal OS-CMR. No cenário de isquemia induzível, a função vascular prejudicada resultaria em aumento da demanda local não atendida por um aumento local do fluxo sanguíneo miocárdico, mesmo na ausência de estenose da artéria coronária epicárdica. Nas imagens de OS-CMR, o aumento local líquido na concentração de desoxihemoglobina leva a uma diminuição da intensidade de sinal local 2,18,19,20.
O relaxamento atenuado da musculatura lisa vascular em resposta a vasodilatadores dependentes e independentes do endotélio (incluindo adenosina) tem sido demonstrado em pacientes com disfunção microvascular coronariana21,22,23,24,25,26,27 . Acredita-se que a disfunção endotelial-independente seja devida a anormalidades estruturais da hipertrofia microvascular ou patologia miocárdica circundante. Em contraste, a disfunção endotelial resulta tanto em vasoconstrição inadequada quanto em vasorelaxamento prejudicado (dependente do endotélio), tipicamente causado pela perda da bioatividade do óxido nítrico na parede do vaso21,28. A disfunção endotelial tem sido implicada na patogênese de uma série de doenças cardiovasculares, incluindo hipercolesterolemia, hipertensão, diabetes, DAC, apneia obstrutiva do sono, INOCA e IC23,24,28,29,30,31,32. De fato, a disfunção endotelial é a manifestação mais precoce da aterosclerosecoronariana33. A imagem da função endotelial tem um potencial muito forte, dado seu papel como preditor significativo de eventos cardiovasculares adversos e desfechos em longo prazo, com profundas implicações prognósticas nos estados de doença cardiovascular23,29,30,31,34,35.
Em contraste com a cintilografia de perfusão, a reserva de oxigenação miocárdica induzida pela respiração (B-MORE), definida como o aumento relativo da oxigenação miocárdica durante uma pausa respiratória pós-hiperventilação, permite visualizar as consequências desse gatilho vasoativo sobre a própria oxigenação global ou regional 2,36. Como um marcador preciso a jusante da função vascular, o B-MORE pode, portanto, não apenas identificar disfunção vascular, mas também isquemia induzível real, indicando um problema mais grave de perfusão local ou oxigenação18,19,37. Isso é conseguido através da capacidade da RMC-OS de visualizar a diminuição relativa da hemoglobina desoxigenada, que é abundante no sistema capilar do miocárdio, que por si só representa uma proporção significativa do tecidomiocárdico24.
Sequência OS-CMR
A sequência de ressonância magnética (RMM) usada para imagens de OS-CMR é uma sequência prospectivamente gated, modificada, balanceada, de estado estacionário, de precessão livre (bSSFP) adquirida em dois cortes de eixo curto. Esta sequência bSSFP é uma sequência clínica padrão disponível (e modificável) em todos os scanners de RM que realizam RM cardíaca, tornando esta técnica independente do fornecedor e facilmente implementada. Em uma sequência de cine bSSFP regular, o tempo de eco, o tempo de repetição e o ângulo de inversão são modificados para sensibilizar a intensidade de sinal resultante ao efeito BOLD e, assim, criar uma sequência sensível à oxigenação. Essa abordagem, uma leitura bSSFP preparada para T2, já se mostrou adequada para a aquisição de imagens sensíveis à oxigenação com uma relação sinal-ruído mais alta, maior qualidade de imagem e tempos de varredura mais rápidos quando comparada às técnicas anteriores de gradiente eco usadas para imagens BOLD38. A realização de RMC-OS com aumento respiratório com essa abordagem pode ser aplicada com pouquíssimos efeitos colaterais leves (Tabela 1). Vale ressaltar que mais de 90% dos participantes completam esse protocolo com tempos de apneia suficientemente longos 4,12,13,16.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os exames de RM utilizando OS-CMR com manobras respiratórias vasoativas devem ser realizados de acordo com as diretrizes institucionais locais. O protocolo descrito a seguir tem sido utilizado em estudos aprovados por diversos comitês de ética em pesquisa com seres humanos da instituição. Consentimento por escrito foi obtido para todos os dados humanos dos participantes e resultados descritos neste protocolo e manuscrito.
1. Visão geral
- Variar os critérios de inclusão e exclusão dependendo da população de interesse do estudo. Use os seguintes critérios gerais e comuns de exclusão para um protocolo de OS-RMC com manobras respiratórias vasoativas: contraindicações gerais de RM (por exemplo, dispositivos incompatíveis com RM, como marca-passos ou desfibriladores, material implantado ou corpos estranhos), consumo de cafeína ou medicação vasoativa nas 12 h anteriores à RM e idade <18 anos.
- Primeiro, adquira o scout de localizador clínico padrão e imagens de estrutura e função ventricular antes de adquirir as aquisições do EO. Use as imagens de cine de eixo longo bSSFP para planejar o posicionamento de fatia das aquisições do sistema operacional.
NOTA: Uma revisão dos protocolos clínicos padronizados de RMC é descrita em outra publicação39. - Apneia basal
- Adquira a primeira série OS-CMR como uma aquisição curta e basal em apneia para avaliar a qualidade da imagem e a localização do corte, verificar se há artefatos, bem como servir como uma linha de base de intensidade de sinal.
- Realizar uma aquisição de ciclo cardíaco curto (~10 s) após o participante estar respirando normalmente. Certifique-se de que a pausa respiratória seja feita no final da expiração.
- Aquisição contínua com manobra respiratória vasoativa
- Adquira a segunda série OS-CMR como uma aquisição contínua de 4 min, composta por 2 min de respiração livre e 1 min de hiperventilação cadenciada, seguida por uma pausa respiratória voluntária máxima (~1 min). À medida que a aquisição contínua obtém múltiplos ciclos cardíacos ao longo de 4 min, modifique um parâmetro adicional (o número de ciclos cardíacos adquiridos pela aquisição) para tornar essa série uma aquisição de medidas repetidas
NOTA: O comprimento mínimo necessário de apneia é de 30 s, embora uma pausa respiratória de 60 s seja considerada o padrão. - Transmitir as instruções para a manobra de respiração vasoativa aos participantes no scanner de RM, direcionando manualmente o participante durante toda a manobra respiratória através de um microfone conectado ao sistema de alto-falante de RM ou através de um arquivo de .mp3 pré-gravado (Arquivo Suplementar 1) que pode ser reproduzido para o participante através do sistema de alto-falante de RM.
- Iniciar a manobra de respiração vasoativa com respiração livre (após 120 s de respiração livre, inicia-se a hiperventilação). Guie o participante através da respiração cadenciada com o uso de bipes audíveis de um metrônomo a uma frequência de 30 respirações/min (um sinal indica inspiração, um sinal indica expiração). Na marca de 55 s de hiperventilação, dê um comando de voz final para "respirar profundamente e, em seguida, expirar e prender a respiração" para garantir que a pausa respiratória seja realizada em um nível de expiração final.
NOTA: A alteração no CO 2 sanguíneo é muito mais pronunciada com a apneia no final da expiração (a superfície pulmonar é menor, minimizando a difusão residual de CO2 nos alvéolos).
- Adquira a segunda série OS-CMR como uma aquisição contínua de 4 min, composta por 2 min de respiração livre e 1 min de hiperventilação cadenciada, seguida por uma pausa respiratória voluntária máxima (~1 min). À medida que a aquisição contínua obtém múltiplos ciclos cardíacos ao longo de 4 min, modifique um parâmetro adicional (o número de ciclos cardíacos adquiridos pela aquisição) para tornar essa série uma aquisição de medidas repetidas
- Análise das imagens
- Para medir o B-MORE, considere a primeira imagem sistólica final durante a apneia como tempo 0 s. Comparar os valores globais ou regionais de intensidade de sinal da imagem sistólica final adquirida mais próximo do ponto de tempo de 30 s da pausa respiratória com a intensidade do sinal da imagem no ponto de tempo de 0 s. Relate BMORE como uma mudança percentual na intensidade do sinal em 30 s em comparação com o tempo 0 s da pausa respiratória.
2. Procedimento pré-digitalização
- Certifique-se de que todos os participantes passem no questionário de segurança e compatibilidade de RM da instituição local (formulário de contraindicação geral de RM), que deve incluir perguntas sobre história médica e cirúrgica pregressa e identificar a presença de qualquer implante, dispositivo ou corpo estranho metálico dentro ou no sítio cirúrgico do participante40.
- Obter um teste de gravidez, se aplicável.
- Verifique se o paciente se absteve de medicação vasoativa e cafeína nas 12 h anteriores à ressonância magnética.
- Mostre ao participante o vídeo instrutivo da manobra respiratória (Vídeo Suplementar S1).
- Realizar uma sessão prática de 60 s de hiperventilação cadenciada seguida de uma máxima pausa voluntária da respiração com todos os participantes fora da sala de varredura da ressonância magnética e fornecer feedback sobre o desempenho da hiperventilação.
- Instrua os participantes que eles podem simplesmente retomar a respiração quando tiverem uma forte vontade de fazê-lo.
NOTA: Consulte a discussão para pontos a serem observados e forneça feedback aos participantes.
3. Aquisição por RM de sequências sensíveis à oxigenação
- Modifique três parâmetros da sequência padrão bSSFP no console de RM: aumentar o tempo de repetição (TR), aumentar o tempo de eco (TE), diminuir o ângulo de inversão (FA).
NOTA: Os valores modificados são dependentes da intensidade do campo do scanner de RM (Tabela 2). O aumento do TR e do TE e a diminuição da AF resultam em aumento da sensibilidade de T2* ou oxigenação da sequência de RM. Essas modificações resultarão em um aumento na largura de banda e na resolução de base da sequência. - Crie duas séries de EO, uma linha de base (rotulada: OS_base) e a aquisição contínua durante a qual a manobra respiratória é realizada (rotulada: OS_cont_acq). Deixe a sequência do sistema operacional de linha de base inalterada. Na aquisição contínua do sistema operacional, aumente as medidas repetidas de 1 para ~25-40 (dependendo do tipo de scanner). Aumentar o número de ciclos cardíacos (medidas) até que o tempo de aquisição seja de ~4,5 min.
NOTA: Duas sequências OS-CMR são necessárias: aquisição basal de OS e aquisição contínua de EO com manobras de respiração vasoativa. As seções a seguir descrevem essas etapas.
4. Aquisição da linha de base do SO
- Para prescrição de fatias, planeje em um quadro sistólico final de um corte de eixo longo (imagem de duas ou quatro câmaras). Prescrever dois cortes de eixo curto, um no nível médio e basal e outro no nível médio e apical. Veja na discussão os pontos a serem considerados em relação à localização da fatia.
- Ajustes de parâmetros de sequência
- Ajuste os parâmetros de sequência conforme necessário para um determinado participante. Consulte a Tabela 3 para parâmetros de sequência que podem ou não ser alterados.
- Ajuste o intervalo/espaçamento médio entre as fatias com base no tamanho do coração do participante e garanta a localização adequada da fatia.
- Ajuste o campo de visão para evitar artefatos de encapsulamento, se necessário. Faça todos os esforços para manter o campo de visão entre 360 mm e 400 mm.
- Volume do calço
- Ajuste o volume do calço para ficar apertado ao redor do ventrículo esquerdo nas vistas de eixo longo e curto.
- Aquisição de sequência
- Aprove a sequência e execute-a durante a pausa respiratória final. Certifique-se de que essa sequência de SO basal dure ~10 s, com base na frequência cardíaca e no scanner de ressonância magnética.
- Verificação de qualidade de imagem
- Verifique ambas as fatias da série adquirida - procure qualquer movimento respiratório, má localização da fatia ou a presença de artefatos. Repita a sequência OS basal até que a qualidade de imagem adequada tenha sido obtida.
- Para solução de problemas, se a localização do corte for muito basal ou muito apical, ajuste o local do corte prescrito para estar mais próximo do nível ventricular médio. Se houver um artefato presente, siga as etapas abaixo:
- Verifique a direção de codificação de fase.
- Aumente o campo de visão.
- Ajustar o volume do calço ao redor do ventrículo esquerdo.
5. Aquisição contínua do EO com manobras respiratórias vasoativas
NOTA: Certifique-se de que todos os participantes foram instruídos sobre o desempenho adequado da manobra respiratória antes de estarem no scanner de ressonância magnética (ver secção 2).
- Planejamento de sequência
- Se possível, copie a posição da fatia e ajuste o volume da imagem basal do SO ou duplique a sequência do SO basal e, em medições repetidas, aumente de 1 para ~25-40 (ou perto de 4,5 min de tempo de aquisição).
- Verifique o posicionamento da imagem e da fatia e, em seguida, capture o ciclo.
- Se possível, abra a janela de transmissão ao vivo.
- Na sala de controle, conecte um dispositivo com as instruções de manobra respiratória .mp3 arquivo na entrada auxiliar ou prepare-se para segurá-lo sobre o microfone projetado no scanner de ressonância magnética. Alternativamente, guie manualmente o participante através da manobra respiratória usando um cronômetro para cronometragem e forneça instruções verbalmente através do microfone conectado ao sistema de alto-falante da RM.
- Aquisição de sequência
- Pressione simultaneamente play para a sequência de aquisição contínua do sistema operacional no scanner de ressonância magnética e reproduza o arquivo de instruções de respiração .mp3 ou inicie o cronômetro se o participante estiver sendo instruído manualmente.
- Se guiar manualmente o participante através das manobras de respiração, instrua-o a inspirar e expirar, em seguida, prenda a respiração por 10 segundos e comece a hiperventilar assim que ouvir o sinal sonoro do metrônomo.
- Notificar o participante na marca de 40 s de hiperventilação (2:40 no cronômetro).
- No momento de 55 s de hiperventilação (2:55 no cronômetro), instrua o participante a "inspirar profundamente, expirar e prender a respiração".
NOTA: As imagens de respiração livre e hiperventilação terão artefatos de movimento. Isso é esperado. No entanto, não deve haver nenhum artefato de movimento durante a pausa para respirar. É extremamente importante que as imagens em pausa na respiração sejam adquiridas após a expiração (posição expiratória final confortável). Apenas uma pausa respiratória após a expiração leva ao rápido aumento do CO2 sanguíneo durante os primeiros 30 segundos da pausa respiratória subsequente, com a alteração associada do fluxo sanguíneo coronariano e da oxigenação miocárdica. - Monitore o desempenho do participante da hiperventilação cadenciada através da janela da sala de controle ou da câmera do scanner de ressonância magnética para garantir o desempenho adequado da respiração profunda. Se forem usados foles, monitore os picos de amplitude no visualizador de gating respiratório. Se a hiperventilação não estiver sendo realizada adequadamente após a orientação inicial, aborte a aquisição e repita a sequência de aquisição contínua do EO.
- Monitore quaisquer pequenas respirações tomadas pelos participantes durante toda a pausa respiratória. Faça isso monitorando o rastreamento de um cinto de respiração no console de ressonância magnética ou visualmente através da janela/câmera.
- Uma vez que o participante começa a respirar no final da pausa respiratória, interrompa a aquisição.
- Após o término da aquisição, pergunte ao participante se ele sentiu algum efeito adverso e permita que ele respire normalmente por 3 min.
- Solução de problemas: aquisição repetida
- Se as manobras respiratórias precisarem ser repetidas, repita a sequência OS basal.
NOTA: Um período de 2-3 min antes de repetir a aquisição é necessário para permitir que a fisiologia retorne à linha de base. Dados prévios mostraram que a fisiologia não retorna aos valores basais após 1 min41. - Se a qualidade da imagem da sequência basal do EO for adequada, repita a aquisição contínua do EO e a realização das manobras respiratórias.
- Se as manobras respiratórias precisarem ser repetidas, repita a sequência OS basal.
6. Análise das imagens
- Importe os conjuntos de dados de imagem OS-CMR para um visualizador DICOM com recursos de contorno de imagem, melhor com funcionalidade para analisar automaticamente mudanças de intensidade de sinal sensíveis à oxigenação.
- Marcadores e sua mensuração
- Adquira uma imagem basal durante uma aquisição de apneia curta e basal antes da hiperventilação (repouso). Compare a primeira imagem da pausa respiratória (que representa o fim do estímulo de "estresse") com a imagem basal.
NOTA: A hiperventilação é um estímulo vasoconstritor que reduz a oxigenação miocárdica (Saudável: %ΔSI ≈−5% a −10%13). - Obter muitas imagens (e ciclos cardíacos) durante a pausa respiratória. Use a primeira imagem da pausa respiratória como linha de base e compare todas as imagens a seguir com essa imagem.
NOTA: A apneia é um estímulo vasodilatador que aumenta a oxigenação miocárdica (%ΔSI ≈ +5%-15%12,13,14,16). - Contornos miocárdicos
Para análise manual: seleção de fase cardíaca- Como a apneia pode conter mais de 400 imagens, analise apenas uma fase de cada ciclo cardíaco. Como resultado, concentre a análise nas imagens sistólicas finais de cada ciclo cardíaco.
- Identificar as imagens sistólicas finais de cada ciclo cardíaco.
- Desenhar os contornos epicárdico e endocárdico ao redor do miocárdio.
- Janela da imagem para procurar artefatos, que aparecerão como áreas escuras (suscetibilidade) ou brilhantes devido ao mau fechamento no miocárdio.
NOTA: Evite incluir pixels com efeitos parciais de volume dos pools de sangue do ventrículo esquerdo e direito. A maioria dos erros de contorno ocorre a partir do contorno endocárdico, incluindo pixels com efeitos parciais de volume e consequente elevação artificial da intensidade de sinal do pool sanguíneo do ventrículo esquerdo. Para evitar isso, desenhe o contorno endocárdico um pixel inteiro dentro do miocárdio. Da mesma forma, certifique-se de que o contorno epicárdico esteja um pixel completo dentro do miocárdio para evitar efeitos parciais de volume do pool sanguíneo do ventrículo direito, da gordura epicárdica ou da interface ar-pulmão. - Copiar e colar os contornos endocárdico e epicárdico da primeira imagem sistólica final do ciclo cardíaco para a imagem sistólica final do próximo ciclo cardíaco. Ajuste os contornos conforme necessário.
Para análise automatizada:
NOTA: Com recursos de contorno automatizado, se desejado, todas as fases do ciclo cardíaco podem ser contornadas e analisadas. - Verifique todas as imagens para garantir contornos precisos.
NOTA: Alguns recursos de contorno automatizado disponíveis comercialmente foram treinados em conjuntos de dados que foram contornados para análise volumétrica. Esses contornos são propensos a efeitos parciais de volume, pois são destinados a beirar o pool sanguíneo e o miocárdio. Os contornos da OS-CMR devem estar totalmente dentro do miocárdio.
- Adquira uma imagem basal durante uma aquisição de apneia curta e basal antes da hiperventilação (repouso). Compare a primeira imagem da pausa respiratória (que representa o fim do estímulo de "estresse") com a imagem basal.
7. Segmentação para análise regional
- Para obter informações regionais, identificar a inserção ântero-septal e ínfero-septal do ventrículo direito para dividir o miocárdio em segmentação da American Heart Association (AHA)42.
8. Calculando B-MAIS
- Expresse B-MORE como uma mudança percentual na intensidade de sinal da linha de base para a vasodilatação (ver equação 1):
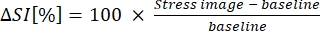 (1º)
(1º) - Calcular o B-MORE global como a intensidade de sinal miocárdico média global das imagens sistólicas finais a 30 s em comparação com 0 s da apneia8 (ver equação 2):
 (2º)
(2º)
Access restricted. Please log in or start a trial to view this content.
Resultados
Interpretação B-MORE
Em estudos publicados anteriormente utilizando OS-CMR com manobras respiratórias vasoativas, o B-MORE global ou regional foi calculado comparando-se a primeira imagem sistólica final da pausa respiratória com a imagem sistólica final mais próxima de 15 s, 30 s, 45 s, etc. da apneia. A fase sistólica final do ciclo cardíaco foi escolhida por vários motivos. A imagem sistólica final é a fase mais consistente identificada entre os leitores: contém o maior número de pixe...
Access restricted. Please log in or start a trial to view this content.
Discussão
A adição de uma aquisição de OS-CMR com manobras respiratórias vasoativas padronizadas a uma pesquisa já estabelecida ou a um protocolo clínico de RM adiciona pouco tempo ao exame geral. Com essa breve adição, informações sobre a função macro e microvascular subjacentes podem ser obtidas (Figura 2). Uma importante consequência da disfunção endotelial é a incapacidade da vasculatura em responder a estímulos fisiológicos, como demonstrado inicialmente por meio de relaxamento...
Access restricted. Please log in or start a trial to view this content.
Divulgações
A MGF está listada como detentora da Patente dos Estados Unidos nº 14/419.877: Indução e medição de alterações da oxigenação miocárdica como marcador de doença cardíaca; United States Patent No. 15/483,712: Medição de alterações de oxigenação no tecido como marcador da função vascular; United States Patent No 10,653,394: Medição de alterações de oxigenação no tecido como marcador da função vascular - continuação; e Canadian Patent CA2020/051776: Método e aparato para determinação de biomarcadores de função vascular utilizando imagens CMR ousadas. A EH está listada como detentora da Patente Internacional CA2020/051776: Método e aparelho para determinação de biomarcadores de função vascular utilizando imagens CMR em negrito.
Agradecimentos
Esta revisão de artigo e metodologia foi possível por toda a equipe do Grupo de Pesquisa CMR Courtois no Centro de Saúde da Universidade McGill. Agradecimentos especiais às nossas tecnólogos de RM Maggie Leo e Sylvie Gelineau pela digitalização de nossos participantes e feedback sobre este manuscrito.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| balanced SSFP MRI sequence | Any | To modify to create the OS-CMR sequence | |
| DICOM/ Imaging Viewer | Any | Best if the viewer has the ability for quantitative measurements (i.e., Area19 prototype software) | |
| Magnetic Resonance Imaging scanner | Any | 3 Tesla or 1.5 Tesla | |
| Metronome | Any | Set to 30 breaths per minute. To use if manually communicating breathing maneuver instructions to participants. | |
| Speaker system | Any | To communicate breathing maneuver instrucitons to participants through | |
| Stopwatch | Any | To use if manually communicating breathing maneuver instructions to participants |
Referências
- Ogawa, S., Lee, T. M., Kay, A. R., Tank, D. W. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proceedings of the National Academy of Sciences of the United States of America. 87 (24), 9868-9872 (1990).
- Friedrich, M. G., Karamitsos, T. D. Oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15, 43(2013).
- Guensch, D. P., et al. The blood oxygen level dependent (BOLD) effect of in-vitro myoglobin and hemoglobin. Scientific Reports. 11 (1), 11464(2021).
- Guensch, D. P., et al. Breathing manoeuvre-dependent changes in myocardial oxygenation in healthy humans. European Heart Journal - Cardiovascular Imaging. 15 (4), 409-414 (2014).
- Fischer, K., Guensch, D. P., Shie, N., Lebel, J., Friedrich, M. G. Breathing maneuvers as a vasoactive stimulus for detecting inducible myocardial ischemia - An experimental cardiovascular magnetic resonance study. PloS One. 11 (10), 0164524(2016).
- Friedrich, M. G. Tracking myocardial oxygenation over a breath hold with blood oxygen level−dependent MRI: A radically different approach to study ischemia. Radiology. 294 (3), 546-547 (2020).
- Teixeira, T., Nadeshalingam, G., Fischer, K., Marcotte, F., Friedrich, M. G. Breathing maneuvers as a coronary vasodilator for myocardial perfusion imaging. Journal of Magnetic Resonance Imaging. 44 (4), 947-955 (2016).
- Fischer, K., Guensch, D. P., Friedrich, M. G. Response of myocardial oxygenation to breathing manoeuvres and adenosine infusion. European Heart Journal Cardiovascular Imaging. 16 (4), 395-401 (2015).
- Ong, P., Athanasiadis, A., Sechtem, U. Intracoronary acetylcholine provocation testing for assessment of coronary vasomotor disorders. Journal of Visualized Experiments. (114), e54295(2016).
- Voigtländer, T., et al. The adverse events and hemodynamic effects of adenosine-based cardiac MRI. Korean Journal of Radiology. 12 (4), 424-430 (2011).
- Tsang, K. H., Chan, W. S. W., Shiu, C. K., Chan, M. K. The safety and tolerability of adenosine as a pharmacological stressor in stress perfusion cardiac magnetic resonance imaging in the Chinese population. Hong Kong Medical Journal. 21 (6), 524-527 (2015).
- Roubille, F., Fischer, K., Guensch, D. P., Tardif, J. -C., Friedrich, M. G. Impact of hyperventilation and apnea on myocardial oxygenation in patients with obstructive sleep apnea - An oxygenation-sensitive CMR study. Journal of Cardiology. 69 (2), 489-494 (2017).
- Fischer, K., et al. Feasibility of cardiovascular magnetic resonance to detect oxygenation deficits in patients with multi-vessel coronary artery disease triggered by breathing maneuvers. Journal of Cardiovascular Magnetic Resonance. 20 (1), 31(2018).
- Iannino, N., et al. Myocardial vascular function assessed by dynamic oxygenation-sensitive cardiac magnetic resonance imaging long-term following cardiac transplantation. Transplantation. 105 (6), 1347-1355 (2021).
- Elharram, M., et al. Regional heterogeneity in the coronary vascular response in women with chest pain and nonobstructive coronary artery disease. Circulation. 143 (7), 764-766 (2021).
- Fischer, K., et al. Insights into myocardial oxygenation and cardiovascular magnetic resonance tissue biomarkers in heart failure with preserved ejection fraction. Circulation: Heart Failure. 15 (4), 008903(2022).
- Li, D., Dhawale, P., Rubin, P. J., Haacke, E. M., Gropler, R. J. Myocardial signal response to dipyridamole and dobutamine: demonstration of the BOLD effect using a double-echo gradient-echo sequence. Magnetic Resonance in Medicine. 36 (1), 16-20 (1996).
- Arnold, J. R., et al. Myocardial oxygenation in coronary artery disease: insights from blood oxygen level-dependent magnetic resonance imaging at 3 tesla. Journal of the American College of Cardiology. 59 (22), 1954-1964 (2012).
- Karamitsos, T. D., et al. Relationship between regional myocardial oxygenation and perfusion in patients with coronary artery disease: Insights from cardiovascular magnetic resonance and positron emission tomography. Circulation: Cardiovascular Imaging. 3 (1), 32-40 (2010).
- Friedrich, M. G., Niendorf, T., Schulz-Menger, J., Gross, C. M., Dietz, R. Blood oxygen level-dependent magnetic resonance imaging in patients with stress-induced angina. Circulation. 108 (18), 2219-2223 (2003).
- Cai, H., Harrison, D. G. Endothelial dysfunction in cardiovascular diseases: The role of oxidant stress. Circulation Research. 87 (10), 840-844 (2000).
- Kothawade, K., Bairey Merz, C. N. Microvascular coronary dysfunction in women: Pathophysiology, diagnosis, and management. Current Problems in Cardiology. 36 (8), 291-318 (2011).
- Gimbrone, M. A., García-Cardeña, G. Endothelial cell dysfunction and the pathobiology of atherosclerosis. Circulation Research. 118 (4), 620-636 (2016).
- Vancheri, F., Longo, G., Vancheri, S., Henein, M. Coronary microvascular dysfunction. Journal of Clinical Medicine. 9 (9), 2880(2020).
- Camici, P. G., Crea, F. Coronary microvascular dysfunction. The New England Journal of Medicine. 356 (8), 830-840 (2007).
- Ford, T. J., et al. Assessment of vascular dysfunction in patients without obstructive coronary artery disease: Why, how, and when. JACC: Cardiovascular Interventions. 13 (16), 1847-1864 (2020).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Budhiraja, R., Parthasarathy, S., Quan, S. F. Endothelial dysfunction in obstructive sleep apnea. Journal of Clinical Sleep Medicine. 3 (4), 409-415 (2007).
- Sena, C. M., Pereira, A. M., Seiça, R. Endothelial dysfunction - A major mediator of diabetic vascular disease. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1832 (12), 2216-2231 (2013).
- Vanhoutte, P. M., Shimokawa, H., Feletou, M., Tang, E. H. C. Endothelial dysfunction and vascular disease - A 30th anniversary update. Acta Physiologica. 219 (1), 22-96 (2017).
- Juni, R. P., Duckers, H. J., Vanhoutte, P. M., Virmani, R., Moens, A. L. Oxidative stress and pathological changes after coronary artery interventions. Journal of the American College of Cardiology. 61 (14), 1471-1481 (2013).
- Simsek, E. C., et al. Endothelial dysfunction in patients with myocardial ischemia or infarction and nonobstructive coronary arteries. Journal of Clinical Ultrasound. 49 (4), 334-340 (2021).
- Stillman, A. E., et al. Imaging the myocardial ischemic cascade. The International Journal of Cardiovascular Imaging. 34 (8), 1249-1263 (2018).
- Fischer, D., et al. Endothelial dysfunction in patients with chronic heart failure is independently associated with increased incidence of hospitalization, cardiac transplantation, or death. European Heart Journal. 26 (1), 65-69 (2005).
- Hurst, T., Olson, T. H., Olson, L. E., Appleton, C. P. Cardiac syndrome X and endothelial dysfunction: New concepts in prognosis and treatment. The American Journal of Medicine. 119 (7), 560-566 (2006).
- Bauer, W. R., et al. Theory of the BOLD effect in the capillary region: An analytical approach for the determination of T*2 in the capillary network of myocardium. Magnetic Resonance in Medicine. 41 (1), 51-62 (1999).
- Manka, R., et al. BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia. Journal of Cardiovascular Magnetic Resonance. 12 (1), 54(2010).
- Dharmakumar, R., Qi, X., Hong, J., Wright, G. A. Detecting microcirculatory changes in blood oxygen state with steady-state free precession imaging. Magnetic Resonance in Medicine. 55 (6), 1372-1380 (2006).
- Kramer, C. M., et al. Standardized cardiovascular magnetic resonance imaging (CMR) protocols: 2020 update. Journal of Cardiovascular Magnetic Resonance. 22 (1), 17(2020).
- Expert Panel on MR Safety et al. ACR guidance document on MR safe practices: 2013. Journal of Magnetic Resonance Imaging: JMRI. 37 (3), 501-530 (2013).
- Macey, P. M., Kumar, R., Ogren, J. A., Woo, M. A., Harper, R. M. Global brain blood-oxygen level responses to autonomic challenges in obstructive sleep apnea. PLoS One. 9 (8), 105261(2014).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. Circulation. 105 (4), 539-542 (2002).
- Hayoz, D., et al. Flow-mediated arterial dilation is abnormal in congestive heart failure. Circulation. 87 (6), 92-96 (1993).
- Hillier, E., Friedrich, M. G. The potential of oxygenation-sensitive CMR in heart failure. Current Heart Failure Reports. 18 (5), 304-314 (2021).
- Hawkins, S. M., et al. Hyperventilation-induced heart rate response as a potential marker for cardiovascular disease. Scientific Reports. 9 (1), 17887(2019).
- Dass, S., et al. No evidence of myocardial oxygen deprivation in nonischemic heart failure. Circulation: Heart Failure. 8 (6), 1088-1093 (2015).
- Endemann, D. H., Schiffrin, E. L. Endothelial dysfunction. Journal of the American Society of Nephrology. 15 (8), 1983-1992 (2004).
- Costanzo, M. R., et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. The Journal of Heart and Lung Transplantation. 29 (8), 914-956 (2010).
- Lanza, G. A. Cardiac syndrome X: A critical overview and future perspectives. Heart. 93 (2), 159-166 (2007).
- Gould, K. L., Johnson, N. P. Coronary physiology beyond coronary flow reserve in microvascular angina: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2642-2662 (2018).
- Guensch, D. P., Nadeshalingam, G., Fischer, K., Stalder, A. F., Friedrich, M. G. The impact of hematocrit on oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 18 (1), 42(2016).
- Dharmakumar, R., et al. Assessment of regional myocardial oxygenation changes in the presence of coronary artery stenosis with balanced SSFP imaging at 3.0T: Theory and experimental evaluation in canines. Journal of Magnetic Resonance Imaging. 27 (5), 1037-1045 (2008).
- Hillier, E., Benovoy, M., Friedrich, M. A fully automated post-processing tool identifies a reduced global myocardial oxygenation reserve in patients with ischemia and no obstructive coronary artery stenosis when compared to patients with significant CAD. SCMR 25th Annual Scientific Sessions. , (2022).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Oxygenation-sensitive Cardiac MRI with Vasoactive Breathing Maneuvers for the Non-invasive Assessment of Coronary Microvascular Dysfunction
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/64149
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados