Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
МРТ сердца, чувствительная к оксигенации, с вазоактивным дыханием для неинвазивной оценки коронарной микроваскулярной дисфункции
В этой статье
Erratum Notice
Резюме
Оценка функции микрососудов с помощью чувствительной к оксигенации магнитно-резонансной томографии сердца в сочетании с вазоактивными дыхательными маневрами уникальна своей способностью оценивать быстрые динамические изменения оксигенации миокарда in vivo и, таким образом, может служить критически важным диагностическим методом функции коронарных сосудов.
Аннотация
Чувствительная к оксигенации магнитно-резонансная томография сердца (OS-CMR) — это диагностический метод, использующий парамагнитные свойства дезоксигемоглобина в качестве эндогенного источника тканевого контраста. Используемый в сочетании со стандартизированными вазоактивными дыхательными маневрами (гипервентиляция и апноэ) в качестве мощного нефармакологического вазомоторного стимула, OS-CMR может отслеживать изменения оксигенации миокарда. Количественная оценка таких изменений во время сердечного цикла и во время вазоактивных маневров может обеспечить маркеры макро- и микрососудистой функции коронарных артерий и, таким образом, избежать необходимости в каких-либо внешних, внутривенных контрастных или фармакологических стрессовых агентах.
OS-CMR использует хорошо известную чувствительность Т2*-взвешенных изображений к оксигенации крови. Чувствительные к оксигенации изображения могут быть получены на любом МРТ-сканере сердца с использованием модифицированной стандартной клинической стационарной свободной прецессии (SSFP), что делает этот метод независимым от поставщика и легко реализуемым. В качестве вазоактивного дыхательного маневра мы применяем протокол дыхания продолжительностью 4 минуты: 120 секунд свободного дыхания, 60 секунд гипервентиляции с последующей задержкой дыхания на выдохе не менее 30 секунд. Региональную и глобальную реакцию оксигенации тканей миокарда на этот маневр можно оценить, отслеживая изменение интенсивности сигнала. Изменение в течение первых 30 с постгипервентиляционной задержки дыхания, называемой резервом оксигенации миокарда (B-MORE), изучено у здоровых людей и различных патологий. Представлен подробный протокол выполнения кислородочувствительного КЦР-сканирования с вазоактивными маневрами.
Как показано у пациентов с микроваскулярной дисфункцией при еще не до конца изученных состояниях, таких как индуцируемая ишемия без обструктивного стеноза коронарных артерий (INOCA), сердечная недостаточность с сохраненной фракцией выброса (HFpEF) или микрососудистая дисфункция после трансплантации сердца, этот подход предоставляет уникальную, клинически значимую и дополнительную информацию о функции коронарных сосудов.
Введение
Чувствительная к оксигенации магнитно-резонансная томография сердца (OS-CMR) использует парамагнитные свойства, присущие дезоксигемоглобину, в качестве эндогенного источника МР-контраста 1,2,3. Используемый в сочетании со стандартизированными вазоактивными дыхательными маневрами (гипервентиляция и апноэ) в качестве мощного нефармакологического вазомоторного стимула, OS-CMR может отслеживать изменения оксигенации миокарда в качестве маркера функции сосудов, тем самым обходя необходимость в любых внешних, внутривенных контрастных или фармакологических стресс-агентах 4,5,6.
Дыхательные маневры, включая задержки дыхания и гипервентиляцию, являются высокоэффективными вазоактивными мерами для изменения вазомоции и, благодаря своей безопасности и простоте, идеально подходят для контролируемой эндотелиально-зависимой вазомоции в рамках диагностической процедуры. Исследования показали дополнительную эффективность при сочетании гипервентиляции с последующей задержкой дыхания4,7, так как при таком протоколе сужение сосудов (за счет связанного с этим снижения содержания углекислого газа в крови) сопровождается вазодилатацией (увеличением содержания углекислого газа в крови); Таким образом, здоровая сосудистая система переходит во всем диапазоне от вазоконстрикции к вазодилатации с сильным усилением кровотока миокарда, что в свою очередь увеличивает оксигенацию миокарда и, таким образом, наблюдаемую интенсивность сигнала на изображениях OS-CMR. Использование киноизображений для получения данных также позволяет получить результаты с разрешением сердечной фазы с лучшим соотношением сигнал/шум по сравнению с инфузией аденозина8.
Дыхательные маневры могут заменить фармакологические стрессовые агенты для индуцирования вазоактивных изменений, которые могут быть использованы для оценки функции коронарных сосудов. Это не только снижает риск для пациента, логистические усилия и связанные с этим расходы, но и помогает обеспечить клинически более значимые результаты. Фармакологические стрессовые агенты, такие как аденозин, вызывают эндотелий-зависимый ответ и, таким образом, отражают саму функцию эндотелия. Такая специфическая оценка функции эндотелия до сих пор была возможна только при внутрикоронарном введении ацетилхолина в качестве эндотелиально-зависимого вазодилататора. Эта процедура, однако, является высокоинвазивной2,9 и, следовательно, выполняется редко.
Не имея доступа к прямым биомаркерам, некоторые диагностические методы использовали суррогатные маркеры, такие как поглощение тканями экзогенного контрастного вещества. Они ограничены необходимостью установки одного или двух капельниц внутривенного доступа, противопоказаниями, такими как тяжелое заболевание почек или атриовентрикулярная блокада, а также необходимостью физического присутствия персонала, прошедшего подготовку по лечению потенциально тяжелых побочных эффектов10,11. Однако наиболее существенным ограничением современной визуализации коронарной функции остается то, что перфузия миокарда в качестве суррогатного маркера не отражает оксигенацию тканей миокарда как наиболее важное последующее последствие сосудистой дисфункции2.
OS-CMR с вазоактивным дыханием был использован для оценки функции сосудов во многих сценариях, включая здоровых людей, макрососудистые заболевания у пациентов с ишемической болезнью сердца (ИБС), а также микрососудистую дисфункцию у пациентов с обструктивным апноэ сна (СОАС), ишемией без обструктивного стеноза коронарных артерий (INOCA), после трансплантации сердца и сердечной недостаточностью с сохраненной фракцией выброса (HFpEF)4, 7,12,13,14,15,16. В популяции пациентов с ИБС было доказано, что протокол для индуцированного дыханием резерва оксигенации миокарда (B-MORE), полученный из OS-CMR, является безопасным, осуществимым и чувствительным в выявлении нарушенной реакции оксигенации в областях миокарда, перфузии коронарной артерии со значительным стенозом13.
При микроваскулярной дисфункции OS-CMR продемонстрировал замедленную реакцию оксигенации миокарда у пациентов с обструктивным апноэ сна, а притупленный B-MORE был обнаружен у пациентов с СНпФВ и после трансплантации сердца12,14,16. У женщин с INOCA дыхательный маневр приводил к аномально гетерогенной реакции оксигенации миокарда, что подчеркивает преимущество высокого пространственного разрешения OS-CMR15. В данной работе рассматривается обоснование и методология выполнения OS-CMR с вазоактивными дыхательными маневрами и обсуждается его клиническая полезность для оценки патофизиологии сосудов в популяциях пациентов с микрососудистой дисфункцией, особенно в отношении эндотелиальной дисфункции.
Физиологический контекст МРТ, чувствительной к оксигенации с усилением дыхания
В нормальных физиологических условиях увеличение потребности в кислороде сопровождается эквивалентным увеличением поступления кислорода за счет увеличения кровотока, в результате чего местная концентрация дезоксигемоглобина не изменяется. Напротив, индуцированная вазодилатация приводит к «избыточному» притоку насыщенной кислородом крови без изменения потребности в кислороде. Следовательно, больше тканевого гемоглобина насыщается кислородом, и, таким образом, дезоксигемоглобина становится меньше, что приводит к относительному увеличению интенсивности сигнала OS-CMR 4,17. Если сосудистая функция нарушена, она не может должным образом реагировать на измененные метаболические потребности или стимулы для увеличения кровотока в миокарде.
В условиях стимула, вызывающего вазомоцию, такого как гипервентиляция, вызывающая сужение сосудов, или длительная задержка дыхания, вызывающая вазодилатация, опосредованная углекислым газом, нарушение вазомоторной активности приводило к относительному увеличению локальной концентрации дезоксигемоглобина по сравнению с другими областями и, следовательно, к уменьшению интенсивности сигнала OS-CMR. На фоне индуцируемой ишемии нарушение функции сосудов приводит к увеличению местной потребности, не удовлетворяемой локальным увеличением кровотока миокарда даже при отсутствии стеноза эпикардиальной коронарной артерии. На изображениях OS-CMR чистое локальное увеличение концентрации дезоксигемоглобина приводит к снижению интенсивности локального сигнала 2,18,19,20.
Ослабленная релаксация гладкой мускулатуры сосудов в ответ на эндотелий-зависимые и независимые вазодилататоры (включая аденозин) была продемонстрирована у пациентов с коронарной микроваскулярной дисфункцией 21,22,23,24,25,26,27 . Считается, что эндотелиально-независимая дисфункция обусловлена структурными аномалиями, вызванными микроваскулярной гипертрофией или сопутствующей патологией миокарда. Напротив, эндотелиальная дисфункция приводит как к неадекватной вазоконстрикции, так и к нарушению (эндотелий-зависимой) вазорелаксации, обычно вызванной потерей биологической активности оксида азота в стенке сосуда21,28. Эндотелиальная дисфункция вовлечена в патогенез ряда сердечно-сосудистых заболеваний, включая гиперхолестеринемию, артериальную гипертензию, сахарный диабет, ИБС, обструктивное апноэ сна, INOCA и HF 23,24,28,29,30,31,32. Фактически, эндотелиальная дисфункция является самым ранним проявлением коронарного атеросклероза33. Визуализация функции эндотелия имеет очень большой потенциал, учитывая ее роль в качестве значимого предиктора неблагоприятных сердечно-сосудистых событий и отдаленных исходов, с глубокими прогностическими последствиями при состояниях сердечно-сосудистых заболеваний 23,29,30,31,34,35.
В отличие от перфузионной визуализации, индуцированный дыханием резерв оксигенации миокарда (B-MORE), определяемый как относительное увеличение оксигенации миокарда во время задержки дыхания после гипервентиляции, позволяет визуализировать последствия такого вазоактивного триггера на саму глобальную или региональную оксигенацию 2,36. Таким образом, в качестве точного маркера функции сосудов B-MORE может не только идентифицировать сосудистую дисфункцию, но и фактическую индуцируемую ишемию, что указывает на более серьезную проблему локальной перфузии или оксигенации18,19,37. Это достигается за счет способности OS-CMR визуализировать относительное снижение деоксигенированного гемоглобина, который в изобилии присутствует в капиллярной системе миокарда, который сам по себе представляет значительную долю ткани миокарда24.
Последовательность OS-CMR
Последовательность магнитно-резонансной томографии (МРТ), используемая для визуализации OS-CMR, представляет собой проспективно стробированную, модифицированную, сбалансированную, стационарную, свободную прецессионную последовательность (bSSFP), полученную в двух коротких осевых срезах. Эта последовательность bSSFP является стандартной клинической последовательностью, доступной (и изменяемой) на всех МРТ-сканерах, выполняющих МРТ сердца, что делает этот метод независимым от производителя и легко реализуемым. В обычной кинопоследовательности bSSFP время эха, время повторения и угол поворота изменяются таким образом, чтобы сенсибилизировать результирующую интенсивность сигнала к эффекту BOLD и, таким образом, создать чувствительную к оксигенации последовательность. Ранее было показано, что этот подход, считывающий bSSFP с помощью T2, подходит для получения чувствительных к оксигенации изображений с более высоким отношением сигнал/шум, более высоким качеством изображения и более коротким временем сканирования по сравнению с предыдущими методами градиентного эха, используемыми для визуализации BOLD38. Выполнение OS-CMR с улучшением дыхания с помощью этого подхода может быть применено с очень небольшим количеством легких побочных эффектов (Таблица 1). Следует отметить, что более 90% участников завершают этот протокол с достаточно длительным временем задержки дыхания 4,12,13,16.
протокол
Все МРТ-сканирования с использованием OS-CMR с вазоактивными дыхательными маневрами должны выполняться в соответствии с местными рекомендациями учреждения. Протокол, изложенный ниже, был использован в исследованиях, одобренных несколькими институциональными комитетами по этике исследований на людях. Было получено письменное согласие на все данные и результаты, описанные в данном протоколе и рукописи.
1. Широкий обзор
- Варьировать критерии включения и исключения в зависимости от интересующей исследуемой популяции. Используйте следующие общие, распространенные критерии исключения для протокола OS-CMR с вазоактивным дыхательным маневром: общие противопоказания к МРТ (например, несовместимые с МРТ устройства, такие как кардиостимуляторы или дефибрилляторы, имплантированный материал или инородные тела), употребление кофеина или вазоактивных препаратов в течение 12 часов до МРТ и возраст <18 лет).
- Во-первых, перед получением данных об ОС необходимо получить стандартные изображения клинического локализатора и структуры и функции желудочков. Используйте киноизображения bSSFP с длинной осью для планирования расположения срезов для получения данных ОС.
ПРИМЕЧАНИЕ: Обзор стандартизированных клинических протоколов CMR описан в другом месте39. - Базовая задержка дыхания
- Получите первую серию OS-CMR в качестве короткого базового захвата дыхания для оценки качества изображения и местоположения среза, проверки на наличие артефактов, а также в качестве базового уровня интенсивности сигнала.
- Выполните короткую (~10 с) однократную регистрацию сердечного цикла после того, как участник начнет нормально дышать. Убедитесь, что задержка дыхания выполняется по окончании выдоха.
- Непрерывный захват данных с помощью вазоактивного дыхательного маневра
- Вторая серия OS-CMR в виде 4-минутного непрерывного захвата, состоящего из 2 минут свободного дыхания и 1 минуты стимуляции гипервентиляции с последующей произвольной максимальной задержкой дыхания (~1 минута). Поскольку непрерывный сбор данных получает несколько сердечных циклов в течение 4 минут, измените один дополнительный параметр (количество сердечных циклов, полученных при сборе), чтобы сделать этот ряд повторяющимся измерением
ПРИМЕЧАНИЕ: Минимальная требуемая продолжительность задержки дыхания составляет 30 с, хотя стандартной считается задержка дыхания в 60 с. - Передайте инструкции по проведению вазоактивного дыхательного маневра участникам в МРТ-сканере, вручную направляя участника на протяжении всего дыхательного маневра через микрофон, подключенный к акустической системе МРТ, или через предварительно записанный файл .mp3 (дополнительный файл 1), который можно воспроизвести для участника через акустическую систему МРТ.
- Начинайте вазоактивный дыхательный маневр со свободного дыхания (через 120 с свободного дыхания начинается гипервентиляция). Проведите испытуемого через ритмичное дыхание с помощью звуковых сигналов метронома с частотой 30 вдохов/мин (один звуковой сигнал указывает на вдох, один звуковой сигнал указывает на выдох). На отметке 55 с гипервентиляции дайте последнюю голосовую команду: «Сделайте глубокий вдох, а затем выдохните и задержите дыхание», чтобы убедиться, что задержка дыхания выполняется на уровне конечного выдоха.
ПРИМЕЧАНИЕ: Изменение уровняСО2 в крови гораздо более выражено при задержке дыхания в конце выдоха (поверхность легких меньше, что сводит к минимуму остаточную диффузиюСО2 в альвеолы).
- Вторая серия OS-CMR в виде 4-минутного непрерывного захвата, состоящего из 2 минут свободного дыхания и 1 минуты стимуляции гипервентиляции с последующей произвольной максимальной задержкой дыхания (~1 минута). Поскольку непрерывный сбор данных получает несколько сердечных циклов в течение 4 минут, измените один дополнительный параметр (количество сердечных циклов, полученных при сборе), чтобы сделать этот ряд повторяющимся измерением
- Анализ изображений
- Чтобы измерить B-MORE, рассмотрим первое изображение конечной систолической задержки дыхания как время 0 с. Сравните глобальные или региональные значения интенсивности сигнала конечного систолического изображения, полученного ближе всего к точке времени задержки дыхания 30 с, с интенсивностью сигнала изображения в точке времени 0 с. Укажите BMORE в виде процентного изменения интенсивности сигнала через 30 с по сравнению со временем задержки дыхания 0 с.
2. Процедура предварительного сканирования
- Убедиться в том, что каждый участник прошел опросник по безопасности и совместимости МРТ местного учреждения (форма общих противопоказаний для МРТ), который должен включать вопросы о прошлом медицинском и хирургическом анамнезе и идентифицировать наличие любого имплантата, устройства или металлического инородного тела внутри или в месте хирургического вмешательстваучастника.
- При необходимости сделайте тест на беременность.
- Убедитесь, что пациент воздерживался от вазоактивных препаратов и кофеина в течение 12 часов до МРТ.
- Покажите участнику обучающее видео по дыхательному маневру (Дополнительный видеоролик S1).
- Выполните 60-секундную практику гипервентиляции с последующей максимальной произвольной задержкой дыхания с каждым участником за пределами кабинета МРТ и дайте обратную связь о выполнении гипервентиляции.
- Проинструктируйте участников, что они могут просто возобновить дыхание, когда у них возникнет сильное желание сделать это.
ПРИМЕЧАНИЕ: Ознакомьтесь с обсуждением, чтобы принять к сведению и оставить отзыв участникам.
3. Получение МРТ чувствительных к оксигенации последовательностей
- Измените три параметра из стандартной последовательности bSSFP на консоли МРТ: увеличьте время повторения (TR), увеличьте время эхо-сигнала (TE), уменьшите угол поворота (FA).
ПРИМЕЧАНИЕ: Измененные значения зависят от напряженности поля МРТ-сканера (Таблица 2). Увеличение TR и TE и снижение FA приводит к увеличению T2* или чувствительности оксигенации последовательности МРТ. Эти изменения приведут к увеличению полосы пропускания и базового разрешения последовательности. - Создайте две серии ОС: базовую (помеченную как OS_base) и непрерывную регистрацию, во время которой выполняется дыхательный маневр (помеченная как OS_cont_acq). Оставьте базовую последовательность ОС без изменений. При непрерывном сборе данных ОС увеличьте количество повторных измерений с 1 до ~25-40 (в зависимости от типа сканера). Увеличивайте количество сердечных циклов (мер) до тех пор, пока время сбора не составит ~4,5 мин.
ПРИМЕЧАНИЕ: Необходимы две последовательности OS-CMR: получение исходного уровня OS и непрерывное получение OS с вазоактивными дыхательными маневрами. Эти действия описаны в следующих разделах.
4. Получение базовых данных ОС
- Для назначения срезов планируйте в конечно-систолическом неподвижном кадре с длинной осью (двух- или четырехкамерное изображение). Назначьте два коротких осевых среза - один на средне-базальном уровне, а другой на средне-апикальном уровне желудочков. Смотрите обсуждение, чтобы узнать, что следует учитывать в отношении расположения среза.
- Корректировка параметров последовательности
- Отрегулируйте параметры последовательности по мере необходимости для данного участника. В таблице 3 приведены параметры последовательности, которые могут или не могут быть изменены.
- Отрегулируйте средний зазор/расстояние между срезами в зависимости от размера сердца участника и обеспечьте правильное расположение срезов.
- Отрегулируйте поле зрения, чтобы избежать артефактов переноса, если это необходимо. Приложите максимум усилий, чтобы поле зрения находилось в диапазоне от 360 мм до 400 мм.
- Объем регулировочной прокладки
- Отрегулируйте объем прокладки так, чтобы он был плотно прилегающим к левому желудочку как по длинной, так и по короткой оси.
- Получение последовательности
- Утвердите последовательность и выполните ее во время задержки дыхания в конце выдоха. Убедитесь, что эта базовая последовательность ОС длится ~10 с, основываясь на частоте сердечных сокращений и МРТ-сканере.
- Проверка качества изображения
- Проверьте оба среза полученной серии — обратите внимание на отсутствие дыхательных движений, неправильного расположения срезов или наличия артефактов. Повторяйте базовую последовательность ОС до тех пор, пока не будет получено достаточное качество изображения.
- Для устранения неполадок, если расположение среза слишком базальное или слишком апикальное, отрегулируйте предписанное расположение среза так, чтобы оно было ближе к среднежелудочковому уровню. Если артефакт присутствует, выполните следующие действия:
- Проверьте направление кодирования фазы.
- Увеличьте поле зрения.
- Отрегулируйте объем прокладки вокруг левого желудочка.
5. Непрерывное получение ОС с помощью вазоактивных дыхательных маневров
ПРИМЕЧАНИЕ: Убедитесь, что каждый участник проинструктирован о правильном выполнении дыхательного маневра до того, как он попадет в МРТ-сканер (см. раздел 2).
- Планирование последовательности
- Если возможно, скопируйте положение среза и отрегулируйте громкость из базового образа ОС или продублируйте базовую последовательность ОС и при повторных измерениях увеличьте время съемки с 1 до ~25-40 (или около 4,5 минут).
- Проверьте положение изображения и фрагмента, а затем цикл захвата.
- Если возможно, откройте окно прямой трансляции.
- В диспетчерской подключите устройство с .mp3 файлом инструкций по дыхательному маневру к вспомогательному входу или подготовьтесь держать его над микрофоном, проецируемым в МРТ-сканер. В качестве альтернативы можно вручную провести участника через дыхательный маневр, используя секундомер для измерения времени и устно дать инструкции через микрофон, подключенный к акустической системе МРТ.
- Получение последовательности
- Одновременно нажмите кнопку воспроизведения последовательности непрерывного сбора данных ОС на МРТ-сканере и воспроизведение файла с инструкциями по дыханию в формате .mp3 или запустите секундомер, если участник получает инструкции вручную.
- Если вы вручную проводите участника через дыхательные маневры, попросите его сделать вдох и выдох, затем задержать дыхание на 10 секунд и начать гипервентиляцию, как только он услышит звуковой сигнал метронома.
- Предупредить участника на отметке 40 с о гипервентиляции (2:40 по секундомеру).
- В момент гипервентиляции через 55 секунд (2:55 по секундомеру) попросите участника «сделать глубокий вдох, выдох и задержать дыхание».
ПРИМЕЧАНИЕ: Изображения свободного дыхания и гипервентиляции будут иметь артефакты движения. Это ожидаемо. Однако во время задержки дыхания не должно быть никаких артефактов движения. Критически важно, чтобы изображения задержки дыхания были получены после выдоха (удобное положение в конце выдоха). Только задержка дыхания после выдоха приводит к быстрому повышениюСО2 в крови в течение первых 30 секунд последующей задержки дыхания с сопутствующим изменением коронарного кровотока и оксигенации миокарда. - Следите за выполнением участником темповой гипервентиляции через окно диспетчерской или камеру МРТ-сканера, чтобы обеспечить адекватное выполнение глубокого дыхания. Если используются сильфоны, то следите за пиками амплитуды на смотровом устройстве для защиты дыхания. Если гипервентиляция не выполняется должным образом после первоначального руководства, прервите регистрацию и повторите последовательность непрерывного сбора данных ОС.
- Следите за любыми небольшими вдохами, сделанными участниками во время задержки дыхания. Для этого отслеживайте отслеживание дыхательного пояса на пульте МРТ или визуально через окно/камеру.
- Как только участник начнет дышать в конце задержки дыхания, прекратите захват.
- После окончания обследования спросите участника, испытывали ли он какие-либо побочные эффекты, и дайте ему нормально дышать в течение 3 минут.
- Поиск и устранение неисправностей: повторное получение данных
- Если дыхательные маневры необходимо повторить, повторите базовую последовательность ОС.
ПРИМЕЧАНИЕ: Требуется 2-3 минуты перед повторным сбором, чтобы физиология вернулась к исходному уровню. Предыдущие данные показали, что физиология не возвращается к исходному уровню через 1 мин41. - Если качество изображения базовой последовательности ОС адекватное, повторите непрерывное получение ОС и выполнение дыхательных маневров.
- Если дыхательные маневры необходимо повторить, повторите базовую последовательность ОС.
6. Анализ изображений
- Импортируйте наборы данных изображений OS-CMR в средство просмотра DICOM с возможностями контурирования изображений, лучше всего с функциональностью для автоматического анализа чувствительных к оксигенации изменений интенсивности сигнала.
- Маркеры и их измерение
- Получение исходного изображения во время короткой базовой задержки дыхания перед гипервентиляцией (отдыхом). Сравните первое изображение задержки дыхания (представляющее окончание «стрессового» стимула) с исходным изображением.
ПРИМЕЧАНИЕ: Гипервентиляция является сосудосуживающим раздражителем, который снижает оксигенацию миокарда (здоровый: %ΔSI от ≈−5% до −10%13). - Получите множество изображений (и сердечных циклов) во время задержки дыхания. Используйте первое изображение задержки дыхания в качестве базовой линии и сравните все последующие изображения с этим изображением.
ПРИМЕЧАНИЕ: Задержка дыхания является сосудорасширяющим стимулом, который увеличивает оксигенацию миокарда (%ΔSI ≈ +5%-15%12,13,14,16). - Контуры миокарда
Для ручного анализа: выбор фазы сердца- Поскольку задержка дыхания может содержать более 400 изображений, анализируйте только одну фазу каждого сердечного цикла. В результате сосредоточьте анализ на конечных систолических изображениях каждого сердечного цикла.
- Определите конечные систолические изображения каждого сердечного цикла.
- Нарисуйте эпикардиальный и эндокардиальный контуры вокруг миокарда.
- Окошко изображения для поиска артефактов, которые будут проявляться либо в виде темных (восприимчивость), либо в виде светлых областей из-за плохого стробирования в миокарде.
ПРИМЕЧАНИЕ: Избегайте включения пикселей с частичными объемными эффектами из бассейнов крови левого и правого желудочков. Большинство ошибок контурирования происходит из-за контура эндокарда, включая пиксели с частичными объемными эффектами и, как следствие, искусственно повышенную интенсивность сигнала из кровообращения левого желудочка. Чтобы этого избежать, нарисуйте контур эндокарда на один полный пиксель внутри миокарда. Точно так же убедитесь, что эпикардиальный контур находится на один полный пиксель внутри миокарда, чтобы избежать частичных объемных эффектов от кровеносной пулы правого желудочка, эпикардиального жира или границы раздела воздух-легкие. - Скопируйте и вставьте контуры эндокарда и эпикарда от первого конечного систолического изображения сердечного цикла к конечному систолическому изображению следующего сердечного цикла. При необходимости скорректируйте контуры.
Для автоматизированного анализа:
ПРИМЕЧАНИЕ: При желании с помощью автоматизированных возможностей контурирования можно очертить и проанализировать все фазы сердечного цикла. - Проверьте все изображения, чтобы убедиться в точности контурирования.
ПРИМЕЧАНИЕ: Некоторые коммерчески доступные возможности автоматического контурирования были обучены на наборах данных, которые были оконтурены для объемного анализа. Эти контуры подвержены эффектам частичного объема, поскольку они предназначены для границы кровеносного бассейна и миокарда. Контуры OS-CMR должны полностью находиться внутри миокарда.
- Получение исходного изображения во время короткой базовой задержки дыхания перед гипервентиляцией (отдыхом). Сравните первое изображение задержки дыхания (представляющее окончание «стрессового» стимула) с исходным изображением.
7. Сегментация для регионального анализа
- Для получения региональной информации определите антерозептальное и нижнесептальное прикрепление правого желудочка для разделения миокарда на сегментацию Американской кардиологической ассоциации (AHA)42.
8. Расчет B-MORE
- Выразим B-MORE в процентах изменения интенсивности сигнала от исходного уровня до вазодилатации (см. уравнение 1):
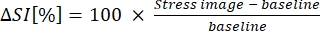 (1)
(1) - Рассчитайте глобальную B-MORE как глобальную среднюю интенсивность сигнала миокарда на конечных систолических изображениях через 30 с по сравнению с 0 с при задержке дыхания8 (см. уравнение 2):
 (2) См.
(2) См.
Результаты
Устный перевод B-MORE
В ранее опубликованных исследованиях с использованием OS-CMR с вазоактивными дыхательными маневрами глобальный или региональный B-MORE рассчитывали путем сравнения первого конечного систолического изображения задержки дыхания с конечным систолическим изоб...
Обсуждение
Добавление OS-CMR со стандартизированными вазоактивными дыхательными маневрами к уже установленному протоколу исследования или клинической МРТ сокращает время общего сканирования. С помощью этого короткого дополнения можно получить информацию о макро- и микрососудистой функции (
Раскрытие информации
MGF указан в качестве владельца патента США No 14/419,877: Индуцирование и измерение изменений оксигенации миокарда в качестве маркера сердечных заболеваний; Патент США No 15/483712: Измерение изменений оксигенации в тканях в качестве маркера функции сосудов; Патент США No 10,653,394: Измерение изменений оксигенации в тканях в качестве маркера функции сосудов - продолжение; и канадский патент CA2020/051776: Метод и устройство для определения биомаркеров функции сосудов с использованием жирных изображений CMR. EH внесена в список обладателей международного патента CA2020/051776: Метод и аппарат для определения биомаркеров функции сосудов с использованием жирных изображений CMR.
Благодарности
Этот обзор статьи и методологии стал возможен благодаря всей команде исследовательской группы Courtois CMR Research Group в Медицинском центре Университета Макгилла. Особая благодарность нашим лаборантам МРТ Мэгги Лео и Сильви Желино за сканирование наших участников и отзывы об этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| balanced SSFP MRI sequence | Any | To modify to create the OS-CMR sequence | |
| DICOM/ Imaging Viewer | Any | Best if the viewer has the ability for quantitative measurements (i.e., Area19 prototype software) | |
| Magnetic Resonance Imaging scanner | Any | 3 Tesla or 1.5 Tesla | |
| Metronome | Any | Set to 30 breaths per minute. To use if manually communicating breathing maneuver instructions to participants. | |
| Speaker system | Any | To communicate breathing maneuver instrucitons to participants through | |
| Stopwatch | Any | To use if manually communicating breathing maneuver instructions to participants |
Ссылки
- Ogawa, S., Lee, T. M., Kay, A. R., Tank, D. W. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proceedings of the National Academy of Sciences of the United States of America. 87 (24), 9868-9872 (1990).
- Friedrich, M. G., Karamitsos, T. D. Oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15, 43 (2013).
- Guensch, D. P., et al. The blood oxygen level dependent (BOLD) effect of in-vitro myoglobin and hemoglobin. Scientific Reports. 11 (1), 11464 (2021).
- Guensch, D. P., et al. Breathing manoeuvre-dependent changes in myocardial oxygenation in healthy humans. European Heart Journal - Cardiovascular Imaging. 15 (4), 409-414 (2014).
- Fischer, K., Guensch, D. P., Shie, N., Lebel, J., Friedrich, M. G. Breathing maneuvers as a vasoactive stimulus for detecting inducible myocardial ischemia - An experimental cardiovascular magnetic resonance study. PloS One. 11 (10), 0164524 (2016).
- Friedrich, M. G. Tracking myocardial oxygenation over a breath hold with blood oxygen level−dependent MRI: A radically different approach to study ischemia. Radiology. 294 (3), 546-547 (2020).
- Teixeira, T., Nadeshalingam, G., Fischer, K., Marcotte, F., Friedrich, M. G. Breathing maneuvers as a coronary vasodilator for myocardial perfusion imaging. Journal of Magnetic Resonance Imaging. 44 (4), 947-955 (2016).
- Fischer, K., Guensch, D. P., Friedrich, M. G. Response of myocardial oxygenation to breathing manoeuvres and adenosine infusion. European Heart Journal Cardiovascular Imaging. 16 (4), 395-401 (2015).
- Ong, P., Athanasiadis, A., Sechtem, U. Intracoronary acetylcholine provocation testing for assessment of coronary vasomotor disorders. Journal of Visualized Experiments. (114), e54295 (2016).
- Voigtländer, T., et al. The adverse events and hemodynamic effects of adenosine-based cardiac MRI. Korean Journal of Radiology. 12 (4), 424-430 (2011).
- Tsang, K. H., Chan, W. S. W., Shiu, C. K., Chan, M. K. The safety and tolerability of adenosine as a pharmacological stressor in stress perfusion cardiac magnetic resonance imaging in the Chinese population. Hong Kong Medical Journal. 21 (6), 524-527 (2015).
- Roubille, F., Fischer, K., Guensch, D. P., Tardif, J. -. C., Friedrich, M. G. Impact of hyperventilation and apnea on myocardial oxygenation in patients with obstructive sleep apnea - An oxygenation-sensitive CMR study. Journal of Cardiology. 69 (2), 489-494 (2017).
- Fischer, K., et al. Feasibility of cardiovascular magnetic resonance to detect oxygenation deficits in patients with multi-vessel coronary artery disease triggered by breathing maneuvers. Journal of Cardiovascular Magnetic Resonance. 20 (1), 31 (2018).
- Iannino, N., et al. Myocardial vascular function assessed by dynamic oxygenation-sensitive cardiac magnetic resonance imaging long-term following cardiac transplantation. Transplantation. 105 (6), 1347-1355 (2021).
- Elharram, M., et al. Regional heterogeneity in the coronary vascular response in women with chest pain and nonobstructive coronary artery disease. Circulation. 143 (7), 764-766 (2021).
- Fischer, K., et al. Insights into myocardial oxygenation and cardiovascular magnetic resonance tissue biomarkers in heart failure with preserved ejection fraction. Circulation: Heart Failure. 15 (4), 008903 (2022).
- Li, D., Dhawale, P., Rubin, P. J., Haacke, E. M., Gropler, R. J. Myocardial signal response to dipyridamole and dobutamine: demonstration of the BOLD effect using a double-echo gradient-echo sequence. Magnetic Resonance in Medicine. 36 (1), 16-20 (1996).
- Arnold, J. R., et al. Myocardial oxygenation in coronary artery disease: insights from blood oxygen level-dependent magnetic resonance imaging at 3 tesla. Journal of the American College of Cardiology. 59 (22), 1954-1964 (2012).
- Karamitsos, T. D., et al. Relationship between regional myocardial oxygenation and perfusion in patients with coronary artery disease: Insights from cardiovascular magnetic resonance and positron emission tomography. Circulation: Cardiovascular Imaging. 3 (1), 32-40 (2010).
- Friedrich, M. G., Niendorf, T., Schulz-Menger, J., Gross, C. M., Dietz, R. Blood oxygen level-dependent magnetic resonance imaging in patients with stress-induced angina. Circulation. 108 (18), 2219-2223 (2003).
- Cai, H., Harrison, D. G. Endothelial dysfunction in cardiovascular diseases: The role of oxidant stress. Circulation Research. 87 (10), 840-844 (2000).
- Kothawade, K., Bairey Merz, C. N. Microvascular coronary dysfunction in women: Pathophysiology, diagnosis, and management. Current Problems in Cardiology. 36 (8), 291-318 (2011).
- Gimbrone, M. A., García-Cardeña, G. Endothelial cell dysfunction and the pathobiology of atherosclerosis. Circulation Research. 118 (4), 620-636 (2016).
- Vancheri, F., Longo, G., Vancheri, S., Henein, M. Coronary microvascular dysfunction. Journal of Clinical Medicine. 9 (9), 2880 (2020).
- Camici, P. G., Crea, F. Coronary microvascular dysfunction. The New England Journal of Medicine. 356 (8), 830-840 (2007).
- Ford, T. J., et al. Assessment of vascular dysfunction in patients without obstructive coronary artery disease: Why, how, and when. JACC: Cardiovascular Interventions. 13 (16), 1847-1864 (2020).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Budhiraja, R., Parthasarathy, S., Quan, S. F. Endothelial dysfunction in obstructive sleep apnea. Journal of Clinical Sleep Medicine. 3 (4), 409-415 (2007).
- Sena, C. M., Pereira, A. M., Seiça, R. Endothelial dysfunction - A major mediator of diabetic vascular disease. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1832 (12), 2216-2231 (2013).
- Vanhoutte, P. M., Shimokawa, H., Feletou, M., Tang, E. H. C. Endothelial dysfunction and vascular disease - A 30th anniversary update. Acta Physiologica. 219 (1), 22-96 (2017).
- Juni, R. P., Duckers, H. J., Vanhoutte, P. M., Virmani, R., Moens, A. L. Oxidative stress and pathological changes after coronary artery interventions. Journal of the American College of Cardiology. 61 (14), 1471-1481 (2013).
- Simsek, E. C., et al. Endothelial dysfunction in patients with myocardial ischemia or infarction and nonobstructive coronary arteries. Journal of Clinical Ultrasound. 49 (4), 334-340 (2021).
- Stillman, A. E., et al. Imaging the myocardial ischemic cascade. The International Journal of Cardiovascular Imaging. 34 (8), 1249-1263 (2018).
- Fischer, D., et al. Endothelial dysfunction in patients with chronic heart failure is independently associated with increased incidence of hospitalization, cardiac transplantation, or death. European Heart Journal. 26 (1), 65-69 (2005).
- Hurst, T., Olson, T. H., Olson, L. E., Appleton, C. P. Cardiac syndrome X and endothelial dysfunction: New concepts in prognosis and treatment. The American Journal of Medicine. 119 (7), 560-566 (2006).
- Bauer, W. R., et al. Theory of the BOLD effect in the capillary region: An analytical approach for the determination of T*2 in the capillary network of myocardium. Magnetic Resonance in Medicine. 41 (1), 51-62 (1999).
- Manka, R., et al. BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia. Journal of Cardiovascular Magnetic Resonance. 12 (1), 54 (2010).
- Dharmakumar, R., Qi, X., Hong, J., Wright, G. A. Detecting microcirculatory changes in blood oxygen state with steady-state free precession imaging. Magnetic Resonance in Medicine. 55 (6), 1372-1380 (2006).
- Kramer, C. M., et al. Standardized cardiovascular magnetic resonance imaging (CMR) protocols: 2020 update. Journal of Cardiovascular Magnetic Resonance. 22 (1), 17 (2020).
- Expert Panel on MR Safety et al. ACR guidance document on MR safe practices: 2013. Journal of Magnetic Resonance Imaging: JMRI. 37 (3), 501-530 (2013).
- Macey, P. M., Kumar, R., Ogren, J. A., Woo, M. A., Harper, R. M. Global brain blood-oxygen level responses to autonomic challenges in obstructive sleep apnea. PLoS One. 9 (8), 105261 (2014).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. Circulation. 105 (4), 539-542 (2002).
- Hayoz, D., et al. Flow-mediated arterial dilation is abnormal in congestive heart failure. Circulation. 87 (6), 92-96 (1993).
- Hillier, E., Friedrich, M. G. The potential of oxygenation-sensitive CMR in heart failure. Current Heart Failure Reports. 18 (5), 304-314 (2021).
- Hawkins, S. M., et al. Hyperventilation-induced heart rate response as a potential marker for cardiovascular disease. Scientific Reports. 9 (1), 17887 (2019).
- Dass, S., et al. No evidence of myocardial oxygen deprivation in nonischemic heart failure. Circulation: Heart Failure. 8 (6), 1088-1093 (2015).
- Endemann, D. H., Schiffrin, E. L. Endothelial dysfunction. Journal of the American Society of Nephrology. 15 (8), 1983-1992 (2004).
- Costanzo, M. R., et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. The Journal of Heart and Lung Transplantation. 29 (8), 914-956 (2010).
- Lanza, G. A. Cardiac syndrome X: A critical overview and future perspectives. Heart. 93 (2), 159-166 (2007).
- Gould, K. L., Johnson, N. P. Coronary physiology beyond coronary flow reserve in microvascular angina: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2642-2662 (2018).
- Guensch, D. P., Nadeshalingam, G., Fischer, K., Stalder, A. F., Friedrich, M. G. The impact of hematocrit on oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 18 (1), 42 (2016).
- Dharmakumar, R., et al. Assessment of regional myocardial oxygenation changes in the presence of coronary artery stenosis with balanced SSFP imaging at 3.0T: Theory and experimental evaluation in canines. Journal of Magnetic Resonance Imaging. 27 (5), 1037-1045 (2008).
- Hillier, E., Benovoy, M., Friedrich, M. A fully automated post-processing tool identifies a reduced global myocardial oxygenation reserve in patients with ischemia and no obstructive coronary artery stenosis when compared to patients with significant CAD. SCMR 25th Annual Scientific Sessions. , (2022).
Erratum
Formal Correction: Erratum: Oxygenation-sensitive Cardiac MRI with Vasoactive Breathing Maneuvers for the Non-invasive Assessment of Coronary Microvascular Dysfunction
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/64149
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены