Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Oxygenierungssensitive Herz-MRT mit vasoaktiven Atemmanövern zur nicht-invasiven Beurteilung der koronaren mikrovaskulären Dysfunktion
In diesem Artikel
Erratum Notice
Zusammenfassung
Die Beurteilung der mikrovaskulären Funktion durch oxygenierungsempfindliche kardiale Magnetresonanztomographie in Kombination mit vasoaktiven Atemmanövern ist einzigartig in ihrer Fähigkeit, schnelle dynamische Veränderungen der myokardialen Oxygenierung in vivo zu beurteilen und kann daher als äußerst wichtige diagnostische Technik für die koronare Gefäßfunktion dienen.
Zusammenfassung
Die oxygenierungsempfindliche kardiale Magnetresonanztomographie (OS-CMR) ist ein diagnostisches Verfahren, das die inhärenten paramagnetischen Eigenschaften von Desoxyhämoglobin als endogene Quelle für Gewebekontrastmittel nutzt. In Kombination mit standardisierten vasoaktiven Atemmanövern (Hyperventilation und Apnoe) als potenter nicht-pharmakologischer vasomotorischer Stimulus kann OS-CMR Veränderungen der myokardialen Oxygenierung überwachen. Die Quantifizierung solcher Veränderungen während des Herzzyklus und während vasoaktiver Manöver kann Marker für die koronare makro- und mikrovaskuläre Funktion liefern und dadurch die Notwendigkeit von extrinsischen, intravenösen Kontrastmitteln oder pharmakologischen Stressmitteln umgehen.
OS-CMR nutzt die bekannte Empfindlichkeit von T2*-gewichteten Bildern gegenüber der Sauerstoffversorgung des Blutes. Oxygenierungsempfindliche Bilder können mit jedem kardialen MRT-Scanner unter Verwendung einer modifizierten klinischen Standard-SSFP-Cine-Sequenz (Steady-State Free Präzession) aufgenommen werden, wodurch diese Technik herstellerunabhängig und einfach zu implementieren ist. Als vasoaktives Atemmanöver wenden wir ein 4-minütiges Atemprotokoll mit 120 s freier Atmung, 60 s beschleunigter Hyperventilation an, gefolgt von einem exspiratorischen Atemanhalten von mindestens 30 s. Die regionale und globale Reaktion der Sauerstoffversorgung des Myokardgewebes auf dieses Manöver kann durch die Verfolgung der Signalintensitätsänderung beurteilt werden. Die Veränderung des Atemanhaltens nach Hyperventilation in den ersten 30 Sekunden, die als atmungsinduzierte myokardiale Oxygenierungsreserve (B-MORE) bezeichnet wird, wurde bei gesunden Menschen und verschiedenen Pathologien untersucht. Ein detailliertes Protokoll für die Durchführung von sauerstoffempfindlichen CMR-Scans mit vasoaktiven Manövern wird bereitgestellt.
Wie bei Patienten mit mikrovaskulärer Dysfunktion unter noch unvollständig verstandenen Erkrankungen, wie z. B. induzierbare Ischämie ohne obstruktive Koronararterienstenose (INOCA), Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) oder mikrovaskulärer Dysfunktion nach Herztransplantation, gezeigt wurde, liefert dieser Ansatz einzigartige, klinisch wichtige und ergänzende Informationen über die koronare Gefäßfunktion.
Einleitung
Die oxygenierungsempfindliche kardiale Magnetresonanztomographie (OS-CMR) nutzt die inhärenten paramagnetischen Eigenschaften von Desoxyhämoglobin als endogene MR-Kontrastquelle 1,2,3. In Kombination mit standardisierten vasoaktiven Atemmanövern (Hyperventilation und Apnoe) als potenter nicht-pharmakologischer vasomotorischer Stimulus kann OS-CMR Veränderungen der myokardialen Oxygenierung als Marker für die Gefäßfunktion überwachen und so die Notwendigkeit von extrinsischen, intravenösen Kontrastmitteln oder pharmakologischen Stressmitteln umgehen 4,5,6.
Atemmanöver, einschließlich Atemanhalten und Hyperventilation, sind hochwirksame vasoaktive Maßnahmen zur Veränderung der Vasomotion und eignen sich aufgrund ihrer Sicherheit und Einfachheit ideal für eine kontrollierte endothelabhängige Vasomotion im Rahmen eines diagnostischen Verfahrens. Studien haben eine zusätzliche Wirksamkeit gezeigt, wenn Hyperventilation mit anschließendem Atemanhalten kombiniertwird 4,7, da während eines solchen Protokolls auf die Vasokonstriktion (durch die damit verbundene Abnahme des Blutkohlendioxids) eine Vasodilatation (Anstieg des Kohlendioxids im Blut) folgt; So durchläuft ein gesundes Gefäßsystem den gesamten Bereich von der Vasokonstriktion zur Vasodilatation mit einer starken Steigerung des myokardialen Blutflusses, was wiederum die myokardiale Oxygenierung und damit die beobachtbare Signalintensität in OS-CMR-Bildern erhöht. Die Verwendung von Cine-Bildern für die Aufnahme ermöglicht auch kardiale phasenaufgelöste Ergebnisse mit einem besseren Signal-Rausch-Verhältnis im Vergleich zur Adenosin-Infusion8.
Atemmanöver können pharmakologische Stressmittel zur Induktion vasoaktiver Veränderungen ersetzen, die zur Beurteilung der koronaren Gefäßfunktion verwendet werden können. Dies reduziert nicht nur das Patientenrisiko, den logistischen Aufwand und die damit verbundenen Kosten, sondern trägt auch dazu bei, klinisch aussagekräftigere Ergebnisse zu liefern. Pharmakologische Stressstoffe wie Adenosin lösen eine Endothel-abhängige Reaktion aus und spiegeln damit die Endothelfunktion selbst wider. Eine solche spezifische Beurteilung der Endothelfunktion war bisher nur durch eine intrakoronare Gabe von Acetylcholin als endothelabhängigem Vasodilatator möglich. Dieses Verfahren ist jedoch hochinvasiv 2,9 und wird daher nur selten durchgeführt.
Da es keinen Zugang zu direkten Biomarkern gibt, werden bei mehreren diagnostischen Techniken Surrogatmarker verwendet, wie z. B. die Gewebeaufnahme eines exogenen Kontrastmittels. Sie sind begrenzt durch die Notwendigkeit von ein oder zwei intravenösen Zugängen, Kontraindikationen wie schwere Nierenerkrankungen oder atrioventrikuläre Blockaden und die Notwendigkeit der physischen Anwesenheit von Personal, das im Umgang mit potenziell schweren Nebenwirkungen geschult ist10,11. Die bedeutendste Einschränkung der aktuellen Bildgebung der Koronarfunktion bleibt jedoch, dass die myokardiale Perfusion als Surrogatmarker nicht die Sauerstoffversorgung des Myokardgewebes als wichtigste nachgeschaltete Folge der vaskulären Dysfunktion widerspiegelt2.
OS-CMR mit vasoaktiven Atemmanövern wurde zur Beurteilung der Gefäßfunktion in zahlreichen Szenarien eingesetzt, darunter gesunde Personen, makrovaskuläre Erkrankungen bei Patienten mit koronarer Herzkrankheit (KHK) sowie mikrovaskuläre Dysfunktion bei Patienten mit obstruktiver Schlafapnoe (OSA), Ischämie ohne obstruktive Koronararterienstenose (INOCA) nach Herztransplantation und Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF)4, 7,12,13,14,15,16. In einer KHK-Population erwies sich das Protokoll für die atmungsinduzierte myokardiale Oxygenierungsreserve (B-MORE), wie es von OS-CMR abgeleitet wurde, als sicher, praktikabel und sensitiv bei der Identifizierung einer beeinträchtigten Oxygenierungsreaktion in myokardialen Territorien, die von einer Koronararterie mit einer signifikanten Stenose durchblutet werden13.
Bei mikrovaskulärer Dysfunktion zeigte die OS-CMR eine verzögerte myokardiale Oxygenierungsantwort bei Patienten mit obstruktiver Schlafapnoe, und bei Patienten mit HFpEF und nach Herztransplantation wurde eine abgestumpfte B-MORE gefunden12,14,16. Bei Frauen mit INOCA führte das Atemmanöver zu einer abnorm heterogenen myokardialen Oxygenierungsreaktion, was den Vorteil der hohen räumlichen Auflösung des OS-CMR15 unterstreicht. Dieser Artikel gibt einen Überblick über die Gründe und Methoden für die Durchführung von OS-CMR mit vasoaktiven Atemmanövern und diskutiert ihren klinischen Nutzen bei der Beurteilung der vaskulären Pathophysiologie bei Patientenpopulationen mit mikrovaskulärer Dysfunktion, insbesondere in Bezug auf die endotheliale Dysfunktion.
Der physiologische Kontext der atmungsverstärkten oxygenierungssensitiven MRT
Unter normalen physiologischen Bedingungen geht ein Anstieg des Sauerstoffbedarfs mit einem entsprechenden Anstieg des Sauerstoffangebots durch einen erhöhten Blutfluss einher, was zu keiner Änderung der lokalen Desoxyhämoglobinkonzentration führt. Im Gegensatz dazu führt die induzierte Vasodilatation zu einem "übermäßigen" Zufluss von sauerstoffreichem Blut, ohne dass sich der Sauerstoffbedarf ändert. Folglich ist ein größerer Teil des Gewebehämoglobins mit Sauerstoff angereichert, und somit gibt es weniger Desoxyhämoglobin, was zu einem relativen Anstieg der OS-CMR-Signalintensität führt 4,17. Wenn die Gefäßfunktion beeinträchtigt ist, kann sie nicht richtig auf einen veränderten Stoffwechselbedarf oder Reiz reagieren, um den myokardialen Blutfluss zu erhöhen.
Bei der Einstellung eines Stimulus zur Auslösung von Vasomotion, wie z. B. einer beschleunigten Hyperventilation, die eine Vasokonstriktion hervorruft, oder einem langen Atemanhalten, der eine Kohlendioxid-vermittelte Vasodilatation hervorruft, würde eine beeinträchtigte vasomotorische Aktivität zu einem relativen Anstieg der lokalen Desoxyhämoglobinkonzentration im Vergleich zu anderen Regionen und in der Folge zu einer reduzierten Änderung der OS-CMR-Signalintensität führen. Im Rahmen einer induzierbaren Ischämie würde eine beeinträchtigte Gefäßfunktion zu einem erhöhten lokalen Bedarf führen, der auch ohne epikardiale Koronararterienstenose nicht durch einen lokalen Anstieg des myokardialen Blutflusses gedeckt werden kann. In OS-CMR-Bildern führt der lokale Nettoanstieg der Desoxyhämoglobinkonzentration zu einer Abnahme der lokalen Signalintensität 2,18,19,20.
Eine abgeschwächte Relaxation der glatten Gefäßmuskulatur als Reaktion auf endothelabhängige und -unabhängige Vasodilatatoren (einschließlich Adenosin) wurde bei Patienten mit koronarer mikrovaskulärer Dysfunktion nachgewiesen 21,22,23,24,25,26,27 . Es wird angenommen, dass eine endotheliale unabhängige Dysfunktion auf strukturelle Anomalien durch mikrovaskuläre Hypertrophie oder umgebende Myokardpathologie zurückzuführen ist. Im Gegensatz dazu führt eine endotheliale Dysfunktion sowohl zu einer inadäquaten Vasokonstriktion als auch zu einer beeinträchtigten (endothelabhängigen) Vasorelaxation, die typischerweise durch einen Verlust der Stickstoffmonoxid-Bioaktivität in der Gefäßwand verursacht wird21,28. Endotheliale Dysfunktion wurde mit der Pathogenese einer Reihe von Herz-Kreislauf-Erkrankungen in Verbindung gebracht, darunter Hypercholesterinämie, Bluthochdruck, Diabetes, KHK, obstruktive Schlafapnoe, INOCA und HF 23,24,28,29,30,31,32. Tatsächlich ist die endotheliale Dysfunktion die früheste Manifestation der koronaren Atherosklerose33. Die Bildgebung der Endothelfunktion hat ein sehr großes Potenzial, da sie ein signifikanter Prädiktor für unerwünschte kardiovaskuläre Ereignisse und Langzeitergebnisse ist, mit tiefgreifenden prognostischen Auswirkungen auf kardiovaskuläre Erkrankungszustände 23,29,30,31,34,35.
Im Gegensatz zur Perfusionsbildgebung ermöglicht die atmungsinduzierte myokardiale Oxygenierungsreserve (B-MORE), definiert als der relative Anstieg der myokardialen Oxygenierung während eines posthyperventilierten Atemanhaltens, die Visualisierung der Folgen eines solchen vasoaktiven Auslösers auf die globale oder regionale Oxygenierung selbst 2,36. Als genauer nachgeschalteter Marker der Gefäßfunktion kann B-MORE daher nicht nur eine vaskuläre Dysfunktion, sondern auch eine tatsächliche induzierbare Ischämie identifizieren, was auf ein schwerwiegenderes lokales Perfusions- oder Oxygenierungsproblem hinweist18,19,37. Dies wird durch die Fähigkeit der OS-CMR erreicht, die relative Abnahme des sauerstoffarmen Hämoglobins sichtbar zu machen, das im Kapillarsystem des Myokards reichlich vorhanden ist, das selbst einen signifikanten Anteil des Myokardgewebes darstellt24.
OS-CMR-Sequenz
Die Magnetresonanztomographie-Sequenz (MRT), die für die OS-CMR-Bildgebung verwendet wird, ist eine prospektiv abgegrenzte, modifizierte, balancierte, stationäre, freie Präzession (bSSFP)-Sequenz, die in zwei Kurzachsenschichten aufgenommen wurde. Diese bSSFP-Sequenz ist eine klinische Standardsequenz, die auf allen MRT-Scannern, die Herz-MRT durchführen, verfügbar (und modifizierbar) ist, wodurch diese Technik herstellerunabhängig und einfach zu implementieren ist. In einer regulären bSSFP-Cine-Sequenz werden Echozeit, Wiederholungszeit und Flip-Winkel modifiziert, um die resultierende Signalintensität für den BOLD-Effekt zu sensibilisieren und so eine oxygenierungsempfindliche Sequenz zu erzeugen. Dieser Ansatz, eine T2-präparierte bSSFP-Auslesung, hat sich bereits als geeignet erwiesen, um oxygenierungsempfindliche Bilder mit einem höheren Signal-Rausch-Verhältnis, einer höheren Bildqualität und schnelleren Scanzeiten im Vergleich zu früheren Gradientenechotechniken zu erfassen, die für die BOLD-Bildgebungverwendet wurden 38. Die Durchführung einer atmungsverstärkten OS-CMR mit diesem Ansatz kann mit sehr wenigen, milden Nebenwirkungen angewendet werden (Tabelle 1). Bemerkenswert ist, dass mehr als 90% der Teilnehmer dieses Protokoll mit ausreichend langen Atemanhaltezeitenvon 4,12,13,16 abschließen.
Protokoll
Alle MRT-Scans mit OS-CMR und vasoaktiven Atemmanövern sollten in Übereinstimmung mit den lokalen institutionellen Richtlinien durchgeführt werden. Das unten beschriebene Protokoll wurde in Studien verwendet, die von mehreren institutionellen Ethikkommissionen für die Humanforschung genehmigt wurden. Für alle in diesem Protokoll und Manuskript beschriebenen Daten und Ergebnisse der menschlichen Teilnehmer wurde eine schriftliche Zustimmung eingeholt.
1. Breiter Überblick
- Variieren Sie die Ein- und Ausschlusskriterien je nach interessierender Studienpopulation. Verwenden Sie die folgenden allgemeinen, gängigen Ausschlusskriterien für ein OS-CMR-Protokoll mit vasoaktiven Atemmanövern: allgemeine MRT-Kontraindikationen (z. B. MRT-inkompatible Geräte wie Herzschrittmacher oder Defibrillatoren, implantiertes Material oder Fremdkörper), Konsum von Koffein oder vasoaktiven Medikamenten in den 12 Stunden vor dem MRT und Alter <18 Jahre.
- Erfassen Sie zunächst den standardmäßigen klinischen Localizer-Scout und ventrikuläre Struktur- und Funktionsbilder, bevor Sie die OS-Akquisitionen erfassen. Verwenden Sie die langachsigen Cine-Bilder von bSSFP, um die Schichtpositionierung der OS-Aufnahmen zu planen.
ANMERKUNG: Eine Übersicht über standardisierte klinische CMR-Protokolle wird an anderer Stellebeschrieben 39. - Grundlinien-Atemanhalten
- Erwerben Sie die erste OS-CMR-Serie als kurze, angehaltene Basisaufnahme, um die Bildqualität und die Position der Schichten zu beurteilen, nach Artefakten zu suchen und als Basislinie für die Signalintensität zu dienen.
- Führen Sie eine kurze (~10 s) Erfassung eines einzelnen Herzzyklus durch, nachdem der Teilnehmer normal geatmet hat. Stellen Sie sicher, dass das Anhalten des Atems am Ende des Ablaufs erfolgt.
- Kontinuierliche Erfassung mit vasoaktivem Atemmanöver
- Erwerben Sie die zweite OS-CMR-Serie als 4-minütige, kontinuierliche Erfassung, die aus 2 Minuten freier Atmung und 1 Minute temporeicher Hyperventilation besteht, gefolgt von einem freiwilligen, maximalen Atemanhalten (~1 Minute). Da die kontinuierliche Erfassung mehrere Herzzyklen über 4 Minuten erhält, ändern Sie einen zusätzlichen Parameter (die Anzahl der durch die Erfassung erfassten Herzzyklen), um diese Reihe zu einer Erfassung mit wiederholten Messungen zu machen
HINWEIS: Die erforderliche Mindestlänge des Atemanhaltens beträgt 30 s, obwohl ein Atemanhalten von 60 s als Standard gilt. - Übermitteln Sie die Anweisungen für das vasoaktive Atemmanöver an die Teilnehmer im MRT-Scanner, indem Sie den Teilnehmer manuell während des Atemmanövers über ein Mikrofon, das an das MRT-Lautsprechersystem angeschlossen ist, oder über eine vorab aufgezeichnete .mp3-Datei (Supplemental File 1) dirigieren, die für den Teilnehmer über das MRT-Lautsprechersystem abgespielt werden kann.
- Beginnen Sie das vasoaktive Atemmanöver mit freier Atmung (nach 120 s freier Atmung beginnt die Hyperventilation). Führen Sie den Teilnehmer durch die Atmung mit akustischen Pieptönen eines Metronoms bei einer Frequenz von 30 Atemzügen/min (ein Piepton zeigt das Einatmen an, ein Piepton das Ausatmen). Geben Sie bei der 55-Sekunden-Marke der Hyperventilation einen letzten Sprachbefehl "tief einatmen und dann ausatmen und den Atem anhalten", um sicherzustellen, dass das Anhalten des Atems auf einem End-Exspirationsniveau durchgeführt wird.
HINWEIS: Die Veränderung des CO 2 im Blut ist mit dem Anhalten des Atems am Ende der Ausatmung viel ausgeprägter (die Lungenoberfläche ist kleiner, wodurch die Restdiffusion von CO2 in die Alveolen minimiert wird).
- Erwerben Sie die zweite OS-CMR-Serie als 4-minütige, kontinuierliche Erfassung, die aus 2 Minuten freier Atmung und 1 Minute temporeicher Hyperventilation besteht, gefolgt von einem freiwilligen, maximalen Atemanhalten (~1 Minute). Da die kontinuierliche Erfassung mehrere Herzzyklen über 4 Minuten erhält, ändern Sie einen zusätzlichen Parameter (die Anzahl der durch die Erfassung erfassten Herzzyklen), um diese Reihe zu einer Erfassung mit wiederholten Messungen zu machen
- Bildanalyse
- Um den B-MORE zu messen, betrachten Sie das erste endsystolische Bild während des Atemanhaltens als Zeit 0 s. Vergleichen Sie die globalen oder regionalen Signalintensitätswerte des endsystolischen Bildes, das dem 30-s-Zeitpunkt des Atemanhaltens am nächsten liegt, mit der Bildsignalintensität zum 0-s-Zeitpunkt. Geben Sie BMORE als prozentuale Änderung der Signalintensität nach 30 s im Vergleich zur Zeit 0 s des Anhaltens des Atems an.
2. Pre-Scan-Verfahren
- Stellen Sie sicher, dass jeder Teilnehmer den MRT-Sicherheits- und Kompatibilitätsfragebogen der örtlichen Einrichtung (MRT-Formular zur allgemeinen Kontraindikation) besteht, der Fragen zur medizinischen und chirurgischen Vorgeschichte enthalten und das Vorhandensein von Implantaten, Geräten oder metallischen Fremdkörpern innerhalb oder an der Operationsstelle des Teilnehmers identifizieren sollte40.
- Lassen Sie gegebenenfalls einen Schwangerschaftstest durchführen.
- Vergewissern Sie sich, dass der Patient in den 12 Stunden vor der MRT-Untersuchung auf vasoaktive Medikamente und Koffein verzichtet hat.
- Zeigen Sie dem Teilnehmer das Video zum Atemmanöver (Supplemental Video S1).
- Führen Sie eine Übungssitzung von 60 Sekunden Hyperventilation durch, gefolgt von einem maximalen freiwilligen Atemanhalten mit jedem Teilnehmer außerhalb des MRT-Scanraums und geben Sie Feedback zur Leistung der Hyperventilation.
- Weisen Sie die Teilnehmer an, dass sie einfach wieder atmen können, wenn sie einen starken Drang dazu verspüren.
HINWEIS: In der Diskussion finden Sie Punkte, die Sie beachten und zu denen Sie den Teilnehmern Feedback geben sollten.
3. MRT-Aufnahme von oxygenierungsempfindlichen Sequenzen
- Ändern Sie drei Parameter aus der Standard-bSSFP-Sequenz auf der MRT-Konsole: Wiederholungszeit (TR) erhöhen, Echozeit erhöhen (TE), Flip-Winkel verringern (FA).
HINWEIS: Die modifizierten Werte sind abhängig von der Feldstärke des MRT-Scanners (Tabelle 2). Eine Erhöhung von TR und TE und eine Verringerung der FA führt zu einer Erhöhung der T2*- oder Oxygenierungsempfindlichkeit der MRT-Sequenz. Diese Modifikationen führen dann zu einer Erhöhung der Bandbreite und der Basisauflösung der Sequenz. - Erstellen Sie zwei OS-Serien, eine Baseline (beschriftet: OS_base) und die kontinuierliche Erfassung, bei der das Atemmanöver ausgeführt wird (beschriftet: OS_cont_acq). Lassen Sie die Baseline-Betriebssystemsequenz unverändert. Erhöhen Sie in der kontinuierlichen Erfassung des Betriebssystems die Anzahl der wiederholten Messungen von 1 auf ~25-40 (je nach Scannertyp). Erhöhen Sie die Anzahl der Herzzyklen (Messungen), bis die Erfassungszeit ~4,5 Minuten beträgt.
HINWEIS: Es werden zwei OS-CMR-Sequenzen benötigt: OS-Baseline-Akquisition und OS-kontinuierliche Akquisition mit vasoaktiven Atemmanövern. In den folgenden Abschnitten werden diese Schritte beschrieben.
4. Basiserfassung des Betriebssystems
- Für die Schnittverschreibung planen Sie in einem endsystolischen Standbild einer Längsachsansicht (Zwei- oder Vierkammerbild). Verschreiben Sie zwei kurzachsige Schnitte - eine auf mittlerer bis basaler und die andere auf mittlerer bis apikaler ventrikulärer Ebene. In der Diskussion finden Sie Punkte, die in Bezug auf die Slice-Position zu berücksichtigen sind.
- Anpassungen der Sequenzparameter
- Passen Sie die Sequenzparameter nach Bedarf für einen bestimmten Teilnehmer an. In Tabelle 3 finden Sie Sequenzparameter, die geändert werden können und welche nicht.
- Passen Sie den durchschnittlichen Abstand zwischen den Scheiben an die Größe des Herzens des Teilnehmers an und stellen Sie sicher, dass die Scheiben richtig platziert sind.
- Passen Sie ggf. das Sichtfeld an, um Wrap-Artefakte zu vermeiden. Bemühen Sie sich, das Sichtfeld zwischen 360 mm und 400 mm zu halten.
- Shim-Lautstärke
- Stellen Sie das Shim-Volumen so ein, dass es sowohl in der Ansicht mit der langen als auch in der kurzen Achse eng um den linken Ventrikel liegt.
- Sequenz-Erfassung
- Genehmigen Sie die Sequenz und führen Sie sie während des Atemanhaltens aus. Stellen Sie sicher, dass diese Basis-OS-Sequenz ~10 s dauert, basierend auf der Herzfrequenz und dem MRT-Scanner.
- Überprüfung der Bildqualität
- Überprüfen Sie beide Schichten des erfassten Serien-Looks auf Atembewegungen, schlechte Schichtpositionen oder das Vorhandensein von Artefakten. Wiederholen Sie die Sequenz des Basisbetriebssystems, bis eine ausreichende Bildqualität erreicht ist.
- Wenn die Schichtposition zu basal oder zu apikal ist, passen Sie zur Fehlerbehebung die vorgeschriebene Schichtposition so an, dass sie näher an der mittelventrikulären Ebene liegt. Wenn ein Artefakt vorhanden ist, führen Sie die folgenden Schritte aus:
- Überprüfen Sie die Richtung der Phasencodierung.
- Vergrößern Sie das Sichtfeld.
- Passen Sie das Shim-Volumen um die linke Herzkammer herum an.
5. Kontinuierliche Erfassung des Betriebssystems mit vasoaktiven Atemmanövern
HINWEIS: Stellen Sie sicher, dass jeder Teilnehmer über die ordnungsgemäße Durchführung des Atemmanövers informiert wurde, bevor er sich im MRT-Scanner befindet (siehe Abschnitt 2).
- Planung der Reihenfolge
- Wenn möglich, kopieren Sie die Schichtposition und passen Sie das Volumen aus dem OS-Baseline-Bild an oder duplizieren Sie die Baseline-OS-Sequenz und erhöhen Sie bei wiederholten Messungen von 1 auf ~25-40 (oder fast 4,5 Minuten Aufnahmezeit).
- Überprüfen Sie die Bild- und Schichtpositionierung und dann den Aufnahmezyklus.
- Öffnen Sie, wenn möglich, das Live-Stream-Fenster.
- Schließen Sie im Kontrollraum ein Gerät mit der .mp3-Datei für Atemmanöveranweisungen an den AUX-Eingang an oder bereiten Sie es darauf vor, es über das Mikrofon zu halten, das in den MRT-Scanner projiziert wird. Alternativ können Sie den Teilnehmer manuell mit einer Stoppuhr für die Zeitmessung durch das Atemmanöver führen und mündliche Anweisungen über das an das MRT-Lautsprechersystem angeschlossene Mikrofon geben.
- Sequenz-Erfassung
- Drücken Sie gleichzeitig Play für die OS Continuous Acquisition-Sequenz auf dem MRT-Scanner und spielen Sie für die .mp3 Atemanweisungsdatei ab oder starten Sie die Stoppuhr, wenn der Teilnehmer manuell angewiesen wird.
- Wenn Sie den Teilnehmer manuell durch die Atemmanöver führen, weisen Sie ihn an, ein- und auszuatmen, dann den Atem 10 Sekunden lang anzuhalten und zu hyperventilieren, sobald er den Metronom-Piepton hört.
- Benachrichtigen Sie den Teilnehmer bei der 40-Sekunden-Marke der Hyperventilation (2:40 auf der Stoppuhr).
- Weisen Sie den Teilnehmer zum Zeitpunkt der Hyperventilation nach 55 s (2:55 auf der Stoppuhr) an, "tief einzuatmen, auszuatmen und den Atem anzuhalten".
HINWEIS: Die Bilder der freien Atmung und Hyperventilation weisen Bewegungsartefakte auf. Dies ist zu erwarten. Während des Atemanhaltens sollten jedoch keine Bewegungsartefakte auftreten. Es ist von entscheidender Bedeutung, dass die Bilder mit angehaltenem Atem nach dem Ausatmen aufgenommen werden (bequeme End-Exspirations-Position). Erst ein Atemanhalten nach dem Ausatmen führt in den ersten 30 Sekunden des anschließenden Atemanhaltens zu einem raschen Anstieg desCO2-Blutes im Blut mit der damit verbundenen Veränderung des koronaren Blutflusses und der myokardialen Oxygenierung. - Überwachen Sie die Leistung des Teilnehmers bei der beschleunigten Hyperventilation durch das Kontrollraumfenster oder die Kamera des MRT-Scanners, um eine angemessene Leistung der tiefen Atmung zu gewährleisten. Wenn ein Blasebalg verwendet wird, überwachen Sie die Amplitudenspitzen auf dem Atemgating-Viewer. Wenn die Hyperventilation nach der anfänglichen Anleitung nicht ausreichend durchgeführt wird, brechen Sie die Akquisition ab und wiederholen Sie die kontinuierliche Akquisitionssequenz des Betriebssystems.
- Achten Sie auf kleine Atemzüge, die von den Teilnehmern während des Atemanhaltens genommen werden. Überwachen Sie dazu das Verfolgen eines Beatmungsgürtels auf der MRT-Konsole oder visuell durch das Fenster/die Kamera.
- Sobald der Teilnehmer am Ende des Atemanhaltens zu atmen beginnt, beenden Sie die Erfassung.
- Fragen Sie den Teilnehmer nach Beendigung der Akquisition, ob er Nebenwirkungen bemerkt hat, und lassen Sie ihn 3 Minuten lang normal atmen.
- Fehlerbehebung: Wiederholungserfassung
- Wenn die Atemmanöver wiederholt werden müssen, wiederholen Sie die OS-Grundsequenz.
HINWEIS: Ein Zeitraum von 2-3 Minuten vor der Wiederholung der Erfassung ist erforderlich, damit die Physiologie zum Ausgangswert zurückkehren kann. Frühere Daten haben gezeigt, dass die Physiologie nach 1 Minute41 nicht zum Ausgangswert zurückkehrt. - Wenn die Bildqualität der OS-Baseline-Sequenz angemessen ist, wiederholen Sie die kontinuierliche Erfassung des OS und die Durchführung der Atemmanöver.
- Wenn die Atemmanöver wiederholt werden müssen, wiederholen Sie die OS-Grundsequenz.
6. Bildanalyse
- Importieren Sie die OS-CMR-Bilddatensätze in einen DICOM-Viewer mit Bildkonturierungsfunktionen, am besten mit Funktionen zur automatischen Analyse von Änderungen der Signalintensität, die auf die Sauerstoffversorgung empfindlich sind.
- Marker und ihre Messung
- Erfassen Sie ein Baseline-Bild während einer kurzen Baseline-Atemanhalteaufnahme, bevor Sie hyperventilieren (Ruhe). Vergleichen Sie das erste Bild des Atemanhaltens (das das Ende des "Stress"-Reizes darstellt) mit dem Ausgangsbild.
HINWEIS: Hyperventilation ist ein vasokonstriktiver Stimulus, der die myokardiale Oxygenierung reduziert (gesund: %ΔSI ≈−5 % bis −10 %13). - Erhalten Sie viele Bilder (und Herzzyklen) während des Atemanhaltens. Verwenden Sie das erste Bild des Atemanhaltens als Grundlage und vergleichen Sie alle folgenden Bilder mit diesem Bild.
HINWEIS: Atemanhalten ist ein gefäßerweiternder Reiz, der die myokardiale Sauerstoffversorgung erhöht (%ΔSI ≈ +5%-15%12,13,14,16). - Myokard-Konturen
Für die manuelle Analyse: Auswahl der Herzphase- Da das Anhalten des Atems mehr als 400 Bilder enthalten kann, analysieren Sie nur eine einzige Phase jedes Herzzyklus. Konzentrieren Sie sich daher bei der Analyse auf die endsystolischen Bilder jedes Herzzyklus.
- Identifizieren Sie die endsystolischen Bilder jedes Herzzyklus.
- Zeichne die epikardialen und endokardialen Konturen um das Myokard herum.
- Fenstern Sie das Bild, um nach Artefakten zu suchen, die entweder als dunkle (Anfälligkeit) oder helle Bereiche aufgrund eines schlechten Gating im Myokard erscheinen.
HINWEIS: Vermeiden Sie es, Pixel mit partiellen Volumeneffekten aus den links- und rechtsventrikulären Blutpools einzubeziehen. Die meisten Konturierungsfehler treten von der endokardialen Kontur auf, einschließlich Pixeln mit partiellen Volumeneffekten und daraus resultierender künstlich erhöhter Signalintensität aus dem linksventrikulären Blutpool. Um dies zu vermeiden, zeichnen Sie die endokardiale Kontur ein ganzes Pixel innerhalb des Myokards. Stellen Sie außerdem sicher, dass die Epikardialkontur ein volles Pixel innerhalb des Myokards beträgt, um Teilvolumeneffekte durch den rechtsventrikulären Blutpool, das Epikardfett oder die Luft-Lungen-Schnittstelle zu vermeiden. - Kopieren Sie die endokardialen und epikardialen Konturen aus dem ersten endsystolischen Bild des Herzzyklus und fügen Sie sie in das endsystolische Bild des nächsten Herzzyklus ein. Passen Sie die Konturen nach Bedarf an.
Für die automatisierte Analyse:
HINWEIS: Mit automatisierten Konturierungsfunktionen können auf Wunsch alle Phasen des Herzzyklus konturiert und analysiert werden. - Überprüfen Sie alle Bilder, um eine genaue Konturierung zu gewährleisten.
HINWEIS: Einige kommerziell erhältliche automatische Konturierungsfunktionen wurden mit Datensätzen trainiert, die für die volumetrische Analyse konturiert wurden. Diese Konturen sind anfällig für partielle Volumeneffekte, da sie den Blutpool und das Myokard begrenzen sollen. Die OS-CMR-Konturen müssen vollständig innerhalb des Myokards liegen.
- Erfassen Sie ein Baseline-Bild während einer kurzen Baseline-Atemanhalteaufnahme, bevor Sie hyperventilieren (Ruhe). Vergleichen Sie das erste Bild des Atemanhaltens (das das Ende des "Stress"-Reizes darstellt) mit dem Ausgangsbild.
7. Segmentierung für regionale Analysen
- Um regionale Informationen zu erhalten, identifizieren Sie den anteroseptalen und inferoseptalen Ansatz des rechten Ventrikels, um das Myokard in die Segmentierung der American Heart Association (AHA) zu unterteilen42.
8. Berechnung von B-MORE
- Drücken Sie B-MORE als prozentuale Änderung der Signalintensität vom Ausgangswert bis zur Vasodilatation aus (siehe Gleichung 1):
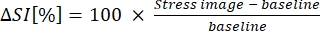 (1)
(1) - Berechnen Sie die globale B-MORE als die globale mittlere myokardiale Signalintensität der endsystolischen Bilder bei 30 s im Vergleich zu 0 s des angehaltenen Atems8 (siehe Gleichung 2):
 (2)
(2)
Ergebnisse
Dolmetschen von B-MORE
In zuvor veröffentlichten Studien, in denen OS-CMR mit vasoaktiven Atemmanövern verwendet wurde, wurde die globale oder regionale B-MORE berechnet, indem das erste endsystolische Bild des Atemanhaltens mit dem endsystolischen Bild verglichen wurde, das 15 s, 30 s, 45 s usw. des angehaltenen Atems am nächsten kam. Die endsystolische Phase des Herzzyklus wurde aus mehreren Gründen gewählt. Das endsystolische Bild ist die konsistenteste Phase, die unter und zwischen den Lesern...
Diskussion
Die Hinzufügung einer OS-CMR-Erfassung mit standardisierten, vasoaktiven Atemmanövern zu einem bereits etablierten Forschungs- oder klinischen MRT-Protokoll verlängert den gesamten Scan nur um wenig Zeit. Mit dieser kurzen Ergänzung können Informationen über die zugrundeliegende makro- und mikrovaskuläre Funktion gewonnen werden (Abbildung 2). Eine wichtige Folge der endothelialen Dysfunktion ist die Unfähigkeit des Gefäßsystems, auf physiologische Reize zu reagieren, wie sie zunä...
Offenlegungen
MGF ist als Inhaber des US-Patents Nr. 14/419,877 aufgeführt: Induktion und Messung von Veränderungen der myokardialen Oxygenierung als Marker für Herzerkrankungen; US-Patent Nr. 15/483,712: Messung von Veränderungen der Sauerstoffversorgung im Gewebe als Marker für die Gefäßfunktion; US-Patent Nr. 10,653,394: Messung von Veränderungen der Sauerstoffversorgung im Gewebe als Marker für die Gefäßfunktion - Fortsetzung; und kanadisches Patent CA2020/051776: Verfahren und Vorrichtung zur Bestimmung von Biomarkern der Gefäßfunktion unter Verwendung von fettgedruckten CMR-Bildern. EH ist als Inhaber des Internationalen Patents CA2020/051776 aufgeführt: Verfahren und Vorrichtung zur Bestimmung von Biomarkern der Gefäßfunktion unter Verwendung von fettgedruckten CMR-Bildern.
Danksagungen
Diese Arbeit und die Überprüfung der Methodik wurden durch das gesamte Team der Courtois CMR Research Group am McGill University Health Centre ermöglicht. Besonderer Dank gilt unseren MRT-Technologinnen Maggie Leo und Sylvie Gelineau für das Scannen unserer Teilnehmer und das Feedback zu diesem Manuskript.
Materialien
| Name | Company | Catalog Number | Comments |
| balanced SSFP MRI sequence | Any | To modify to create the OS-CMR sequence | |
| DICOM/ Imaging Viewer | Any | Best if the viewer has the ability for quantitative measurements (i.e., Area19 prototype software) | |
| Magnetic Resonance Imaging scanner | Any | 3 Tesla or 1.5 Tesla | |
| Metronome | Any | Set to 30 breaths per minute. To use if manually communicating breathing maneuver instructions to participants. | |
| Speaker system | Any | To communicate breathing maneuver instrucitons to participants through | |
| Stopwatch | Any | To use if manually communicating breathing maneuver instructions to participants |
Referenzen
- Ogawa, S., Lee, T. M., Kay, A. R., Tank, D. W. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proceedings of the National Academy of Sciences of the United States of America. 87 (24), 9868-9872 (1990).
- Friedrich, M. G., Karamitsos, T. D. Oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15, 43 (2013).
- Guensch, D. P., et al. The blood oxygen level dependent (BOLD) effect of in-vitro myoglobin and hemoglobin. Scientific Reports. 11 (1), 11464 (2021).
- Guensch, D. P., et al. Breathing manoeuvre-dependent changes in myocardial oxygenation in healthy humans. European Heart Journal - Cardiovascular Imaging. 15 (4), 409-414 (2014).
- Fischer, K., Guensch, D. P., Shie, N., Lebel, J., Friedrich, M. G. Breathing maneuvers as a vasoactive stimulus for detecting inducible myocardial ischemia - An experimental cardiovascular magnetic resonance study. PloS One. 11 (10), 0164524 (2016).
- Friedrich, M. G. Tracking myocardial oxygenation over a breath hold with blood oxygen level−dependent MRI: A radically different approach to study ischemia. Radiology. 294 (3), 546-547 (2020).
- Teixeira, T., Nadeshalingam, G., Fischer, K., Marcotte, F., Friedrich, M. G. Breathing maneuvers as a coronary vasodilator for myocardial perfusion imaging. Journal of Magnetic Resonance Imaging. 44 (4), 947-955 (2016).
- Fischer, K., Guensch, D. P., Friedrich, M. G. Response of myocardial oxygenation to breathing manoeuvres and adenosine infusion. European Heart Journal Cardiovascular Imaging. 16 (4), 395-401 (2015).
- Ong, P., Athanasiadis, A., Sechtem, U. Intracoronary acetylcholine provocation testing for assessment of coronary vasomotor disorders. Journal of Visualized Experiments. (114), e54295 (2016).
- Voigtländer, T., et al. The adverse events and hemodynamic effects of adenosine-based cardiac MRI. Korean Journal of Radiology. 12 (4), 424-430 (2011).
- Tsang, K. H., Chan, W. S. W., Shiu, C. K., Chan, M. K. The safety and tolerability of adenosine as a pharmacological stressor in stress perfusion cardiac magnetic resonance imaging in the Chinese population. Hong Kong Medical Journal. 21 (6), 524-527 (2015).
- Roubille, F., Fischer, K., Guensch, D. P., Tardif, J. -. C., Friedrich, M. G. Impact of hyperventilation and apnea on myocardial oxygenation in patients with obstructive sleep apnea - An oxygenation-sensitive CMR study. Journal of Cardiology. 69 (2), 489-494 (2017).
- Fischer, K., et al. Feasibility of cardiovascular magnetic resonance to detect oxygenation deficits in patients with multi-vessel coronary artery disease triggered by breathing maneuvers. Journal of Cardiovascular Magnetic Resonance. 20 (1), 31 (2018).
- Iannino, N., et al. Myocardial vascular function assessed by dynamic oxygenation-sensitive cardiac magnetic resonance imaging long-term following cardiac transplantation. Transplantation. 105 (6), 1347-1355 (2021).
- Elharram, M., et al. Regional heterogeneity in the coronary vascular response in women with chest pain and nonobstructive coronary artery disease. Circulation. 143 (7), 764-766 (2021).
- Fischer, K., et al. Insights into myocardial oxygenation and cardiovascular magnetic resonance tissue biomarkers in heart failure with preserved ejection fraction. Circulation: Heart Failure. 15 (4), 008903 (2022).
- Li, D., Dhawale, P., Rubin, P. J., Haacke, E. M., Gropler, R. J. Myocardial signal response to dipyridamole and dobutamine: demonstration of the BOLD effect using a double-echo gradient-echo sequence. Magnetic Resonance in Medicine. 36 (1), 16-20 (1996).
- Arnold, J. R., et al. Myocardial oxygenation in coronary artery disease: insights from blood oxygen level-dependent magnetic resonance imaging at 3 tesla. Journal of the American College of Cardiology. 59 (22), 1954-1964 (2012).
- Karamitsos, T. D., et al. Relationship between regional myocardial oxygenation and perfusion in patients with coronary artery disease: Insights from cardiovascular magnetic resonance and positron emission tomography. Circulation: Cardiovascular Imaging. 3 (1), 32-40 (2010).
- Friedrich, M. G., Niendorf, T., Schulz-Menger, J., Gross, C. M., Dietz, R. Blood oxygen level-dependent magnetic resonance imaging in patients with stress-induced angina. Circulation. 108 (18), 2219-2223 (2003).
- Cai, H., Harrison, D. G. Endothelial dysfunction in cardiovascular diseases: The role of oxidant stress. Circulation Research. 87 (10), 840-844 (2000).
- Kothawade, K., Bairey Merz, C. N. Microvascular coronary dysfunction in women: Pathophysiology, diagnosis, and management. Current Problems in Cardiology. 36 (8), 291-318 (2011).
- Gimbrone, M. A., García-Cardeña, G. Endothelial cell dysfunction and the pathobiology of atherosclerosis. Circulation Research. 118 (4), 620-636 (2016).
- Vancheri, F., Longo, G., Vancheri, S., Henein, M. Coronary microvascular dysfunction. Journal of Clinical Medicine. 9 (9), 2880 (2020).
- Camici, P. G., Crea, F. Coronary microvascular dysfunction. The New England Journal of Medicine. 356 (8), 830-840 (2007).
- Ford, T. J., et al. Assessment of vascular dysfunction in patients without obstructive coronary artery disease: Why, how, and when. JACC: Cardiovascular Interventions. 13 (16), 1847-1864 (2020).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Budhiraja, R., Parthasarathy, S., Quan, S. F. Endothelial dysfunction in obstructive sleep apnea. Journal of Clinical Sleep Medicine. 3 (4), 409-415 (2007).
- Sena, C. M., Pereira, A. M., Seiça, R. Endothelial dysfunction - A major mediator of diabetic vascular disease. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1832 (12), 2216-2231 (2013).
- Vanhoutte, P. M., Shimokawa, H., Feletou, M., Tang, E. H. C. Endothelial dysfunction and vascular disease - A 30th anniversary update. Acta Physiologica. 219 (1), 22-96 (2017).
- Juni, R. P., Duckers, H. J., Vanhoutte, P. M., Virmani, R., Moens, A. L. Oxidative stress and pathological changes after coronary artery interventions. Journal of the American College of Cardiology. 61 (14), 1471-1481 (2013).
- Simsek, E. C., et al. Endothelial dysfunction in patients with myocardial ischemia or infarction and nonobstructive coronary arteries. Journal of Clinical Ultrasound. 49 (4), 334-340 (2021).
- Stillman, A. E., et al. Imaging the myocardial ischemic cascade. The International Journal of Cardiovascular Imaging. 34 (8), 1249-1263 (2018).
- Fischer, D., et al. Endothelial dysfunction in patients with chronic heart failure is independently associated with increased incidence of hospitalization, cardiac transplantation, or death. European Heart Journal. 26 (1), 65-69 (2005).
- Hurst, T., Olson, T. H., Olson, L. E., Appleton, C. P. Cardiac syndrome X and endothelial dysfunction: New concepts in prognosis and treatment. The American Journal of Medicine. 119 (7), 560-566 (2006).
- Bauer, W. R., et al. Theory of the BOLD effect in the capillary region: An analytical approach for the determination of T*2 in the capillary network of myocardium. Magnetic Resonance in Medicine. 41 (1), 51-62 (1999).
- Manka, R., et al. BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia. Journal of Cardiovascular Magnetic Resonance. 12 (1), 54 (2010).
- Dharmakumar, R., Qi, X., Hong, J., Wright, G. A. Detecting microcirculatory changes in blood oxygen state with steady-state free precession imaging. Magnetic Resonance in Medicine. 55 (6), 1372-1380 (2006).
- Kramer, C. M., et al. Standardized cardiovascular magnetic resonance imaging (CMR) protocols: 2020 update. Journal of Cardiovascular Magnetic Resonance. 22 (1), 17 (2020).
- Expert Panel on MR Safety et al. ACR guidance document on MR safe practices: 2013. Journal of Magnetic Resonance Imaging: JMRI. 37 (3), 501-530 (2013).
- Macey, P. M., Kumar, R., Ogren, J. A., Woo, M. A., Harper, R. M. Global brain blood-oxygen level responses to autonomic challenges in obstructive sleep apnea. PLoS One. 9 (8), 105261 (2014).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. Circulation. 105 (4), 539-542 (2002).
- Hayoz, D., et al. Flow-mediated arterial dilation is abnormal in congestive heart failure. Circulation. 87 (6), 92-96 (1993).
- Hillier, E., Friedrich, M. G. The potential of oxygenation-sensitive CMR in heart failure. Current Heart Failure Reports. 18 (5), 304-314 (2021).
- Hawkins, S. M., et al. Hyperventilation-induced heart rate response as a potential marker for cardiovascular disease. Scientific Reports. 9 (1), 17887 (2019).
- Dass, S., et al. No evidence of myocardial oxygen deprivation in nonischemic heart failure. Circulation: Heart Failure. 8 (6), 1088-1093 (2015).
- Endemann, D. H., Schiffrin, E. L. Endothelial dysfunction. Journal of the American Society of Nephrology. 15 (8), 1983-1992 (2004).
- Costanzo, M. R., et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. The Journal of Heart and Lung Transplantation. 29 (8), 914-956 (2010).
- Lanza, G. A. Cardiac syndrome X: A critical overview and future perspectives. Heart. 93 (2), 159-166 (2007).
- Gould, K. L., Johnson, N. P. Coronary physiology beyond coronary flow reserve in microvascular angina: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2642-2662 (2018).
- Guensch, D. P., Nadeshalingam, G., Fischer, K., Stalder, A. F., Friedrich, M. G. The impact of hematocrit on oxygenation-sensitive cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 18 (1), 42 (2016).
- Dharmakumar, R., et al. Assessment of regional myocardial oxygenation changes in the presence of coronary artery stenosis with balanced SSFP imaging at 3.0T: Theory and experimental evaluation in canines. Journal of Magnetic Resonance Imaging. 27 (5), 1037-1045 (2008).
- Hillier, E., Benovoy, M., Friedrich, M. A fully automated post-processing tool identifies a reduced global myocardial oxygenation reserve in patients with ischemia and no obstructive coronary artery stenosis when compared to patients with significant CAD. SCMR 25th Annual Scientific Sessions. , (2022).
Erratum
Formal Correction: Erratum: Oxygenation-sensitive Cardiac MRI with Vasoactive Breathing Maneuvers for the Non-invasive Assessment of Coronary Microvascular Dysfunction
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/64149
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten