A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تنقية بوليسوم من العقيدات التكافلية لفول الصويا
In This Article
Summary
يصف هذا البروتوكول طريقة لتنقية متعدد حقيقيات النواة من عقيدات فول الصويا السليمة. بعد التسلسل ، يمكن استخدام خطوط الأنابيب القياسية لتحليل التعبير الجيني لتحديد الجينات المعبر عنها بشكل تفاضلي على مستويات النسخ و translatome.
Abstract
الهدف من هذا البروتوكول هو توفير استراتيجية لدراسة ترانسلاتوم حقيقيات النواة للعقيدات التكافلية لفول الصويا (الجلايسين ماكس). تصف هذه الورقة الطرق المحسنة لعزل البوليريبوسومات المشتقة من النباتات والحمض النووي الريبوزي المرسال المرتبط بها ليتم تحليلها باستخدام تسلسل الحمض النووي الريبي. أولا ، يتم الحصول على التحلل السيتوبلازمي من خلال التجانس في ظروف الحفاظ على الحمض النووي الريبي والحمض النووي الريبي من عقيدات فول الصويا الكاملة المجمدة. بعد ذلك ، يتم مسح الليزات عن طريق الطرد المركزي منخفض السرعة ، ويتم استخدام 15٪ من المادة الفائقة لعزل الحمض النووي الريبي الكلي (TOTAL). يتم استخدام المحللات المتبقية التي تم تطهيرها لعزل البوليسومات عن طريق الطرد المركزي الفائق من خلال وسادة السكروز المكونة من طبقتين (12٪ و 33.5٪). يتم تنقية الحمض النووي الريبوزي المرسال المرتبط بالبوليسومات (PAR) من الكريات متعددة الصبغيات بعد إعادة التعليق. يتم تقييم كل من TOTAL و PAR بواسطة الرحلان الكهربائي الشعري عالي الحساسية لتلبية معايير الجودة لمكتبات التسلسل ل RNA-seq. كمثال على تطبيق المصب ، بعد التسلسل ، يمكن استخدام خطوط الأنابيب القياسية لتحليل التعبير الجيني للحصول على جينات معبر عنها بشكل تفاضلي على مستويات النسخ و translatome. باختصار ، تسمح هذه الطريقة ، بالاقتران مع RNA-seq ، بدراسة التنظيم الانتقالي للحمض النووي الريبي المرسال حقيقيات النواة في نسيج معقد مثل العقيدات التكافلية.
Introduction
يمكن للنباتات البقولية ، مثل فول الصويا (Glycine max) ، أن تنشئ تكافلا مع بكتيريا تربة محددة تسمى ريزوبيا. هذه العلاقة المتبادلة تثير تشكيل أعضاء جديدة ، العقيدات التكافلية ، على جذور النباتات. العقيدات هي الأعضاء النباتية التي تستضيف البكتيريا وتتكون من خلايا مضيفة يستعمر السيتوبلازم الخاص بها مع شكل متخصص من الجذور يسمى البكتيريا. تحفز هذه البكتيريا على تقليل النيتروجين الجوي (N 2) إلى الأمونيا ، والتي يتم نقلها إلى النبات مقابل الكربوهيدرات 1,2.
على الرغم من أن هذا التكافل المثبت للنيتروجين هو واحد من أكثر التكافل بين النبات والميكروبات دراسة جيدة ، إلا أنه لا يزال يتعين فهم العديد من الجوانب بشكل أفضل ، مثل كيفية قيام النباتات المعرضة لظروف الإجهاد اللاأحيائي المختلفة بتعديل تفاعلها مع شريكها التكافلي وكيف يؤثر ذلك على استقلاب العقيدات. ويمكن فهم هذه العمليات بشكل أفضل من خلال تحليل ترانسلاتوم العقيدات (أي المجموعة الفرعية من الحمض النووي الريبي المرسال [mRNAs] التي تترجم بنشاط). البولي ريبوسومات أو البوليسومات هي مجمعات من الريبوسومات المتعددة المرتبطة بالحمض النووي الريبوزي المرسال ، وتستخدم عادة لدراسة الترجمة3. تتكون طريقة التنميط المتعدد من تحليل الحمض النووي الريبوزي المرسال المرتبط ب polysomes وقد تم استخدامه بنجاح لدراسة آليات ما بعد النسخ التي تتحكم في التعبير الجيني الذي يحدث في العمليات البيولوجية المتنوعة 4,5.
تاريخيا ، ركز تحليل التعبير الجيني في المقام الأول على تحديد وفرة الحمض النووي الريبوزي المرسال6،7،8،9. ومع ذلك ، هناك نقص في العلاقة بين مستويات النسخ والبروتين بسبب المراحل المختلفة لتنظيم ما بعد النسخ للتعبير الجيني ، وخاصة الترجمة 10،11،12. علاوة على ذلك ، لم يلاحظ أي اعتماد بين التغييرات على مستوى النسخ وتلك التي تحدث على مستوى translatome13. يسمح التحليل المباشر لمجموعة الحمض النووي الريبوزي المرسال التي يتم ترجمتها بقياس أكثر دقة واكتمالا للتعبير الجيني للخلية (الذي تكون نقطة نهايته وفرة البروتين) من ذلك الذي تم الحصول عليه عندما يتم تحليل مستويات الحمض النووي الريبوزي المرسال فقط14،15،16.
يصف هذا البروتوكول كيفية تنقية البوليسومات المشتقة من النباتات من عقيدات فول الصويا السليمة عن طريق الطرد المركزي التفاضلي من خلال وسادة السكروز المكونة من طبقتين (الشكل 1). ومع ذلك ، نظرا لأن الريبوسومات المشتقة من البكتيريا موجودة أيضا في العقيدات ، يتم تنقية مزيج من أنواع الريبوسومات والحمض النووي الريبي ، على الرغم من أن الأنواع حقيقية النواة تمثل الجزء الرئيسي (90٪ -95٪). كما يتم وصف عزل الحمض النووي الريبي اللاحق ، والقياس الكمي ، ومراقبة الجودة (الشكل 1). يجب أن يوفر هذا البروتوكول ، بالاقتران مع RNA-seq ، نتائج تجريبية حول التنظيم الانتقالي للحمض النووي الريبي المرسال حقيقيات النواة في نسيج معقد مثل العقيدات التكافلية.
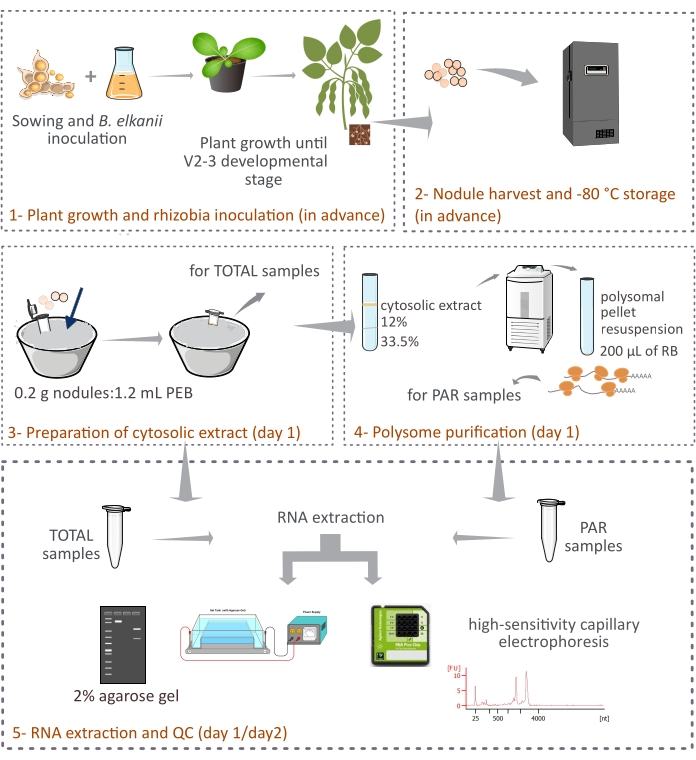
الشكل 1: نظرة عامة تخطيطية على المنهجية المقترحة لتنقية تنقية الصبغات متعددة حقيقيات النواة من العقيدات التكافلية. يقدم المخطط لمحة عامة عن الخطوات المتبعة في البروتوكول من (1) نمو النبات و (2) حصاد العقيدات إلى (3) إعداد المستخلصات الخلوية ، (3) الحصول على عينات TOTAL و (4) عينات PAR ، و (5) استخراج الحمض النووي الريبي ومراقبة الجودة. الاختصارات: PEB = مخزن مؤقت لاستخراج polysome ؛ RB = المخزن المؤقت لإعادة التعليق; المجموع = إجمالي الحمض النووي الريبي. PAR = الحمض النووي الريبوزي المرسال المرتبط بالبوليسومات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. نمو النبات وتلقيح الجذور
- لتوليد العقيدات المطلوبة ، زرع بذور فول الصويا المفضلة في الركيزة المختارة في غرفة النمو في ظل ظروف خاضعة للرقابة.
ملاحظة: في هذا البروتوكول ، زرعت البذور في زجاجة بلاستيكية سعة 0.5 لتر مملوءة بمزيج من الرمل: الفيرميكوليت (1: 1). تم ضبط غرفة النمو مع درجة حرارة دورة النهار / الليل من 28 درجة مئوية / 20 درجة مئوية ، على التوالي ، وفترة ضوئية للضوء / الظلام من 16 ساعة / 8 ساعات ، على التوالي. كانت شدة الإشعاع النشطة ضوئيا 620 ميكرومول·m−2·s−1. - تحضير مسبق للخميرة السائلة - استخراج مانيتول (YEM) - متوسطة (انظر جدول المواد). الأوتوكلاف الوسط.
- في نفس اليوم من بذر البذور ، قم بتلقيح قارورة واحدة تحتوي على 100 مل من YEM مع سلالة Bradyrhizobium elkanii U1302. احتضن القارورة عند 28 درجة مئوية على شاكر مداري عند 100 دورة في الدقيقة.
- دع الريزوبيا تنمو لمدة يومين وقم بتلقيح الشتلات ب 2 مل من الثقافة.
2. معالجة العجز المائي (اختياري)
ملاحظة: يحدد هذا البروتوكول معالجة العجز المائي لنباتات فول الصويا. يمكن تغيير هذا الجزء أو حذفه بالكامل اعتمادا على السؤال التجريبي المطروح.
- تنمو شتلات فول الصويا لمدة 19 يوما (مرحلة تطور V2-3) دون قيود على الماء. حافظ على الركيزة في السعة الميدانية مع B&D-medium17 مع 0.5 mM KNO3.
- في اليوم 20 ، اسحب الري.
ملاحظة: هنا، تم قياس محتوى المياه يوميا عن طريق قياس الجاذبية (محتوى الجاذبية المائية) خلال فترات النمو والعجز المائي. - قم بقياس التوصيل الفموي في ثلاثة أضعاف يوميا على سطح الورقة المحورية باستخدام مقياس المسامير ، وفقا لتعليمات الشركة المصنعة (انظر جدول المواد) ، من اليوم 20 حتى نهاية فترة العجز المائي.
ملاحظة: تم تحديد نهاية فترة العجز المائي بشكل فردي لكل مصنع عندما كانت قيمة التوصيل الفموي حوالي 50٪ من تلك التي تم الحصول عليها في اليوم 20 من البذر.
3. حصاد العقيدات
- جمع النيتروجين السائل في وعاء نظيف ووضع ملصقات 15 مل أنابيب (واحد لكل نبات).
تنبيه: تعامل مع النيتروجين السائل مرتديا قفازات التبريد ودروع الوجه ونظارات السلامة. - استرجع كل نبات على حدة. قطع وتجاهل الجزء الهوائي. اغسل الجذر جيدا بالماء لإزالة أي ركيزة متبقية.
- افصل كل عقيدة عن الجذر واجمعها في أنبوب 15 مل مبرد مسبقا. قم بتجميد الأنابيب وتخزينها عند -80 درجة مئوية.
4. إعداد مقتطفات cytosolic
ملاحظة: الهدف النهائي من هذا البروتوكول هو الحصول على الحمض النووي الريبي الكلي عالي الجودة (TOTAL) والحمض النووي الريبي المرتبط بالبوليسومات (PAR). لذلك ، اعمل في ظل ظروف تمنع تحلل الحمض النووي الريبي ، مع الحفاظ دائما على العينات عند 4 درجات مئوية واستخدام معدات وحلول مختبرية خالية من RNase. ما لم يتم تحديده ، يتم إعداد جميع الحلول بمياه فائقة النقاء معقمة.
- إعداد حلول المخزون العازل
- قم بإعداد حلول المخزون القابلة للتعقيم المدرجة في الجدول 1 ، وأوتوكلافها لمدة 15 دقيقة ، واحتفظ بها في RT.
- قم بإعداد حلول المخزون القابلة للتعقيم بالترشيح المدرجة في الجدول 1 ، وقم بتصفيتها وتعقيمها ، واحتفظ بها عند -20 درجة مئوية.
- قم بإعداد مخزن مؤقت لاستخراج البوليسوم (PEB ، انظر الجدول 1) واحتفظ به على الجليد.
ملاحظة: المجلدات المقدمة هي لست عينات. - قم بتبريد جهاز الطرد المركزي إلى 4 درجات مئوية ووضع أنابيب الطرد المركزي الدقيقة 2 مل على الجليد.
- يزن حوالي 0.2 غرام من العقيدات السليمة في طبق وزن وينقلها إلى أنبوب 2 مل مبرد مسبقا.
ملاحظة: قم بتنفيذ هذه الخطوة بسرعة لتجنب ذوبان العينات. وبدلا من ذلك، يمكن استخدام حجم العقيدات المقدر ب 0.4-0.5 مل بدلا من 0.2 غرام. - أضف 1.2 مل من PEB ، واترك العينة تذوب لمدة دقيقتين ، وتجانس مع مطحنة الأنسجة حتى التعطيل الكامل والتجانس للعقيدات.
ملاحظة: تأكد من طحن العقيدات بمجرد إذابتها لأنها ستكون ناعمة بما يكفي لتعطيلها بسهولة باستخدام مطاحن الأنسجة (انظر جدول المواد) في أنابيب الطرد المركزي الدقيق. من الصعب طحن العقيدات المجمدة. أيضا ، يوصى بوضع الأنابيب في مبرد على الطاولة (0 درجة مئوية) من أجل التجانس السليم مع الحفاظ على برودة العينات. - احتضان العينات على الجليد مع إثارة لطيفة لمدة 10 دقائق أو حتى تتم معالجة جميع العينات.
- جهاز طرد مركزي على ارتفاع 16000 × غرام لمدة 15 دقيقة عند 4 درجات مئوية لتكسير الحطام. استعادة supernatant وتكرار خطوة جهاز الطرد المركزي.
- استرجع بعناية مستخلص الخلايا المصفاة وانقل أليكوت 200 ميكرولتر إلى أنبوب طرد مركزي دقيق نظيف سعة 1.5 مل للعزل الكلي (عينات توتال ؛ انظر القسم 7).
5. إعداد وسائد السكروز
ملاحظة: يستخدم هذا البروتوكول وسادة سكروز من طبقتين (12٪ و 33.5٪) في أنابيب الطرد المركزي فائقة 13.2 مل (انظر جدول المواد). يتم إعداد جميع الحلول بمياه فائقة النقاء معقمة.
- تحضير حلول السكروز والملح المخزون.
- تحضير 100 مل من محلول السكروز 2 م (68.5 ٪ ، الجدول 1).
- تحضير محلول الملح 10x (الجدول 1).
- تحضير طبقتين من وسادة السكروز كما هو موضح في الجدول 2. انظر الجدول 1 للاطلاع على تكوين محاليل مخزون المضادات الحيوية (CHX وCHL).
ملاحظة: الأحجام المقدمة هي لست وسائد. - صب 4.5 مل من طبقة السكروز 33.5٪ في أنابيب الطرد المركزي. ثم ، أضف 4.5 مل من طبقة 12٪ بعناية وببطء باستخدام ماصة دقيقة P1000. ضع الأنابيب على الجليد حتى إضافة مستخلص الخلايا المصفية.
6. تنقية بوليسوم
- قم بتحميل 1 مل من المستخلص الخلوي المصفى (الخطوة 4.8) أعلى وسادة السكروز عن طريق السحب بعناية على الجدار الجانبي للأنبوب.
- انقل أنابيب أجهزة الطرد المركزي الفائقة إلى جرافات مبردة مسبقا وأجهزة طرد مركزي عند 217,874 × جم (35,000 دورة في الدقيقة في الدوار المشار إليه [انظر جدول المواد]) لمدة 2 ساعة عند 4 درجات مئوية.
- تخلص من المستخلص الخلوي المتبقي ووسادة السكروز ، وأعد تعليق الكريات متعددة الصبغيات مع 200 ميكرولتر من RB المبرد مسبقا (تم إعداده مسبقا وفقا للجدول 1).
- احتضن لمدة 30 دقيقة على الثلج ثم انقل إعادة التعليق المتعدد الصبغيات إلى أنابيب مبردة مسبقا سعة 1.5 مل. تابع استخراج الحمض النووي الريبي (عينات PAR).
7. استخراج الحمض النووي الريبي ومراقبة الجودة
ملاحظة: يتم تنفيذ هذه الخطوة ل TOTAL (الخطوة 4.8) وعينات PAR (الخطوة 6.4).
- تحضير 75٪ EtOH بالماء فائق النقاء المعقم وتبريده إلى -20 درجة مئوية. بالإضافة إلى ذلك ، قم بتبريد الكلوروفورم والأيزوبروبانول إلى -20 درجة مئوية.
- تجانس العينات مع 750 ميكرولتر من كاشف عزل الحمض النووي الريبي واحتضان لمدة 5 دقائق في RT.
- أضف 200 ميكرولتر من الكلوروفورم البارد وهز الأنابيب بقوة لمدة 15 ثانية. احتضان في RT لمدة 10 دقائق.
- جهاز طرد مركزي عند 12000 × جم لمدة 15 دقيقة عند 4 درجات مئوية لفصل الطور. انقل 500 ميكرولتر من الطور المائي العلوي إلى أنبوب نظيف دون إزعاج الطور العضوي الوردي ، وأضف 375 ميكرولتر من الأيزوبروبانول البارد و 0.5 ميكرولتر من الجليكوجين الخالي من RNase (انظر جدول المواد). تخلط جيدا عن طريق سحب لأعلى ولأسفل.
ملاحظة: الجليكوجين هو ناقل يستخدم كمرسب مشارك لزيادة استرداد الحمض النووي من هطول الكحول. - احتضن المزيج لمدة 10 دقائق عند 4 درجات مئوية وأجهزة الطرد المركزي عند 12000 × غرام لمدة 15 دقيقة. تخلص من السوبرناتانت.
- اغسل راسب الحمض النووي الريبي مع 1 مل من البرد 75٪ EtOH. مزيج عن طريق دوامة قصيرة.
ملاحظة: في هذه المرحلة، يمكن تخزين العينات عند -20 درجة مئوية بين عشية وضحاها. - جهاز طرد مركزي عند 7500 × جم لمدة 5 دقائق عند 4 درجات مئوية ، وإزالة supernatant بعناية باستخدام ماصة دقيقة ، وتجفيف حبيبات الحمض النووي الريبي في الهواء.
- تذوب الكريات في 50 ميكرولتر من الماء الخالي من RNase وتحضنها عند 65 درجة مئوية لمدة 5 دقائق.
- تقييم تركيز الحمض النووي الريبي وسلامته باستخدام الرحلان الكهربائي الشعري عالي الحساسية18 (انظر جدول المواد) و / أو الرحلان الكهربائي على جل أغاروز خال من RNase2٪ 19 (انظر جدول المواد).
ملاحظة: إذا لم يتم استخدام عينات الحمض النووي الريبي على الفور أو سيتم إرسالها إلى مرفق التسلسل لإعداد مكتبة RNA-seq ، فمن المستحسن استخدام EtOH لتعجيلها.
8. هطول الأمطار الحمض النووي الريبي
- قم بتبريد جهاز الطرد المركزي و EtOH إلى 4 درجات مئوية.
- تحضير 3 م من خلات الصوديوم.
- تحضير 70٪ EtOH مع الماء فائق النقاء المعقم وتبريده إلى -20 درجة مئوية.
- تقدير حجم العينة. أضف 0.1 مجلدا من 3 M من خلات الصوديوم ، و 3 أحجام من EtOH البارد ، و 0.5 ميكرولتر من الجليكوجين الخالي من RNase. اخلطي جيدا.
- اتركيه عند -20 درجة مئوية حتى الحاجة.
ملاحظة: يمكن تخزين العينات المترسبة من الحمض النووي الريبي لمدة تصل إلى 1 سنة عند -80 درجة مئوية.
9. خط أنابيب قياسي لتحليل التعبير الجيني
- قم بإجراء ما معدله 40 مليون قراءة مقترنة من Illumina ، مع طول قراءة >100 نقطة أساس ، لتحليل بيانات النسخ و translatome بثقة.
ملاحظة: يتضمن تحليل بيانات RNA-seq القياسي الخطوات التالية 9.2-9.5. - قم بإجراء فحص جودة القراءة باستخدام FastQC (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/) أو MultiQC20 متعدد العينات.
- قم بإزالة المحول والتسلسلات منخفضة الجودة باستخدام إما Trimmomatic21 أو BBDuk (http://jgi.doe.gov/data-and-tools/bb-tools/) أو cutadapt 22 أو sickle23 أو Trim Galore (https://www.bioinformatics.babraham.ac.uk/projects/trim_galore/) ، من بين أمور أخرى.
- إذا كان الجينوم المرجعي متاحا للأنواع ، فقم بإجراء خرائط قراءة مقابل المرجع ، متبوعا بقياس كمي للوفرة ، باستخدام Bowtie224 أو TopHat2 25 أو Salmon26 ، و featureCounts27 ، إلى جانب أدوات أخرى مفتوحة المصدر.
- قم بإجراء تحليل إحصائي لتحديد الجينات المعبر عنها بالتفاضلية باستخدام edgeR28 أو DESeq229 أو limma30 ، من بين أمور أخرى.
ملاحظة: يمكن استخدام هذه البرامج مفتوحة المصدر محليا، عبر سطر الأوامر. بدلا من ذلك ، يمكن تشغيلها من خلال متصفح ويب على خادم عام ، مثل Galaxy31 أو GEOexplorer32 ، والتي توفر واجهة مستخدم رسومية ، بحيث لا يلزم معرفة سطر الأوامر لاستخدامها.
النتائج
يعد تقييم كمية ونوعية كسور TOTAL و PAR التي تم تنقيتها بالإجراء المذكور أعلاه أمرا أساسيا لتحديد نجاحها ، حيث أنه بالنسبة لمعظم التطبيقات النهائية ، مثل تسلسل الحمض النووي الريبي ، تعد العينات عالية الجودة أساسية لإعداد المكتبة وتسلسلها. علاوة على ذلك ، تسمح سلامة جزيئات الحمض النووي الريبي ?...
Discussion
تعد دراسة تنظيم التعبير الجيني على المستوى الانتقالي أمرا بالغ الأهمية لفهم العمليات البيولوجية المختلفة بشكل أفضل لأن نقطة النهاية للتعبير الجيني للخلية هي وفرة البروتين13,14. يمكن تقييم ذلك من خلال تحليل translatome للنسيج أو الكائن الحي محل الاهتمام الذي يجب ?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
تم تمويل هذا البحث من قبل منحة CSIC I + D 2020 رقم 282 ، ومنحة FVF 2017 رقم 210 ، و PEDECIBA (ماريا مارثا ساينز).
Materials
| Name | Company | Catalog Number | Comments |
| Plant growth and rhizobia inoculation | |||
| Orbital shaker | Daihan Scientific | Model SHO-1D | |
| YEM-medium | Amresco | J850 (yeast extract) 0122 (mannitol) | |
| Water deficit treatment | |||
| KNO3 | Merck | 221295 | |
| Porometer | Decagon Device | Model SC-1 | |
| Scalpel | |||
| Preparation of cytosolic extracts | |||
| Brij L23 | Sigma-Aldrich | P1254 | |
| Centrifuge | Sigma | Model 2K15 | |
| Chloranphenicol | Sigma-Aldrich | C0378 | |
| Cycloheximide | Sigma-Aldrich | C7698 | |
| DOC | Sigma-Aldrich | 30970 | |
| DTT | Sigma-Aldrich | D9779 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Igepal CA 360 | Sigma-Aldrich | I8896 | |
| KCl | Merck | 1.04936 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| Plastic tissue grinder | Fisher Scientific | 12649595 | |
| PMSF | Sigma-Aldrich | P7626 | |
| PTE | Sigma-Aldrich | P2393 | |
| Tris | Invitrogen | 15504-020 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Weighing dish | Deltalab | 1911103 | |
| Preparation of sucrose cushions | |||
| Sucrose | Invitrogen | 15503022 | |
| SW 40 Ti rotor | Beckman-Coulter | ||
| Ultracentrifuge | Beckman-Coulter | Optima L-100K | |
| Ultracentrifuge tubes | Beckman-Coulter | 344059 | 13.2 mL tubes |
| RNA extraction and quality control | |||
| Agarose | Thermo scientific | R0492 | |
| Bioanalyzer | Agilent | Model 2100. Eukaryote total RNA nano assay | |
| Chloroform | DI | 41191 | |
| Ethanol | Dorwil | UN1170 | |
| Isopropanol | Mallinckrodt | 3032-06 | |
| Glycogen | Sigma | 10814-010 | |
| TRIzol LS | Ambion | 102960028 | |
| Miscellaneous | |||
| Falcon tubes 15 mL | Biologix | 10-0152 | |
| Filter tips 10 µL | BioPointe Scientific | 321-4050 | |
| Filter tips 1000 µL | BioPointe Scientific | 361-1050 | |
| Filter tips 20 µL | BioPointe Scientific | 341-4050 | |
| Filter tips 200 µL | Tarsons | 528104 | |
| Microcentrifuge tubes 1.5 mL | Tarsons | 500010-N | |
| Microcentrifuge tubes 2.0 mL | Tarsons | 500020-N | |
| Sequencing company | Macrogen | ||
| Sterile 250 mL flask | Marienfeld | 4110207 |
References
- Limpens, E., et al. Cell- and tissue-specific transcriptome analyses of Medicago truncatula root nodules. PLoS ONE. 8 (5), 64377 (2013).
- Masson-Boivin, C., Giraud, E., Perret, X., Batut, J. Establishing nitrogen-fixing symbiosis with legumes: How many rhizobium recipes. Trends in Microbiology. 17 (10), 458-466 (2009).
- King, H. A., Gerber, A. P. Translatome profiling: Methods for genome-scale analysis of mRNA translation. Briefings in Functional Genomics. 15 (1), 22-31 (2014).
- Chassé, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), 15 (2017).
- Yángüez, E., Castro-Sanz, A. B., Fernández-Bautista, N., Oliveros, J. C., Castellano, M. M. Analysis of genome-wide changes in the translatome of Arabidopsis seedlings subjected to heat stress. PloS ONE. 8 (8), 71425 (2013).
- Brown, P. O., Botstein, D. Exploring the new world of the genome with DNA microarrays. Nature Genetics. 21, 33-37 (1999).
- Krishnamurthy, A., Ferl, R. J., Paul, A. -. L. Comparing RNA-Seq and microarray gene expression data in two zones of the Arabidopsis root apex relevant to spaceflight. Applications in Plant Sciences. 6 (11), 1197 (2018).
- Shulse, C. N., et al. High-throughput single-cell transcriptome profiling of plant cell types. Cell Reports. 27 (7), 2241-2247 (2019).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: A revolutionary tool for transcriptomics. Nature Reviews Genetics. 10 (1), 57-63 (2009).
- Kawaguchi, R., Girke, T., Bray, E. A., Bailey-Serres, J. Differential mRNA translation contributes to gene regulation under non-stress and dehydration stress conditions in Arabidopsis thaliana. The Plant Journal. 38 (5), 823-839 (2004).
- Larsson, O., Tian, B., Sonenberg, N. Toward a genome-wide landscape of translational control. Cold Spring Harbor Perspectives in Biology. 5 (1), 012302 (2013).
- Vogel, C., Marcotte, E. M. Insights into regulation of protein abundance from proteomics and transcriptomis analyses. Nature Reviews Genetics. 13 (4), 227-232 (2013).
- Tebaldi, T., et al. Widespread uncoupling between transcriptome and translatome variations after a stimulus in mammalian cells. BMC Genomics. 13 (220), 1-15 (2012).
- Wang, T., et al. Translating mRNAs strongly correlate to proteins in a multivariate manner and their translation ratios are phenotype specific. Nucleic Acids Research. 41 (9), 4743-4754 (2013).
- Ingolia, N. T. Ribosome profiling: New views of translation, from single codons to genome scale. Nature Reviews Genetics. 15 (3), 205-213 (2014).
- Lukoszek, R., Feist, P., Ignatova, Z. Insights into the adaptive response of Arabidopsis thaliana to prolonged thermal stress by ribosomal profiling and RNA-Seq. BMC Plant Biology. 16 (1), 1-13 (2016).
- Broughton, W. J., Dilworth, M. J. Control of leghaemoglobin synthesis in snake beans. Biochemical Journal. 125 (4), 1075-1080 (1971).
- Schroeder, A., et al. The RIN: An RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 1-14 (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing agarose gel electrophoresis of RNA nondenaturing agarose gel electrophoresis of RNA. Cold Spring Harbor Protocols. 2010 (6), 1-3 (2012).
- Ewels, P., Magnusson, M., Lundin, S., Käller, M. MultiQC: Summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 32 (19), 3047-3048 (2016).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: A flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Marcel, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet.journal. 17 (1), 10-12 (2011).
- . Sickle: A sliding-window, adaptive, quality-based trimming tool for FastQ files (Version 1.33) Available from: https://github.com/najoshi/sickle (2011)
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357-359 (2012).
- Kim, D., et al. TopHat2: Accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions. Genome Biology. 14 (4), 1-13 (2013).
- Patro, R., Duggal, G., Love, M. I., Irizarry, R. A., Kingsford, C. Salmon provides fast and bias-aware quantification of transcript expression. Nature Methods. 14 (4), 417-419 (2017).
- Liao, Y., Smyth, G. K., Shi, W. featureCounts: An efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics. 30 (7), 923-930 (2013).
- Robinson, M. D., McCarthy, D. J., Smyth, G. K. edgeR: A Bioconductor package for differential expression analysis of digital gene expression data. Bioinformatics. 26 (1), 139-140 (2010).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15 (550), 1-21 (2014).
- Ritchie, M. E., et al. limma powers differential expression analyses for RNA-sequencing and microarray studies. Nucleic Acids Research. 43 (7), 47 (2015).
- Afgan, E., et al. The Galaxy platform for accessible, reproducible and collaborative biomedical analyses: 2018 update. Nucleic Acids Research. 46, 537-544 (2018).
- Hunt, G. P., et al. GEOexplorer: A webserver for gene expression analysis and visualisation. Nucleic Acids Research. , (2022).
- Imbeaud, S., et al. Towards standardization of RNA quality assessment using user-independent classifiers of microcapillary electrophoresis traces. Nucleic Acids Research. 33 (6), 1-12 (2005).
- Di Paolo, A., et al. PDCD4 regulates axonal growth by translational repression of neurite growth-related genes and is modulated during nerve injury responses. RNA. 26 (11), 1637-1653 (2020).
- Smircich, P., et al. Ribosome profiling reveals translation control as a key mechanism generating differential gene expression in Trypanosoma cruzi. BMC Genomics. 16 (1), 443 (2015).
- Eastman, G., Sharlow, E. R., Lazo, J. S., Bloom, G. S., Sotelo-Silveira, J. R. Transcriptome and translatome regulation of pathogenesis in Alzheimer's disease model mice. Journal of Alzheimer's Disease. 86 (1), 365-386 (2022).
- Zanetti, M. E., Chang, I. -. F., Gong, F., Galbraith, D. W., Bailey-Serres, J. Immunopurification of polyribosomal complexes of Arabidopsis for global analysis of gene expression. Plant physiology. 138 (2), 624-635 (2005).
- Mustroph, A., et al. Profiling translatomes of discrete cell populations resolves altered cellular priorities during hypoxia in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18843-11848 (2009).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324 (5924), 218-223 (2009).
- Brar, G. A., Weissman, J. S. Ribosome profiling reveals the what, when, where and how of protein synthesis. Nature Reviews. Molecular Cell Biology. 16 (11), 651-664 (2015).
- Eastman, G., Smircich, P., Sotelo-Silveira, J. R. Following ribosome footprints to understand translation at a genome wide level. Computational and Structural Biotechnology Journal. 16, 167-176 (2018).
- Westermann, A. J., Gorski, S. A., Vogel, J. Dual RNA-seq of pathogen and host. Nature Reviews Microbiology. 10 (9), 618-630 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved