A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد النشاط المضاد للفطريات للببتيدات ضد المبيضات البيض
In This Article
Summary
يصف هذا البروتوكول طريقة للحصول على بيانات كمية عن النشاط المضاد للفطريات للببتيدات والمركبات الأخرى ، مثل العوامل المضادة للفطريات ذات الجزيئات الصغيرة ، ضد المبيضات البيض. إن استخدامه للكثافة الضوئية بدلا من حساب وحدات تشكيل المستعمرات لتحديد تثبيط النمو يوفر الوقت والموارد.
Abstract
الطرق التقليدية لإجراء اختبار الحساسية المضادة للفطريات للمبيضات البيض تستغرق وقتا طويلا وتفتقر إلى النتائج الكمية. على سبيل المثال ، يعتمد النهج الشائع على طلاء الخلايا المعالجة بتركيزات مختلفة من الجزيئات المضادة للفطريات على ألواح الآجار ثم عد المستعمرات لتحديد العلاقة بين تركيز الجزيء وتثبيط النمو. تتطلب هذه الطريقة العديد من اللوحات ووقتا طويلا لحساب المستعمرات. نهج شائع آخر يلغي لوحات وعد المستعمرات عن طريق الفحص البصري للثقافات المعالجة بالعوامل المضادة للفطريات لتحديد الحد الأدنى من التركيز المطلوب لمنع النمو ؛ ومع ذلك ، فإن الفحص البصري ينتج عنه نتائج نوعية فقط ، وتضيع المعلومات المتعلقة بالنمو عند تركيزات دون مثبطة. يصف هذا البروتوكول طريقة لقياس حساسية C. albicans للببتيدات المضادة للفطريات. من خلال الاعتماد على قياسات الكثافة الضوئية للمزارع ، تقلل الطريقة من الوقت والمواد اللازمة للحصول على نتائج كمية حول نمو الثقافة بتركيزات مختلفة من الببتيد. يتم إجراء حضانة الفطريات بالببتيدات في صفيحة 96 بئرا باستخدام مخزن مؤقت مناسب ، مع ضوابط لا تمثل أي تثبيط للنمو وتثبيط نمو كامل. بعد الحضانة مع الببتيد ، يتم تخفيف معلقات الخلايا الناتجة لتقليل نشاط الببتيد ثم تنمو بين عشية وضحاها. بعد النمو بين عشية وضحاها ، يتم قياس الكثافة البصرية لكل بئر ومقارنتها بالضوابط الإيجابية والسلبية لحساب تثبيط النمو الناتج عند كل تركيز ببتيد. النتائج باستخدام هذا الفحص قابلة للمقارنة مع النتائج باستخدام الطريقة التقليدية لطلاء الثقافات على ألواح الآجار ، لكن هذا البروتوكول يقلل من النفايات البلاستيكية والوقت المستغرق في عد المستعمرات. على الرغم من أن تطبيقات هذا البروتوكول قد ركزت على الببتيدات المضادة للفطريات ، إلا أن الطريقة ستكون قابلة للتطبيق أيضا لاختبار جزيئات أخرى ذات نشاط مضاد للفطريات معروف أو مشتبه به.
Introduction
المبيضات البيض هي عضو في الجراثيم البشرية التي تستعمر العديد من المواقع ، بما في ذلك تجويف الفم والجلد والجهاز الهضمي والمهبل1. بالنسبة للمرضى الذين يعانون من نقص المناعة بسبب أمراض مثل فيروس نقص المناعة البشرية (HIV) والعلاجات المثبطة للمناعة ، قد يؤدي استعمار C. albicans إلى داء المبيضات المحلي أو الجهازي 2,3. يمكن أن يكون استخدام العلاجات المضادة للفطريات ذات الجزيئات الصغيرة المتاحة حاليا ، مثل الأمفوتريسين B أو الأزول أو echinocandins ، معقدا بسبب مشاكل الذوبان والسمية ومقاومة العدوى للعلاجات 4,5. نظرا لقيود العوامل المضادة للفطريات الحالية ، يبحث الباحثون باستمرار عن جزيئات جديدة مضادة للفطريات لها نشاط ضد C. albicans.
الببتيدات المضادة للميكروبات (AMPs) هي بديل محتمل للعوامل المضادة للفطريات ذات الجزيئات الصغيرةالحالية 6،7،8 ويقترح أن تكون أقل عرضة لتطور المقاومة مقارنة بالأدوية ذات الجزيئات الصغيرة9. AMPs هي مجموعة متنوعة من الببتيدات ، لكنها غالبا ما تكون كاتيونية ، مع مجموعة واسعة من النشاط10،11،12. تشمل AMPs ذات النشاط ضد C. albicans الببتيدات المعروفة من عائلات الهيستاتين والسيكروبين 13،14،15 ، جنبا إلى جنب مع الببتيدات الموصوفة مؤخرا مثل ToAP2 و NDBP-5.7 ومتغير الهيستاتين 5 K11R-K17R16,17. نظرا لقدرتها على علاج عدوى المبيضات ، فإن تحديد وتصميم AMPs الجديدة التي تستهدف C. albicans هو هدف مهم للعديد من المجموعات البحثية.
كجزء من عملية تطوير AMPs فعالة (وغيرها من العوامل المضادة للفطريات) التي تستهدف C. albicans ، يستخدم الاختبار في المختبر بشكل شائع لتحديد الببتيدات الواعدة. عادة ما تتضمن طرق اختبار النشاط المضاد للفطريات ضد C. albicans احتضان الخلايا ذات التخفيفات التسلسلية ل AMPs (في المخزن المؤقت أو المتوسط) في 96 لوحة بئر. تتوفر عدة طرق لتقييم النشاط المضاد للفطريات بعد الحضانة. تستخدم التقنية التي وصفها معهد معايير المختبرات السريرية تقييما بصريا بحتا لتعكر الآبار لتحديد الحد الأدنى للتركيز (MIC) للتثبيط الكامل للنمو (تثبيط 50٪ على الأقل لعوامل مضادة للفطريات مختارة ، مثل الأزول و echinocandins) ولا توفر أي تقدير كمي للنمو عند تركيزات فرعية من MIC18 . هناك نهج آخر شائع الاستخدام يتضمن تحديد الصلاحية بعد الحضانة باستخدام AMPs عن طريق طلاء محتويات الآبار على ألواح الآجار ، واحتضان الألواح ، ثم حساب عدد وحدات تشكيل المستعمرات (CFUs) على اللوحة. تم استخدام هذه الطريقة لتقييم عدد من الببتيدات ، بما في ذلك الببتيدات القائمة على الهيستاتين 5 ، LL-37 ، واللاكتوفيرين البشري19،20،21. تتطلب هذه التقنية حجما كبيرا نسبيا من الآجار وعددا كبيرا من الألواح وتتضمن العد الممل لوحدات CFU على اللوحات. للحصول على مزيد من البيانات الكمية مع توليد نفايات بلاستيكية أقل وتجنب عد وحدات CFU ، يمكن استخدام محتويات الآبار لتلقيح وسط جديد في لوحة أخرى من 96 بئرا. بعد احتضان الصفيحة الملقحة حديثا ، يمكن قياس النمو عن طريق قياس الكثافة البصرية عند 600 نانومتر (OD600) على قارئ لوحة الامتصاص. تم استخدام هذه الطريقة لتحديد النشاط المضاد للفطريات للهيستاتين 5 وشظايا تحلله والببتيدات المخترقة للخلايا17،22،23،24،25.
يصف هذا البروتوكول كيفية اختبار النشاط المضاد للفطريات للببتيدات ويستخدم طريقة OD600 لتحديد الانخفاض في صلاحية C. albicans بسبب الببتيدات.
Protocol
تم الحصول على الموافقة من جامعة ميريلاند ، كوليدج بارك ، اللجنة المؤسسية للسلامة الأحيائية (IBC) للعمل مع C. albicans في هذا البروتوكول (PN 274). تم استخدام سلالة C. albicans SC5314 (انظر جدول المواد) في هذه الدراسة. ومع ذلك ، يمكن أيضا استخدام أي سلالة أخرى.
1. تحضير المحلول والماء المعقم ووسط الاستزراع
- تحضير محلول فوسفات الصوديوم المعقم 0.1 M (NaPB)26 عند الرقم الهيدروجيني 7.4 ، وتخفيفه إلى 2 mM و 1 mM بالماء المعقم. وسيكون تحضير 100 مل لكل من 2 ملليمتر من ثنائي الفينيل متعدد البروم و1 ملليمتر من البروم ثنائي الفينيل أكثر من كاف لمعظم تطبيقات هذا البروتوكول.
- تحضير الخميرة السائلة المعقمة - الببتون - سكر العنب (YPD ، انظر جدول المواد) متوسطة (10 جم / لتر من خلاصة الخميرة ، 20 جم / لتر سكر العنب ، 20 جم / لتر من الببتون). سيكون تحضير 100 مل من YPD أكثر من كاف لمعظم تطبيقات هذا البروتوكول.
- تحضير المياه المعقمة عالية النقاء. سيكون تحضير 100 مل من الماء أكثر من كاف لمعظم تطبيقات هذا البروتوكول.
ملاحظة: يتم تعقيم المخازن المؤقتة والوسائط والمياه عن طريق التعقيم عند 121 درجة مئوية في دورة سائلة لفترة مناسبة بناء على الحجم في الحاويات التي يتم تعقيمها27. على سبيل المثال ، بالنسبة للزجاجات التي تحتوي على 500 مل ، يجب أن يكون وقت التعرض 40 دقيقة.
2. تلقيح وزراعة وتثاقف C. albicans
تنبيه: اتبع جميع اللوائح المؤسسية والحكومية للعمل مع C. albicans ، والتي غالبا ما تصنفها مؤسسات البحث الأكاديمي على أنها كائن حي من مستوى السلامة البيولوجية (BSL) 2 بغض النظر عن مقاومة الأدوية ومن قبل مجموعة ثقافة النوع الأمريكية (ATCC) ككائن BSL1 أو BSL2 ، اعتمادا على مقاومة الأدوية للسلالة28.
ملاحظة: قم بإجراء أجزاء التلقيح والزراعة من هذه الخطوة (الخطوات 2.1-2.2) في اليوم السابق لبدء اختبار النشاط المضاد للفطريات. إذا أمكن ، قم بتنفيذ جميع خطوات البروتوكول مع الخلايا (والحلول التي سيتم تحضينها مع الخلايا) في خزانة السلامة البيولوجية.
- قم بتلقيح سلالة C. albicans المرغوبة في 10 مل من وسط YPD في أنبوب استزراع.
ملاحظة: يمكن تلقيح المزرعة من مخزون التجميد أو من لوحة أجار ، ولكن يجب استخدام مصدر ثابت لجميع البيانات التي ستتم مقارنتها. - قم بتنمية الثقافة بين عشية وضحاها (~ 12-16 ساعة) عند 30 درجة مئوية و 230 دورة في الدقيقة على شاكر دوار.
- الاستزراع الفرعي للثقافة الليلية ل C. albicans ، وتنمو إلىOD 600 من ~ 1.0-1.2.
- قم بقياس OD600 للثقافة الليلية باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية (انظر جدول المواد).
- استنادا إلى OD 600 للثقافة الليلية ، استخدم الثقافة الليلية لتلقيح ثقافة فرعية عندOD 600 من 0.1 في10 مل من YPD.
- قم بتنمية الثقافة الفرعية عند 30 درجة مئوية على شاكر دوار عند 230 دورة في الدقيقة حتى يصل OD600 إلى ~ 1.0-1.2 ، والذي من المحتمل أن يستغرق 4-6 ساعات. أكمل الخطوة 3 (تحضير محاليل الببتيد) أثناء نمو الثقافة الفرعية ؛ سيتم تخفيف الثقافة الفرعية لاستخدامها في الفحص في الخطوة 4.
3. تحضير محاليل الببتيد في صفيحة 96 بئرا
ملاحظة: يمكن القيام بهذه الخطوة في وقت مبكر ، إذا كانت محاليل مخزون الببتيد مستقرة أثناء التخزين. عادة ، يتم تخزين محاليل الببتيد عند -20 درجة مئوية حتى الاستخدام. يمكن إذابتها في حمام مائي بدرجة حرارة الغرفة قبل الانتقال إلى الخطوة التالية.
- حدد أعلى تركيز لكل ببتيد ليتم اختباره في الفحص. سيختلف هذا بناء على الببتيدات المختارة. بالنسبة للبيانات المقدمة في قسم النتائج التمثيلية ، تم اختبار الهيستاتين 5 والنظائر الهندسية22 ، وكان أعلى تركيز تم اختباره هو 50 ميكرومتر.
ملاحظة: يتم تحديد أعلى تركيز ليتم اختباره باستخدام البيانات الواردة في الأدبيات أو عن طريق إجراء تجارب أولية على مجموعة واسعة من تركيزات الببتيد. وينبغي، عندما يكون ذلك ممكنا، اختيار أعلى تركيز لمراقبة الهضبة من أجل الانخفاض الكامل في الصلاحية عند أعلى التركيزات المختبرة، والهضبة لعدم انخفاض الصلاحية عند أدنى التركيزات المختبرة، مما يسمح بالتحديد الكمي للنطاق الكامل لنشاط الببتيد. - قم بإذابة كل ببتيد في ماء معقم بمعدل ضعف أعلى تركيز مرغوب. بالنسبة للبيانات المقدمة في قسم النتائج التمثيلية ، تم تحضير 150 ميكرولتر من محاليل 100 ميكرومتر من الهيستاتين 5 والنظائر الهندسية في ماء معقم.
ملاحظة: إذا كان الببتيد غير قابل للذوبان في الماء ، فقد يكون الذوبان في مذيب آخر ضروريا قبل هذه الخطوة. يستخدم ثنائي ميثيل سلفوكسيد (DMSO) بشكل شائع لإذابة الببتيدات بتركيز عال قبل التخفيف إلى تركيز العمل. تأكد من أن التركيز النهائي ل DMSO هو 1٪ (v / v) أو أقل29 وأن المذيبات البديلة لا تؤثر على نمو الخلايا. تأكد أيضا من الحفاظ على تركيز المذيب ثابتا في جميع الآبار في الخطوات 3.4-3.5. - أضف 40 ميكرولتر من محاليل مخزون الببتيد المطلوبة إلى البئر الأول (العمود 1) لكل صف في صفيحة استزراع مستديرة القاع مكونة من 96 بئرا (انظر جدول المواد). هذه اللوحة هي اللوحة 1 (الشكل 1).
ملاحظة: تحتوي كل لوحة على ثمانية صفوف تستخدم لاختبار الببتيدات. يمكن استخدام هذه الصفوف لببتيدات مختلفة أو لنسخ متماثلة من نفس الببتيدات. قم بتضمين ببتيد واحد فقط في كل صف. - أضف 20 ميكرولتر من الماء المعقم عالي النقاء إلى العمود 2 إلى العمود 12 من الصفوف التي تحتوي على الببتيد (الشكل 1).
ملاحظة: إذا تم تحضير مخزون الببتيد بمذيب آخر غير الماء النقي في الخطوة 3.2 ، فيجب استبدال الماء المعقم في هذه الخطوة بالمذيب الموجود في مخزون الببتيد المضاف إلى العمود الأول. على سبيل المثال ، إذا تم إذابة الببتيد في DMSO وكان مخزون الببتيد يحتوي على 1٪ (v / v) DMSO في الماء ، فيجب إضافة الماء الذي يحتوي على 1٪ DMSO إلى العمود 2 إلى العمود 12. - قم بتخفيف محاليل مخزون الببتيد بشكل تسلسلي عبر اللوحة إلى العمود 10 (الشكل 1).
ملاحظة: بدلا من إجراء التخفيفات التسلسلية في اللوحة كما هو موضح أدناه ، يمكن أيضا إجراء التخفيفات في أنابيب الطرد المركزي الدقيقة ونقلها إلى لوحة 96 بئرا.- قم بإزالة 20 ميكرولتر من العمود 1 ، وانقله إلى العمود 2 ، واخلطه عن طريق السحب لأعلى ولأسفل. يحتوي العمود 2 الآن على 40 ميكرولتر من محلول الببتيد عند تخفيف 1: 2 للتركيز في العمود 1.
- أزل 20 ميكرولتر من العمود 2 ، وانقله إلى العمود 3 ، واخلطه عن طريق السحب لأعلى ولأسفل ، بحيث يحتوي العمود 3 الآن على 40 ميكرولتر من محلول الببتيد عند تخفيف التركيز في العمود 1: 4.
- كرر هذه العملية حتى يحتوي العمود 10 على 40 ميكرولتر من محلول الببتيد عند تخفيف 1:512 للتركيز في العمود 1.
- قم بإزالة 20 ميكرولتر من محلول الببتيد من العمود 10 وتخلص منه. يحتوي كل عمود الآن على 20 ميكرولتر من محلول الببتيد (الأعمدة 1-10) أو الماء (العمود 11 والعمود 12).
ملاحظة: تعمل الآبار الموجودة في العمود 11 كضوابط للعقم، وتعمل الآبار الموجودة في العمود 12 كعناصر تحكم لا تحتوي على الببتيد.
4. تخفيف الثقافة الفرعية C. albicans
ملاحظة: ابدأ هذه الخطوة بعد أن تصل الثقافة الفرعية إلىOD 600 من ~ 1.0-1.2 (الخطوة 2.3.3).
- نقل المستزرع الفرعي إلى أنبوب طرد مركزي سعة 15 مل ، وأجهزة طرد مركزي عند 3,900 × جم لمدة 3 دقائق في درجة حرارة الغرفة لتكوير الخلايا. قم بإزالة المادة الطافية عن طريق السحب أو الصب.
- أعد تعليق الحبيبات ب 1 مل من 2 ملليمتر NaPB (الخطوة 1.1) ، وانقل التعليق إلى أنبوب طرد مركزي سعة 1.7 مل.
- قم بتكسير الخلايا (كما في الخطوة 4.1) ، وتخلص من المادة الطافية ، ثم أعد تعليق الحبيبات مرة أخرى في 1 مل من 2 ملليمتر NaPB.
- كرر الخطوة 4.3 مرتين إضافيتين لترك الخلايا المغسولة في 1 مل من 2 ملليمتر NaPB.
- حدد كثافة الخلية للتعليق المغسول ، واحسب عامل التخفيف اللازم للحصول على كثافة خلية تبلغ 5 × 105 خلايا / مل. سيؤدي هذا التركيز في النهاية إلى إضافة 1 × 104 خلايا إلى كل بئر من لوحة 96 بئرا.
ملاحظة: يمكن تحديد كثافة خلية التعليق باستخدام عدد من الطرق ، بما في ذلك مقياس الدم أو عداد الخلايا الآلي. تم استخدام منحنى قياسي لكثافة الخلايا مقابل OD600 لسلالة الاهتمام المزروعة في ظل الظروف ذات الصلة في هذه الدراسة. تم تحضير هذا المنحنى باستخدام مقياس الدم (انظر جدول المواد) لتحديد كثافة الخلايا للمعلقات ذات قيم OD600 المتغيرة. - خفف معلق الخلية إلى 5 × 105 خلايا / مل في 2 مللي مول NaPB. سيكون تحضير 10 مل من هذا التعليق المخفف أكثر من كاف لإكمال هذه الدراسة.
5. حضانة C. albicans مع حلول الببتيد وإعداد الخلايا لتحديد كمية الجدوى
- أضف 20 ميكرولتر من تعليق C. albicans المخفف (الخطوة 4.6) إلى الأعمدة 1-10 والعمود 12 من كل صف (الشكل 1).
ملاحظة: تركيز الببتيد النهائي في العمود الأول هو الآن نصف تركيز مخزون الببتيد. بالنسبة للدراسة الحالية ، كان تركيز الببتيد النهائي 50 ميكرومتر في هذه المرحلة. يحتوي تعليق الخلية النهائي في كل بئر على 2.5 × 105 خلايا / مل. تعمل الأعمدة 1-10 كآبار تجريبية لتقييم النشاط المضاد للفطريات بتركيزات مختلفة من الببتيد ، ويعمل العمود 12 كعنصر تحكم للنمو بدون ببتيد. - أضف 20 ميكرولتر من 2 mM NaPB إلى العمود 11. ويبلغ التركيز النهائي لجميع الآبار الآن 1 ملليمتر من NaPB. العمود 11 بمثابة التحكم في العقم.
- قم بتغطية اللوحة 1 (التي تحتوي على كل من الخلايا والببتيد) ، واحتضانها على حرارة 30 درجة مئوية لمدة 30 دقيقة.
ملاحظة: وقت الحضانة لمدة 30 دقيقة يكفي للعديد من الببتيدات17،21،22،30 ، ولكن يمكن زيادة وقت الحضانة إلى 60 دقيقة إذا رغبت في حساب الببتيدات التي قد تتطلب وقتا أطول لممارسة نشاطها المضاد للفطريات25،31،32. - قم بإعداد صفيحة استزراع جديدة مكونة من 96 بئرا (اللوحة 2) لاستخدامها في تحديد الصلاحية (الشكل 2).
ملاحظة: يجب تحضير لوحة الاستزراع أثناء حضانة اللوحة 1.- أضف 100 ميكرولتر من YPD (الخطوة 1.2) إلى جميع آبار اللوحة.
- أضف 100 ميكرولتر من 2 mM NaPB (الخطوة 1.1) إلى جميع آبار الصفيحة.
- تمييع العينات في اللوحة 1 (التي تحتوي على الخلايا والببتيدات) ، ونقلها إلى اللوحة 2 (التي تحتوي على وسيط وعازلة).
- استرجع اللوحة 1 من الحاضنة بعد 30 دقيقة من الحضانة.
- خفف كل بئر من الصفيحة 1 بإضافة 280 ميكرولتر من 1 مليمتر من NaPB (الخطوة 1.1) لحجم إجمالي قدره 320 ميكرولتر في كل بئر (الشكل 2).
- امزج جميع الآبار التي تحتوي على الخلايا والببتيدات عن طريق السحب لأعلى ولأسفل لضمان إعادة تعليق جميع الخلايا وعدم ظهور خلايا مستقرة في قاع الآبار.
- نقل 8 ميكرولتر من كل بئر في اللوحة 1 إلى البئر المقابلة في اللوحة 2. ينقل هذا الحجم ما يقرب من 250 خلية من كل بئر من اللوحة 1 إلى اللوحة 2 (الشكل 2).
- قم بتغطية اللوحة 2 واحتضانها على شاكر لوحة المعايرة الدقيقة (انظر جدول المواد) عند 350 دورة في الدقيقة لمدة 17 ساعة عند 30 درجة مئوية.
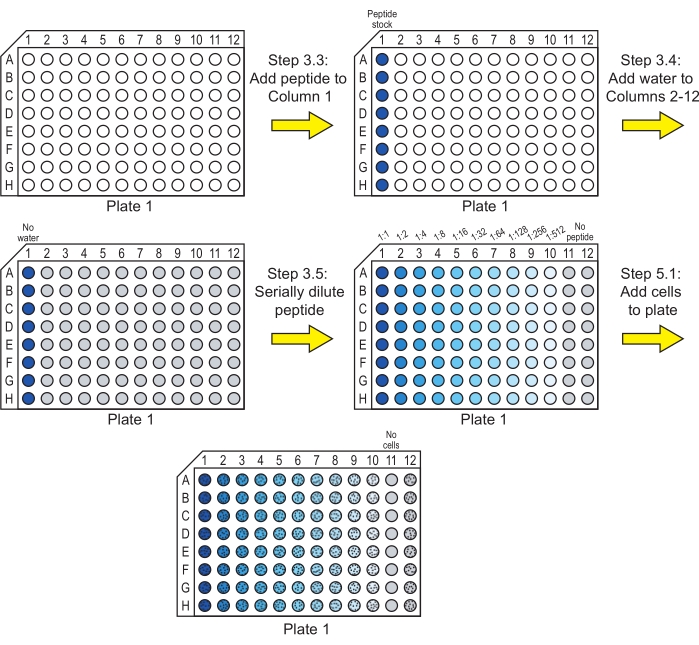
الشكل 1: تحضير الصفيحة 1 لحضانة التخفيفات التسلسلية الببتيدية مع الخلايا. يتم إجراء التخفيفات التسلسلية للببتيد في الماء ، وتضاف خلايا C. albicans إلى اللوحة 1. يشير اللون الأزرق إلى وجود الببتيد في البئر ، ويشير اللون الرمادي إلى بئر به ماء ولا يحتوي على ببتيد. يشار إلى الآبار التي تحتوي على خلايا بنمط من النقاط السوداء. بعد هذه الخطوات ، يتم تحضين اللوحة للسماح للببتيد بممارسة نشاطه المضاد للفطريات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحضير اللوحة 2 لتحديد الانخفاض في الصلاحية بسبب الببتيد. يضاف وسط YPD و NaPB إلى اللوحة 2. بعد تخفيف محتويات اللوحة 1 ، يتم نقل حصة من كل بئر من اللوحة 1 إلى اللوحة 2. ثم يتم تحضين اللوحة 2 للسماح لأي خلايا قابلة للحياة بالنمو للقياس الكمي عن طريق قياس OD600. وبالنسبة للوحة 2، تظهر الآبار التي تحتوي على YPD وNaPB فقط باللون البرتقالي. تظهر الآبار التي تحتوي على حصص من اللوحة 1 مختلطة مع YPD و NaPB باللون الأخضر. انظر وسيلة إيضاح الشكل 1 للحصول على وصف الألوان على اللوحة 1. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. تحديد النشاط المضاد للفطريات
- احصل على قراءات OD600 لكل بئر في اللوحة 2.
- إزالة لوحة 2 من الحاضنة بعد 17 ساعة من الحضانة.
- امزج جميع الآبار في اللوحة 2 عن طريق السحب لأعلى ولأسفل لضمان إعادة تعليق جميع الخلايا وعدم ظهور خلايا مستقرة في قاع الآبار.
ملاحظة: تجنب توليد فقاعات أثناء هذه الخطوة ، لأنها قد تتداخل مع قراءات OD600 . إذا تشكلت الفقاعات ، فيمكن غالبا فرقعة بطرف ماصة جاف أو إزالتها باستخدام طرفين ماصة لرفعها من البئر. - استخدم قارئ لوحة الامتصاص (انظر جدول المواد) بطول موجي 600 نانومتر للحصول على OD600 لكل بئر.
- حساب تثبيط النمو (كنسبة مئوية) ، ورسمه لتحديد تأثير الببتيدات على نمو C. albicans.
- لكل بئر ، احسب الانخفاض في الجدوى مقارنة بالتحكم (كنسبة مئوية) باستخدام المعادلة التالية17،22،23:
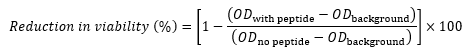
حيث OD مع الببتيد هو OD 600 لبئر يحتوي على تركيز معين من الببتيد ، خلفية OD هي OD 600 من العمود 11 في نفس الصف (عنصر تحكم لا يحتوي على خلايا) ، و
ODلا يوجد ببتيد هو OD600 من العمود 12 في نفس الصف (التحكم الذي يحتوي على خلايا ولا يوجد ببتيد). - على سبيل المثال، استخدم التعبير التالي لحساب الانخفاض في الصلاحية في البئر B5 من قيم OD600 للصف B:
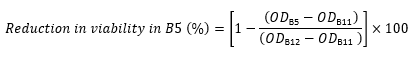
- لكل بئر ، احسب الانخفاض في الجدوى مقارنة بالتحكم (كنسبة مئوية) باستخدام المعادلة التالية17،22،23:
- ارسم الانخفاض في الصلاحية كدالة لتركيز الببتيد.
النتائج
إن استخدام قياسات OD600 لتحديد الانخفاض في النمو بسبب الببتيدات المضادة للفطريات يوفر وقتا كبيرا مقارنة بعينات الطلاء وحساب CFUs. تتطلب الطريقة الموضحة في هذا البروتوكول إكمال الخطوات في ثلاثة أيام مختلفة. في اليوم الأول ، هناك حاجة إلى حوالي 1 ساعة لإعداد المخازن المؤقتة والوسائط (لا ت?...
Discussion
يصف هذا البروتوكول نهجا فعالا للحصول على بيانات كمية عن النشاط المضاد للفطريات ل AMPs ضد الممرض الفطري C. albicans. أحد الأساليب البديلة الشائعة لاختبار الببتيدات والعوامل المضادة للفطريات الأخرى هو التخفيف الدقيق للمرق الموصوف في معيار M2718 التابع لمعهد معايير المختبرات السر?...
Disclosures
ويعلن صاحبا البلاغ أنه ليس لهما مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة (R03DE029270 ، T32AI089621B) ، والمؤسسة الوطنية للعلوم (CBET 1511718) ، ووزارة التعليم (GAANN-P200A180093) ، ومنحة البذور عبر الحرم الجامعي بجامعة ميريلاند.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well plates (round bottom) | VWR | 10062-902 | |
| Absorbance microplate reader | N/A | N/A | Any available microplate reader is sufficient |
| C. albicans strain SC5314 | ATCC | MYA-2876 | Other C. albicans may also be used |
| Hemocytometer | N/A | N/A | Can be used to make a standard curve relating cell number to OD600 |
| Microplate shaker | VWR | 2620-926 | |
| Peptide(s) | N/A | N/A | Peptides can be commercially synthesized by any reliable vendor; a purity of ≥95% and trifluoroacetic acid salt removal to hydrochloride salt are recommended |
| Reagent reservoirs for multichannel pipettors | VWR | 18900-320 | Simplifies pipetting into multiwell plates with multichannel pipettor |
| Sodium phosphate, dibasic | Fisher Scientific | BP332-500 | For making NaPB |
| Sodium phosphate, monobasic | Fisher Scientific | BP329-500 | For making NaPB |
| UV spectrophotometer | N/A | N/A | Any available UV spectrophotometer is sufficient |
| YPD medium powder | BD Life Sciences | 242820 | May also be made from yeast extract, peptone, and dextrose |
References
- Gulati, M., Nobile, C. J. Candida albicans biofilms: Development, regulation, and molecular mechanisms. Microbes and Infection. 18 (5), 310-321 (2016).
- Arya, N. R., Rafiq, N. B. Candidiasis. StatPearls. , (2021).
- de Oliveira Santos, G. C., et al. Candida infections and therapeutic strategies: Mechanisms of action for traditional and alternative agents. Frontiers in Microbiology. 9, 1351 (2018).
- Espinel-Ingroff, A. Mechanisms of resistance to antifungal agents: Yeasts and filamentous fungi. Revista Iberoamericana de Micología. 25 (2), 101-106 (2008).
- Wang, X., et al. Delivery strategies of amphotericin B for invasive fungal infections. Acta Pharmaceutica Sinica B. 11 (8), 2585-2604 (2021).
- Struyfs, C., Cammue, B. P. A., Thevissen, K. Membrane-interacting antifungal peptides. Frontiers in Cell and Developmental Biology. 9, 649875 (2021).
- Huan, Y., Kong, Q., Mou, H., Yi, H. Antimicrobial peptides: Classification, design, application and research progress in multiple fields. Frontiers in Microbiology. 11, 582779 (2020).
- Sarkar, T., Chetia, M., Chatterjee, S. Antimicrobial peptides and proteins: From nature's reservoir to the laboratory and beyond. Frontiers in Chemistry. 9, 691532 (2021).
- Mahlapuu, M., Bjorn, C., Ekblom, J. Antimicrobial peptides as therapeutic agents: Opportunities and challenges. Critical Reviews in Biotechnology. 40 (7), 978-992 (2020).
- Lei, J., et al. The antimicrobial peptides and their potential clinical applications. American Journal of Translational Research. 11 (7), 3919-3931 (2019).
- Mercer, D. K., O'Neil, D. A. Innate inspiration: Antifungal peptides and other immunotherapeutics from the host immune response. Frontiers in Immunology. 11, 2177 (2020).
- Bin Hafeez, A., Jiang, X., Bergen, P. J., Zhu, Y. Antimicrobial peptides: An update on classifications and databases. International Journal of Molecular Sciences. 22 (21), 11691 (2021).
- Xu, T., Levitz, S. M., Diamond, R. D., Oppenheim, F. G. Anticandidal activity of major human salivary histatins. Infection and Immunity. 59 (8), 2549-2554 (1991).
- Helmerhorst, E. J., et al. Amphotericin B- and fluconazole-resistant Candida spp., Aspergillus fumigatus, and other newly emerging pathogenic fungi are susceptible to basic antifungal peptides. Antimicrobial Agents and Chemotherapy. 43 (3), 702-704 (1999).
- Andra, J., Berninghausen, O., Leippe, M. Cecropins, antibacterial peptides from insects and mammals, are potently fungicidal against Candida albicans. Medical Microbiology and Immunology. 189, 169-173 (2001).
- do Nascimento Dias, J., et al. Mechanisms of action of antimicrobial peptides ToAP2 and NDBP-5.7 against Candida albicans planktonic and biofilm cells. Scientific Reports. 10, 10327 (2020).
- Ikonomova, S. P., et al. Effects of histatin 5 modifications on antifungal activity and kinetics of proteolysis. Protein Science. 29, 480-493 (2020).
- Clinical Laboratory Standards Institute. . M27-A3. Reference method for broth dilution antifungal susceptibility testing of yeasts; Approved standard - Third edition. , (2008).
- Lupetti, A., et al. Candidacidal activities of human lactoferrin peptides derived from the N terminus. Antimicrobial Agents and Chemotherapy. 44 (12), 3257-3263 (2000).
- Han, J., Jyoti, M. A., Song, H. Y., Jang, W. S. Antifungal activity and action mechanism of histatin 5-halocidin hybrid peptides against Candida ssp. PLoS One. 11 (2), 0150196 (2016).
- den Hertog, A. L., et al. Candidacidal effects of two antimicrobial peptides: histatin 5 causes small membrane defects, but LL-37 causes massive disruption of the cell membrane. Biochemical Journal. 388, 689-695 (2005).
- Ikonomova, S. P., Moghaddam-Taaheri, P., Jabra-Rizk, M. A., Wang, Y., Karlsson, A. J. Engineering improved variants of the antifungal peptide histatin 5 with reduced susceptibility to Candida albicans secreted aspartic proteases and enhanced antimicrobial potency. The FEBS Journal. 285 (1), 146-159 (2018).
- Moghaddam-Taaheri, P., Leissa, J. A., Eppler, H. B., Jewell, C. M., Karlsson, A. J. Histatin 5 variant reduces Candida albicans biofilm viability and inhibits biofilm formation. Fungal Genetics and Biology. 149, 103529 (2021).
- Gong, Z., Doolin, M. T., Adhikari, S., Stroka, K. M., Karlsson, A. J. Role of charge and hydrophobicity in translocation of cell-penetrating peptides into Candida albicans cells. AIChE Journal. 65 (12), 16768 (2019).
- Gong, Z., Karlsson, A. J. Translocation of cell-penetrating peptides into Candida fungal pathogens. Protein Science. 26 (9), 1714-1725 (2017).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. Fourth edition. 3, (2012).
- Consolidated Sterilizer Systems. Laboratory and Research Autoclaves Available from: https://consteril.com/wp-content/uploads/2020/12/CSS-Product-Brochure.pdf (2022)
- Rodriguez-Tudela, J. L., Cuenca-Estrella, M., Diaz-Guerra, T. M., Mellado, E. Standardization of antifungal susceptibility variables for a semiautomated methodology. Journal of Clinical Microbiology. 39 (7), 2513-2517 (2001).
- Mbuayama, K. R., Taute, H., Strmstedt, A. A., Bester, M. J., Gaspar, A. R. M. Antifungal activity and mode of action of synthetic peptides derived from the tick OsDef2 defensin. Journal of Peptide Science. 28 (5), 3383 (2022).
- Rossignol, T., Kelly, B., Dobson, C., d'Enfert, C. Endocytosis-mediated vacuolar accumulation of the human ApoE apolipoprotein-derived ApoEdpL-W antimicrobial peptide contributes to its antifungal activity in Candida albicans. Antimicrobial Agents and Chemotherapy. 55 (10), 4670-4681 (2011).
- Helmerhorst, E. J., Reijnders, I. M., van't Hof, W., Veerman, E. C., Nieuw Amerongen, A. V. A critical comparison of the hemolytic and fungicidal activities of cationic antimicrobial peptides. FEBS Letters. 449 (2-3), 105-110 (1999).
- Kerenga, B. K., et al. Salt-tolerant antifungal and antibacterial activities of the corn defensin ZmD32. Frontiers in Microbiology. 10, 795 (2019).
- Lee, I. H., Cho, Y., Lehrer, R. I. Effects of pH and salinity on the antimicrobial properties of clavanins. Infection and Immunity. 65 (7), 2898-2903 (1997).
- Li, X. S., Reddy, M. S., Baev, D., Edgerton, M. Candida albicans Ssa1/2p is the cell envelope binding protein for human salivary histatin 5. Journal of Biological Chemistry. 278 (31), 28553-28561 (2003).
- Rothstein, D. M., et al. Anticandida activity is retained in P-113, a 12-amino-acid fragment of histatin 5. Antimicrobial Agents and Chemotherapy. 45 (5), 1367-1373 (2001).
- Sanders, E. R. Aseptic laboratory techniques: Volume transfers with serological pipettes and micropipettors. Journal of Visualized Experiments. (63), e2754 (2012).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Report. 26, 100987 (2021).
- Goughenour, K. D., Balada-Llasat, J. M., Rappleye, C. A. Quantitative microplate-based growth assay for determination of antifungal susceptibility of Histoplasma capsulatum yeasts. Journal of Clinical Microbiology. 53 (10), 3286-3295 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved