Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantifizierung der antimykotischen Aktivität von Peptiden gegen Candida albicans
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein Verfahren zur Gewinnung quantitativer Daten über die antimykotische Aktivität von Peptiden und anderen Verbindungen, wie z. B. niedermolekularen Antimykotika, gegen Candida albicans. Die Verwendung der optischen Dichte anstelle der Zählung koloniebildender Einheiten zur Quantifizierung der Wachstumshemmung spart Zeit und Ressourcen.
Zusammenfassung
Herkömmliche Methoden zur Durchführung von antimykotischen Empfindlichkeitstests für Candida albicans sind zeitaufwändig und es fehlen quantitative Ergebnisse. Ein gängiger Ansatz beruht beispielsweise darauf, Zellen, die mit unterschiedlichen Konzentrationen antimykotischer Moleküle behandelt wurden, auf Agarplatten zu plattieren und dann die Kolonien zu zählen, um die Beziehung zwischen Molekülkonzentration und Wachstumshemmung zu bestimmen. Diese Methode erfordert viele Platten und viel Zeit, um die Kolonien zu zählen. Ein anderer gängiger Ansatz eliminiert die Platten und das Zählen von Kolonien, indem mit Antimykotika behandelte Kulturen visuell inspiziert werden, um die Mindestkonzentration zu ermitteln, die zur Hemmung des Wachstums erforderlich ist. Die visuelle Inspektion liefert jedoch nur qualitative Ergebnisse, und Informationen über das Wachstum bei subinhibitorischen Konzentrationen gehen verloren. Dieses Protokoll beschreibt eine Methode zur Messung der Empfindlichkeit von C. albicans gegenüber antimykotischen Peptiden. Durch die Verwendung optischer Dichtemessungen von Kulturen reduziert die Methode den Zeit- und Materialaufwand, der benötigt wird, um quantitative Ergebnisse zum Kulturwachstum bei verschiedenen Peptidkonzentrationen zu erhalten. Die Inkubation des Pilzes mit Peptiden wird in einer 96-Well-Platte unter Verwendung eines geeigneten Puffers durchgeführt, wobei die Kontrollen keine Wachstumshemmung und eine vollständige Wachstumshemmung darstellen. Nach der Inkubation mit dem Peptid werden die resultierenden Zellsuspensionen verdünnt, um die Peptidaktivität zu reduzieren, und dann über Nacht gezüchtet. Nach dem Wachstum über Nacht wird die optische Dichte jeder Vertiefung gemessen und mit den Positiv- und Negativkontrollen verglichen, um die resultierende Wachstumshemmung bei jeder Peptidkonzentration zu berechnen. Die Ergebnisse mit diesem Assay sind vergleichbar mit den Ergebnissen mit der traditionellen Methode der Beschichtung der Kulturen auf Agarplatten, aber dieses Protokoll reduziert den Plastikmüll und den Zeitaufwand für die Zählung der Kolonien. Obwohl sich die Anwendungen dieses Protokolls auf antimykotische Peptide konzentriert haben, wird die Methode auch auf die Untersuchung anderer Moleküle mit bekannter oder vermuteter antimykotischer Aktivität anwendbar sein.
Einleitung
Candida albicans ist ein Mitglied der menschlichen Mikrobiota, die zahlreiche Stellen besiedelt, darunter die Mundhöhle, die Haut, den Magen-Darm-Trakt und die Vagina1. Bei Patienten, die aufgrund von Krankheiten wie dem humanen Immundefizienzvirus (HIV) und immunsuppressiven Behandlungen immungeschwächt sind, kann die Besiedlung von C. albicans zu einer lokalen oder systemischen Candidose führen 2,3. Die Verwendung von derzeit verfügbaren niedermolekularen antimykotischen Therapeutika wie Amphotericin B, Azolen oder Echinocandinen kann durch Löslichkeits- und Toxizitätsprobleme sowie durch die Resistenz von Infektionen gegen die Therapeutikaerschwert werden 4,5. Aufgrund der Einschränkungen der derzeitigen Antimykotika suchen Forscher ständig nach neuen antimykotischen Molekülen, die gegen C. albicans wirksam sind.
Antimikrobielle Peptide (AMPs) sind eine potenzielle Alternative zu den derzeitigen niedermolekularen Antimykotika 6,7,8 und gelten als weniger anfällig für die Entwicklung von Resistenzen im Vergleich zu niedermolekularen Arzneimitteln 9. AMPs sind eine vielfältige Gruppe von Peptiden, aber sie sind oft kationisch, mit einem breiten Wirkungsspektrum10,11,12. Zu den AMPs mit Aktivität gegen C. albicans gehören bekannte Peptide aus den Histatin- und Cecropin-Familien 13,14,15 sowie neuere beschriebene Peptide wie ToAP2, NDBP-5.7 und die Histatin-5-Variante K11R-K17R 16,17. Aufgrund ihres Potenzials zur Behandlung von Candida-Infektionen ist die Identifizierung und Entwicklung neuer AMPs, die auf C. albicans abzielen, ein wichtiges Ziel für viele Forschungsgruppen.
Als Teil des Prozesses zur Entwicklung wirksamer AMPs (und anderer Antimykotika), die auf C. albicans abzielen, werden häufig In-vitro-Tests verwendet, um vielversprechende Peptide zu identifizieren. Methoden zum Testen der antimykotischen Aktivität gegen C. albicans beinhalten typischerweise die Inkubation von Zellen mit seriellen Verdünnungen der AMPs (in Puffer oder Medium) in 96-Well-Platten. Es stehen verschiedene Methoden zur Verfügung, um die antimykotische Aktivität nach der Inkubation zu beurteilen. Eine vom Clinical Laboratory Standards Institute beschriebene Technik verwendet eine rein visuelle Beurteilung der Trübung der Vertiefungen, um die Mindestkonzentration (MHK) für die vollständige Hemmung des Wachstums zu bestimmen (mindestens 50% Hemmung für ausgewählte Antimykotika wie Azole und Echinocandine) und liefert keine Quantifizierung des Wachstums bei Sub-MIC-Konzentrationen18 . Ein weiterer häufig verwendeter Ansatz besteht darin, die Lebensfähigkeit nach der Inkubation mit AMPs zu quantifizieren, indem der Inhalt der Vertiefungen auf Agarplatten plattiert, die Platten inkubiert und dann die Anzahl der koloniebildenden Einheiten (KBE) auf der Platte gezählt wird. Diese Methode wurde zur Bewertung einer Reihe von Peptiden verwendet, darunter Histatin-5-basierte Peptide, LL-37 und humanes Lactoferrin 19,20,21. Diese Technik erfordert ein relativ großes Agarvolumen und eine hohe Anzahl von Platten und beinhaltet das mühsame Zählen von KBE auf den Platten. Um mehr quantitative Daten zu erhalten und gleichzeitig weniger Plastikmüll zu erzeugen und das Zählen von KBE zu vermeiden, kann der Inhalt der Vertiefungen verwendet werden, um frisches Medium in einer weiteren 96-Well-Platte zu impfen. Nach der Inkubation der neu beimpften Platte kann das Wachstum quantifiziert werden, indem die optische Dichte bei 600 nm (OD600) auf einem Absorptionsplattenleser gemessen wird. Diese Methode wurde verwendet, um die antimykotische Aktivität von Histatin 5 und seinen Abbaufragmenten und zelldurchdringenden Peptiden 17,22,23,24,25 zu bestimmen.
Dieses Protokoll beschreibt, wie die antimykotische Aktivität von Peptiden getestet werden kann, und verwendet die OD600-Methode , um die Verringerung der Lebensfähigkeit von C. albicans aufgrund von Peptiden zu quantifizieren.
Protokoll
Die Genehmigung wurde von der University of Maryland, College Park, Institutional Biosafety Committee (IBC) für die Arbeit mit C. albicans in diesem Protokoll (PN 274) eingeholt. In der vorliegenden Studie wurde der C . albicans-Stamm SC5314 (siehe Materialtabelle) verwendet; Es kann jedoch auch jede andere Sorte verwendet werden.
1. Vorbereitung des Puffers, des sterilen Wassers und des Nährmediums
- Steriler 0,1 M Natriumphosphatpuffer (NaPB)26 wird bei einem pH-Wert von 7,4 hergestellt und mit sterilem Wasser auf 2 mM und 1 mM verdünnt. Die Herstellung von jeweils 100 ml von 2 mM NaPB und 1 mM NaPB ist für die meisten Anwendungen dieses Protokolls mehr als ausreichend.
- Steriles flüssiges Hefe-Pepton-Dextrose-Medium (YPD, siehe Materialtabelle) herstellen (10 g/l Hefeextrakt, 20 g/l Dextrose, 20 g/l Pepton). Die Herstellung von 100 ml YPD ist für die meisten Anwendungen dieses Protokolls mehr als ausreichend.
- Bereiten Sie steriles Reinstwasser vor. Die Zubereitung von 100 ml Wasser ist für die meisten Anwendungen dieses Protokolls mehr als ausreichend.
ANMERKUNG: Die Puffer, das Medium und das Wasser werden durch Autoklavieren bei 121 °C in einem Flüssigkeitszyklus für eine angemessene Zeit auf der Grundlage des Volumens in den zu autoklavierenden Behälternsterilisiert 27. Bei Flaschen mit einem Fassungsvermögen von 500 ml sollte die Einwirkzeit beispielsweise 40 Minuten betragen.
2. Inokulation, Kultivierung und Subkultivierung von C. albicans
ACHTUNG: Befolgen Sie alle institutionellen und staatlichen Vorschriften für die Arbeit mit C. albicans, der von akademischen Forschungseinrichtungen häufig als Organismus der Biosicherheitsstufe (BSL) 2 unabhängig von der Arzneimittelresistenz und von der American Type Culture Collection (ATCC) als BSL1- oder BSL2-Organismus eingestuft wird, abhängig von der Arzneimittelresistenz des Stammes28.
HINWEIS: Führen Sie die Inokulations- und Kultivierungsabschnitte dieses Schritts (Schritte 2.1-2.2) am Tag vor Beginn des Tests auf antimykotische Aktivität durch. Wenn möglich, führen Sie alle Protokollschritte mit den Zellen (und den Lösungen, die mit den Zellen inkubiert werden) in einer Biosicherheitswerkbank durch.
- Inokulieren Sie den gewünschten C. albicans-Stamm in 10 ml YPD-Medium in einem Kulturröhrchen.
HINWEIS: Die Kultur kann aus einem Gefriervorrat oder aus einer Agarplatte geimpft werden, aber für alle Daten, die verglichen werden, muss eine konsistente Quelle verwendet werden. - Züchten Sie die Kultur über Nacht (~12-16 h) bei 30 °C und 230 U/min auf einem Rotationsschüttler.
- Subkultivieren Sie die Übernachtkultur von C. albicans und wachsen Sie auf einen OD600 von ~1,0-1,2.
- Messen Sie den OD600 der Nachtkultur mit einem UV-Spektralphotometer (siehe Materialtabelle).
- Basierend auf dem OD 600 der Overnight-Kultur wird die Overnight-Kultur verwendet, um eine Subkultur mit einem OD600 von 0,1 in10 ml YPD zu impfen.
- Züchten Sie die Subkultur bei 30 °C auf einem Rotationsschüttler bei 230 U/min, bis der OD600 ~1,0-1,2 erreicht, was wahrscheinlich 4-6 Stunden dauern wird. Führen Sie Schritt 3 (Herstellung von Peptidlösungen) aus, während die Subkultur wächst. Die Subkultur wird für die Verwendung im Assay in Schritt 4 verdünnt.
3. Herstellung der Peptidlösungen in einer 96-Well-Platte
HINWEIS: Dieser Schritt kann im Voraus durchgeführt werden, wenn die Peptidstammlösungen während der Lagerung stabil sind. Typischerweise werden die Peptidlösungen bis zur Verwendung bei −20 °C gelagert. Sie können in einem Wasserbad bei Raumtemperatur aufgetaut werden, bevor mit dem nächsten Schritt fortgefahren wird.
- Bestimmen Sie die höchste Konzentration jedes Peptids, das im Assay getestet werden soll. Dies hängt von den ausgewählten Peptiden ab. Für die im Abschnitt "Repräsentative Ergebnisse" dargestellten Daten wurden Histatin 5 und technische Analoga22 getestet, und die höchste getestete Konzentration betrug 50 μM.
ANMERKUNG: Die höchste zu testende Konzentration wird anhand von Daten aus der Literatur oder durch Vorversuche über einen breiten Bereich von Peptidkonzentrationen bestimmt. Wenn möglich, sollte die höchste Konzentration ausgewählt werden, um ein Plateau für eine vollständige Verringerung der Lebensfähigkeit bei den höchsten getesteten Konzentrationen und ein Plateau für keine Verringerung der Lebensfähigkeit bei den niedrigsten getesteten Konzentrationen zu beobachten, was die Quantifizierung des gesamten Spektrums der Peptidaktivität ermöglicht. - Lösen Sie jedes Peptid in sterilem Wasser mit der doppelten gewünschten höchsten Konzentration auf. Für die im Abschnitt über die repräsentativen Ergebnisse dargestellten Daten wurden 150 μl 100-μM-Lösungen von Histatin 5 und technisch hergestellten Analoga in sterilem Wasser hergestellt.
HINWEIS: Wenn ein Peptid nicht wasserlöslich ist, kann vor diesem Schritt eine Solubilisierung in einem anderen Lösungsmittel erforderlich sein. Dimethylsulfoxid (DMSO) wird üblicherweise verwendet, um Peptide in einer hohen Konzentration zu solubilisieren, bevor sie auf die Arbeitskonzentration verdünnt werden. Stellen Sie sicher, dass die Endkonzentration des DMSO 1% (v/v) oder wenigerals 29 beträgt und dass alternative Lösungsmittel das Wachstum der Zellen nicht beeinträchtigen. Stellen Sie außerdem sicher, dass die Lösungsmittelkonzentration in allen Vertiefungen in den Schritten 3.4-3.5 konstant gehalten wird. - Geben Sie 40 μl der gewünschten Peptidstammlösungen in die erste Vertiefung (Spalte 1) jeder Reihe in einer 96-Well-Kulturplatte mit rundem Boden (siehe Materialtabelle). Bei dieser Platte handelt es sich um Tafel 1 (Abbildung 1).
HINWEIS: Jede Platte hat acht Reihen, die zum Testen von Peptiden verwendet werden. Diese Reihen können für verschiedene Peptide oder für Replikate derselben Peptide verwendet werden. Fügen Sie nur ein einzelnes Peptid in jede Zeile ein. - Geben Sie 20 μl steriles Reinstwasser in Spalte 2 bis Spalte 12 der Reihen, die das Peptid enthalten (Abbildung 1).
ANMERKUNG: Wenn die Peptidvorräte in Schritt 3.2 mit einem anderen Lösungsmittel als reinem Wasser hergestellt wurden, sollte das sterile Wasser in diesem Schritt durch das Lösungsmittel ersetzt werden, das in dem Peptidstamm vorhanden ist, der der ersten Säule zugesetzt wurde. Wenn das Peptid beispielsweise in DMSO solubilisiert wurde und der Peptidstamm 1% (v/v) DMSO in Wasser enthält, muss Wasser, das 1% DMSO enthält, in Spalte 2 bis Spalte 12 gegeben werden. - Verdünnen Sie die Peptidlösungen seriell über die Platte bis zur Spalte 10 (Abbildung 1).
HINWEIS: Anstatt die seriellen Verdünnungen in der Platte wie unten beschrieben durchzuführen, könnten die Verdünnungen auch in Mikrozentrifugenröhrchen durchgeführt und auf die 96-Well-Platte übertragen werden.- Nehmen Sie 20 μl aus Säule 1, übertragen Sie sie in Säule 2 und mischen Sie sie durch Auf- und Abpipettieren. Spalte 2 enthält nun 40 μl Peptidlösung bei einer 1:2-Verdünnung der Konzentration in Spalte 1.
- 20 μl aus Säule 2 entnehmen, in Säule 3 überführen und durch Auf- und Abpipettieren mischen, so dass Säule 3 nun 40 μl Peptidlösung bei einer 1:4-Verdünnung der Konzentration in Spalte 1 enthält.
- Wiederholen Sie diesen Vorgang, bis Spalte 10 40 μl Peptidlösung bei einer Verdünnung der Konzentration in Spalte 1 von 1:512 enthält.
- Entfernen Sie 20 μl Peptidlösung aus Spalte 10 und entsorgen Sie sie. Jede Säule enthält nun 20 μl Peptidlösung (Spalten 1-10) oder Wasser (Spalte 11 und Spalte 12).
HINWEIS: Die Vertiefungen in Spalte 11 dienen als Sterilitätskontrollen, und die Vertiefungen in Spalte 12 dienen als Kontrollen, die kein Peptid enthalten.
4. Verdünnung der Subkultur C. albicans
HINWEIS: Beginnen Sie mit diesem Schritt, nachdem die Subkultur einen OD600 von ~1,0-1,2 erreicht hat (Schritt 2.3.3).
- Die Subkultur wird in ein 15-ml-Zentrifugenröhrchen überführt und bei 3.900 x g 3 min bei Raumtemperatur zentrifugiert, um die Zellen zu pelletieren. Entfernen Sie den Überstand durch Pipettieren oder Dekantieren.
- Resuspendieren Sie das Pellet mit 1 ml 2 mM NaPB (Schritt 1.1) und überführen Sie die Suspension in ein 1,7-ml-Zentrifugenröhrchen.
- Pelletieren Sie die Zellen (wie in Schritt 4.1), verwerfen Sie den Überstand und resuspendieren Sie das Pellet erneut in 1 ml 2 mM NaPB.
- Wiederholen Sie Schritt 4.3 zwei weitere Male, um die gewaschenen Zellen in 1 ml 2 mM NaPB zu belassen.
- Bestimmen Sie die Zelldichte der gewaschenen Suspension und berechnen Sie den Verdünnungsfaktor, der erforderlich ist, um eine Zelldichte von 5 x 105 Zellen/ml zu erhalten. Diese Konzentration führt letztendlich dazu, dass 1 x 104 Zellen zu jeder Vertiefung der 96-Well-Platte hinzugefügt werden.
HINWEIS: Die Zelldichte der Suspension kann mit einer Reihe von Methoden bestimmt werden, einschließlich eines Hämozytometers oder eines automatisierten Zellzählers. Für die vorliegende Studie wurde eine Standardkurve der Zelldichte im Vergleich zu OD600 für den interessierenden Stamm verwendet, der unter relevanten Bedingungen gezüchtet wurde. Diese Kurve wurde mit einem Hämozytometer (siehe Materialtabelle) erstellt, um die Zelldichte von Suspensionen mit unterschiedlichen OD600-Werten zu bestimmen. - Verdünnen Sie die Zellsuspension auf 5 x 105 Zellen/ml in 2 mM NaPB. Die Herstellung von 10 ml dieser verdünnten Suspension ist mehr als ausreichend, um diese Studie abzuschließen.
5. Inkubation von C. albicans mit Peptidlösungen und Vorbereitung der Zellen zur Quantifizierung der Lebensfähigkeit
- 20 μl der verdünnten C. albicans-Suspension (Schritt 4.6 ) werden in die Spalten 1-10 und Spalte 12 jeder Reihe gegeben (Abbildung 1).
HINWEIS: Die endgültige Peptidkonzentration in der ersten Spalte beträgt jetzt die Hälfte der Peptidbestandskonzentration. Für die vorliegende Studie betrug die endgültige Peptidkonzentration zu diesem Zeitpunkt 50 μM. Die endgültige Zellsuspension in jeder Vertiefung enthält 2,5 x 105 Zellen/ml. Die Säulen 1-10 dienen als experimentelle Vertiefungen, um die antimykotische Aktivität bei verschiedenen Peptidkonzentrationen zu bewerten, und Spalte 12 dient als Kontrolle für das Wachstum ohne Peptid. - 20 μl 2 mM NaPB in Säule 11 geben. Alle Bohrungen haben nun eine Endkonzentration von 1 mM NaPB. Säule 11 dient als Sterilitätskontrolle.
- Decken Sie die Platte 1 (die sowohl die Zellen als auch das Peptid enthält) ab und inkubieren Sie sie bei 30 °C für 30 Minuten.
HINWEIS: Eine Inkubationszeit von 30 min ist für viele Peptide 17,21,22,30 ausreichend, aber die Inkubationszeit kann auf Wunsch auf 60 min erhöht werden, um Peptide zu berücksichtigen, die möglicherweise eine längere Zeit benötigen, um ihre antimykotische Wirkung auszuüben 25,31,32. - Bereiten Sie eine neue 96-Well-Kulturplatte (Tafel 2) zur Quantifizierung der Lebensfähigkeit vor (Abbildung 2).
HINWEIS: Die Kulturplatte sollte während der Inkubation von Platte 1 vorbereitet werden.- Geben Sie 100 μl YPD (Schritt 1.2) in alle Vertiefungen der Platte.
- Geben Sie 100 μl 2 mM NaPB (Schritt 1.1) in alle Vertiefungen der Platte.
- Verdünnen Sie die Proben in Platte 1 (mit Zellen und Peptiden) und übertragen Sie sie auf Platte 2 (mit Medium und Puffer).
- Holen Sie Platte 1 nach der 30-minütigen Inkubation aus dem Inkubator.
- Jede Vertiefung von Platte 1 wird durch Zugabe von 280 μl 1 mM NaPB (Schritt 1.1) für ein Gesamtvolumen von 320 μl in jeder Vertiefung verdünnt (Abbildung 2).
- Mischen Sie alle Vertiefungen, die Zellen und Peptide enthalten, indem Sie auf und ab pipettieren, um sicherzustellen, dass alle Zellen resuspendiert sind und keine abgesetzten Zellen am Boden der Vertiefungen sichtbar sind.
- Übertragen Sie 8 μl von jeder Vertiefung in Platte 1 in die entsprechende Vertiefung von Platte 2. Dieses Volumen überträgt etwa 250 Zellen aus jeder Vertiefung von Platte 1 in Platte 2 (Abbildung 2).
- Platte 2 abdecken und auf einem Mikrotiterplattenschüttler (siehe Materialtabelle) bei 350 U/min für 17 h bei 30 °C inkubieren.
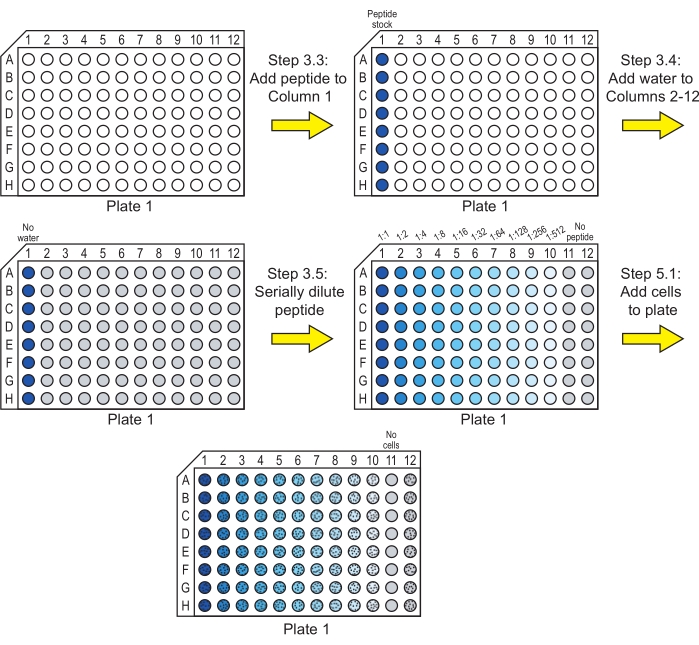
Abbildung 1: Herstellung von Platte 1 für die Inkubation von Peptid-Serienverdünnungen mit Zellen. Serielle Verdünnungen des Peptids werden in Wasser hergestellt, und C. albicans-Zellen werden zu Platte 1 hinzugefügt. Eine blaue Farbe zeigt an, dass Peptid im Brunnen vorhanden ist, und Grau zeigt einen Brunnen mit Wasser und ohne Peptid an. Vertiefungen, die Zellen enthalten, sind mit einem Muster aus schwarzen Punkten gekennzeichnet. Nach diesen Schritten wird die Platte inkubiert, damit das Peptid seine antimykotische Wirkung entfalten kann. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Herstellung von Platte 2 zur Quantifizierung der Verringerung der Lebensfähigkeit aufgrund des Peptids. YPD-Medium und NaPB werden zu Tafel 2 hinzugefügt. Nach dem Verdünnen des Inhalts von Platte 1 wird ein Aliquot aus jeder Vertiefung von Platte 1 auf Platte 2 übertragen. Platte 2 wird dann inkubiert, damit alle lebensfähigen Zellen für die Quantifizierung durch Messung des OD600 wachsen können. Für Tafel 2 sind Bohrlöcher, die nur YPD und NaPB enthalten, orange dargestellt. Bohrlöcher, die Aliquote von Platte 1 enthalten, die mit YPD und NaPB gemischt sind, sind grün dargestellt. In der Legende von Abbildung 1 finden Sie eine Beschreibung der Farben auf Tafel 1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Bestimmung der antimykotischen Aktivität
- Erhalten Sie OD600-Messwerte für jede Vertiefung in Tafel 2.
- Nehmen Sie Platte 2 nach 17 Stunden Inkubation aus dem Inkubator.
- Mischen Sie alle Vertiefungen in Platte 2, indem Sie auf und ab pipettieren, um sicherzustellen, dass alle Zellen resuspendiert sind und keine abgesetzten Zellen am Boden der Vertiefungen sichtbar sind.
HINWEIS: Vermeiden Sie bei diesem Schritt die Erzeugung von Blasen, da diese die OD600-Messwerte beeinträchtigen können. Wenn sich Blasen bilden, können sie oft mit einer trockenen Pipettenspitze geplatzt oder entfernt werden, indem zwei Pipettenspitzen verwendet werden, um sie aus der Vertiefung zu heben. - Verwenden Sie einen Absorptionsplattenleser (siehe Materialtabelle) bei einer Wellenlänge von 600 nm, um den OD600 für jede Vertiefung zu erhalten.
- Berechnen Sie die Hemmung des Wachstums (in Prozent) und zeichnen Sie sie auf, um die Wirkung der Peptide auf das Wachstum von C. albicans zu bestimmen.
- Berechnen Sie für jede Bohrung die Verringerung der Lebensfähigkeit im Vergleich zur Kontrolle (in Prozent) unter Verwendung der folgenden Gleichung 17,22,23:
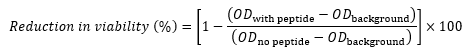
wobei OD mit Peptid die OD 600 einer Vertiefung ist, die eine bestimmte Peptidkonzentration enthält, OD Hintergrund die OD 600 von Spalte 11 in derselben Zeile ist (Kontrolle, die keine Zellen enthält), und
OD kein Peptid ist das OD600 von Spalte 12 in der gleichen Zeile (Kontrolle enthaltende Zellen und kein Peptid). - Verwenden Sie z. B. den folgenden Ausdruck, um die Verringerung der Viabilität in Bohrloch B5 aus den OD600-Werten für Zeile B zu berechnen:
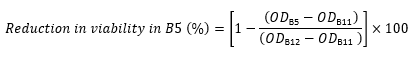
- Berechnen Sie für jede Bohrung die Verringerung der Lebensfähigkeit im Vergleich zur Kontrolle (in Prozent) unter Verwendung der folgenden Gleichung 17,22,23:
- Zeichnen Sie die Verringerung der Lebensfähigkeit als Funktion der Peptidkonzentration auf.
Ergebnisse
Die Verwendung von OD600-Messungen zur Quantifizierung der Wachstumsminderung durch antimykotische Peptide spart im Vergleich zum Platieren von Proben und Zählen von KBE erheblich Zeit. Die in diesem Protokoll beschriebene Methode erfordert, dass die Schritte an drei verschiedenen Tagen ausgeführt werden. Am ersten Tag wird ca. 1 h benötigt, um die Puffer und Medien (ohne Sterilisationszeit) vorzubereiten und die Ausgangskultur von C. albicans für die Inkubation über Nacht zu beimpfen. Am zweiten...
Diskussion
Dieses Protokoll beschreibt einen effizienten Ansatz zur Gewinnung quantitativer Daten zur antimykotischen Aktivität von AMPs gegen den Pilzerreger C. albicans. Ein gängiger alternativer Ansatz zum Testen von Peptiden und anderen Antimykotika ist die Bouillon-Mikrodilution, die im Standard M2718 des Clinical Laboratory Standards Institute (CLSI) beschrieben ist, aber dieser Standard konzentriert sich auf die Erzielung qualitativer visueller Ergebnisse anstelle von quantitativen Ergebnis...
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health (R03DE029270, T32AI089621B), der National Science Foundation (CBET 1511718), dem Bildungsministerium (GAANN-P200A180093) und einem Cross-Campus Seed Grant der University of Maryland unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well plates (round bottom) | VWR | 10062-902 | |
| Absorbance microplate reader | N/A | N/A | Any available microplate reader is sufficient |
| C. albicans strain SC5314 | ATCC | MYA-2876 | Other C. albicans may also be used |
| Hemocytometer | N/A | N/A | Can be used to make a standard curve relating cell number to OD600 |
| Microplate shaker | VWR | 2620-926 | |
| Peptide(s) | N/A | N/A | Peptides can be commercially synthesized by any reliable vendor; a purity of ≥95% and trifluoroacetic acid salt removal to hydrochloride salt are recommended |
| Reagent reservoirs for multichannel pipettors | VWR | 18900-320 | Simplifies pipetting into multiwell plates with multichannel pipettor |
| Sodium phosphate, dibasic | Fisher Scientific | BP332-500 | For making NaPB |
| Sodium phosphate, monobasic | Fisher Scientific | BP329-500 | For making NaPB |
| UV spectrophotometer | N/A | N/A | Any available UV spectrophotometer is sufficient |
| YPD medium powder | BD Life Sciences | 242820 | May also be made from yeast extract, peptone, and dextrose |
Referenzen
- Gulati, M., Nobile, C. J. Candida albicans biofilms: Development, regulation, and molecular mechanisms. Microbes and Infection. 18 (5), 310-321 (2016).
- Arya, N. R., Rafiq, N. B. Candidiasis. StatPearls. , (2021).
- de Oliveira Santos, G. C., et al. Candida infections and therapeutic strategies: Mechanisms of action for traditional and alternative agents. Frontiers in Microbiology. 9, 1351 (2018).
- Espinel-Ingroff, A. Mechanisms of resistance to antifungal agents: Yeasts and filamentous fungi. Revista Iberoamericana de Micología. 25 (2), 101-106 (2008).
- Wang, X., et al. Delivery strategies of amphotericin B for invasive fungal infections. Acta Pharmaceutica Sinica B. 11 (8), 2585-2604 (2021).
- Struyfs, C., Cammue, B. P. A., Thevissen, K. Membrane-interacting antifungal peptides. Frontiers in Cell and Developmental Biology. 9, 649875 (2021).
- Huan, Y., Kong, Q., Mou, H., Yi, H. Antimicrobial peptides: Classification, design, application and research progress in multiple fields. Frontiers in Microbiology. 11, 582779 (2020).
- Sarkar, T., Chetia, M., Chatterjee, S. Antimicrobial peptides and proteins: From nature's reservoir to the laboratory and beyond. Frontiers in Chemistry. 9, 691532 (2021).
- Mahlapuu, M., Bjorn, C., Ekblom, J. Antimicrobial peptides as therapeutic agents: Opportunities and challenges. Critical Reviews in Biotechnology. 40 (7), 978-992 (2020).
- Lei, J., et al. The antimicrobial peptides and their potential clinical applications. American Journal of Translational Research. 11 (7), 3919-3931 (2019).
- Mercer, D. K., O'Neil, D. A. Innate inspiration: Antifungal peptides and other immunotherapeutics from the host immune response. Frontiers in Immunology. 11, 2177 (2020).
- Bin Hafeez, A., Jiang, X., Bergen, P. J., Zhu, Y. Antimicrobial peptides: An update on classifications and databases. International Journal of Molecular Sciences. 22 (21), 11691 (2021).
- Xu, T., Levitz, S. M., Diamond, R. D., Oppenheim, F. G. Anticandidal activity of major human salivary histatins. Infection and Immunity. 59 (8), 2549-2554 (1991).
- Helmerhorst, E. J., et al. Amphotericin B- and fluconazole-resistant Candida spp., Aspergillus fumigatus, and other newly emerging pathogenic fungi are susceptible to basic antifungal peptides. Antimicrobial Agents and Chemotherapy. 43 (3), 702-704 (1999).
- Andra, J., Berninghausen, O., Leippe, M. Cecropins, antibacterial peptides from insects and mammals, are potently fungicidal against Candida albicans. Medical Microbiology and Immunology. 189, 169-173 (2001).
- do Nascimento Dias, J., et al. Mechanisms of action of antimicrobial peptides ToAP2 and NDBP-5.7 against Candida albicans planktonic and biofilm cells. Scientific Reports. 10, 10327 (2020).
- Ikonomova, S. P., et al. Effects of histatin 5 modifications on antifungal activity and kinetics of proteolysis. Protein Science. 29, 480-493 (2020).
- Clinical Laboratory Standards Institute. . M27-A3. Reference method for broth dilution antifungal susceptibility testing of yeasts; Approved standard - Third edition. , (2008).
- Lupetti, A., et al. Candidacidal activities of human lactoferrin peptides derived from the N terminus. Antimicrobial Agents and Chemotherapy. 44 (12), 3257-3263 (2000).
- Han, J., Jyoti, M. A., Song, H. Y., Jang, W. S. Antifungal activity and action mechanism of histatin 5-halocidin hybrid peptides against Candida ssp. PLoS One. 11 (2), 0150196 (2016).
- den Hertog, A. L., et al. Candidacidal effects of two antimicrobial peptides: histatin 5 causes small membrane defects, but LL-37 causes massive disruption of the cell membrane. Biochemical Journal. 388, 689-695 (2005).
- Ikonomova, S. P., Moghaddam-Taaheri, P., Jabra-Rizk, M. A., Wang, Y., Karlsson, A. J. Engineering improved variants of the antifungal peptide histatin 5 with reduced susceptibility to Candida albicans secreted aspartic proteases and enhanced antimicrobial potency. The FEBS Journal. 285 (1), 146-159 (2018).
- Moghaddam-Taaheri, P., Leissa, J. A., Eppler, H. B., Jewell, C. M., Karlsson, A. J. Histatin 5 variant reduces Candida albicans biofilm viability and inhibits biofilm formation. Fungal Genetics and Biology. 149, 103529 (2021).
- Gong, Z., Doolin, M. T., Adhikari, S., Stroka, K. M., Karlsson, A. J. Role of charge and hydrophobicity in translocation of cell-penetrating peptides into Candida albicans cells. AIChE Journal. 65 (12), 16768 (2019).
- Gong, Z., Karlsson, A. J. Translocation of cell-penetrating peptides into Candida fungal pathogens. Protein Science. 26 (9), 1714-1725 (2017).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. Fourth edition. 3, (2012).
- Consolidated Sterilizer Systems. Laboratory and Research Autoclaves Available from: https://consteril.com/wp-content/uploads/2020/12/CSS-Product-Brochure.pdf (2022)
- Rodriguez-Tudela, J. L., Cuenca-Estrella, M., Diaz-Guerra, T. M., Mellado, E. Standardization of antifungal susceptibility variables for a semiautomated methodology. Journal of Clinical Microbiology. 39 (7), 2513-2517 (2001).
- Mbuayama, K. R., Taute, H., Strmstedt, A. A., Bester, M. J., Gaspar, A. R. M. Antifungal activity and mode of action of synthetic peptides derived from the tick OsDef2 defensin. Journal of Peptide Science. 28 (5), 3383 (2022).
- Rossignol, T., Kelly, B., Dobson, C., d'Enfert, C. Endocytosis-mediated vacuolar accumulation of the human ApoE apolipoprotein-derived ApoEdpL-W antimicrobial peptide contributes to its antifungal activity in Candida albicans. Antimicrobial Agents and Chemotherapy. 55 (10), 4670-4681 (2011).
- Helmerhorst, E. J., Reijnders, I. M., van't Hof, W., Veerman, E. C., Nieuw Amerongen, A. V. A critical comparison of the hemolytic and fungicidal activities of cationic antimicrobial peptides. FEBS Letters. 449 (2-3), 105-110 (1999).
- Kerenga, B. K., et al. Salt-tolerant antifungal and antibacterial activities of the corn defensin ZmD32. Frontiers in Microbiology. 10, 795 (2019).
- Lee, I. H., Cho, Y., Lehrer, R. I. Effects of pH and salinity on the antimicrobial properties of clavanins. Infection and Immunity. 65 (7), 2898-2903 (1997).
- Li, X. S., Reddy, M. S., Baev, D., Edgerton, M. Candida albicans Ssa1/2p is the cell envelope binding protein for human salivary histatin 5. Journal of Biological Chemistry. 278 (31), 28553-28561 (2003).
- Rothstein, D. M., et al. Anticandida activity is retained in P-113, a 12-amino-acid fragment of histatin 5. Antimicrobial Agents and Chemotherapy. 45 (5), 1367-1373 (2001).
- Sanders, E. R. Aseptic laboratory techniques: Volume transfers with serological pipettes and micropipettors. Journal of Visualized Experiments. (63), e2754 (2012).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Report. 26, 100987 (2021).
- Goughenour, K. D., Balada-Llasat, J. M., Rappleye, C. A. Quantitative microplate-based growth assay for determination of antifungal susceptibility of Histoplasma capsulatum yeasts. Journal of Clinical Microbiology. 53 (10), 3286-3295 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten