È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificare l'attività antifungina dei peptidi contro la Candida albicans
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per ottenere dati quantitativi sull'attività antifungina di peptidi e altri composti, come agenti antifungini a piccole molecole, contro la Candida albicans. Il suo uso della densità ottica piuttosto che contare le unità formanti colonie per quantificare l'inibizione della crescita consente di risparmiare tempo e risorse.
Abstract
I metodi tradizionali per eseguire test di sensibilità antifungina per Candida albicans richiedono molto tempo e mancano di risultati quantitativi. Ad esempio, un approccio comune si basa sulla placcatura delle cellule trattate con diverse concentrazioni di molecole antifungine su piastre di agar e quindi sul conteggio delle colonie per determinare la relazione tra concentrazione molecolare e inibizione della crescita. Questo metodo richiede molte piastre e un tempo considerevole per contare le colonie. Un altro approccio comune elimina le piastre e il conteggio delle colonie ispezionando visivamente le colture trattate con agenti antifungini per identificare la concentrazione minima richiesta per inibire la crescita; Tuttavia, l'ispezione visiva produce solo risultati qualitativi e le informazioni sulla crescita a concentrazioni subinibitorie vengono perse. Questo protocollo descrive un metodo per misurare la suscettibilità di C. albicans ai peptidi antifungini. Basandosi su misurazioni della densità ottica delle colture, il metodo riduce il tempo e i materiali necessari per ottenere risultati quantitativi sulla crescita delle colture a diverse concentrazioni peptidiche. L'incubazione del fungo con peptidi viene eseguita in una piastra a 96 pozzetti utilizzando un tampone appropriato, con controlli che rappresentano nessuna inibizione della crescita e completa inibizione della crescita. Dopo l'incubazione con il peptide, le sospensioni cellulari risultanti vengono diluite per ridurre l'attività del peptide e quindi coltivate durante la notte. Dopo la crescita durante la notte, la densità ottica di ciascun pozzetto viene misurata e confrontata con i controlli positivi e negativi per calcolare l'inibizione della crescita risultante a ciascuna concentrazione di peptidi. I risultati che utilizzano questo test sono paragonabili ai risultati che utilizzano il metodo tradizionale di placcatura delle colture su piastre di agar, ma questo protocollo riduce i rifiuti di plastica e il tempo speso per contare le colonie. Sebbene le applicazioni di questo protocollo si siano concentrate sui peptidi antifungini, il metodo sarà applicabile anche alla sperimentazione di altre molecole con attività antifungina nota o sospetta.
Introduzione
Candida albicans è un membro del microbiota umano che colonizza numerose località, tra cui la cavità orale, la pelle, il tratto gastrointestinale e la vagina1. Per i pazienti immunocompromessi a causa di malattie come il virus dell'immunodeficienza umana (HIV) e trattamenti immunosoppressivi, la colonizzazione di C. albicans può portare a candidosi locale o sistemica 2,3. L'uso di terapie antifungine a piccole molecole attualmente disponibili, come amfotericina B, azoli o echinocandine, può essere complicato da problemi di solubilità e tossicità e dalla resistenza delle infezioni alle terapie 4,5. A causa dei limiti degli attuali agenti antifungini, i ricercatori sono continuamente alla ricerca di nuove molecole antifungine con attività contro C. albicans.
I peptidi antimicrobici (AMP) sono una potenziale alternativa agli attuali agenti antifungini a piccole molecole 6,7,8 e si propone che siano meno suscettibili allo sviluppo di resistenza rispetto ai farmaci a piccole molecole 9. Gli AMP sono un insieme diversificato di peptidi, ma sono spesso cationici, con un ampio spettro di attività10,11,12. Gli AMP con attività contro C. albicans includono peptidi ben noti delle famiglie di istatina e cecropina 13,14,15, insieme a peptidi descritti più recentemente come ToAP2, NDBP-5.7 e la variante dell'istatina 5 K11R-K17R16,17. A causa del loro potenziale per il trattamento delle infezioni da Candida, identificare e progettare nuovi AMP che colpiscono C. albicans è un obiettivo importante per molti gruppi di ricerca.
Come parte del processo per sviluppare AMP efficaci (e altri agenti antifungini) che colpiscono C. albicans, i test in vitro sono comunemente usati per identificare peptidi promettenti. I metodi per testare l'attività antifungina contro C. albicans implicano tipicamente l'incubazione di cellule con diluizioni seriali degli AMP (in tampone o mezzo) in piastre a 96 pozzetti. Sono disponibili diversi metodi per valutare l'attività antifungina dopo l'incubazione. Una tecnica descritta dal Clinical Laboratory Standards Institute utilizza una valutazione puramente visiva della torbidità dei pozzetti per determinare la concentrazione minima (MIC) per la completa inibizione della crescita (almeno il 50% di inibizione per agenti antifungini selezionati, come azoli ed echinocandine) e non fornisce alcuna quantificazione della crescita a concentrazioni sub-MIC18 . Un altro approccio comunemente usato consiste nel quantificare la vitalità dopo l'incubazione con AMP placcando il contenuto dei pozzetti su piastre di agar, incubando le piastre e quindi contando il numero di unità formanti colonie (CFU) sulla piastra. Questo metodo è stato utilizzato per valutare un certo numero di peptidi, tra cui peptidi a base di istatina 5, LL-37 e lattoferrina umana 19,20,21. Questa tecnica richiede un volume relativamente grande di agar e un numero elevato di piastre e comporta il noioso conteggio dei CFU sulle piastre. Per ottenere più dati quantitativi generando meno rifiuti di plastica ed evitando il conteggio dei CFU, il contenuto dei pozzi può essere utilizzato per inoculare il terreno fresco in un'altra piastra da 96 pozzetti. Dopo aver incubato la piastra appena inoculata, la crescita può essere quantificata misurando la densità ottica a 600 nm (OD600) su un lettore di piastre di assorbanza. Questo metodo è stato utilizzato per determinare l'attività antifungina dell'istatina 5 e dei suoi frammenti di degradazione e peptidi penetranti nelle cellule 17,22,23,24,25.
Questo protocollo descrive come testare l'attività antifungina dei peptidi e utilizza il metodo OD600 per quantificare la riduzione della vitalità di C. albicans dovuta ai peptidi.
Protocollo
L'approvazione è stata ottenuta dall'Università del Maryland, College Park, Institutional Biosafety Committee (IBC) per il lavoro con C. albicans in questo protocollo (PN 274). Il ceppo SC5314 di C. albicans (vedi tabella dei materiali) è stato utilizzato nel presente studio; tuttavia, può essere utilizzato anche qualsiasi altro ceppo.
1. Preparazione del tampone, dell'acqua sterile e del terreno di coltura
- Preparare un tampone sterile di fosfato di sodio 0,1 M (NaPB)26 a pH 7,4 e diluire a 2 mM e 1 mM con acqua sterile. La preparazione di 100 mL ciascuno di 2 mM NaPB e 1 mM NaPB sarà più che sufficiente per la maggior parte delle applicazioni di questo protocollo.
- Preparare lievito liquido sterile-peptone-destrosio (YPD, vedi tabella dei materiali) medio (10 g/L di estratto di lievito, 20 g/L di destrosio, 20 g/L di peptone). La preparazione di 100 ml di YPD sarà più che sufficiente per la maggior parte delle applicazioni di questo protocollo.
- Preparare acqua ultrapura sterile. La preparazione di 100 ml di acqua sarà più che sufficiente per la maggior parte delle applicazioni di questo protocollo.
NOTA: I tamponi, i mezzi e l'acqua vengono sterilizzati in autoclave a 121 °C su un ciclo liquido per un tempo adeguato in base al volume nei contenitori in autoclave27. Ad esempio, per le bottiglie contenenti 500 ml, il tempo di esposizione dovrebbe essere di 40 minuti.
2. Inoculazione, coltivazione e subcoltura di C. albicans
ATTENZIONE: Seguire tutte le normative istituzionali e governative per lavorare con C. albicans, che è spesso classificato dagli istituti di ricerca accademici come organismo di livello di biosicurezza (BSL) 2 indipendentemente dalla resistenza ai farmaci e dall'American Type Culture Collection (ATCC) come organismo BSL1 o BSL2, a seconda della resistenza ai farmaci del ceppo28.
NOTA: Eseguire le parti di inoculazione e coltura di questo passaggio (fasi 2.1-2.2) il giorno prima di iniziare il test per l'attività antifungina. Se possibile, eseguire tutte le fasi del protocollo con le cellule (e le soluzioni che verranno incubate con le cellule) in un armadio di biosicurezza.
- Inoculare il ceppo desiderato di C. albicans in 10 mL di terreno YPD in una provetta di coltura.
NOTA: la coltura può essere inoculata da un congelatore o da una piastra di agar, ma è necessario utilizzare una fonte coerente per tutti i dati che verranno confrontati. - Coltivare la coltura durante la notte (~12-16 h) a 30 °C e 230 giri/min su uno shaker rotante.
- Sottocultura la cultura notturna di C. albicans, e crescere fino a un OD600 di ~1.0-1.2.
- Misurare l'OD600 della coltura notturna utilizzando uno spettrofotometro UV (vedi Tabella dei materiali).
- Sulla base dell'OD 600 della coltura notturna, utilizzare la coltura notturna per inoculare una sottocoltura a un OD600 di 0,1 in10 mL di YPD.
- Coltivare la sottocoltura a 30 °C su uno shaker rotativo a 230 rpm fino a quando l'OD600 raggiunge ~1.0-1.2, che probabilmente richiederà 4-6 ore. Completare la fase 3 (preparazione di soluzioni peptidiche) mentre la sottocoltura sta crescendo; La sottocoltura sarà diluita per l'uso nel test nella fase 4.
3. Preparazione delle soluzioni peptidiche in una piastra a 96 pozzetti
NOTA: Questo passaggio può essere eseguito in anticipo, se le soluzioni di stock di peptidi sono stabili durante la conservazione. Tipicamente, le soluzioni peptidiche vengono conservate a -20 °C fino all'uso. Possono essere scongelati a bagnomaria a temperatura ambiente prima di procedere al passaggio successivo.
- Determinare la concentrazione più alta di ciascun peptide da testare nel test. Questo varierà in base ai peptidi selezionati. Per i dati presentati nella sezione dei risultati rappresentativi, sono stati testati l'istatina 5 e gli analoghi ingegnerizzati22 e la concentrazione più alta testata è stata di 50 μM.
NOTA: La concentrazione massima da testare viene determinata utilizzando i dati riportati in letteratura o eseguendo esperimenti preliminari su un'ampia gamma di concentrazioni peptidiche. Quando possibile, dovrebbe essere selezionata la concentrazione più elevata per osservare un plateau per una riduzione completa della vitalità alle concentrazioni più elevate testate e un plateau per nessuna riduzione della vitalità alle concentrazioni più basse testate, consentendo la quantificazione dell'intera gamma di attività peptidica. - Sciogliere ogni peptide in acqua sterile al doppio della massima concentrazione desiderata. Per i dati presentati nella sezione dei risultati rappresentativi, 150 μL di soluzioni da 100 μM di istatina 5 e analoghi ingegnerizzati sono stati preparati in acqua sterile.
NOTA: Se un peptide non è solubile in acqua, la solubilizzazione in un altro solvente può essere necessaria prima di questa fase. Il dimetilsolfossido (DMSO) è comunemente usato per solubilizzare i peptidi ad alta concentrazione prima di diluire alla concentrazione di lavoro. Assicurarsi che la concentrazione finale del DMSO sia dell'1% (v/v) o inferiorea 29 e che i solventi alternativi non influenzino la crescita delle cellule. Inoltre, assicurarsi che la concentrazione di solvente sia mantenuta costante in tutti i pozzetti nei passaggi 3.4-3.5. - Aggiungere 40 μL delle soluzioni di riserva peptidica desiderate al primo pozzetto (colonna 1) di ogni riga in una piastra di coltura a 96 pozzetti a fondo arrotondato (vedere Tabella dei materiali). Questa piastra è la Tavola 1 (Figura 1).
NOTA: Ogni piastra ha otto righe che vengono utilizzate per testare i peptidi. Queste righe possono essere utilizzate per diversi peptidi o per repliche degli stessi peptidi. Includi solo un singolo peptide in ogni riga. - Aggiungere 20 μL di acqua ultrapura sterile alla colonna da 2 a colonna 12 delle righe contenenti peptide (Figura 1).
NOTA: Se i materiali di prova peptidici sono stati preparati con un solvente diverso dall'acqua pura nella fase 3.2, l'acqua sterile in questa fase deve essere sostituita con il solvente presente nello stock di peptidi aggiunto alla prima colonna. Ad esempio, se il peptide è stato solubilizzato in DMSO e lo stock peptidico contiene l'1% (v/v) di DMSO in acqua, l'acqua contenente l'1% di DMSO deve essere aggiunta alla colonna 2 alla colonna 12. - Diluire serialmente le soluzioni di peptide attraverso la piastra fino alla colonna 10 (Figura 1).
NOTA: Invece di eseguire le diluizioni seriali nella piastra come descritto di seguito, le diluizioni potrebbero anche essere eseguite in tubi di microcentrifuga e trasferiti sulla piastra a 96 pozzetti.- Rimuovere 20 μL dalla colonna 1, trasferirli nella colonna 2 e mescolare mediante pipettaggio su e giù. La colonna 2 contiene ora 40 μL di soluzione peptidica ad una diluizione 1:2 della concentrazione nella colonna 1.
- Rimuovere 20 μL dalla colonna 2, trasferirli nella colonna 3 e mescolare mediante pipettaggio su e giù, in modo che la colonna 3 contenga ora 40 μL di soluzione peptidica a una diluizione 1:4 della concentrazione nella colonna 1.
- Ripetere questo processo fino a quando la colonna 10 contiene 40 μL di soluzione peptidica ad una diluizione 1:512 della concentrazione nella colonna 1.
- Rimuovere 20 μL di soluzione peptidica dalla colonna 10 ed eliminarla. Ogni colonna contiene ora 20 μL di soluzione peptidica (colonne 1-10) o acqua (colonna 11 e colonna 12).
NOTA: I pozzetti nella colonna 11 servono come controlli di sterilità e i pozzetti nella colonna 12 servono come controlli che non contengono peptidi.
4. Diluizione della sottocultura di C. albicans
NOTA: iniziare questo passaggio dopo che la sottocultura ha raggiunto un OD600 di ~1.0-1.2 (passaggio 2.3.3).
- Trasferire la sottocoltura in una provetta da centrifuga da 15 ml e centrifugare a 3.900 x g per 3 minuti a temperatura ambiente per pellettare le cellule. Rimuovere il surnatante mediante pipettaggio o decantazione.
- Risospendere il pellet con 1 mL di 2 mM NaPB (fase 1.1) e trasferire la sospensione in una provetta da centrifuga da 1,7 mL.
- Pellet le cellule (come al punto 4.1), scartare il surnatante e risospendere nuovamente il pellet in 1 mL di 2 mM NaPB.
- Ripetere il punto 4.3 altre due volte per lasciare le celle lavate in 1 mL di 2 mM NaPB.
- Determinare la densità cellulare della sospensione lavata e calcolare il fattore di diluizione necessario per ottenere una densità cellulare di 5 x 105 celle/ml. Questa concentrazione alla fine porterà ad aggiungere 1 x 104 cellule a ciascun pozzetto della piastra a 96 pozzetti.
NOTA: La densità cellulare della sospensione può essere determinata utilizzando una serie di metodi, tra cui un emocitometro o un contatore automatico delle cellule. Per il presente studio è stata utilizzata una curva standard della densità cellulare rispetto a OD600 per il ceppo di interesse coltivato in condizioni rilevanti. Questa curva è stata preparata utilizzando un emocitometro (vedi Tabella dei materiali) per determinare la densità cellulare delle sospensioni con valori variabili di OD600 . - Diluire la sospensione cellulare a 5 x 105 cellule/ml in 2 mM NaPB. La preparazione di 10 ml di questa sospensione diluita sarà più che sufficiente per completare questo studio.
5. Incubazione di C. albicans con soluzioni peptidiche e preparazione delle cellule per la quantificazione della vitalità
- Aggiungere 20 μL della sospensione diluita di C. albicans (fase 4.6 ) alle colonne da 1 a 10 e alla colonna 12 di ciascuna riga (figura 1).
NOTA: La concentrazione finale di peptidi nella prima colonna è ora la metà della concentrazione di stock peptidico. Per il presente studio, la concentrazione finale del peptide era di 50 μM a questo punto. La sospensione cellulare finale in ciascun pozzetto contiene 2,5 x 105 cellule / ml. Le colonne 1-10 fungono da pozzetti sperimentali per valutare l'attività antifungina a diverse concentrazioni di peptidi e la colonna 12 funge da controllo per la crescita senza peptide. - Aggiungere 20 μL di 2 mM NaPB alla colonna 11. Tutti i pozzi hanno ora una concentrazione finale di 1 mM NaPB. La colonna 11 funge da controllo della sterilità.
- Coprire la piastra 1 (contenente sia le cellule che il peptide) e incubarla a 30 °C per 30 minuti.
NOTA: Un tempo di incubazione di 30 minuti è sufficiente per molti peptidi 17,21,22,30, ma il tempo di incubazione può essere aumentato a 60 minuti se lo si desidera per tenere conto dei peptidi che possono richiedere un tempo più lungo per esercitare la loro attività antifungina 25,31,32. - Preparare una nuova piastra di coltura a 96 pozzetti (Tavola 2) da utilizzare per quantificare la vitalità (Figura 2).
NOTA: La piastra di coltura deve essere preparata durante l'incubazione della piastra 1.- Aggiungere 100 μL di YPD (fase 1.2) a tutti i pozzetti della piastra.
- Aggiungere 100 μL di 2 mM NaPB (Passo 1.1) a tutti i pozzetti della piastra.
- Diluire i campioni nella piastra 1 (contenente cellule e peptidi) e trasferirli nella piastra 2 (contenente terreno e tampone).
- Recuperare la piastra 1 dall'incubatrice dopo i 30 minuti di incubazione.
- Diluire ciascun pozzetto della piastra 1 aggiungendo 280 μL di 1 mM NaPB (fase 1.1) per un volume totale di 320 μL in ciascun pozzetto (Figura 2).
- Mescolare tutti i pozzetti contenenti cellule e peptidi pipettando su e giù per garantire che tutte le cellule siano risospese e che nessuna cellula stabilizzata sia visibile sul fondo dei pozzetti.
- Trasferire 8 μL da ciascun pozzetto nella piastra 1 al pozzetto corrispondente della piastra 2. Questo volume trasferisce circa 250 celle da ciascun pozzetto della Piastra 1 alla Piastra 2 (Figura 2).
- Coprire la piastra 2 e incubare su uno scuotitore a piastre microtitolanti (vedi tabella dei materiali) a 350 giri/min per 17 ore a 30 °C.
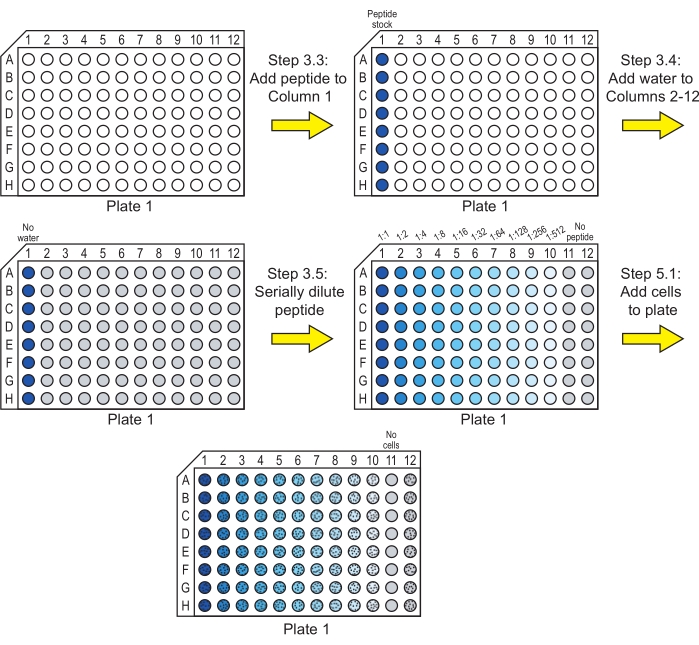
Figura 1: Preparazione della piastra 1 per l'incubazione di diluizioni seriali peptidiche con cellule. Le diluizioni seriali del peptide sono fatte in acqua e le cellule di C. albicans vengono aggiunte alla piastra 1. Un colore blu indica che il peptide è presente nel pozzo e il grigio indica un pozzo con acqua e nessun peptide. I pozzetti contenenti cellule sono indicati con un motivo di punti neri. Dopo questi passaggi, la piastra viene incubata per consentire al peptide di esercitare la sua attività antifungina. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Preparazione della piastra 2 per quantificare la riduzione della vitalità dovuta al peptide. YPD medium e NaPB vengono aggiunti alla piastra 2. Dopo aver diluito il contenuto della piastra 1, un'aliquota di ciascun pozzetto viene trasferita dalla piastra 1 alla piastra 2. La piastra 2 viene quindi incubata per consentire a qualsiasi cellula vitale di crescere per la quantificazione misurando l'OD600. Per la Tavola 2, i pozzi contenenti solo YPD e NaPB sono mostrati in arancione. I pozzetti contenenti aliquote della Piastra 1 mescolate con YPD e NaPB sono mostrati in verde. Vedere la legenda della Figura 1 per la descrizione dei colori sulla Tavola 1. Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Determinazione dell'attività antifungina
- Ottenere letture OD600 per ciascun pozzetto nella piastra 2.
- Rimuovere la piastra 2 dall'incubatore dopo 17 ore di incubazione.
- Mescolare tutti i pozzetti nella piastra 2 mediante pipettaggio su e giù per assicurarsi che tutte le celle siano risospese e che nessuna cella stabilizzata sia visibile sul fondo dei pozzetti.
NOTA: evitare di generare bolle durante questo passaggio, poiché potrebbero interferire con le letture OD600 . Se si formano delle bolle, spesso possono essere fatte scoppiare con una punta di pipetta asciutta o rimosse usando due punte di pipetta per sollevarle dal pozzo. - Utilizzare un lettore di piastre assorbenti (vedere Tabella dei materiali) ad una lunghezza d'onda di 600 nm per ottenere l'OD600 per ciascun pozzetto.
- Calcola l'inibizione della crescita (in percentuale) e tracciala per determinare l'effetto dei peptidi sulla crescita di C. albicans.
- Per ogni pozzo, calcolare la riduzione della vitalità rispetto al controllo (in percentuale) utilizzando la seguente equazione 17,22,23:
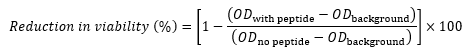
dove OD con peptide è l'OD 600 di un pozzetto contenente una data concentrazione di peptide, losfondo OD è l'OD600 della colonna 11 nella stessa riga (controllo che non contiene cellule), e
OD no peptide è l'OD600 della colonna 12 nella stessa riga (controllo contenente cellule e nessun peptide). - Ad esempio, utilizzare l'espressione seguente per calcolare la riduzione della redditività nel pozzo B5 dai valori OD600 per la riga B:
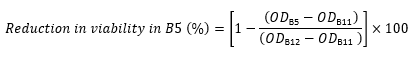
- Per ogni pozzo, calcolare la riduzione della vitalità rispetto al controllo (in percentuale) utilizzando la seguente equazione 17,22,23:
- Tracciare la riduzione della vitalità in funzione della concentrazione di peptidi.
Risultati
L'utilizzo delle misurazioni OD600 per quantificare la riduzione della crescita dovuta ai peptidi antifungini consente di risparmiare tempo rispetto ai campioni di placcatura e al conteggio dei CFU. Il metodo descritto in questo protocollo richiede il completamento dei passaggi in tre giorni diversi. Il primo giorno, è necessaria circa 1 ora per preparare i tamponi e i mezzi (escluso il tempo di sterilizzazione) e inoculare la coltura iniziale di C. albicans per l'incubazione notturna. Il secondo gio...
Discussione
Questo protocollo descrive un approccio efficiente per ottenere dati quantitativi sull'attività antifungina degli AMP contro il patogeno fungino C. albicans. Un approccio alternativo comune per testare peptidi e altri agenti antifungini è la microdiluizione del brodo descritta nello standard M2718 del Clinical Laboratory Standards Institute (CLSI), ma questo standard si concentra sull'ottenimento di risultati visivi qualitativi anziché quantitativi. Un altro approccio alternativo è qu...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health (R03DE029270, T32AI089621B), dalla National Science Foundation (CBET 1511718), dal Dipartimento dell'Istruzione (GAANN-P200A180093) e da un Cross Campus Seed Grant dell'Università del Maryland.
Materiali
| Name | Company | Catalog Number | Comments |
| 96-well plates (round bottom) | VWR | 10062-902 | |
| Absorbance microplate reader | N/A | N/A | Any available microplate reader is sufficient |
| C. albicans strain SC5314 | ATCC | MYA-2876 | Other C. albicans may also be used |
| Hemocytometer | N/A | N/A | Can be used to make a standard curve relating cell number to OD600 |
| Microplate shaker | VWR | 2620-926 | |
| Peptide(s) | N/A | N/A | Peptides can be commercially synthesized by any reliable vendor; a purity of ≥95% and trifluoroacetic acid salt removal to hydrochloride salt are recommended |
| Reagent reservoirs for multichannel pipettors | VWR | 18900-320 | Simplifies pipetting into multiwell plates with multichannel pipettor |
| Sodium phosphate, dibasic | Fisher Scientific | BP332-500 | For making NaPB |
| Sodium phosphate, monobasic | Fisher Scientific | BP329-500 | For making NaPB |
| UV spectrophotometer | N/A | N/A | Any available UV spectrophotometer is sufficient |
| YPD medium powder | BD Life Sciences | 242820 | May also be made from yeast extract, peptone, and dextrose |
Riferimenti
- Gulati, M., Nobile, C. J. Candida albicans biofilms: Development, regulation, and molecular mechanisms. Microbes and Infection. 18 (5), 310-321 (2016).
- Arya, N. R., Rafiq, N. B. Candidiasis. StatPearls. , (2021).
- de Oliveira Santos, G. C., et al. Candida infections and therapeutic strategies: Mechanisms of action for traditional and alternative agents. Frontiers in Microbiology. 9, 1351 (2018).
- Espinel-Ingroff, A. Mechanisms of resistance to antifungal agents: Yeasts and filamentous fungi. Revista Iberoamericana de Micología. 25 (2), 101-106 (2008).
- Wang, X., et al. Delivery strategies of amphotericin B for invasive fungal infections. Acta Pharmaceutica Sinica B. 11 (8), 2585-2604 (2021).
- Struyfs, C., Cammue, B. P. A., Thevissen, K. Membrane-interacting antifungal peptides. Frontiers in Cell and Developmental Biology. 9, 649875 (2021).
- Huan, Y., Kong, Q., Mou, H., Yi, H. Antimicrobial peptides: Classification, design, application and research progress in multiple fields. Frontiers in Microbiology. 11, 582779 (2020).
- Sarkar, T., Chetia, M., Chatterjee, S. Antimicrobial peptides and proteins: From nature's reservoir to the laboratory and beyond. Frontiers in Chemistry. 9, 691532 (2021).
- Mahlapuu, M., Bjorn, C., Ekblom, J. Antimicrobial peptides as therapeutic agents: Opportunities and challenges. Critical Reviews in Biotechnology. 40 (7), 978-992 (2020).
- Lei, J., et al. The antimicrobial peptides and their potential clinical applications. American Journal of Translational Research. 11 (7), 3919-3931 (2019).
- Mercer, D. K., O'Neil, D. A. Innate inspiration: Antifungal peptides and other immunotherapeutics from the host immune response. Frontiers in Immunology. 11, 2177 (2020).
- Bin Hafeez, A., Jiang, X., Bergen, P. J., Zhu, Y. Antimicrobial peptides: An update on classifications and databases. International Journal of Molecular Sciences. 22 (21), 11691 (2021).
- Xu, T., Levitz, S. M., Diamond, R. D., Oppenheim, F. G. Anticandidal activity of major human salivary histatins. Infection and Immunity. 59 (8), 2549-2554 (1991).
- Helmerhorst, E. J., et al. Amphotericin B- and fluconazole-resistant Candida spp., Aspergillus fumigatus, and other newly emerging pathogenic fungi are susceptible to basic antifungal peptides. Antimicrobial Agents and Chemotherapy. 43 (3), 702-704 (1999).
- Andra, J., Berninghausen, O., Leippe, M. Cecropins, antibacterial peptides from insects and mammals, are potently fungicidal against Candida albicans. Medical Microbiology and Immunology. 189, 169-173 (2001).
- do Nascimento Dias, J., et al. Mechanisms of action of antimicrobial peptides ToAP2 and NDBP-5.7 against Candida albicans planktonic and biofilm cells. Scientific Reports. 10, 10327 (2020).
- Ikonomova, S. P., et al. Effects of histatin 5 modifications on antifungal activity and kinetics of proteolysis. Protein Science. 29, 480-493 (2020).
- Clinical Laboratory Standards Institute. . M27-A3. Reference method for broth dilution antifungal susceptibility testing of yeasts; Approved standard - Third edition. , (2008).
- Lupetti, A., et al. Candidacidal activities of human lactoferrin peptides derived from the N terminus. Antimicrobial Agents and Chemotherapy. 44 (12), 3257-3263 (2000).
- Han, J., Jyoti, M. A., Song, H. Y., Jang, W. S. Antifungal activity and action mechanism of histatin 5-halocidin hybrid peptides against Candida ssp. PLoS One. 11 (2), 0150196 (2016).
- den Hertog, A. L., et al. Candidacidal effects of two antimicrobial peptides: histatin 5 causes small membrane defects, but LL-37 causes massive disruption of the cell membrane. Biochemical Journal. 388, 689-695 (2005).
- Ikonomova, S. P., Moghaddam-Taaheri, P., Jabra-Rizk, M. A., Wang, Y., Karlsson, A. J. Engineering improved variants of the antifungal peptide histatin 5 with reduced susceptibility to Candida albicans secreted aspartic proteases and enhanced antimicrobial potency. The FEBS Journal. 285 (1), 146-159 (2018).
- Moghaddam-Taaheri, P., Leissa, J. A., Eppler, H. B., Jewell, C. M., Karlsson, A. J. Histatin 5 variant reduces Candida albicans biofilm viability and inhibits biofilm formation. Fungal Genetics and Biology. 149, 103529 (2021).
- Gong, Z., Doolin, M. T., Adhikari, S., Stroka, K. M., Karlsson, A. J. Role of charge and hydrophobicity in translocation of cell-penetrating peptides into Candida albicans cells. AIChE Journal. 65 (12), 16768 (2019).
- Gong, Z., Karlsson, A. J. Translocation of cell-penetrating peptides into Candida fungal pathogens. Protein Science. 26 (9), 1714-1725 (2017).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. Fourth edition. 3, (2012).
- Consolidated Sterilizer Systems. Laboratory and Research Autoclaves Available from: https://consteril.com/wp-content/uploads/2020/12/CSS-Product-Brochure.pdf (2022)
- Rodriguez-Tudela, J. L., Cuenca-Estrella, M., Diaz-Guerra, T. M., Mellado, E. Standardization of antifungal susceptibility variables for a semiautomated methodology. Journal of Clinical Microbiology. 39 (7), 2513-2517 (2001).
- Mbuayama, K. R., Taute, H., Strmstedt, A. A., Bester, M. J., Gaspar, A. R. M. Antifungal activity and mode of action of synthetic peptides derived from the tick OsDef2 defensin. Journal of Peptide Science. 28 (5), 3383 (2022).
- Rossignol, T., Kelly, B., Dobson, C., d'Enfert, C. Endocytosis-mediated vacuolar accumulation of the human ApoE apolipoprotein-derived ApoEdpL-W antimicrobial peptide contributes to its antifungal activity in Candida albicans. Antimicrobial Agents and Chemotherapy. 55 (10), 4670-4681 (2011).
- Helmerhorst, E. J., Reijnders, I. M., van't Hof, W., Veerman, E. C., Nieuw Amerongen, A. V. A critical comparison of the hemolytic and fungicidal activities of cationic antimicrobial peptides. FEBS Letters. 449 (2-3), 105-110 (1999).
- Kerenga, B. K., et al. Salt-tolerant antifungal and antibacterial activities of the corn defensin ZmD32. Frontiers in Microbiology. 10, 795 (2019).
- Lee, I. H., Cho, Y., Lehrer, R. I. Effects of pH and salinity on the antimicrobial properties of clavanins. Infection and Immunity. 65 (7), 2898-2903 (1997).
- Li, X. S., Reddy, M. S., Baev, D., Edgerton, M. Candida albicans Ssa1/2p is the cell envelope binding protein for human salivary histatin 5. Journal of Biological Chemistry. 278 (31), 28553-28561 (2003).
- Rothstein, D. M., et al. Anticandida activity is retained in P-113, a 12-amino-acid fragment of histatin 5. Antimicrobial Agents and Chemotherapy. 45 (5), 1367-1373 (2001).
- Sanders, E. R. Aseptic laboratory techniques: Volume transfers with serological pipettes and micropipettors. Journal of Visualized Experiments. (63), e2754 (2012).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Report. 26, 100987 (2021).
- Goughenour, K. D., Balada-Llasat, J. M., Rappleye, C. A. Quantitative microplate-based growth assay for determination of antifungal susceptibility of Histoplasma capsulatum yeasts. Journal of Clinical Microbiology. 53 (10), 3286-3295 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon