このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
カンジダ・アルビカンスに対するペプチドの抗真菌活性の定量化
要約
このプロトコルは、カン ジダ・アルビカンスに対するペプチドおよび他の化合物(例えば、小分子抗真菌剤)の抗真菌活性に関する定量的データを得るための方法を記載する。増殖阻害を定量化するためにコロニー形成単位をカウントするのではなく、光学密度を使用することで、時間とリソースを節約できます。
要約
カン ジダ・アルビカンスの 抗真菌感受性試験を実施する従来の方法は時間がかかり、定量的な結果が得られません。たとえば、一般的なアプローチは、寒天プレート上で異なる濃度の抗真菌分子で処理された細胞をプレーティングし、コロニーをカウントして分子濃度と増殖阻害の関係を決定することに依存しています。この方法では、コロニーを数えるのに多くのプレートとかなりの時間が必要です。別の一般的なアプローチは、抗真菌剤で処理された培養物を視覚的に検査して成長を阻害するのに必要な最小濃度を特定することにより、プレートとコロニーのカウントを排除します。しかし、目視検査では定性的な結果しか得られず、亜阻害濃度での増殖に関する情報は失われます。このプロトコルは、抗真菌ペプチドに対する C.アルビカンスの 感受性を測定するための方法を記載している。培養物の光学密度測定に依存することにより、この方法は、異なるペプチド濃度での培養増殖に関する定量結果を得るために必要な時間と材料を削減します。真菌とペプチドとのインキュベーションは、適切なバッファーを使用して96ウェルプレートで行われ、コントロールは成長阻害なしおよび完全な成長阻害を表します。ペプチドとのインキュベーションに続いて、得られた細胞懸濁液を希釈してペプチド活性を低下させ、次いで一晩増殖させる。一晩増殖後、各ウェルの光学濃度を測定し、ポジティブおよびネガティブコントロールと比較して、各ペプチド濃度で得られた増殖阻害を計算する。このアッセイを使用した結果は、培養物を寒天プレートにプレーティングする従来の方法を使用した結果に匹敵しますが、このプロトコルにより、プラスチック廃棄物とコロニーのカウントに費やす時間が削減されます。このプロトコルのアプリケーションは抗真菌ペプチドに焦点を当てていますが、この方法は、既知または疑われる抗真菌活性を持つ他の分子の試験にも適用できます。
概要
カンジダ・アルビカンスは、口腔、皮膚、胃腸管、膣など、多くの場所にコロニーを形成するヒト微生物叢のメンバーです1。ヒト免疫不全ウイルス(HIV)や免疫抑制治療などの疾患のために免疫不全の患者の場合、C.アルビカンスのコロニー形成は局所的または全身性カンジダ症につながる可能性があります2,3。アムホテリシンB、アゾール、またはエキノカンジンなどの現在利用可能な低分子抗真菌治療薬の使用は、溶解性および毒性の問題、ならびに治療薬に対する感染の耐性によって複雑になる可能性があります4,5。現在の抗真菌剤の限界のために、研究者はC.アルビカンスに対して活性を有する新しい抗真菌分子を継続的に探索している。
抗菌ペプチド(AMP)は、現在の低分子抗真菌剤6,7,8の潜在的な代替物であり、低分子薬物9と比較して耐性の発生の影響を受けにくいことが提案されています。AMPは多様なペプチドのセットですが、多くの場合陽イオンであり、幅広い活性スペクトルを持っています10、11、12。C.アルビカンスに対する活性を有するAMPには、ヒスタチンおよびセクロピンファミリー13,14,15の周知のペプチド、ならびにToAP2、NDBP-5.7、およびヒスタチン5変異体K11R-K17R16,17などのより最近記載されたペプチドが含まれる。カンジダ感染症の治療に潜在的であるため、C.アルビカンスを標的とする新しいAMPの同定と設計は、多くの研究グループにとって重要な目標です。
C.アルビカンスを標的とする効果的なAMP(および他の抗真菌剤)を開発するプロセスの一環として、有望なペプチドを同定するためにin vitro試験が一般的に使用されます。C. albicansに対する抗真菌活性を試験する方法は、通常、96ウェルプレート中でAMPの段階希釈(バッファーまたは培地中)で細胞をインキュベートすることを含みます。インキュベーション後の抗真菌活性を評価するためにいくつかの方法が利用可能です。臨床検査標準研究所によって記述された技術は、ウェルの濁度の純粋に視覚的評価を使用して、成長の完全な阻害(アゾールやエキノカンジンなどの選択された抗真菌剤の少なくとも50%阻害)の最小濃度(MIC)を決定し、サブMIC濃度での成長の定量化を提供しません18.別の一般的に使用されるアプローチでは、寒天プレート上にウェルの内容物をプレーティングし、プレートをインキュベートし、プレート上のコロニー形成単位(CFU)の数をカウントすることにより、AMPとのインキュベーション後の生存率を定量化します。この方法は、ヒスタチン5ベースのペプチド、LL-37、およびヒトラクトフェリン19、20、21を含む多数のペプチドを評価するために使用されています。この技術は、比較的大量の寒天と多数のプレートを必要とし、プレート上のCFUの面倒なカウントを伴います。プラスチック廃棄物の発生を減らし、CFUのカウントを回避しながら、より定量的なデータを取得するには、ウェルの内容物を使用して、別の96ウェルプレートに新鮮な培地を接種することができます。新たに接種したプレートをインキュベートした後、成長は、吸光度プレートリーダー上で600nm(OD600)における光学密度を測定することによって定量化することができる。この方法は、ヒスタチン5およびその分解断片ならびに細胞透過性ペプチド17、22、23、24、25の抗真菌活性を決定するために使用されている。
このプロトコルは、ペプチドの抗真菌活性を試験する方法を説明し、OD600 法を使用して、ペプチドによる C.アルビカンスの 生存率の低下を定量化します。
プロトコル
メリーランド大学カレッジパーク校の施設バイオセーフティ委員会(IBC)から、このプロトコル(PN 274)での C.アルビカンス との作業について承認が得られました。 C.アルビカンス 株SC5314( 材料の表を参照)を本研究では使用しました。しかしながら、任意の他の株も使用され得る。
1.緩衝液、滅菌水、培地の調製
- pH 7.4で滅菌済みの0.1 Mリン酸ナトリウムバッファー(NaPB)26 を調製し、滅菌水で2 mMおよび1 mMに希釈します。2 mM NaPBと1 mM NaPBのそれぞれ100 mLを調製するだけで、このプロトコルのほとんどのアプリケーションには十分すぎるほどです。
- 滅菌液体酵母-ペプトン-デキストロース(YPD、 材料表を参照)培地(10 g / L酵母エキス、20 g / Lデキストロース、20 g / Lペプトン)を準備します。100 mLのYPDを調製するだけで、このプロトコルのほとんどのアプリケーションには十分すぎるほどです。
- 滅菌済みの超純水を用意します。100 mLの水を調製するだけで、このプロトコルのほとんどのアプリケーションには十分すぎるほどです。
注:バッファー、培地、および水は、オートクレーブされる容器内の容量に基づいて、液体サイクルで121°Cで適切な時間オートクレーブ滅菌されます27。たとえば、500 mLを含むボトルの場合、暴露時間は40分である必要があります。
2. C. アルビカンスの接種・培養・継代培養
注意:学術研究機関によって薬剤耐性に関係なくバイオセーフティレベル(BSL)2生物として分類され、アメリカンタイプカルチャーコレクション(ATCC)によってBSL1またはBSL2生物として分類されることが多い C.アルビカンスを扱うためのすべての制度的および政府の規制に従ってください、株28の薬剤耐性に応じて。
注:このステップの接種および培養部分(ステップ2.1〜2.2)は、抗真菌活性のテストを開始する前日に実行してください。可能であれば、バイオセーフティキャビネット内の細胞(および細胞とともにインキュベートされる溶液)を使用して、すべてのプロトコルステップを実行します。
- 目的の C.アルビカンス 株を培養チューブ内の10 mLのYPD培地に接種します。
注:培養液は冷凍庫ストックまたは寒天プレートから接種できますが、比較するすべてのデータには一貫したソースを使用する必要があります。 - ロータリーシェーカーで30°C、230rpmで一晩(~12-16時間)培養物を成長させます。
- C. albicansの一晩培養物を継代培養し、~1.0-1.2のOD600に増殖させる。
- UV分光光度計を用いて一晩培養のOD600 を測定する( 材料表参照)。
- 一晩培養のOD600に基づいて、一晩培養を使用して、10mL のYPD中に0.1のOD600 で継代培養を接種する。
- 継代培養液を30°C、ロータリーシェーカーで230rpmで、OD600 が~1.0-1.2に達するまで成長させますが、これには4-6時間かかる可能性があります。継代培養が成長している間にステップ3(ペプチド溶液の調製)を完了します。継代培養は、ステップ4のアッセイで使用するために希釈されます。
3. 96ウェルプレートでのペプチド溶液の調製
注:このステップは、ペプチドストック溶液が保存中に安定している場合、事前に行うことができます。典型的には、ペプチド溶液は、使用するまで−20°Cで保存される。次のステップに進む前に、室温の水浴で解凍できます。
- アッセイで試験する各ペプチドの最高濃度を決定します。これは、選択されたペプチドに基づいて変化する。代表的な結果セクションに提示されたデータについて、ヒスタチン5および操作された類似体22 が試験され、試験された最高濃度は50μMであった。
注:試験する最高濃度は、文献で報告されたデータを使用するか、広範囲のペプチド濃度にわたって予備実験を行うことによって決定されます。可能であれば、最高濃度を選択して、試験した最高濃度で生存率を完全に低下させるプラトーを観察し、試験した最低濃度で生存率を低下させないプラトーを観察し、ペプチド活性の全範囲を定量できるようにする必要があります。 - 各ペプチドを所望の最高濃度の2倍の滅菌水に溶解する。代表的な結果セクションに提示されたデータについて、ヒスタチン5および操作された類似体の150μLの100μM溶液を滅菌水中で調製した。
注:ペプチドが水に溶けない場合は、このステップの前に別の溶媒への可溶化が必要になる場合があります。ジメチルスルホキシド(DMSO)は、使用濃度に希釈する前にペプチドを高濃度で可溶化するために一般的に使用されます。DMSOの最終濃度が1%(v / v)または29 以下であり、代替溶媒が細胞の成長に影響を与えないことを確認してください。また、ステップ3.4〜3.5ですべてのウェルで溶媒濃度が一定に保たれていることを確認してください。 - 40 μLの目的のペプチドストック溶液を、96ウェルの丸底培養プレートの各行の最初のウェル(カラム1)に追加します( 材料の表を参照)。このプレートはプレート1です(図1)。
注:各プレートには、ペプチドのテストに使用される8つの列があります。これらの行は、異なるペプチドまたは同じペプチドの複製に使用できます。各行に単一のペプチドのみを含めます。 - ペプチドを含む列のカラム2からカラム12に滅菌超純水20 μLを加えます(図1)。
注:ステップ3.2でペプチドストックを純水以外の溶媒で調製した場合、このステップの滅菌水は、最初のカラムに追加されたペプチドストックに存在する溶媒と交換する必要があります。たとえば、ペプチドがDMSOに可溶化され、ペプチドストックが水中に1%(v/v)のDMSOを含む場合、1%のDMSOを含む水を列2から列12に追加する必要があります。 - プレート全体のペプチドストック溶液をカラム10まで順次希釈します(図1)。
注:以下に説明するようにプレート内で段階希釈を行うのではなく、マイクロ遠心チューブで希釈を行い、96ウェルプレートに移すこともできます。- カラム1から20 μLを取り出し、カラム2に移し、上下にピペッティングして混合します。カラム2には、カラム1の濃度の1:2希釈で40 μLのペプチド溶液が含まれています。
- カラム2から20 μLを取り出し、カラム3に移し、上下にピペッティングして混合するため、カラム3にはカラム1の濃度の1:4希釈で40 μLのペプチド溶液が含まれます。
- カラム10に40 μLのペプチド溶液がカラム1の濃度の1:512希釈で含まれるまで、このプロセスを繰り返します。
- カラム10から20 μLのペプチド溶液を除去し、廃棄します。各カラムには、20 μLのペプチド溶液(カラム1〜10)または水(カラム11およびカラム12)が含まれています。
注:カラム11のウェルは無菌コントロールとして機能し、カラム12のウェルはペプチドを含まないコントロールとして機能します。
4. C.アルビカンス 継代培養の希釈
注: 継代培養が ~1.0-1.2 の OD600 に達した後に、この手順を開始します (手順 2.3.3)。
- 継代培養液を15 mL遠沈管に移し、3,900 x g で室温で3分間遠心分離し、細胞をペレット化します。ピペッティングまたはデカントによって上清を除去します。
- ペレットを1 mLの2 mM NaPBで再懸濁し(ステップ1.1)、懸濁液を1.7 mL遠沈管に移します。
- 細胞をペレット化し(ステップ4.1と同様)、上清を廃棄し、ペレットを1mLの2mM NaPBに再度再懸濁する。
- ステップ4.3をさらに2回繰り返して、洗浄した細胞を1 mLの2 mM NaPB中に残します。
- 洗浄した懸濁液の細胞密度を決定し、5 x 105 細胞/mLの細胞密度を得るために必要な希釈係数を計算します。この濃度は、最終的に96ウェルプレートの各ウェルに1 x 104 細胞を添加することにつながります。
注:懸濁液の細胞密度は、血球計算盤または自動細胞カウンターを含む多くの方法を使用して決定できます。関連する条件下で増殖させた目的の株の細胞密度対OD600の標準曲線を本研究に使用しました。この曲線は、血球計算盤(材料の表を参照)を使用して作成し、OD600値を変化させた懸濁液の細胞密度を決定しました。 - 細胞懸濁液を2 mM NaPB中で5 x 105 細胞/mLに希釈します。この希釈懸濁液を10mL調製するだけで、この研究を完了するのに十分すぎるほどです。
5.ペプチド溶液による C.アルビカンスの インキュベーションと生存率の定量化のための細胞の調製
- 希釈した C.アルビカンス 懸濁液20 μL(ステップ4.6)を各行の列1〜10および列12に追加します(図1)。
注:最初の列の最終ペプチド濃度は、ペプチドストック濃度の半分になりました。本研究では、この時点で最終的なペプチド濃度は50μMであった。各ウェルの最終細胞懸濁液には、2.5 x 105 細胞/mLが含まれています。カラム1〜10は、異なるペプチド濃度での抗真菌活性を評価するための実験ウェルとして機能し、カラム12は、ペプチドを含まない増殖のコントロールとして機能します。 - 20 μLの2 mM NaPBをカラム11に追加します。現在、すべてのウェルの最終濃度は1 mM NaPBです。カラム11は、無菌性コントロールとして機能する。
- カバープレート1(細胞とペプチドの両方を含む)をカバーし、30°Cで30分間インキュベートします。
注:多くのペプチド17、21、22、30では30分のインキュベーション時間で十分ですが、抗真菌活性を発揮するのに長い時間を必要とする可能性のあるペプチドを説明するために、必要に応じてインキュベーション時間を60分に増やすことができます25,31,32。 - 生存率の定量に使用するために、新しい96ウェル培養プレート(プレート2)を準備します(図2)。
注:培養プレートは、プレート1のインキュベーション中に準備する必要があります。- プレートのすべてのウェルに100 μLのYPDを追加します(ステップ1.2)。
- プレートのすべてのウェルに100 μLの2 mM NaPBを加えます(ステップ1.1)。
- サンプルをプレート1(細胞とペプチドを含む)で希釈し、プレート2(培地とバッファーを含む)に移します。
- 30分間のインキュベーション後にインキュベーターからプレート1を取り出します。
- プレート1の各ウェルに280 μLの1 mM NaPBを加えて希釈し(ステップ1.1)、各ウェルに合計320 μLの容量を与えます(図2)。
- 細胞とペプチドを含むすべてのウェルを上下にピペッティングして混合し、すべての細胞が再懸濁され、ウェルの底に沈降細胞が見えないようにします。
- プレート1の各ウェルからプレート2の対応するウェルに8 μLを移します。このボリュームは、プレート1の各ウェルからプレート2に約250個の細胞を移します(図2)。
- プレート2を覆い、マイクロタイタープレートシェーカー( 材料の表を参照)で350rpmで30°Cで17時間インキュベートします。
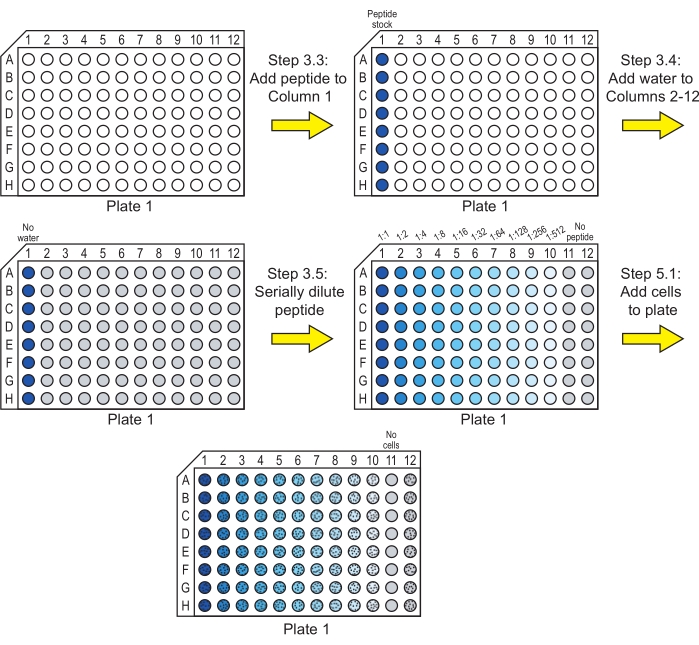
図1:細胞とのペプチド段階希釈のインキュベーションのためのプレート1の調製。ペプチドの段階希釈を水中で行い、C.アルビカンス細胞をプレート1に添加します。青色はペプチドがウェルに存在し、灰色は水を含みペプチドがないウェルを示す。細胞を含むウェルは黒い点のパターンで示されます。これらのステップの後、プレートをインキュベートして、ペプチドがその抗真菌活性を発揮できるようにします。この図の拡大版を表示するには、ここをクリックしてください。

図2:ペプチドに起因する生存率の低下を定量化するためのプレート2の調製。YPD培地とNaPBをプレート2に加えます。プレート1の内容物を希釈した後、各ウェルからのアリコートをプレート1からプレート2に移す。次いで、プレート2をインキュベートして、OD600を測定することによって定量化のために任意の生細胞を増殖させる。プレート2では、YPDとNaPBのみを含むウェルはオレンジ色で示されています。YPDおよびNaPBと混合されたプレート1からのアリコートを含むウェルは緑色で示されています。プレート1の色の説明については、図1の凡例を参照してください。この図の拡大版を表示するには、ここをクリックしてください。
6.抗真菌活性の測定
- プレート2の各ウェルのOD600 の読み取り値を取得します。
- 17時間のインキュベーション後にプレート2をインキュベーターから取り出します。
- プレート2のすべてのウェルを上下にピペッティングして混合し、すべての細胞が再懸濁され、ウェルの底に沈降した細胞が見えないようにします。
注意: OD600 の読み取り値に干渉する可能性があるため、この手順では気泡を発生させないでください。気泡が形成された場合は、多くの場合、乾いたピペットチップで弾くか、2つのピペットチップを使用してウェルから持ち上げて取り除くことができます。 - 波長600 nmの吸光度プレートリーダー( 材料の表を参照)を使用して、各ウェルのOD600 を取得します。
- 成長の阻害を(パーセンテージで)計算し、それをプロットして、 C.アルビカンスの成長に対するペプチドの効果を決定します。
- 各ウェルについて、以下の式17、22、23を使用して、対照と比較した生存率の低下(パーセンテージとして)を計算します。
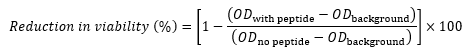
ここで、ペプチドを含むODは、所与の濃度のペプチドを含むウェルのOD600であり、ODバックグラウンドは、同じ行の列11(細胞を含まない対照)のOD600であり、
ペプチドなしのODは、同じ行の列12のOD600である(ペプチドを含まない細胞を含む対照)。 - たとえば、次の式を使用して、行 B の OD600 値から井戸 B5 の生存率の低下を計算します。
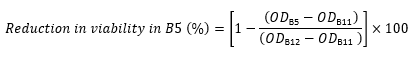
- 各ウェルについて、以下の式17、22、23を使用して、対照と比較した生存率の低下(パーセンテージとして)を計算します。
- 生存率の低下をペプチド濃度の関数としてプロットする。
結果
OD600 測定を使用して抗真菌ペプチドによる増殖の減少を定量化することで、サンプルのメッキやCFUのカウントと比較して時間を大幅に節約できます。このプロトコルで説明されている方法では、3つの異なる日に手順を完了する必要があります。初日に、バッファーと培地(滅菌時間を含まない)を調製し、一晩インキュベーションするために C.アルビカンスの 出発培養物を接種?...
ディスカッション
このプロトコルは、真菌病原体 C.アルビカンスに対するAMPの抗真菌活性に関する定量的データを取得するための効率的なアプローチを説明しています。ペプチドやその他の抗真菌剤を試験するための一般的な代替アプローチの1つは、臨床検査標準研究所(CLSI)の標準M2718に記載されているブロス微量希釈ですが、この標準は定量的結果ではなく定性的な視覚的結果を得?...
開示事項
著者は、競合する経済的利益はないと宣言しています。
謝辞
この研究は、国立衛生研究所(R03DE029270、T32AI089621B)、国立科学財団(CBET 1511718)、教育省(GAANN-P200A180093)、およびメリーランド大学クロスキャンパスシード助成金の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 96-well plates (round bottom) | VWR | 10062-902 | |
| Absorbance microplate reader | N/A | N/A | Any available microplate reader is sufficient |
| C. albicans strain SC5314 | ATCC | MYA-2876 | Other C. albicans may also be used |
| Hemocytometer | N/A | N/A | Can be used to make a standard curve relating cell number to OD600 |
| Microplate shaker | VWR | 2620-926 | |
| Peptide(s) | N/A | N/A | Peptides can be commercially synthesized by any reliable vendor; a purity of ≥95% and trifluoroacetic acid salt removal to hydrochloride salt are recommended |
| Reagent reservoirs for multichannel pipettors | VWR | 18900-320 | Simplifies pipetting into multiwell plates with multichannel pipettor |
| Sodium phosphate, dibasic | Fisher Scientific | BP332-500 | For making NaPB |
| Sodium phosphate, monobasic | Fisher Scientific | BP329-500 | For making NaPB |
| UV spectrophotometer | N/A | N/A | Any available UV spectrophotometer is sufficient |
| YPD medium powder | BD Life Sciences | 242820 | May also be made from yeast extract, peptone, and dextrose |
参考文献
- Gulati, M., Nobile, C. J. Candida albicans biofilms: Development, regulation, and molecular mechanisms. Microbes and Infection. 18 (5), 310-321 (2016).
- Arya, N. R., Rafiq, N. B. Candidiasis. StatPearls. , (2021).
- de Oliveira Santos, G. C., et al. Candida infections and therapeutic strategies: Mechanisms of action for traditional and alternative agents. Frontiers in Microbiology. 9, 1351 (2018).
- Espinel-Ingroff, A. Mechanisms of resistance to antifungal agents: Yeasts and filamentous fungi. Revista Iberoamericana de Micología. 25 (2), 101-106 (2008).
- Wang, X., et al. Delivery strategies of amphotericin B for invasive fungal infections. Acta Pharmaceutica Sinica B. 11 (8), 2585-2604 (2021).
- Struyfs, C., Cammue, B. P. A., Thevissen, K. Membrane-interacting antifungal peptides. Frontiers in Cell and Developmental Biology. 9, 649875 (2021).
- Huan, Y., Kong, Q., Mou, H., Yi, H. Antimicrobial peptides: Classification, design, application and research progress in multiple fields. Frontiers in Microbiology. 11, 582779 (2020).
- Sarkar, T., Chetia, M., Chatterjee, S. Antimicrobial peptides and proteins: From nature's reservoir to the laboratory and beyond. Frontiers in Chemistry. 9, 691532 (2021).
- Mahlapuu, M., Bjorn, C., Ekblom, J. Antimicrobial peptides as therapeutic agents: Opportunities and challenges. Critical Reviews in Biotechnology. 40 (7), 978-992 (2020).
- Lei, J., et al. The antimicrobial peptides and their potential clinical applications. American Journal of Translational Research. 11 (7), 3919-3931 (2019).
- Mercer, D. K., O'Neil, D. A. Innate inspiration: Antifungal peptides and other immunotherapeutics from the host immune response. Frontiers in Immunology. 11, 2177 (2020).
- Bin Hafeez, A., Jiang, X., Bergen, P. J., Zhu, Y. Antimicrobial peptides: An update on classifications and databases. International Journal of Molecular Sciences. 22 (21), 11691 (2021).
- Xu, T., Levitz, S. M., Diamond, R. D., Oppenheim, F. G. Anticandidal activity of major human salivary histatins. Infection and Immunity. 59 (8), 2549-2554 (1991).
- Helmerhorst, E. J., et al. Amphotericin B- and fluconazole-resistant Candida spp., Aspergillus fumigatus, and other newly emerging pathogenic fungi are susceptible to basic antifungal peptides. Antimicrobial Agents and Chemotherapy. 43 (3), 702-704 (1999).
- Andra, J., Berninghausen, O., Leippe, M. Cecropins, antibacterial peptides from insects and mammals, are potently fungicidal against Candida albicans. Medical Microbiology and Immunology. 189, 169-173 (2001).
- do Nascimento Dias, J., et al. Mechanisms of action of antimicrobial peptides ToAP2 and NDBP-5.7 against Candida albicans planktonic and biofilm cells. Scientific Reports. 10, 10327 (2020).
- Ikonomova, S. P., et al. Effects of histatin 5 modifications on antifungal activity and kinetics of proteolysis. Protein Science. 29, 480-493 (2020).
- Clinical Laboratory Standards Institute. . M27-A3. Reference method for broth dilution antifungal susceptibility testing of yeasts; Approved standard - Third edition. , (2008).
- Lupetti, A., et al. Candidacidal activities of human lactoferrin peptides derived from the N terminus. Antimicrobial Agents and Chemotherapy. 44 (12), 3257-3263 (2000).
- Han, J., Jyoti, M. A., Song, H. Y., Jang, W. S. Antifungal activity and action mechanism of histatin 5-halocidin hybrid peptides against Candida ssp. PLoS One. 11 (2), 0150196 (2016).
- den Hertog, A. L., et al. Candidacidal effects of two antimicrobial peptides: histatin 5 causes small membrane defects, but LL-37 causes massive disruption of the cell membrane. Biochemical Journal. 388, 689-695 (2005).
- Ikonomova, S. P., Moghaddam-Taaheri, P., Jabra-Rizk, M. A., Wang, Y., Karlsson, A. J. Engineering improved variants of the antifungal peptide histatin 5 with reduced susceptibility to Candida albicans secreted aspartic proteases and enhanced antimicrobial potency. The FEBS Journal. 285 (1), 146-159 (2018).
- Moghaddam-Taaheri, P., Leissa, J. A., Eppler, H. B., Jewell, C. M., Karlsson, A. J. Histatin 5 variant reduces Candida albicans biofilm viability and inhibits biofilm formation. Fungal Genetics and Biology. 149, 103529 (2021).
- Gong, Z., Doolin, M. T., Adhikari, S., Stroka, K. M., Karlsson, A. J. Role of charge and hydrophobicity in translocation of cell-penetrating peptides into Candida albicans cells. AIChE Journal. 65 (12), 16768 (2019).
- Gong, Z., Karlsson, A. J. Translocation of cell-penetrating peptides into Candida fungal pathogens. Protein Science. 26 (9), 1714-1725 (2017).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. Fourth edition. 3, (2012).
- Consolidated Sterilizer Systems. Laboratory and Research Autoclaves Available from: https://consteril.com/wp-content/uploads/2020/12/CSS-Product-Brochure.pdf (2022)
- Rodriguez-Tudela, J. L., Cuenca-Estrella, M., Diaz-Guerra, T. M., Mellado, E. Standardization of antifungal susceptibility variables for a semiautomated methodology. Journal of Clinical Microbiology. 39 (7), 2513-2517 (2001).
- Mbuayama, K. R., Taute, H., Strmstedt, A. A., Bester, M. J., Gaspar, A. R. M. Antifungal activity and mode of action of synthetic peptides derived from the tick OsDef2 defensin. Journal of Peptide Science. 28 (5), 3383 (2022).
- Rossignol, T., Kelly, B., Dobson, C., d'Enfert, C. Endocytosis-mediated vacuolar accumulation of the human ApoE apolipoprotein-derived ApoEdpL-W antimicrobial peptide contributes to its antifungal activity in Candida albicans. Antimicrobial Agents and Chemotherapy. 55 (10), 4670-4681 (2011).
- Helmerhorst, E. J., Reijnders, I. M., van't Hof, W., Veerman, E. C., Nieuw Amerongen, A. V. A critical comparison of the hemolytic and fungicidal activities of cationic antimicrobial peptides. FEBS Letters. 449 (2-3), 105-110 (1999).
- Kerenga, B. K., et al. Salt-tolerant antifungal and antibacterial activities of the corn defensin ZmD32. Frontiers in Microbiology. 10, 795 (2019).
- Lee, I. H., Cho, Y., Lehrer, R. I. Effects of pH and salinity on the antimicrobial properties of clavanins. Infection and Immunity. 65 (7), 2898-2903 (1997).
- Li, X. S., Reddy, M. S., Baev, D., Edgerton, M. Candida albicans Ssa1/2p is the cell envelope binding protein for human salivary histatin 5. Journal of Biological Chemistry. 278 (31), 28553-28561 (2003).
- Rothstein, D. M., et al. Anticandida activity is retained in P-113, a 12-amino-acid fragment of histatin 5. Antimicrobial Agents and Chemotherapy. 45 (5), 1367-1373 (2001).
- Sanders, E. R. Aseptic laboratory techniques: Volume transfers with serological pipettes and micropipettors. Journal of Visualized Experiments. (63), e2754 (2012).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Report. 26, 100987 (2021).
- Goughenour, K. D., Balada-Llasat, J. M., Rappleye, C. A. Quantitative microplate-based growth assay for determination of antifungal susceptibility of Histoplasma capsulatum yeasts. Journal of Clinical Microbiology. 53 (10), 3286-3295 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved