Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Peptitlerin Candida albicans'a Karşı Antifungal Aktivitesinin Ölçülmesi
Bu Makalede
Özet
Bu protokol, peptitlerin ve küçük moleküllü antifungal ajanlar gibi diğer bileşiklerin Candida albicans'a karşı antifungal aktivitesi hakkında nicel veriler elde etmek için bir yöntemi açıklar. Büyüme inhibisyonunu ölçmek için koloni oluşturan birimleri saymak yerine optik yoğunluk kullanımı, zamandan ve kaynaklardan tasarruf sağlar.
Özet
Candida albicans için antifungal duyarlılık testi yapmak için geleneksel yöntemler zaman alıcıdır ve nicel sonuçlardan yoksundur. Örneğin, yaygın bir yaklaşım, agar plakaları üzerinde farklı konsantrasyonlarda antifungal moleküllerle muamele edilmiş hücrelerin kaplanmasına ve daha sonra molekül konsantrasyonu ile büyüme inhibisyonu arasındaki ilişkiyi belirlemek için kolonilerin sayılmasına dayanır. Bu yöntem, kolonileri saymak için birçok plaka ve önemli bir zaman gerektirir. Başka bir yaygın yaklaşım, büyümeyi engellemek için gereken minimum konsantrasyonu belirlemek için antifungal ajanlarla muamele edilen kültürleri görsel olarak inceleyerek plakaları ve kolonilerin sayımını ortadan kaldırır; Bununla birlikte, görsel muayene sadece kalitatif sonuçlar üretir ve subinhibitör konsantrasyonlarda büyüme hakkında bilgi kaybolur. Bu protokol, C. albicans'ın antifungal peptitlere duyarlılığını ölçmek için bir yöntem açıklar. Kültürlerin optik yoğunluk ölçümlerine dayanarak, yöntem farklı peptit konsantrasyonlarında kültür büyümesi üzerinde nicel sonuçlar elde etmek için gereken zamanı ve malzemeleri azaltır. Mantarın peptitlerle inkübasyonu, uygun bir tampon kullanılarak 96 delikli bir plakada, büyüme inhibisyonu ve tam büyüme inhibisyonunu temsil etmeyen kontrollerle gerçekleştirilir. Peptit ile inkübasyonu takiben, elde edilen hücre süspansiyonları peptid aktivitesini azaltmak için seyreltilir ve daha sonra gece boyunca büyütülür. Gece boyunca büyümeden sonra, her bir kuyucuğun optik yoğunluğu ölçülür ve her peptid konsantrasyonunda ortaya çıkan büyüme inhibisyonunu hesaplamak için pozitif ve negatif kontrollerle karşılaştırılır. Bu tahlili kullanan sonuçlar, kültürleri agar plakalarına kaplamanın geleneksel yöntemini kullanan sonuçlarla karşılaştırılabilir, ancak bu protokol plastik atıkları ve kolonileri saymak için harcanan zamanı azaltır. Bu protokolün uygulamaları antifungal peptitlere odaklanmış olsa da, yöntem bilinen veya şüphelenilen antifungal aktiviteye sahip diğer moleküllerin test edilmesine de uygulanacaktır.
Giriş
Candida albicans, ağız boşluğu, cilt, gastrointestinal sistem ve vajina1 dahil olmak üzere çok sayıda yeri kolonize eden insan mikrobiyotasının bir üyesidir. İnsan immün yetmezlik virüsü (HIV) ve immünsüpresif tedaviler gibi hastalıklar nedeniyle bağışıklık sistemi baskılanmış hastalar için, C. albicans'ın kolonizasyonu lokal veya sistemik kandidiyazise yol açabilir 2,3. Amfoterisin B, azoller veya ekinokandinler gibi şu anda mevcut olan küçük moleküllü antifungal terapötiklerin kullanımı, çözünürlük ve toksisite sorunları ve enfeksiyonların terapötiklere direnci ile karmaşık olabilir 4,5. Mevcut antifungal ajanların sınırlamaları nedeniyle, araştırmacılar sürekli olarak C. albicans'a karşı aktiviteye sahip yeni antifungal moleküller aramaktadır.
Antimikrobiyal peptitler (AMP'ler) mevcut küçük moleküllü antifungal ajanlara potansiyel bir alternatiftir 6,7,8 ve küçük moleküllü ilaçlara kıyasla direnç gelişimine daha az duyarlı oldukları öne sürülmektedir 9. AMP'ler çeşitli peptitler kümesidir, ancak genellikle katyoniktirler ve geniş bir aktivite spektrumu10,11,12'dir. C. albicans'a karşı aktivitesi olan AMP'ler, 13,14,15 histatin ve çekropin ailelerinden iyi bilinen peptitlerin yanı sıra ToAP2, NDBP-5.7 ve histatin 5 varyantı K11R-K17R16,17 gibi daha yakın zamanda tanımlanmış peptitleri içerir. Candida enfeksiyonlarını tedavi etme potansiyelleri nedeniyle, C. albicans'ı hedef alan yeni AMP'lerin tanımlanması ve tasarlanması birçok araştırma grubu için önemli bir hedeftir.
C. albicans'ı hedef alan etkili AMP'ler (ve diğer antifungal ajanlar) geliştirme sürecinin bir parçası olarak, in vitro testler umut verici peptitleri tanımlamak için yaygın olarak kullanılır. Antifungal aktiviteyi C. albicans'a karşı test etme yöntemleri tipik olarak 96 delikli plakalarda AMP'lerin seri seyreltilmeleriyle (tampon veya ortamda) hücrelerin inkübe edilmesini içerir. Kuluçka sonrası antifungal aktiviteyi değerlendirmek için çeşitli yöntemler mevcuttur. Klinik Laboratuvar Standartları Enstitüsü tarafından tanımlanan bir teknik, büyümenin tamamen inhibisyonu için minimum konsantrasyonu (MIC) belirlemek için kuyucukların bulanıklığının tamamen görsel bir değerlendirmesini kullanır (azoller ve ekinokandinler gibi seçilmiş antifungal ajanlar için en az% 50 inhibisyon) ve alt MIC konsantrasyonlarında büyümenin nicelleştirilmesini sağlamaz18 . Yaygın olarak kullanılan bir diğer yaklaşım, kuyucukların içeriğini agar plakaları üzerine kaplayarak, plakaları inkübe ederek ve daha sonra plakadaki koloni oluşturan birimlerin (CFU'lar) sayısını sayarak AMP'lerle inkübasyondan sonra canlılığın ölçülmesini içerir. Bu yöntem, histatin 5 bazlı peptitler, LL-37 ve insan laktoferrin 19,20,21 dahil olmak üzere bir dizi peptidi değerlendirmek için kullanılmıştır. Bu teknik, nispeten büyük miktarda agar ve çok sayıda plaka gerektirir ve plakalardaki CFU'ların sıkıcı bir şekilde sayılmasını içerir. Daha az plastik atık üretirken ve CFU'ları saymaktan kaçınırken daha fazla nicel veri elde etmek için, kuyuların içeriği başka bir 96 kuyucuklu plakada taze ortamı aşılamak için kullanılabilir. Yeni aşılanan plakayı inkübe ettikten sonra, bir absorbans plakası okuyucusunda optik yoğunluğu 600 nm'de (OD600) ölçerek büyüme ölçülebilir. Bu yöntem, histatin 5'in antifungal aktivitesini ve bozunma fragmanlarını ve hücre penetran peptitleri 17,22,23,24,25'i belirlemek için kullanılmıştır.
Bu protokol, peptitlerin antifungal aktivitesinin nasıl test edileceğini açıklar ve peptidler nedeniyle C. albicans'ın yaşayabilirliğindeki azalmayı ölçmek için OD600 yöntemini kullanır.
Protokol
Maryland Üniversitesi, College Park, Kurumsal Biyogüvenlik Komitesi'nden (IBC) bu protokolde C. albicans ile yapılan çalışmalar için onay alınmıştır (PN 274). Bu çalışmada C. albicans suşu SC5314 (bakınız Malzeme Tablosu) kullanılmıştır; Bununla birlikte, başka herhangi bir suş da kullanılabilir.
1. Tamponun, steril suyun ve kültür ortamının hazırlanması
- pH 7,4'te steril 0,1 M sodyum fosfat tamponu (NaPB)26 hazırlayın ve steril suyla 2 mM ve 1 mM'ye kadar seyreltin. 2 mM NaPB ve 1 mM NaPB'nin her biri 100 mL hazırlamak, bu protokolün çoğu uygulaması için fazlasıyla yeterli olacaktır.
- Steril sıvı maya-pepton-dekstroz (YPD, bakınız Malzeme Tablosu) ortamı (10 g/L maya ekstresi, 20 g/L dekstroz, 20 g/L pepton) hazırlayın. 100 mL YPD hazırlamak, bu protokolün çoğu uygulaması için fazlasıyla yeterli olacaktır.
- Steril ultra saf su hazırlayın. 100 mL su hazırlamak, bu protokolün çoğu uygulaması için fazlasıyla yeterli olacaktır.
NOT: Tamponlar, ortamlar ve su, otoklavlanan kaplardaki hacme bağlı olarak uygun bir süre için bir sıvı döngüsü üzerinde 121 °C'de otoklavlama ile sterilize edilir27. Örneğin, 500 mL içeren şişeler için maruz kalma süresi 40 dakika olmalıdır.
2. C. albicans'ın aşılanması, kültürlenmesi ve alt kültürlenmesi
DİKKAT: Akademik araştırma kurumları tarafından genellikle ilaç direncinden bağımsız olarak biyogüvenlik seviyesi (BSL) 2 organizması olarak sınıflandırılan C. albicans ile çalışmak için tüm kurumsal ve hükümet düzenlemelerine ve Amerikan Tipi Kültür Koleksiyonu (ATCC) tarafından BSL1 veya BSL2 organizması olarak sınıflandırılmıştır.
NOT: Bu adımın aşılama ve kültürleme bölümlerini (adım 2.1-2.2) antifungal aktivite testine başlamadan önceki gün gerçekleştirin. Mümkünse, tüm protokol adımlarını hücrelerle (ve hücrelerle inkübe edilecek çözeltilerle) bir biyogüvenlik kabininde gerçekleştirin.
- İstenilen C. albicans suşunu bir kültür tüpünde 10 mL YPD ortamına aşılayın.
NOT: Kültür bir dondurucu stoğundan veya bir agar plakasından aşılanabilir, ancak karşılaştırılacak tüm veriler için tutarlı bir kaynak kullanılmalıdır. - Kültürü gece boyunca (~ 12-16 saat) 30 ° C'de ve döner bir çalkalayıcıda 230 rpm'de büyütün.
- Alt kültür, C. albicans'ın bir gecede kültürüdür ve ~ 1.0-1.2'lik bir OD 600'e büyür.
- UV spektrofotometresi kullanarak gece kültürünün OD600'ünü ölçün (bkz.
- Geceleme kültürünün OD 600'üne dayanarak,10 mL YPD'de 0,1'lik bir OD600'de bir alt kültürü aşılamak için gecelik kültürü kullanın.
- Alt kültürü, OD 600 ~ 1.0-1.2'ye ulaşana kadar 230 rpm'de döner bir çalkalayıcı üzerinde30 ° C'de büyütün, bu da 4-6 saat sürecektir. Alt kültür büyürken 3. adımı tamamlayın (peptid çözeltilerinin hazırlanması); alt kültür, 4. adımda tahlilde kullanılmak üzere seyreltilecektir.
3. Peptit çözeltilerinin 96 delikli bir plakada hazırlanması
NOT: Bu adım, peptid stok çözeltileri depolama sırasında kararlıysa, önceden yapılabilir. Tipik olarak, peptid çözeltileri kullanıma kadar -20 ° C'de saklanır. Bir sonraki adıma geçmeden önce oda sıcaklığında bir su banyosunda çözülebilirler.
- Tahlilde test edilecek her peptidin en yüksek konsantrasyonunu belirleyin. Bu, seçilen peptitlere bağlı olarak değişecektir. Temsili sonuçlar bölümünde sunulan veriler için, histatin 5 ve mühendislik analogları22 test edildi ve test edilen en yüksek konsantrasyon 50 μM idi.
NOT: Test edilecek en yüksek konsantrasyon, literatürde bildirilen veriler kullanılarak veya çok çeşitli peptit konsantrasyonları üzerinde ön deneyler yapılarak belirlenir. Mümkün olduğunda, test edilen en yüksek konsantrasyonlarda canlılıkta tam bir azalma için bir plato gözlemlemek için en yüksek konsantrasyon ve test edilen en düşük konsantrasyonlarda canlılıkta azalma olmaması için bir plato seçilmeli ve bu da peptid aktivitesinin tüm aralığının nicelleştirilmesine izin vermelidir. - Her peptidi steril suda istenen en yüksek konsantrasyonun iki katında çözün. Temsili sonuçlar bölümünde sunulan veriler için, steril suda 100 μM histatin 5 ve mühendislik analoglarının 150 μL çözeltisi hazırlanmıştır.
NOT: Bir peptit suda çözünmüyorsa, bu adımdan önce başka bir çözücüde çözündürme gerekebilir. Dimetil sülfoksit (DMSO), çalışma konsantrasyonuna seyreltmeden önce peptitleri yüksek konsantrasyonda çözündürmek için yaygın olarak kullanılır. DMSO'nun nihai konsantrasyonunun% 1 (v / v) veya daha düşük29 olduğundan ve alternatif çözücülerin hücrelerin büyümesini etkilemediğinden emin olun. Ayrıca, 3.4-3.5 adımlarında çözücü konsantrasyonunun tüm kuyucuklarda sabit tutulmasını sağlayın. - İstenilen peptid stok çözeltilerinden 40 μL'yi, 96 delikli, yuvarlak tabanlı bir kültür plakasındaki her satırın ilk kuyucuğuna (Sütun 1) ekleyin (bkz. Bu plaka Plaka 1'dir (Şekil 1).
NOT: Her plakanın peptitleri test etmek için kullanılan sekiz sırası vardır. Bu sıralar farklı peptitler veya aynı peptitlerin replikaları için kullanılabilir. Her satıra sadece tek bir peptit ekleyin. - Peptit içeren satırların Sütun 2 ila Sütun 12'sine 20 μL steril ultra saf su ekleyin (Şekil 1).
NOT: Peptit stokları adım 3.2'de saf su dışında bir çözücü ile hazırlanmışsa, bu adımdaki steril su, ilk sütuna eklenen peptid stoğunda bulunan çözücü ile değiştirilmelidir. Örneğin, peptid DMSO'da çözünmüşse ve peptid stoğu suda% 1 (v / v) DMSO içeriyorsa,% 1 DMSO içeren su, Sütun 2'den Sütun 12'ye eklenmelidir. - Peptit stok çözeltilerini plaka boyunca Sütun 10'a kadar seri olarak seyreltin (Şekil 1).
NOT: Seri seyreltmelerin plakada aşağıda açıklandığı gibi gerçekleştirilmesi yerine, seyreltmeler mikrosantrifüj tüplerinde de gerçekleştirilebilir ve 96 delikli plakaya aktarılabilir.- Sütun 1'den 20 μL'yi çıkarın, Sütun 2'ye aktarın ve yukarı ve aşağı pipetle çekerek karıştırın. Sütun 2 şimdi Sütun 1'deki konsantrasyonun 1: 2 seyreltilmesinde 40 μL peptid çözeltisi içerir.
- Sütun 2'den 20 μL'yi çıkarın, Sütun 3'e aktarın ve yukarı ve aşağı pipetleyerek karıştırın, böylece Sütun 3 şimdi Sütun 1'deki konsantrasyonun 1: 4 seyreltilmesinde 40 μL peptid çözeltisi içerir.
- Sütun 10, Sütun 1'deki konsantrasyonun 1:512 seyreltilmesinde 40 μL peptid çözeltisi içerene kadar bu işlemi tekrarlayın.
- Sütun 10'dan 20 μL peptit çözeltisini çıkarın ve atın. Her kolon artık 20 μL peptit çözeltisi (Sütun 1-10) veya su (Sütun 11 ve Sütun 12) içerir.
NOT: Sütun 11'deki kuyular sterilite kontrolleri olarak hizmet eder ve Sütun 12'deki kuyular peptid içermeyen kontroller olarak hizmet eder.
4. C. albicans alt kültürünün seyreltilmesi
NOT: Alt kültür ~1.0-1.2 OD600'e ulaştıktan sonra bu adıma başlayın (adım 2.3.3).
- Alt kültürü 15 mL'lik bir santrifüj tüpüne aktarın ve hücreleri peletlemek için oda sıcaklığında 3 dakika boyunca 3.900 x g'de santrifüj yapın. Süpernatantı pipetleme veya dekantlama ile çıkarın.
- Peleti 1 mL'lik 2 mM NaPB (adım 1.1) ile yeniden askıya alın ve süspansiyonu 1,7 mL'lik bir santrifüj tüpüne aktarın.
- Hücreleri pelet (adım 4.1'de olduğu gibi), süpernatanı atın ve peleti 2 mM NaPB'nin 1 mL'sinde tekrar askıya alın.
- Yıkanmış hücreleri 1 mL'lik 2 mM NaPB'de bırakmak için adım 4.3'ü iki kez daha tekrarlayın.
- Yıkanmış süspansiyonun hücre yoğunluğunu belirleyin ve 5 x 10 5 hücre / mL'lik bir hücre yoğunluğu elde etmek için gereken seyreltme faktörünü hesaplayın. Bu konsantrasyon nihayetinde 96 kuyucuklu plakanın her bir kuyucuğuna 1 x 104 hücre eklenmesine yol açacaktır.
NOT: Süspansiyonun hücre yoğunluğu, hemositometre veya otomatik hücre sayacı da dahil olmak üzere bir dizi yöntem kullanılarak belirlenebilir. Bu çalışmada, ilgili koşullar altında yetiştirilen ilgi suşu için OD600'e karşı standart bir hücre yoğunluğu eğrisi kullanılmıştır. Bu eğri, değişen OD600 değerlerine sahip süspansiyonların hücre yoğunluğunu belirlemek için bir hemositometre (bakınız Malzeme Tablosu) kullanılarak hazırlanmıştır. - Hücre süspansiyonunu 2 mM NaPB'de 5 x 105 hücre/mL'ye seyreltin. Bu seyreltilmiş süspansiyonun 10 mL'sinin hazırlanması bu çalışmayı tamamlamak için fazlasıyla yeterli olacaktır.
5. C. albicans'ın peptid çözeltileri ile inkübasyonu ve canlılığın ölçülmesi için hücrelerin hazırlanması
- Seyreltilmiş C. albicans süspansiyonunun 20 μL'sini (adım 4.6) her satırın 1-10 arası Sütunlarına ve Sütun 12'sine ekleyin (Şekil 1).
NOT: İlk sütundaki son peptid konsantrasyonu şimdi peptid stok konsantrasyonunun yarısıdır. Bu çalışma için, son peptid konsantrasyonu bu noktada 50 μM idi. Her kuyucuktaki son hücre süspansiyonu 2,5 x 105 hücre/mL içerir. Sütun 1-10, farklı peptid konsantrasyonlarında antifungal aktiviteyi değerlendirmek için deneysel kuyular görevi görür ve Sütun 12, peptid içermeyen büyüme için bir kontrol görevi görür. - Sütun 11'e 20 μL 2 mM NaPB ekleyin. Tüm kuyular artık 1 mM NaPB'lik bir nihai konsantrasyona sahiptir. Sütun 11 sterilite kontrolü görevi görür.
- Kapak Plakası 1 (hem hücreleri hem de peptidi içerir) ve 30 dakika boyunca 30 ° C'de inkübe edin.
NOT: Birçok peptid 17,21,22,30 için 30 dakikalık bir inkübasyon süresi yeterlidir, ancak antifungal aktivitelerini uygulamak için daha uzun bir süre gerektirebilecek peptidleri hesaba katmak için istenirse inkübasyon süresi 60 dakikaya çıkarılabilir 25,31,32. - Canlılığı ölçmede kullanılmak üzere yeni bir 96 delikli kültür plakası (Plaka 2) hazırlayın (Şekil 2).
NOT: Kültür plakası, Plaka 1'in inkübasyonu sırasında hazırlanmalıdır.- Plakanın tüm kuyularına 100 μL YPD (adım 1.2) ekleyin.
- Plakanın tüm kuyularına 100 μL 2 mM NaPB (Adım 1.1) ekleyin.
- Numuneleri Plaka 1'de (hücreler ve peptitler içeren) seyreltin ve Plaka 2'ye (ortam ve tampon içeren) aktarın.
- 30 dakikalık inkübasyonun ardından Plaka 1'i inkübatörden alın.
- Her bir kuyucukta toplam 320 μL hacim için 280 μL 1 mM NaPB (adım 1.1) ekleyerek Plaka 1'in her bir kuyusunu seyreltin (Şekil 2).
- Tüm hücrelerin yeniden askıya alındığından ve kuyucukların dibinde yerleşmiş hücrelerin görünmediğinden emin olmak için hücreleri ve peptitleri içeren tüm kuyucukları yukarı ve aşağı pipetleyerek karıştırın.
- Plaka 1'deki her bir kuyudan Plaka 2'nin karşılık gelen kuyusuna 8 μL aktarın. Bu hacim, Plaka 1'in her bir kuyucuğundan yaklaşık 250 hücreyi Plaka 2'ye aktarır (Şekil 2).
- Kapak Plakası 2 ve 30 ° C'de 17 saat boyunca 350 rpm'de bir mikrotitre plaka çalkalayıcı üzerinde inkübe edin ( Malzeme Tablosuna bakınız).
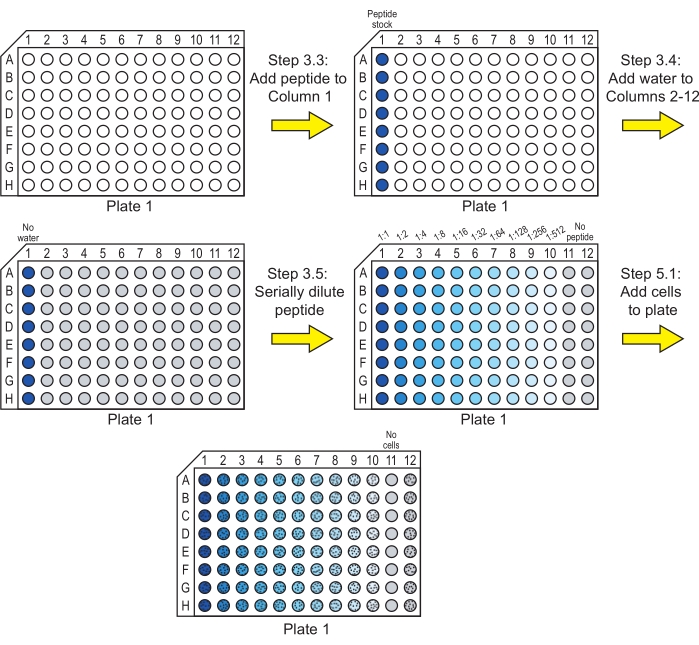
Şekil 1: Peptit seri seyreltmelerinin hücrelerle inkübasyonu için Plaka 1'in hazırlanması. Peptitin seri seyreltmeleri suda yapılır ve C. albicans hücreleri Plaka 1'e eklenir. Mavi renk, kuyuda peptidin bulunduğunu ve gri, su içeren ve peptid içermeyen bir kuyuyu gösterir. Hücreleri içeren kuyucuklar siyah noktalardan oluşan bir desenle gösterilir. Bu adımlardan sonra, peptidin antifungal aktivitesini göstermesine izin vermek için plaka inkübe edilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Peptit nedeniyle canlılıktaki azalmayı ölçmek için Plaka 2'nin hazırlanması. Plaka 2'ye YPD ortamı ve NaPB eklenir. Plaka 1'in içeriği seyreltildikten sonra, her bir kuyucuktan bir aliquot Plaka 1'den Plaka 2'ye aktarılır. Plaka 2 daha sonra OD600'ü ölçerek herhangi bir canlı hücrenin niceleme için büyümesine izin vermek için inkübe edilir. Plaka 2 için, sadece YPD ve NaPB içeren kuyular turuncu renkle gösterilir. YPD ve NaPB ile karıştırılmış Plaka 1'den alikotlar içeren kuyular yeşil renkte gösterilir. Plaka 1'deki renklerin açıklaması için Şekil 1 göstergesine bakın. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. Antifungal aktivitenin belirlenmesi
- Plaka 2'deki her kuyu için OD600 okumaları elde edin.
- Plaka 2'yi 17 saatlik inkübasyondan sonra inkübatörden çıkarın.
- Tüm hücrelerin yeniden askıya alındığından ve kuyucukların dibinde yerleşmiş hücrelerin görünmediğinden emin olmak için Plaka 2'deki tüm kuyucukları yukarı ve aşağı pipetleyerek karıştırın.
NOT: OD600 okumalarını engelleyebileceğinden, bu adım sırasında kabarcıklar oluşturmaktan kaçının. Kabarcıklar oluşursa, genellikle kuru bir pipet ucu ile patlatılabilir veya kuyudan çıkarmak için iki pipet ucu kullanılarak çıkarılabilir. - Her kuyucukiçin OD 600'ü elde etmek için 600 nm dalga boyunda bir emicilik plakası okuyucu kullanın (bkz.
- Büyümenin inhibisyonunu hesaplayın (yüzde olarak) ve peptitlerin C. albicans'ın büyümesi üzerindeki etkisini belirlemek için çizin.
- Her kuyucuk için, aşağıdaki denklem17,22,23'ü kullanarak kontrole kıyasla (yüzde olarak) canlılıktaki azalmayı hesaplayın:
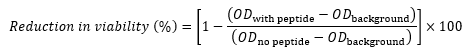
peptidli OD, belirli bir peptid konsantrasyonunu içeren bir kuyunun OD 600'ü olduğunda, OD arka planı aynı sıradaki Sütun 11'in OD 600'üdür (hücre içermeyen kontrol) ve
ODno peptide, aynı sıradaki Sütun 12'nin OD600'üdür (kontrol içeren hücreler ve peptid içermez). - Örneğin, B Satırı için OD600 değerlerinden Kuyu B5'teki uygulanabilirlik azalmasını hesaplamak için aşağıdaki ifadeyi kullanın:
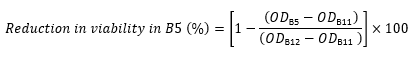
- Her kuyucuk için, aşağıdaki denklem17,22,23'ü kullanarak kontrole kıyasla (yüzde olarak) canlılıktaki azalmayı hesaplayın:
- Peptit konsantrasyonunun bir fonksiyonu olarak canlılıktaki azalmayı çizin.
Sonuçlar
Antifungal peptitler nedeniyle büyümedeki azalmayı ölçmek için OD600 ölçümlerinin kullanılması, numunelerin kaplanması ve CFU'ların sayılmasına kıyasla önemli ölçüde zaman kazandırır. Bu protokolde açıklanan yöntem, adımların üç farklı günde tamamlanmasını gerektirir. İlk gün, tamponları ve ortamları hazırlamak (sterilizasyon süresi hariç) ve C. albicans'ın başlangıç kültürünü gece boyunca inkübasyon için aşılamak için yaklaşık 1 saate ihtiyaç va...
Tartışmalar
Bu protokol, mantar patojeni C. albicans'a karşı AMP'lerin antifungal aktivitesi hakkında nicel veriler elde etmek için etkili bir yaklaşımı açıklamaktadır. Peptitleri ve diğer antifungal ajanları test etmek için yaygın bir alternatif yaklaşım, Klinik Laboratuvar Standartları Enstitüsü'nün (CLSI) standardı M2718'de açıklanan et suyu mikrodilüsyonudur, ancak bu standart nicel sonuçlar yerine nitel görsel sonuçlar elde etmeye odaklanmaktadır. Başka bir alternati...
Açıklamalar
Yazarlar, rekabet eden finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri (R03DE029270, T32AI089621B), Ulusal Bilim Vakfı (CBET 1511718), Eğitim Bakanlığı (GAANN-P200A180093) ve Maryland Üniversitesi Kampüsler Arası Tohum Bursu tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well plates (round bottom) | VWR | 10062-902 | |
| Absorbance microplate reader | N/A | N/A | Any available microplate reader is sufficient |
| C. albicans strain SC5314 | ATCC | MYA-2876 | Other C. albicans may also be used |
| Hemocytometer | N/A | N/A | Can be used to make a standard curve relating cell number to OD600 |
| Microplate shaker | VWR | 2620-926 | |
| Peptide(s) | N/A | N/A | Peptides can be commercially synthesized by any reliable vendor; a purity of ≥95% and trifluoroacetic acid salt removal to hydrochloride salt are recommended |
| Reagent reservoirs for multichannel pipettors | VWR | 18900-320 | Simplifies pipetting into multiwell plates with multichannel pipettor |
| Sodium phosphate, dibasic | Fisher Scientific | BP332-500 | For making NaPB |
| Sodium phosphate, monobasic | Fisher Scientific | BP329-500 | For making NaPB |
| UV spectrophotometer | N/A | N/A | Any available UV spectrophotometer is sufficient |
| YPD medium powder | BD Life Sciences | 242820 | May also be made from yeast extract, peptone, and dextrose |
Referanslar
- Gulati, M., Nobile, C. J. Candida albicans biofilms: Development, regulation, and molecular mechanisms. Microbes and Infection. 18 (5), 310-321 (2016).
- Arya, N. R., Rafiq, N. B. Candidiasis. StatPearls. , (2021).
- de Oliveira Santos, G. C., et al. Candida infections and therapeutic strategies: Mechanisms of action for traditional and alternative agents. Frontiers in Microbiology. 9, 1351 (2018).
- Espinel-Ingroff, A. Mechanisms of resistance to antifungal agents: Yeasts and filamentous fungi. Revista Iberoamericana de Micología. 25 (2), 101-106 (2008).
- Wang, X., et al. Delivery strategies of amphotericin B for invasive fungal infections. Acta Pharmaceutica Sinica B. 11 (8), 2585-2604 (2021).
- Struyfs, C., Cammue, B. P. A., Thevissen, K. Membrane-interacting antifungal peptides. Frontiers in Cell and Developmental Biology. 9, 649875 (2021).
- Huan, Y., Kong, Q., Mou, H., Yi, H. Antimicrobial peptides: Classification, design, application and research progress in multiple fields. Frontiers in Microbiology. 11, 582779 (2020).
- Sarkar, T., Chetia, M., Chatterjee, S. Antimicrobial peptides and proteins: From nature's reservoir to the laboratory and beyond. Frontiers in Chemistry. 9, 691532 (2021).
- Mahlapuu, M., Bjorn, C., Ekblom, J. Antimicrobial peptides as therapeutic agents: Opportunities and challenges. Critical Reviews in Biotechnology. 40 (7), 978-992 (2020).
- Lei, J., et al. The antimicrobial peptides and their potential clinical applications. American Journal of Translational Research. 11 (7), 3919-3931 (2019).
- Mercer, D. K., O'Neil, D. A. Innate inspiration: Antifungal peptides and other immunotherapeutics from the host immune response. Frontiers in Immunology. 11, 2177 (2020).
- Bin Hafeez, A., Jiang, X., Bergen, P. J., Zhu, Y. Antimicrobial peptides: An update on classifications and databases. International Journal of Molecular Sciences. 22 (21), 11691 (2021).
- Xu, T., Levitz, S. M., Diamond, R. D., Oppenheim, F. G. Anticandidal activity of major human salivary histatins. Infection and Immunity. 59 (8), 2549-2554 (1991).
- Helmerhorst, E. J., et al. Amphotericin B- and fluconazole-resistant Candida spp., Aspergillus fumigatus, and other newly emerging pathogenic fungi are susceptible to basic antifungal peptides. Antimicrobial Agents and Chemotherapy. 43 (3), 702-704 (1999).
- Andra, J., Berninghausen, O., Leippe, M. Cecropins, antibacterial peptides from insects and mammals, are potently fungicidal against Candida albicans. Medical Microbiology and Immunology. 189, 169-173 (2001).
- do Nascimento Dias, J., et al. Mechanisms of action of antimicrobial peptides ToAP2 and NDBP-5.7 against Candida albicans planktonic and biofilm cells. Scientific Reports. 10, 10327 (2020).
- Ikonomova, S. P., et al. Effects of histatin 5 modifications on antifungal activity and kinetics of proteolysis. Protein Science. 29, 480-493 (2020).
- Clinical Laboratory Standards Institute. . M27-A3. Reference method for broth dilution antifungal susceptibility testing of yeasts; Approved standard - Third edition. , (2008).
- Lupetti, A., et al. Candidacidal activities of human lactoferrin peptides derived from the N terminus. Antimicrobial Agents and Chemotherapy. 44 (12), 3257-3263 (2000).
- Han, J., Jyoti, M. A., Song, H. Y., Jang, W. S. Antifungal activity and action mechanism of histatin 5-halocidin hybrid peptides against Candida ssp. PLoS One. 11 (2), 0150196 (2016).
- den Hertog, A. L., et al. Candidacidal effects of two antimicrobial peptides: histatin 5 causes small membrane defects, but LL-37 causes massive disruption of the cell membrane. Biochemical Journal. 388, 689-695 (2005).
- Ikonomova, S. P., Moghaddam-Taaheri, P., Jabra-Rizk, M. A., Wang, Y., Karlsson, A. J. Engineering improved variants of the antifungal peptide histatin 5 with reduced susceptibility to Candida albicans secreted aspartic proteases and enhanced antimicrobial potency. The FEBS Journal. 285 (1), 146-159 (2018).
- Moghaddam-Taaheri, P., Leissa, J. A., Eppler, H. B., Jewell, C. M., Karlsson, A. J. Histatin 5 variant reduces Candida albicans biofilm viability and inhibits biofilm formation. Fungal Genetics and Biology. 149, 103529 (2021).
- Gong, Z., Doolin, M. T., Adhikari, S., Stroka, K. M., Karlsson, A. J. Role of charge and hydrophobicity in translocation of cell-penetrating peptides into Candida albicans cells. AIChE Journal. 65 (12), 16768 (2019).
- Gong, Z., Karlsson, A. J. Translocation of cell-penetrating peptides into Candida fungal pathogens. Protein Science. 26 (9), 1714-1725 (2017).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. Fourth edition. 3, (2012).
- Consolidated Sterilizer Systems. Laboratory and Research Autoclaves Available from: https://consteril.com/wp-content/uploads/2020/12/CSS-Product-Brochure.pdf (2022)
- Rodriguez-Tudela, J. L., Cuenca-Estrella, M., Diaz-Guerra, T. M., Mellado, E. Standardization of antifungal susceptibility variables for a semiautomated methodology. Journal of Clinical Microbiology. 39 (7), 2513-2517 (2001).
- Mbuayama, K. R., Taute, H., Strmstedt, A. A., Bester, M. J., Gaspar, A. R. M. Antifungal activity and mode of action of synthetic peptides derived from the tick OsDef2 defensin. Journal of Peptide Science. 28 (5), 3383 (2022).
- Rossignol, T., Kelly, B., Dobson, C., d'Enfert, C. Endocytosis-mediated vacuolar accumulation of the human ApoE apolipoprotein-derived ApoEdpL-W antimicrobial peptide contributes to its antifungal activity in Candida albicans. Antimicrobial Agents and Chemotherapy. 55 (10), 4670-4681 (2011).
- Helmerhorst, E. J., Reijnders, I. M., van't Hof, W., Veerman, E. C., Nieuw Amerongen, A. V. A critical comparison of the hemolytic and fungicidal activities of cationic antimicrobial peptides. FEBS Letters. 449 (2-3), 105-110 (1999).
- Kerenga, B. K., et al. Salt-tolerant antifungal and antibacterial activities of the corn defensin ZmD32. Frontiers in Microbiology. 10, 795 (2019).
- Lee, I. H., Cho, Y., Lehrer, R. I. Effects of pH and salinity on the antimicrobial properties of clavanins. Infection and Immunity. 65 (7), 2898-2903 (1997).
- Li, X. S., Reddy, M. S., Baev, D., Edgerton, M. Candida albicans Ssa1/2p is the cell envelope binding protein for human salivary histatin 5. Journal of Biological Chemistry. 278 (31), 28553-28561 (2003).
- Rothstein, D. M., et al. Anticandida activity is retained in P-113, a 12-amino-acid fragment of histatin 5. Antimicrobial Agents and Chemotherapy. 45 (5), 1367-1373 (2001).
- Sanders, E. R. Aseptic laboratory techniques: Volume transfers with serological pipettes and micropipettors. Journal of Visualized Experiments. (63), e2754 (2012).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Report. 26, 100987 (2021).
- Goughenour, K. D., Balada-Llasat, J. M., Rappleye, C. A. Quantitative microplate-based growth assay for determination of antifungal susceptibility of Histoplasma capsulatum yeasts. Journal of Clinical Microbiology. 53 (10), 3286-3295 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır