A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
معدل ترسيب كرات الدم الحمراء: توصيف مدفوع بالفيزياء في سياق طبي
In This Article
Summary
معدل ترسيب كرات الدم الحمراء (ESR) هو معلمة فيزيائية ، وغالبا ما تستخدم في الفحوصات الصحية الروتينية والتشخيص الطبي. تم مؤخرا تطوير نموذج نظري يسمح باستخراج معلمات ذات مغزى مادي من منحنى الترسيب بأكمله ، بناء على المعرفة الغروية الحديثة. هنا ، نقدم بروتوكولا لجمع ESR تلقائيا بمرور الوقت ، واستخراج معلمات هذا النموذج الأخير من جمع البيانات الآلي هذا. من المرجح أيضا أن تؤدي هذه المعايير المكررة إلى تحسين الشهادة الطبية.
Abstract
معدل ترسيب كرات الدم الحمراء (أو خلايا الدم الحمراء) (ESR) هو معلمة مشتقة ماديا من الدم والتي غالبا ما تستخدم في الفحوصات الصحية الروتينية والتشخيص الطبي. على سبيل المثال ، في حالة الالتهاب ، لوحظ ارتفاع ESR بسبب الزيادة المرتبطة في الفيبرينوجين وبروتينات البلازما الأخرى. كان يعتقد أن هذه الزيادة كانت بسبب تكوين مجاميع أكبر من خلايا الدم الحمراء (كرات الدم الحمراء) الناجمة عن الزيادة في الفيبرينوجين. في الواقع ، الفيبرينوجين هو تجمع معزز للعوامل من كرات الدم الحمراء وفي نظام ستوكس يفترض أنه لوحظ في رواسب المجاميع الأكبر حجما في الدم بشكل أسرع. ومع ذلك ، فإن جميع نماذج قياسات ESR بناء على هذه الفرضية تتطلب المزيد من الافتراضات الفيزيائية المحددة ، غير المطلوبة في أي نظام آخر. إلى جانب ذلك ، أثبتت الدراسات الحديثة في مجال المعلقات الغروية أن الجسيمات الجذابة تشكل مجاميع متسربة (أي مجاميع بعرض الحاوية). ثم يتبع ترسيب هذه الغرويات ما يسمى ب "انهيار الهلام الغروي". في الآونة الأخيرة ، ثبت أن كرات الدم الحمراء تتبع بالفعل نفس السلوك. تسمح هذه الفرضية أيضا بنمذجة منحنى الترسيب لكرات الدم الحمراء بكفاءة وتحليلية ، والتي يمكن من خلالها استخراج واصفات قوية وذات مغزى مادي. تصف هذه المخطوطة كيفية إجراء مثل هذا التحليل، وتناقش فوائد هذا النهج.
Introduction
معدل ترسيب كرات الدم الحمراء (ESR) هو أداة سريرية طبية في المختبر ، تم تقديمها رسميا في الطب القائم على الأدلة خلال القرن العشرين1،2،3،4. يستخدم حاليا في جميع أنحاء العالم كاختبار التهابي غير محدد ، أو لمراقبة تطور بعض الحالات المحددة5،6،7،8. ويرجع ذلك أساسا إلى زيادة تركيز الفيبرينوجين ، ولكن أيضا في مكونات البلازما الأخرى مثل IgM1،9،10،11. وفقا لبروتوكول Westergren القياسي الحالي ، يتم الإبلاغ عن قيم ESR كقياس لطبقة البلازما الخالية من الخلايا في نقطة زمنية معينة (30 دقيقة أو 1 ساعة) بعد ترك أنبوب عمودي بحجم نموذجي يبلغ 20 سم عموديا عند الراحة12. ومع ذلك ، فقد تم انتقاد طريقة القياس هذه حيث تم الإبلاغ عن مراحل مختلفة نوعيا في عملية الترسيب ، بما في ذلك التأخير قبل الوصول إلى أقصى سرعةترسب 13. يستمر هذا التأخير لأكثر من 1 ساعة في ما يقرب من نصف العينات السليمة14. السرعة خلال هذه المرحلة تطيع قياسا مختلفا عن المرحلة الثانية الأسرع من الترسيب15. إن تقييد القراءة بمتوسط سرعة الاستقرار خلال الساعة الأولى يقارن مزيجا مختلفا من خصائص الدم المختلفة بين الأفراد المختلفين.
علاوة على ذلك ، فقد ثبت مؤخرا أن الاعتبارات النظرية المعتادة وراء هذا البروتوكول كانت خاطئة16،17،18. في الهيماتوكريت الفسيولوجي (أعلى من 25٪ تقريبا) ، لا تترسب خلايا الدم الحمراء (كرات الدم الحمراء) كمجاميع منفصلة ، بل كشبكة مستمرة ، تسمى الترشيح ، من كرات الدم الحمراء 17,18 ، تطيع مجموعة مختلفة من المعادلات الفيزيائية عن ترسيب ستوكس المذكور عادة 16,17. لقد ثبت أن النظر في الوصف المادي بناء على القياسات التي تم حلها زمنيا للترسيب (المنحنى الكامل) كان أكثر قوة في بعض السياقات الطبية الجديدة19،20. علاوة على ذلك ، يمكن استخدام هذه القياسات لإلقاء الضوء على الآليات الفيزيائية التي تغير ESR في الأمراض التي يتم فيها تغيير أشكال الخلايا19,20. بالإضافة إلى ذلك ، يمكن أن يكون ل ESR البطيء تفسير طبي مفيد ، كما هو موضح في قياسات مجموعة من مرضى متلازمة كثرة الخلايا العصبية19,20. تستعرض هذه المقالة كيفية التنفيذ العملي لقياس المعلمات ذات المغزى المادي ، بناء على حركية ESR بأكملها. بشكل أكثر دقة ، تستخرج الطريقة المعروضة هنا أقصى سرعة ترسيب Um ، والتي يمكن تصحيح قيمتها للنظر في تأثير الهيماتوكريت للمتبرع16,17. هذه المعلمة أكثر دقة وبالتالي أكثر موثوقية من القياس التقليدي16،17،19،20.
بالإضافة إلى ذلك ، في بعض الأبحاث الأساسية ، بدلا من مراقبة حالة الالتهاب لمريض معين ، من المثير للاهتمام استبعاد تأثير الهيماتوكريت على ESR 21،22،23 ، أو التحقيق في دور كرات الدم الحمراء في ESRالمعدل 19،20،24،25 بين مختلف المانحين. قد يكون من المفيد مقارنة العينات التي ليست عينات دم كاملة مباشرة من المرضى. لذلك ، يمكن استخدام تعليق كرات الدم الحمراء مع الهيماتوكريت المتحكم فيه في البلازما الذاتية ، أو في بديل البلازما ، كخطوة أولى لقياس ESR. على سبيل المثال ، تنتج محاليل ديكستران 70 كيلو دالتون بتركيز 55 مجم / مل في محلول ملحي مخزن بالفوسفات (PBS) نطاق ترسيب ضمن نطاق التحكم للخلايا السليمة19. توضح هذه المخطوطة أيضا كيفية إجراء مثل هذه الخطوات ، وأن التحليل المقدم مهم أيضا في هذه الحالات.
Protocol
تمت الموافقة على جمع عينات الدم والتجارب من قبل "Ärztekammer des Saarlandes" ، أخلاقيات التصويت 51/18 ، وتم إجراؤها بعد الحصول على موافقة مستنيرة وفقا لإعلان هلسنكي. يجب إجراء القياسات القياسية باستخدام حمض الإيثيلين ديامينيترايتيك (EDTA) - الدم المضاد للتخثر (تركيز EDTA القياسي 1.6 مجم / مل في الدم ، المعيار الأوروبي NF EN ISO 6710) ، في أنابيب Westergren. يعتمد الحجم المطلوب لملء أنبوب Westergren على الشركة المصنعة (حيث تحتوي الأجزاء السفلية أحيانا على خزان أوسع) ؛ يجب أن يكون الحجم حوالي 1 مل من الدم الكامل ، و 800 ميكرولتر للأنابيب المشار إليها في جدول المواد. ومع ذلك ، فإن الطريقة الموضحة أدناه صالحة بغض النظر عن شكل التعليق والحاوية المحدد ، طالما أن الهيماتوكريت للعينات التي تم فحصها أعلى من 25٪ 16. لذلك يجب اختيار الأحجام والحاويات ووسط التعليق والمواد المضافة وفقا للأهداف المحددة للبحث الذي تم إجراؤه.
1. التجارب والقياسات
ملاحظة: سجل معدل ترسيب العينة كل دقيقة.
- تحضير العينة (إذا لزم الأمر): إذا كانت هناك حاجة إلى عنصر تحكم في الهيماتوكريت أو سائل معلق ، فابدأ بغسل الخلايا وإعداد العينات (على سبيل المثال ، نوضح كيفية تحضير العينات بمستويات مختلفة من الفيبرينوجين ، عن طريق خلط المصل الذاتي والبلازما). يمكن بالفعل تقريب المصل على أنه بلازما خالية من الفيبرينوجين26,27 ، ويمكن استخدامه لتقليل تراكم كرات الدم الحمراء ، في ظروف فسيولوجية أخرى. من أجل تحضير عدة عينات ، اجمع الدم في أنابيب EDTA القياسية سعة 9 مل والمصل في أنابيب المصل القياسية (مع حبات السيليكا كمنشطات تخثر) من 9 مل.
- أجهزة الطرد المركزي لعينات الدم (أي 9 مل من EDTA القياسية وأنابيب المصل في المثال المختار) عند 3000 × جم لمدة 7 دقائق على الأقل ، من أجل الضغط الأمثل لكريات الدم الحمراء المعبأة. استبدل المادة الطافية ب PBS أو السائل المعلق المطلوب ، إذا توفرت كمية كافية. إذا كان مطلوبا ببساطة التحكم في الهيماتوكريت في البلازما الذاتية ، فانتقل مباشرة إلى الخطوة 1.1.3. خلاف ذلك ، تخلط بلطف بعد إدراج طاف للغسيل.
- كرر ثلاث مرات. أداء الغسيل الأخير مع السائل المعلق المطلوب في أي حال.
- في المثال المختار ، قم بإعداد مخاليط من البلازما الذاتية والمصل بنسب محددة (على سبيل المثال ، 25٪ / 75٪ ، 50٪ / 50٪ ، أو 75٪ / 25٪ من جزء حجم مصل البلازما). على سبيل المثال ، عند تحضير 2.5 مل من خليط مصل البلازما 25٪ / 75٪ ، أضف 0.625 مل من البلازما إلى 1.875 مل من المصل.
- استخراج الحجم المطلوب من الخلايا المعبأة وتعليقه في السائل المطلوب. قم بمعالجة الخلايا المعبأة كسائل عالي اللزوجة (باستخدام ماصة قياسية مسبقة و / أو ماصة عكسية أو ماصة إزاحة موجبة28). في المثال المختار ، بالنسبة لعينة 4 مل عند الهيماتوكريت بنسبة 45٪ ، قم بتعليق 1.8 مل من الخلايا المعبأة ضمن 2.2 مل من خليط مصل البلازما.
- إذا لم يتم التحكم في الهيماتوكريت في العينة ، فحدده عن طريق الطرد المركزي الدقيق عالي السرعة (الطرق القياسية الأخرى مناسبة أيضا).
- استخراج الكمية المطلوبة من العينة لتحديد الهيماتوكريت: املأ الشعيرات الدموية الدقيقة للهيماتوكريت عن طريق غمر طرفها السفلي في السائل. أوقفها عن طريق تغطية الفتحة العلوية عندما ترتفع الكمية المطلوبة من العينة في الأنبوب عن طريق الشفط الشعري.
- ختم الشعيرات الدموية مع الشمع الختم. ضعها في جهاز الطرد المركزي الهيماتوكريت الدقيق وقم بتشغيلها بسرعة 15000 × جم (12000 دورة في الدقيقة) لمدة 5 دقائق ، أو وفقا لتعليمات الشركة المصنعة.
- اقرأ مستوى الهيماتوكريت على الشعيرات الدموية واكتبه كمرجع.
- قم بإعداد كاميرا لتسجيل ترسب العينات. لتجنب التحميل الزائد على الذاكرة أو استنزاف البطارية ، قم بتشغيل الجهاز من التيار الكهربائي واحفظ الصور مباشرة على جهاز كمبيوتر أو محرك أقراص ثابت خارجي.
- قم بإعداد كاميرا ثابتة أمام الحامل حيث سيتم ترك أنابيب ESR في حالة راحة. استخدم خلفية بيضاء مضيئة (أوراق بيضاء في الخلفية تعمل بشكل مثالي).
- باستخدام أنابيب Westergren الفارغة ، ويفضل أن يكون ذلك بدون علامات ، اضبط التركيز ومجال رؤية الكاميرا للحصول على أعلى دقة حيث سيتم وضع العينات. على نحو مفضل ، تأكد من محاذاة حدود الصور في الاتجاه الرأسي والأفقي.
- التقط صورة لأنبوب متدرج لاستخراج دقة البكسل. يوصى باستخدام صور RGB.
- اضبط الضوء ووقت التعرض للكاميرا للحصول على خلفية بيضاء ، ولكن بدون تشبع. تم الحصول على المثال الوارد في الشكل 1 باستخدام كاميرا EOS M50 من Canon، مع وقت تعريض 1 /15 ثانية، وفتحة عدسة F8.0، وتوازن اللون الأبيض التنغستن، في وضع اللقطة الواحدة مع التركيز البؤري اليدوي، وسرعة ISO تبلغ 1000.
- تحضير ووضع أنابيب ESR.
- املأ الحاوية السفلية لأنبوب Westergren بالحجم المقابل لتعليمات الشركة المصنعة. أدخل أنبوب Westergren في الحاوية السفلية كما هو موضح من قبل الشركة المصنعة.
- بمجرد أن يصبح الأنبوب الأول جاهزا ، ضعه في الحامل وابدأ تسجيل الكاميرا. عادة ما يعطي تسجيل صورة واحدة كل دقيقة دقة جيدة للمنحنى الحركي ESR.
- تحضير ووضع العينات التالية. تأكد من عدم الوقوف أمام أي عينة عند التقاط صورة.
- دع القياسات تعمل لمدة 2 ساعة على الأقل ، من أجل المقارنة مع القياسات القياسية في 30 دقيقة و 1 ساعة و 2 ساعة. ومع ذلك ، من الأفضل أيضا رؤية تشبع وإيقاف الترسيب. بالنسبة للعينات الصحية ، أو في حالة الالتهاب ، فإن تسجيل العينات بين عشية وضحاها ، بين 12 ساعة و 24 ساعة ، أكثر من كاف لأن انحناء أسرع العينات مرئي في غضون 3 ساعات13,19. ومع ذلك ، إذا كانت الحالة تقلل من سرعة الترسيب ، كما يفعل انخفاض تركيز الفيبرينوجين (أي في المثال المختار ، جزء حجم مصل مرتفع) ، فقد تكون هناك حاجة إلى تسجيلات 50 ساعة أو أكثر للحصول على المعلومات الأكثر دقة16,19.
2. تحليل الصور
ملاحظة: بمجرد تسجيل الصور ، قم باستخراج منحنى ESR. يتم توفير مثال على كود Matlab كملف تكميلي 1 (MatlabCodeImageAnalysisSampled.m).
- حدد أو حدد منطقة الاهتمام (ROI) حيث يكون أنبوب واحد فقط مرئيا ، ويقع الحد السفلي تحت أدنى موضع لواجهة البلازما الخالية من خلايا كرات الدم الحمراء ولكن داخل العينة (انظر الشكل 1 أ ، ب). إذا لزم الأمر ، قم بتدوير الصورة بحيث يتم محاذاة الاتجاه الرأسي على طول المكون الأول من الصورة.
- قم بتحويل عائد الاستثمار لصورة RGB إلى صورة ذات مقياس رمادي أو مصفوفة Gr. عادة ما يكون الجمع بين القنوات ثلاثية الألوان (الأحمر [R] والأخضر [G] والأزرق [B]) مثل Gr = 2 * R - B - G فعالا للغاية مع خلفية واضحة (انظر الشكل 1C وخطوط MatlabCodeImageAnalysisSampled.m 121-128).
- اربط الصورة. للحصول على عينة صحية ، عادة ما يعطي استخدام عتبة Otsu29 نتيجة متسقة (انظر الشكل 1D والسطر 133 من MatlabCodeImageAnalysisSampled.m). بالنسبة للعينات التي تحتوي على نسبة عالية من الهيماتوكريت أو مع بعض انحلال الدم ، قد يكون من الأفضل ضبطها يدويا أو استخدام طريقة تلقائية أخرى (كما هو الحال في الأسطر 129-131 من MatlabCodeImageAnalysisSampled.m) ، اعتمادا على التباين الدقيق الذي تم الحصول عليه بين المراحل المختلفة داخل الأنبوب.
- احصل على متوسط قيم البكسل (أو العناصر) ل Gr على طول الاتجاه الأفقي. تقلل هذه الخطوة من الضوضاء وتحقق متوسط المخالفات المحتملة للواجهة بكفاءة (انظر الشكل 1E و MatlabCodeImageAnalysisSampled.m السطر 137).
- قبل حساب الاختلافات ، قم بتنعيم المنحنى بمتوسط متحرك ، خاصة إذا كانت الأنابيب تحتوي على بعض العلامات الأفقية (انظر الشكل 1F). بالنسبة للأمثلة المقدمة ، تم استخدام نافذة متحركة ~ 2.5 مم (50 بكسل) لهذه العملية (انظر السطر 138 من MatlabCodeImageAnalysisSampled.m). بعد ذلك ، حدد موضع الواجهة كنقطة ذات تباين أعلى كثافة (انظر الشكل 1G).
- كرر لكل صورة وكل عينة. لكل عينة ، احفظ مواضع الواجهة بمرور الوقت بتنسيق مناسب لتناسب النموذج المادي مع أي برنامج مناسب.
3. تركيب النموذج المادي
- باستخدام أي برنامج مناسب بشكل مناسب ، ومعرفة الهيماتوكريت والارتفاع الأولي لعمود الدم h 0 ، أوجد قيم وقت التأخير t0 ، والوقت الذي لا أبعاد له γ ، والكسر الحجمي النهائي المعبأ Φmمن كريات الدم الحمراء الذي يقلل من مجموع الانحرافات المتبقية التربيعية للنموذج المادي17. يتم توفير رمز Matlab (ShapeAnalyzerIntegrated.m) كملف تكميلي 2 كمثال على كيفية إجراء مثل هذا الملاءمة. انظر الملف التكميلي 2 للحصول على مزيد من التعليمات. كما هو موضح في مكان آخر16،17 ، كريات الدم الحمراء في رواسب الهيماتوكريت الفسيولوجية كهلام جسيمات ناعمة ، حيث المعلمات الفيزيائية المهمة هي الفرق في الكثافة بين البلازما وكرات الدم الحمراء للمتبرع Δρ ، قطر خاصية كرات الدم الحمراء rRBC ، لزوجة البلازما في درجة حرارة الغرفة η ، وهيماتوكريت المتبرع Φ . باستخدام هذه المعلمات ، وبافتراض أن إجهاد الجاذبية هو العملية الدافعة الرئيسية لتدفق البلازما لأعلى عبر الشبكة المسامية التي شكلتها كريات الدم الحمراء بعد وقت تأخير t0 ، يحصل المرء على التطور الزمني16,17:
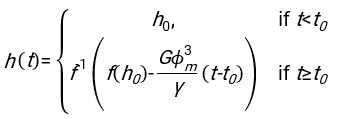
مع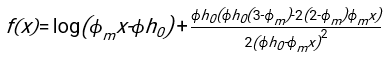 ، ،
، ، 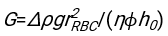 وكونه
وكونه 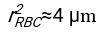 متوسط نصف قطر القرص لكرات الدم الحمراء. يتم توفير مثال على رمز Matlab الذي يقوم بذلك كمرفق (يناسب ShapeAnalyzerIntegrated.m الوظيفة المحددة في SedimFit.m [الملف التكميلي 3]). بدلا من ذلك ، يمكن أيضا استخدام G / γ مباشرة كمعلمة ملائمة بوحدات 1 / t.
متوسط نصف قطر القرص لكرات الدم الحمراء. يتم توفير مثال على رمز Matlab الذي يقوم بذلك كمرفق (يناسب ShapeAnalyzerIntegrated.m الوظيفة المحددة في SedimFit.m [الملف التكميلي 3]). بدلا من ذلك ، يمكن أيضا استخدام G / γ مباشرة كمعلمة ملائمة بوحدات 1 / t. - بمجرد استخراج المنحنى الكمي من الصورة ، احفظ المعلمات الفيزيائية للعينة. لا يزال من الممكن استخراج قيم ESR التقليدية عند 30 دقيقة أو 1 ساعة أو 2 ساعة من المنحنى للرجوع إليها (انظر خطوط ShapeAnalyzerIntegrated.m 123-132).
النتائج
يتم توفير مثال على تسلسل الصور الذي تم الحصول عليه بشكل صحيح كفيلم تكميلي 1 (MovieS1.avi). يتم عرض سلسلة من النوبات المميزة للنموذج لظروف مختلفة في الشكل 2. تم تحديد تركيز الفيبرينوجين من تركيز الفيبرينوجين في البلازما فيب0 ، على افتراض أن المصل لا يحتوي على أي ...
Discussion
لكي يعمل البروتوكول الآلي بكفاءة ، من المهم أن يكون لديك خلفية واضحة وإضاءة مناسبة. قد تمنع الخلفية المظلمة وجود عتبة ثنائية فعالة. بالنسبة للعينات التي تحتوي على بعض انحلال الدم ، والذي يحدث عادة (يزيد) بمرور الوقت ، من المهم التحقق أولا من أن عتبة الازدواجية المختارة ذات صلة بكل من الصور ?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عن صلة بمحتوى هذه المقالة.
Acknowledgements
تم دعم هذا العمل من قبل وحدة الأبحاث FOR 2688 - Wa1336/12 التابعة لمؤسسة الأبحاث الألمانية واتفاقية منحة Marie Skłodowska-Curie رقم 860436-EVIDENCE. يقر T. J. و C. W. بتمويل من الجامعة الفرنسية الألمانية (DFH / UFA). يقر A. D. بالتمويل من منحة الباحث الشاب من جامعة سارلاند.
Materials
| Name | Company | Catalog Number | Comments |
| Anticoagulant (EDTA or Heparin) tube (for blood sample) | SARSTEDT | 267001 or 265 | Anticoagulated blood sample to characterize |
| Camera EOS M50 | Canon | Kit EF-M18-150 IS STM | Any camera should work, provided that sector alimentation, connection to computer for automated shooting and adapted objective are available |
| Centrifuge | HERMLE | 302.00 V03 - Z 36 HK | Requirements: at least 3000 x g ofr 7 min. |
| Micro-centrifuge | MLW | TH21 | or any other way to determine the hematocrit |
| Micro-hematocrit capilaries | Fisher scientific | 11884040 | or other capillaries/containers for hematocrit determination |
| Phosphate Buffered Saline (PBS) | ThermoFisher | 10010023 | 1x PBS, pH 7.4, 298 Osm |
| Pipettes (e.g. positive displacement pipette) | Gilson | FD10006 | Pipette required to manipulate blood and/or packed cells.Other models are of course suitable, but be careful to treat blood and pakced cells as highly viscous fluids. |
| Wax sealing plate | Hirschmann | 9120101 | Sealing wax for the micro-hematocrit capillaries |
| Westergren tubes | Praxindo | A9244560 | Any other standard Wetsergren tube should work too |
| White background with illumination | / | / | White sheet(s) of paper behind the samples, with usual room light is perfcetly sufficient. |
References
- Bedell, S. E., Bush, B. T. Erythrocyte sedimentation rate. From folklore to facts. The American Journal of Medicine. 78, 1001-1009 (1985).
- Grzybowski, A., Sak, J. Edmund Biernacki (1866-1911): Discoverer of the erythrocyte sedimentation rate. On the 100th anniversary of his death. Clinics in Dermatology. 29 (6), 697-703 (2011).
- Kushner, I., Mackiewicz, A. . The Acute Phase Response: An Overview. Acute Phase Proteins. , (1993).
- Tishkowski, K., Gupta, V. Erythrocyte Sedimentation Rate. StatPearls Publishing. , (2022).
- Menees, S. B., Powell, C., Kurlander, J., Goel, A., Chey, W. D. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. The Americal Journal of Gastroenterology. 110 (3), 444-454 (2015).
- Brigden, M. L. Clinical utility of the erythrocyte sedimentation rate. Americal Family Physician. 60 (5), 1443-1450 (1999).
- Liu, S., et al. Preliminary case-control study to evaluate diagnostic values of C-reactive protein and erythrocyte sedimentation rate in differentiating active Crohn's disease from intestinal lymphoma, intestinal tuberculosis and Behcet's syndrome. The American Journal of the Medical Sciences. 346 (6), 467-472 (2013).
- Greidanus, N. V., et al. Use of erythrocyte sedimentation rate and C-reactive protein level to diagnose infection before revision total knee arthroplasty: A prospective evaluation. The Journal of Bone and Joint Surgery. 89 (7), 1409-1416 (2007).
- Flormann, D., Kuder, E., Lipp, P., Wagner, C., Kaestner, L. Is there a role of C-reactive protein in red blood cell aggregation. International Journal of Laboratory Hematology. 37 (4), 474-482 (2015).
- Brust, M., et al. The plasma protein fibrinogen stabilizes clusters of red blood cells in microcapillary flows. Scientific Reports. 4, 4348 (2014).
- Gray, S. J., Mitchell, E. B., Dick, G. F. Effect of purified protein fractions on sedimentation rate of erythrocytes. Proceedings of the Society for Experimental Biology and Medicine. 51 (3), 403-404 (1942).
- Kratz, A., et al. ICSH recommendations for modified and alternate methods measuring the erythrocyte sedimentation rate. International Journal of Laboratory Hematology. 39 (5), 448-457 (2017).
- Hung, W. T., Collings, A. F., Low, J. Erythrocyte sedimentation rate studies in whole human blood. Physics in Medicine and Biology. 39 (11), 1855-1873 (1994).
- Woodland, N. B., Cordatos, K., Hung, W. T., Reuben, A., Holley, L. Erythrocyte sedimentation in columns and the significance of ESR. Biorheology. 33 (6), 477-488 (1996).
- Holley, L., Woodland, N., Hung, W. T., Cordatos, K., Reuben, A. Influence of fibrinogen and haematocrit on erythrocyte sedimentation kinetics. Biorheology. 36 (4), 287-297 (1999).
- Dasanna, A. K., et al. Erythrocyte sedimentation: Effect of aggregation energy on gel structure during collapse. Physical Review. E. 105 (2-1), 024610 (2022).
- Darras, A., et al. Erythrocyte sedimentation: collapse of a high-volume-fraction soft-particle gel. Physical Review Letters. 128 (8), 088101 (2022).
- Darras, A., et al. Imaging erythrocyte sedimentation in whole blood. Frontiers in Physiology. 12, 729191 (2022).
- Darras, A., et al. Acanthocyte sedimentation rate as a diagnostic biomarker for neuroacanthocytosis syndromes: Experimental evidence and physical justification. Cells. 10 (4), 788 (2021).
- Rabe, A., et al. The erythrocyte sedimentation rate and its relation to cell shape and rigidity of red blood cells from chorea-acanthocytosis patients in an off-label treatment with dasatinib. Biomolecules. 11 (5), 727 (2021).
- Giavarina, D., Capuzzo, S., Pizzolato, U., Soffiati, G. Length of erythrocyte sedimentation rate (ESR) adjusted for the hematocrit: reference values for the TEST 1 method. Clinical Laboratory. 52 (5-6), 241-245 (2006).
- Bull, B. S. Is a standard ESR possible. Laboratory Medicine. 6 (11), 31-39 (1975).
- Bull, B. S., Brecher, G. An evaluation of the relative merits of the Wintrobe and Westergren sedimentation methods, including hematocrit correction. American Journal of Clinical Pathology. 62 (4), 502-510 (1974).
- Reinhart, W. H., Singh, A., Straub, P. W. Red blood cell aggregation and sedimentation: the role of the cell shape. British Journal of Haematology. 73 (4), 551-556 (1989).
- Jan, K., Usami, S., Smith, J. A. Influence of oxygen tension and hematocrit reading on ESRs of sickle cells: Role of RBC aggregation. Archives of Internal Medicine. 141 (13), 1815-1818 (1981).
- Issaq, H. J., Xiao, Z., Veenstra, T. D. Serum and plasma proteomics. Chemical Reviews. 107 (8), 3601-3620 (2007).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), 21230 (2011).
- . Proper Pipetting Techniques - DE Available from: https://www.thermofisher.com/de/de/home/life-science/lab-plasticware-supplies/lab-plasticware-supplies-learning-center/lab-plasticware-supplies-resource-library/fundamentals-of-pipetting/proper-pipetting-techniques.html (2023)
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Transaction on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Solomon, C., et al. A comparison of fibrinogen measurement methods with fibrin clot elasticity assessed by thromboelastometry, before and after administration of fibrinogen concentrate in cardiac surgery patients. Transfusion. 51 (8), 1695-1706 (2011).
- Norouzi, N., Bhakta, H. C., Grover, W. H. Sorting cells by their density. PLoS One. 12 (7), 0180520 (2017).
- Trudnowski, R. J., Rico, R. C. Specific gravity of blood and plasma at 4 and 37 degrees C. Clinical Chemistry. 20 (5), 615-616 (1974).
- Késmárky, G., Kenyeres, P., Rábai, M., Tóth, K. Plasma viscosity: A forgotten variable. Clinical Hemorheology and Microcirculation. 39 (1-4), 243-246 (2008).
- Teece, L. J., et al. Gels under stress: The origins of delayed collapse. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 458, 126-133 (2014).
- Lindström, S. B., Kodger, T. E., Sprakel, J., Weitz, D. A. Structures, stresses, and fluctuations in the delayed failure of colloidal gels. Soft Matter. 8 (13), 3657-3664 (2012).
- Bartlett, P., Teece, L. J., Faers, M. A. Sudden collapse of a colloidal gel. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 85, 021404 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved