Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Скорость оседания эритроцитов: характеристика, основанная на физике, в медицинском контексте
В этой статье
Резюме
Скорость оседания эритроцитов (СОЭ) — это физический параметр, часто используемый при рутинных медицинских осмотрах и медицинской диагностике. Недавно была разработана теоретическая модель, позволяющая извлекать физически значимые параметры из всей седиментационной кривой, основанная на современных коллоидных знаниях. Здесь мы представляем протокол для автоматического сбора ESR с течением времени и извлечения параметров этой недавней модели из этого автоматизированного сбора данных. Эти уточненные параметры также, вероятно, улучшат медицинские показания.
Аннотация
Скорость оседания эритроцитов (или эритроцитов) (СОЭ) является физическим производным параметром крови, который часто используется при рутинных медицинских осмотрах и медицинской диагностике. Например, в случае воспаления наблюдается более высокая СОЭ из-за связанного с этим увеличения фибриногена и других белков плазмы. Считалось, что это увеличение было связано с образованием более крупных агрегатов эритроцитов (эритроцитов), вызванных увеличением фибриногена. Действительно, фибриноген является агентом, способствующим агрегации эритроцитов, и в режиме Стокса, который, как предполагается, наблюдается в крови, более крупные агрегаты откладываются быстрее. Однако все модели измерений ЭПР, основанные на этой гипотезе, требуют дополнительных специфических физических допущений, не требуемых ни в одной другой системе. Кроме того, современные исследования в области коллоидных суспензий установили, что притягивающие частицы образуют просачивающиеся агрегаты (т.е. агрегаты шириной с контейнер). Оседание этих коллоидов затем следует за так называемым «коллапсом коллоидного геля». Недавно было показано, что эритроциты на самом деле следуют тому же поведению. Эта гипотеза также позволяет эффективно и аналитически смоделировать кривую седиментации эритроцитов, из которой могут быть извлечены надежные и физически значимые дескрипторы. В этой рукописи описывается, как выполнить такой анализ, и обсуждаются преимущества этого подхода.
Введение
Скорость оседания эритроцитов (СОЭ) является медицинским клиническим инструментом in vitro, официально введенным в доказательную медицину в двадцатом веке 1,2,3,4. В настоящее время он используется во всем мире в качестве неспецифического воспалительного теста или для мониторинга развития некоторых специфических состояний 5,6,7,8. В основном это связано с увеличением концентрации фибриногена, а также других компонентов плазмы, таких как IgM 1,9,10,11. Согласно действующему стандартному протоколу Вестергрена, значения СОЭ сообщаются как измерение бесклеточного слоя плазмы в заданный момент времени (30 мин или 1 ч) после оставления вертикальной пробирки типичного размера 20 см по вертикали в состоянии покоя12. Однако этот метод измерения подвергся критике, поскольку сообщалось о качественно различных стадиях процесса осаждения, включая задержку перед достижением максимальной скорости осаждения13. Эта задержка длится более 1 ч примерно у половины здоровыхобразцов14. Скорость во время этой фазы подчиняется иному масштабированию, чем во время второй, более быстрой фазы осаждения15. Ограничение считывания средней скоростью осаждения в течение первого часа затем сравнивает различную смесь различных свойств крови у разных людей.
Более того, недавно было продемонстрировано, что обычные теоретические соображения, лежащие в основе этого протокола, были ошибочными16,17,18. При физиологическом гематокрите (выше примерно 25%) эритроциты (эритроциты) осаждаются не как отдельные агрегаты, а скорее как непрерывная, так называемая перколяционная сеть эритроцитов 17,18, подчиняющаяся другому набору физических уравнений, чем обычно упоминаемое седиментацияСтокса 16,17. Было показано, что рассмотрение физического описания, основанного на измерениях седиментации (всей кривой) с временным разрешением, было более надежным в некоторых новых медицинских контекстах19,20. Более того, эти измерения могут быть использованы, чтобы пролить свет на физические механизмы, изменяющие СОЭ при патологиях, при которых изменяются формы клеток19,20. Кроме того, медленная СОЭ может иметь полезную медицинскую интерпретацию, как указано в измерениях когорты пациентов с синдромом нейроакантоцитоза19,20. В данной статье рассматривается, как практически реализовать измерение физико-значимых параметров, основанных на кинетике всей СОЭ. Более точно, представленный здесь метод извлекает максимальную скорость седиментации Um, значение которой можно скорректировать, чтобы учесть влияние гематокрита донора16,17. Этот параметр является более точным и, следовательно, более надежным, чем традиционное измерение16,17,19,20.
Кроме того, в некоторых фундаментальных исследованиях вместо мониторинга воспалительного состояния данного пациента интересно исключить влияние гематокрита на СОЭ 21,22,23 или исследовать роль эритроцитов в модифицированной СОЭ 19,20,24,25 между разными донорами. Может быть полезно сравнить образцы, которые не являются непосредственно полными образцами крови пациентов. Таким образом, ресуспендирование эритроцитов контролируемым гематокритом в аутологичной плазме или в плазменном заместителе может быть использовано в качестве первого этапа измерения СОЭ. Например, растворы декстрана 70 кДа с концентрацией 55 мг/мл в фосфатном буферном физиологическом растворе (PBS) дают диапазон осаждения в пределах контрольного диапазона для здоровых клеток19. В этой рукописи также показано, как должны проводиться такие шаги, и что представленный анализ также актуален в этих случаях.
протокол
Сбор образцов крови и эксперименты были одобрены «Ärztekammer des Saarlandes», ethics votum 51/18, и проводились после получения информированного согласия в соответствии с Хельсинкской декларацией. Стандартные измерения следует проводить с этилендиаминтетрауксусной кислотой (ЭДТА) - антикоагулянтной кровью (стандартная концентрация ЭДТА 1,6 мг / мл крови, европейская норма NF EN ISO 6710) в пробирках Вестергрена. Объем, необходимый для заполнения трубки Вестергрена, зависит от производителя (так как нижние части иногда содержат более широкий резервуар); Объем должен составлять около 1 мл полной крови и 800 мкл для пробирок, указанных в Таблице материалов. Однако метод, описанный ниже, действителен независимо от конкретной суспензии и формы контейнера, если гематокрит исследуемых образцов превышает 25%16. Поэтому объемы, контейнеры, суспендирующая среда и добавки должны быть выбраны в соответствии с конкретными целями проводимого исследования.
1. Эксперименты и измерения
ПРИМЕЧАНИЕ: Записывайте скорость осаждения образца каждую минуту.
- Пробоподготовка (при необходимости): Если требуется контрольный гематокрит или суспендирующая жидкость, начните с промывки клеток и подготовки образцов (в качестве примера мы покажем, как подготовить образцы с различными уровнями фибриногена, смешивая аутологичную сыворотку и плазму). Сыворотка действительно может быть аппроксимирована как плазма без фибриногена26,27 и может быть использована для уменьшения агрегации эритроцитов в других физиологических условиях. Чтобы подготовить несколько образцов, собирают кровь в стандартные пробирки ЭДТА объемом 9 мл и сыворотку в стандартные пробирки сыворотки (с шариками кремнезема в качестве активаторов свертывания крови) объемом 9 мл.
- Центрифугируют образцы крови (т.е. 9 мл стандартной ЭДТА и сывороточных пробирок в выбранном примере) в концентрации 3000 x g в течение не менее 7 мин для оптимального уплотнения упакованных эритроцитов. Замените надосадочную жидкость PBS или желаемой суспендирующей жидкостью, если имеется достаточное количество. Если требуется просто контролировать гематокрит в аутологичной плазме, переходите непосредственно к шагу 1.1.3. В противном случае аккуратно перемешайте после включения надосадочной жидкости для стирки.
- Повторите три раза. Последнюю стирку в любом случае выполняйте с желаемой суспензионной жидкостью.
- В выбранном примере готовят смеси аутологичной плазмы и сыворотки с определенными пропорциями (например, 25%/75%, 50%/50% или 75%/25% объемной доли плазмы и сыворотки). Например, при приготовлении 2,5 мл смеси 25%/75% плазма и сыворотка добавляют 0,625 мл плазмы к 1,875 мл сыворотки.
- Извлеките необходимый объем упакованных клеток и суспендируйте его в нужной жидкости. Упакованные ячейки обрабатывают как высоковязкую жидкость (с использованием стандартной предварительной пипетки и/или обратной пипетки или пипетки28 с принудительным вытеснением). В выбранном примере для образца объемом 4 мл при гематокрите 45% суспендировать 1,8 мл упакованных клеток в пределах 2,2 мл смеси плазма и сыворотка.
- Если гематокрит образца не контролируется, определяют его с помощью высокоскоростного микроцентрифугирования (подойдут и другие стандартные методы).
- Извлеките необходимое количество образца для определения гематокрита: заполните микрогематокритные капилляры, погрузив его нижний кончик в жидкость. Остановите его, закрыв верхнее отверстие, когда необходимое количество образца поднимется в пробирке путем капиллярного всасывания.
- Запечатайте капилляры сургучом. Поместите их в центрифугу микрогематокрита и запустите ее при 15 000 x g (12 000 об/мин) в течение 5 минут или в соответствии с инструкциями производителя.
- Прочтите уровень гематокрита на капилляре и запишите его для справки.
- Установите камеру для записи осаждения образцов. Чтобы избежать перегрузки памяти или разрядки аккумулятора, включите устройство от сети и сохраните снимки непосредственно на компьютер или внешний жесткий диск.
- Установите устойчивую камеру перед держателем, где трубки ESR будут оставлены в покое. Используйте белый, освещенный фон (белые листы бумаги на заднем плане отлично работают).
- Используя пустые трубки Вестергрена, желательно без маркировки, установите фокус и поле зрения камеры, чтобы получить максимальное разрешение, где будут размещены образцы. Желательно, чтобы границы рисунков были выровнены по вертикали и горизонтали.
- Сфотографируйте масштабированную трубку, чтобы извлечь разрешение в пикселях. Рекомендуется использовать изображения RGB.
- Установите свет и время экспозиции камеры так, чтобы фон был белым, но без насыщенности. Пример на рисунке 1 был получен с использованием Canon EOS M50 с выдержкой 1/15 с, диафрагмой F8.0, вольфрамовым балансом белого, в режиме одного кадра с ручной фокусировкой и чувствительностью ISO 1 000.
- Подготовьте и поместите трубки ESR.
- Наполните нижнюю емкость трубки Вестергрена объемом, соответствующим инструкциям производителя. Вставьте трубку Вестергрена в нижний контейнер, как указано производителем.
- Как только первая трубка будет готова, поместите ее в держатель и начните запись на камеру. Запись одного снимка каждую минуту обычно дает хорошее разрешение кинетической кривой ESR.
- Подготовьте и разместите следующие образцы. Убедитесь, что вы не стоите перед каким-либо образцом, когда делается снимок.
- Пусть измерения длятся не менее 2 часов, чтобы сравнить их со стандартными измерениями через 30 минут, 1 час и 2 часа. Тем не менее, также лучше увидеть насыщение и остановку седиментации. Для здоровых образцов или в случае воспаления более чем достаточно записи образцов в течение ночи, между 12 и 24 часами, поскольку кривизна самых быстрых образцов видна в течение 3 часов13,19. Однако, если какое-либо условие снижает скорость седиментации, как это происходит при снижении концентрации фибриногена (т.е. в выбранном примере, высокая объемная доля сыворотки), для получения наиболее точной информации может потребоваться регистрация в течение 50 ч или более 16,19.
2. Анализ изображений
ПРИМЕЧАНИЕ: После того, как изображения будут записаны, извлеките кривую ESR. Пример кода Matlab представлен в виде дополнительного файла 1 (MatlabCodeImageAnalysisSampled.m).
- Выберите или определите интересующую область (ROI), где видна только одна пробирка, нижняя граница которой расположена под самым нижним положением границы раздела бесклеточной плазмы эритроцитов, но внутри образца (см. рис. 1A, B). При необходимости поверните рисунок так, чтобы вертикальное направление было выровнено вдоль первого компонента рисунка.
- Преобразуйте ROI изображения RGB в изображение в оттенках серого или матрицу Gr. Обычно объединение трехцветных каналов (красный [R], зеленый [G] и синий [B]) как Gr = 2 * R - B - G очень эффективно с четким фоном (см. рис. 1C и MatlabCodeImageAnalysisSampled.m строки 121-128).
- Бинаризируйте картину. Для работоспособного образца использование порогаОцу 29 обычно дает согласованный результат (см. рисунок 1D и строку 133 MatlabCodeImageAnalysisSampled.m). Для образцов с высоким гематокритом или с некоторым гемолизом может быть лучше настроить его вручную или использовать другой автоматический метод (как это сделано в строках 129-131 MatlabCodeImageAnalysisSampled.m), в зависимости от точного контраста, полученного между различными фазами внутри пробирки.
- Получите среднее значение значений пикселей (или элементов) Gr вдоль горизонтального направления. Этот шаг минимизирует шум и эффективно усредняет возможные неровности интерфейса (см. рис. 1E и строку 137 MatlabCodeImageAnalysisSampled.m).
- Прежде чем вычислять вариации, сгладьте кривую с помощью скользящей средней, особенно если трубки содержат некоторую горизонтальную разметку (см. рис. 1F). Для приведенных примеров для этого процесса использовалось движущееся окно размером ~2,5 мм (50 пикселей) (см. строку 138 MatlabCodeImageAnalysisSampled.m). Затем определите положение интерфейса как точку с наибольшим изменением интенсивности (см. рис. 1G).
- Повторите эти действия для каждого рисунка и каждого образца. Для каждого образца сохраняйте положения интерфейса во времени в соответствующем формате, чтобы соответствовать физической модели с любым подходящим программным обеспечением.
3. Подгонка физической модели
- Используя любое подходящее программное обеспечение, зная гематокрит и начальную высоту столбика крови h 0, найдите значения времени задержки t0, безразмерного времени γ и конечной упакованной объемной доли Φmэритроцитов, которая минимизирует сумму квадратов остаточных отклонений для физической модели17. Код Matlab (ShapeAnalyzerIntegrated.m) предоставляется в виде дополнительного файла 2 в качестве примера того, как выполнить такую подгонку. Дополнительные инструкции см. в Дополнительном файле 2. Как описано в другом месте16,17, эритроциты при физиологическом гематокрите осаждаются в виде мягких частиц геля, где важными физическими параметрами являются разница в плотности между плазмой и эритроцитами донора Δρ, характерный диаметр эритроцитов r эритроцитов, вязкость плазмы при комнатной температуре η и гематокрит донора Φ . Используя эти параметры и предполагая, что гравитационное напряжение является основным движущим процессом для потока плазмы вверх через пористую сеть, образованную эритроцитами после времени задержки t0, получаем временную эволюцию16,17:
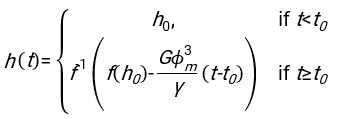
где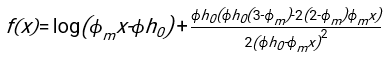 , ,
, , 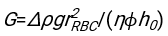 и
и 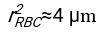 средний радиус диска эритроцита. Пример кода Matlab, выполняющего это, приведен в виде вложения (ShapeAnalyzerIntegrated.m соответствует функции, определенной в SedimFit.m [Дополнительный файл 3]). В качестве альтернативы G/γ также можно использовать непосредственно в качестве параметра подгонки с единицами измерения 1/т.
средний радиус диска эритроцита. Пример кода Matlab, выполняющего это, приведен в виде вложения (ShapeAnalyzerIntegrated.m соответствует функции, определенной в SedimFit.m [Дополнительный файл 3]). В качестве альтернативы G/γ также можно использовать непосредственно в качестве параметра подгонки с единицами измерения 1/т. - После того, как количественная кривая будет извлечена из изображения, сохраните физические параметры образца. Традиционные значения ESR через 30 мин, 1 ч или 2 ч все еще могут быть извлечены из кривой для справки (см. строки 123-132 ShapeAnalyzerIntegrated.m).
Результаты
Пример правильно полученной последовательности изображений приведен в виде дополнительного фильма 1 (MovieS1.avi). Ряд характерных подгонок модели показан для различных условий на рисунке 2. Концентрацию фибриногена определяли по концентрации фибриногена в плазме...
Обсуждение
Для эффективной работы автоматизированного протокола важно иметь четкий фон и правильное освещение. Темный фон может препятствовать существованию эффективного порога бинаризации. Для образцов с некоторым гемолизом, который обычно происходит (увеличивается) с течением времени, важно...
Раскрытие информации
У авторов нет конфликта интересов, чтобы заявить о том, что это имеет отношение к содержанию этой статьи.
Благодарности
Эта работа была поддержана исследовательским подразделением FOR 2688 - Wa1336/12 Немецкого научно-исследовательского общества и грантовым соглашением Марии Склодовской-Кюри No 860436-EVIDENCE. Т. Д. и К. В. признают финансирование со стороны Французско-немецкого университета (DFH/UFA). A. D. признает финансирование грантом для молодых исследователей Саарского университета.
Материалы
| Name | Company | Catalog Number | Comments |
| Anticoagulant (EDTA or Heparin) tube (for blood sample) | SARSTEDT | 267001 or 265 | Anticoagulated blood sample to characterize |
| Camera EOS M50 | Canon | Kit EF-M18-150 IS STM | Any camera should work, provided that sector alimentation, connection to computer for automated shooting and adapted objective are available |
| Centrifuge | HERMLE | 302.00 V03 - Z 36 HK | Requirements: at least 3000 x g ofr 7 min. |
| Micro-centrifuge | MLW | TH21 | or any other way to determine the hematocrit |
| Micro-hematocrit capilaries | Fisher scientific | 11884040 | or other capillaries/containers for hematocrit determination |
| Phosphate Buffered Saline (PBS) | ThermoFisher | 10010023 | 1x PBS, pH 7.4, 298 Osm |
| Pipettes (e.g. positive displacement pipette) | Gilson | FD10006 | Pipette required to manipulate blood and/or packed cells.Other models are of course suitable, but be careful to treat blood and pakced cells as highly viscous fluids. |
| Wax sealing plate | Hirschmann | 9120101 | Sealing wax for the micro-hematocrit capillaries |
| Westergren tubes | Praxindo | A9244560 | Any other standard Wetsergren tube should work too |
| White background with illumination | / | / | White sheet(s) of paper behind the samples, with usual room light is perfcetly sufficient. |
Ссылки
- Bedell, S. E., Bush, B. T. Erythrocyte sedimentation rate. From folklore to facts. The American Journal of Medicine. 78, 1001-1009 (1985).
- Grzybowski, A., Sak, J. Edmund Biernacki (1866-1911): Discoverer of the erythrocyte sedimentation rate. On the 100th anniversary of his death. Clinics in Dermatology. 29 (6), 697-703 (2011).
- Kushner, I., Mackiewicz, A. . The Acute Phase Response: An Overview. Acute Phase Proteins. , (1993).
- Tishkowski, K., Gupta, V. Erythrocyte Sedimentation Rate. StatPearls Publishing. , (2022).
- Menees, S. B., Powell, C., Kurlander, J., Goel, A., Chey, W. D. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. The Americal Journal of Gastroenterology. 110 (3), 444-454 (2015).
- Brigden, M. L. Clinical utility of the erythrocyte sedimentation rate. Americal Family Physician. 60 (5), 1443-1450 (1999).
- Liu, S., et al. Preliminary case-control study to evaluate diagnostic values of C-reactive protein and erythrocyte sedimentation rate in differentiating active Crohn's disease from intestinal lymphoma, intestinal tuberculosis and Behcet's syndrome. The American Journal of the Medical Sciences. 346 (6), 467-472 (2013).
- Greidanus, N. V., et al. Use of erythrocyte sedimentation rate and C-reactive protein level to diagnose infection before revision total knee arthroplasty: A prospective evaluation. The Journal of Bone and Joint Surgery. 89 (7), 1409-1416 (2007).
- Flormann, D., Kuder, E., Lipp, P., Wagner, C., Kaestner, L. Is there a role of C-reactive protein in red blood cell aggregation. International Journal of Laboratory Hematology. 37 (4), 474-482 (2015).
- Brust, M., et al. The plasma protein fibrinogen stabilizes clusters of red blood cells in microcapillary flows. Scientific Reports. 4, 4348 (2014).
- Gray, S. J., Mitchell, E. B., Dick, G. F. Effect of purified protein fractions on sedimentation rate of erythrocytes. Proceedings of the Society for Experimental Biology and Medicine. 51 (3), 403-404 (1942).
- Kratz, A., et al. ICSH recommendations for modified and alternate methods measuring the erythrocyte sedimentation rate. International Journal of Laboratory Hematology. 39 (5), 448-457 (2017).
- Hung, W. T., Collings, A. F., Low, J. Erythrocyte sedimentation rate studies in whole human blood. Physics in Medicine and Biology. 39 (11), 1855-1873 (1994).
- Woodland, N. B., Cordatos, K., Hung, W. T., Reuben, A., Holley, L. Erythrocyte sedimentation in columns and the significance of ESR. Biorheology. 33 (6), 477-488 (1996).
- Holley, L., Woodland, N., Hung, W. T., Cordatos, K., Reuben, A. Influence of fibrinogen and haematocrit on erythrocyte sedimentation kinetics. Biorheology. 36 (4), 287-297 (1999).
- Dasanna, A. K., et al. Erythrocyte sedimentation: Effect of aggregation energy on gel structure during collapse. Physical Review. E. 105 (2-1), 024610 (2022).
- Darras, A., et al. Erythrocyte sedimentation: collapse of a high-volume-fraction soft-particle gel. Physical Review Letters. 128 (8), 088101 (2022).
- Darras, A., et al. Imaging erythrocyte sedimentation in whole blood. Frontiers in Physiology. 12, 729191 (2022).
- Darras, A., et al. Acanthocyte sedimentation rate as a diagnostic biomarker for neuroacanthocytosis syndromes: Experimental evidence and physical justification. Cells. 10 (4), 788 (2021).
- Rabe, A., et al. The erythrocyte sedimentation rate and its relation to cell shape and rigidity of red blood cells from chorea-acanthocytosis patients in an off-label treatment with dasatinib. Biomolecules. 11 (5), 727 (2021).
- Giavarina, D., Capuzzo, S., Pizzolato, U., Soffiati, G. Length of erythrocyte sedimentation rate (ESR) adjusted for the hematocrit: reference values for the TEST 1 method. Clinical Laboratory. 52 (5-6), 241-245 (2006).
- Bull, B. S. Is a standard ESR possible. Laboratory Medicine. 6 (11), 31-39 (1975).
- Bull, B. S., Brecher, G. An evaluation of the relative merits of the Wintrobe and Westergren sedimentation methods, including hematocrit correction. American Journal of Clinical Pathology. 62 (4), 502-510 (1974).
- Reinhart, W. H., Singh, A., Straub, P. W. Red blood cell aggregation and sedimentation: the role of the cell shape. British Journal of Haematology. 73 (4), 551-556 (1989).
- Jan, K., Usami, S., Smith, J. A. Influence of oxygen tension and hematocrit reading on ESRs of sickle cells: Role of RBC aggregation. Archives of Internal Medicine. 141 (13), 1815-1818 (1981).
- Issaq, H. J., Xiao, Z., Veenstra, T. D. Serum and plasma proteomics. Chemical Reviews. 107 (8), 3601-3620 (2007).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), 21230 (2011).
- . Proper Pipetting Techniques - DE Available from: https://www.thermofisher.com/de/de/home/life-science/lab-plasticware-supplies/lab-plasticware-supplies-learning-center/lab-plasticware-supplies-resource-library/fundamentals-of-pipetting/proper-pipetting-techniques.html (2023)
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Transaction on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Solomon, C., et al. A comparison of fibrinogen measurement methods with fibrin clot elasticity assessed by thromboelastometry, before and after administration of fibrinogen concentrate in cardiac surgery patients. Transfusion. 51 (8), 1695-1706 (2011).
- Norouzi, N., Bhakta, H. C., Grover, W. H. Sorting cells by their density. PLoS One. 12 (7), 0180520 (2017).
- Trudnowski, R. J., Rico, R. C. Specific gravity of blood and plasma at 4 and 37 degrees C. Clinical Chemistry. 20 (5), 615-616 (1974).
- Késmárky, G., Kenyeres, P., Rábai, M., Tóth, K. Plasma viscosity: A forgotten variable. Clinical Hemorheology and Microcirculation. 39 (1-4), 243-246 (2008).
- Teece, L. J., et al. Gels under stress: The origins of delayed collapse. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 458, 126-133 (2014).
- Lindström, S. B., Kodger, T. E., Sprakel, J., Weitz, D. A. Structures, stresses, and fluctuations in the delayed failure of colloidal gels. Soft Matter. 8 (13), 3657-3664 (2012).
- Bartlett, P., Teece, L. J., Faers, M. A. Sudden collapse of a colloidal gel. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 85, 021404 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены