このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
赤血球沈降速度:医療における物理学主導の特性評価
要約
赤血球沈降速度(ESR)は物理的パラメータであり、定期的な健康診断や医療診断でよく使用されます。現代のコロイド知識に基づいて、沈降曲線全体から物理的に意味のあるパラメータを抽出することを可能にする理論モデルが最近開発されました。ここでは、経時的にESRを自動的に収集し、この自動データ収集からこの最近のモデルのパラメータを抽出するプロトコルを提示します。これらの洗練されたパラメータは、医学的証言を改善する可能性もあります。
要約
赤血球(または赤血球)沈降速度(ESR)は、定期的な健康診断や医療診断でよく使用される血液の物理的派生パラメータです。例えば、炎症の場合、フィブリノーゲンおよび他の血漿タンパク質の関連する増加のために、より高いESRが観察される。この増加は、フィブリノーゲンの増加によって引き起こされた赤血球(RBC)のより大きな凝集体の形成によるものと考えられていました。実際、フィブリノーゲンは赤血球の凝集を促進する薬剤であり、ストークス体制では、血液中のより大きな凝集体堆積物がより早く観察されると考えられています。ただし、この仮説に基づくESR測定のすべてのモデルには、他のシステムでは必要とされない、さらに特定の物理的仮定が必要です。その上、コロイド懸濁液の分野における現代の研究は、魅力的な粒子が浸透する凝集体(すなわち、容器と同じ幅の凝集体)を形成することを確立した。これらのコロイドの沈降は、いわゆる「コロイドゲル崩壊」に続く。最近、RBCが実際に同じ動作に従うことが示されています。この仮説はまた、赤血球の沈降曲線を効率的かつ分析的にモデル化することを可能にし、そこから堅牢で物理的に意味のある記述子を抽出することができます。この原稿では、このような分析を実行する方法について説明し、このアプローチの利点について説明します。
概要
赤血球沈降速度(ESR)は、20世紀にエビデンスに基づく医学に正式に導入された医療in vitro臨床ツールです1,2,3,4。現在、非特異的炎症検査として、またはいくつかの特定の状態の進行を監視するために世界中で使用されています5、6、7、8。これは主にフィブリノーゲン濃度の増加によるものですが、IgM 1,9,10,11などの他の血漿成分にも起因しています。現在のWestergren標準プロトコルによれば、ESR値は、安静時に垂直に20cmの典型的なサイズの垂直管を放置した後の所与の時点(30分または1時間)における無細胞血漿層の測定値として報告される12。しかし、この測定方法は、最大沈降速度13に達するまでの遅延など、沈降過程の質的に異なる段階が報告されているため、批判されてきました。この遅延は、健康なサンプルの約半分で1時間以上続きます14。この段階の間の速度は、沈降15の第2のより速い段階の間とは異なるスケーリングに従う。読み出しを最初の1時間の平均沈降速度に制限し、異なる個人間のさまざまな血液特性の異なる組み合わせを比較します。
さらに、このプロトコルの背後にある通常の理論的考慮事項が誤っていたことが最近実証されました16,17,18。生理的ヘマトクリット値(約25%以上)では、赤血球(RBC)は別々の凝集体として沈降するのではなく、通常言及されているストークス沈降とは異なる一連の物理方程式に従う、RBCの連続した、いわゆるパーコレーションネットワーク17,18として沈降します16,17。沈降(曲線全体)の時間分解測定値に基づく物理的記述を考慮することは、いくつかの新しい医学的文脈においてより堅牢であることが示されている19,20。さらに、これらの測定値は、細胞の形状が変化する病状におけるESRを変化させる物理的メカニズムを明らかにするために使用できます19,20。さらに、遅いESRは、神経表皮球症症候群患者のコホートの測定に示されるように、有用な医学的解釈を有することができる19,20。この記事では、ESRキネティクス全体に基づいて、物理的に意味のあるパラメータの測定を実際に実装する方法をレビューします。より正確には、ここに提示された方法は、最大沈降速度Umを抽出し、その値は、ドナー16、17のヘマトクリットの影響を考慮するように補正することができる。このパラメータは、従来の測定値16,17,19,20よりも正確であり、信頼性が高い。
さらに、いくつかの基礎研究では、特定の患者の炎症状態を監視する代わりに、ESR21,22,23に対するヘマトクリットの影響を除外するか、修正ESR19,20,24,25における赤血球の役割を調査することは興味深い。 異なるドナー間。患者からの直接の全血サンプルではないサンプルを比較することは有用かもしれません。したがって、ヘマトクリット値が制御されたRBCを自家血漿または血漿置換基に再懸濁することが、ESR測定の最初のステップとして使用できる可能性があります。例えば、リン酸緩衝生理食塩水(PBS)中の濃度55 mg/mLのデキストラン70 kDaの溶液は、健康な細胞の対照範囲内の沈降範囲を生成します19。この原稿はまた、そのようなステップがどのように行われるべきか、そして提示された分析がこれらのケースにも関連していることを示しています。
プロトコル
血液サンプルの採取と実験は、ヘルシンキ宣言に従ってインフォームドコンセントが得られた後に実施された。標準測定は、ウェスターグレンチューブ内のエチレンジアミン四酢酸(EDTA)-抗凝固血液(標準EDTA濃度1.6 mg / mL血液、欧州規格NF EN ISO 6710)を使用して実行する必要があります。ウェスターグレン管を充填するために必要な量は、製造元によって異なります(下部にはより広いリザーバーが含まれている場合があるため)。容量は約1 mLの全血で、 材料の表に示されているチューブの場合は800 μLである必要があります。ただし、以下に説明する方法は、プローブされたサンプルのヘマトクリット値が25%16を超える限り、特定の懸濁液や容器の形状に関係なく有効です。したがって、容量、容器、懸濁媒体、および添加剤は、実施された研究の特定の目的に従って選択する必要があります。
1. 実験・測定
注:サンプルの沈降速度を毎分記録します。
- サンプル調製(必要な場合):コントロールヘマトクリットまたは懸濁液が必要な場合は、細胞を洗浄してサンプルを調製することから始めます(例として、自家血清と血漿を混合することにより、さまざまなフィブリノーゲンレベルのサンプルを調製する方法を示します)。血清は実際にフィブリノーゲンフリー血漿26,27として近似することができ、そうでなければ生理学的条件下で赤血球の凝集を減少させるために使用することができる。いくつかのサンプルを調製するには、9 mLの標準EDTAチューブに血液を採取し、9 mLの標準血清チューブ(凝固活性化剤としてシリカビーズを使用)に血清を採取します。
- 血液サンプル(選択した例では9 mLの標準EDTAおよび血清チューブ)を3,000 x g で少なくとも7分間遠心分離し、充填された赤血球を最適に圧縮します。十分な量がある場合は、上清をPBSまたは目的の懸濁液と交換します。.単に自家血漿中のヘマトクリット値を制御する必要がある場合は、ステップ1.1.3に直接進んでください。それ以外の場合は、洗浄用の上清を入れた後、穏やかに混合します。
- 3回繰り返します。いずれの場合も、希望の懸濁液で最後の洗浄を実行します。
- 選択した例では、決定された比率(例えば、血漿-血清体積画分の25%/ 75%、50%/ 50%、または75%/ 25%)で自己血漿と血清の混合物を準備します。例えば、2.5 mLの25%/75%血漿-血清混合物を調製する場合、0.625 mLの血漿を1.875 mLの血清に加えます。
- 必要量のパックセルを抽出し、目的の液体に懸濁します。充填されたセルを高粘度の液体として処理します(標準のプレピペッティングおよび/またはリバースピペッティングまたは容積式ピペット28を使用)。選択した例では、ヘマトクリット値が45%の4 mLサンプルの場合、血漿-血清混合物の2.2 mL内に1.8 mLの充填細胞を懸濁します。
- サンプルのヘマトクリット値が制御されていない場合は、高速微量遠心分離によって決定します(他の標準的な方法も適しています)。
- ヘマトクリット測定に必要な量のサンプルを抽出します:マイクロヘマトクリット毛細血管の下部先端を液体に浸して充填します。毛細管吸引によって必要量のサンプルがチューブ内で上昇したときに上部の開口部を覆って停止します。
- キャピラリーをシーリングワックスで密封します。それらをマイクロヘマトクリット遠心分離機に入れ、15,000 x g(12,000 rpm)で5分間、または製造元の指示に従って実行します。
- 毛細血管のヘマトクリットレベルを読み、参照用に書き留めます。
- サンプルの沈降を記録するためのカメラを設置します。メモリの過負荷やバッテリーの消耗を防ぐために、主電源からデバイスに電力を供給し、写真をコンピューターまたは外付けハードドライブに直接保存します。
- ESRチューブを静止させたままにするホルダーの前に安定したカメラを設置します。白い照らされた背景を使用します(背景の白い紙は完全に機能します)。
- 空のウェスターグレン管を使用して、できればマーキングなしで、カメラの焦点と視野を設定して、サンプルが配置される最高の解像度を取得します。できれば、画像の境界線が垂直方向と水平方向に揃えられていることを確認してください。
- スケーリングされたチューブの写真を撮って、ピクセル解像度を抽出します。RGB画像の使用をお勧めします。
- カメラの光と露出時間を白い背景に設定しますが、彩度は設定しません。 図1 の例は、キヤノンEOS M50を使用して、露光時間1/15秒、絞りF8.0、タングステンホワイトバランス、マニュアルフォーカス付きシングルショットモード、ISO感度1,000で取得したものです。
- ESRチューブを準備して配置します。
- ウェスターグレンチューブの一番下の容器に、製造元の指示に対応する容量を入れます。製造元の指示に従って、ウェスターグレンチューブを下部の容器に挿入します。
- 最初のチューブの準備ができたらすぐにホルダーに入れてカメラの録画を開始します。毎分1枚の画像を記録すると、通常、ESR運動曲線の良好な解像度が得られます。
- 次のサンプルを準備して配置します。写真を撮るときは、サンプルの前に立たないように注意してください。
- 30分、1時間、および2時間の標準測定値と比較するために、測定を少なくとも2時間実行します。ただし、沈降の飽和と停止を確認することもより良いです。健康なサンプルの場合、または炎症の場合、最速のサンプルの曲率が3時間13,19以内に見えるため、12時間から24時間の間に一晩サンプルを記録するだけで十分です。しかしながら、ある条件が沈降速度を低下させる場合、フィブリノーゲン濃度の低下がそうであるように(すなわち、選択された例では、高い血清体積分率)、最も正確な情報を得るために50時間以上の記録が必要とされるかもしれない16、19。
2. 画像解析
注意: 画像が記録されたら、ESR曲線を抽出します。Matlab コードの例は、 Supplementary File 1 (MatlabCodeImageAnalysisSampled.m) として提供されています。
- チューブが1本しか見えず、下の境界が赤血球無細胞血漿インターフェースの最下に位置するがサンプル内にある関心領域(ROI)を選択または特定します(図1A、Bを参照)。必要に応じて、垂直方向が画像の最初のコンポーネントに沿って揃うように画像を回転します。
- RGB画像のROIをグレースケール画像またはマトリックス Grに変換します。通常、3 色のチャネル (赤 [R]、緑 [G]、青 [B]) を Gr = 2 * R - B - G として組み合わせることは、背景が鮮明で非常に効率的です ( 図 1C および MatlabCodeImageAnalysisSampled.m 行目 121 から 128 を参照)。
- 画像を二値化します。正常なサンプルの場合、通常、大津閾値29 を使用すると、一貫した結果が得られます ( 図 1D および MatlabCodeImageAnalysisSampled.m の 133 行目を参照)。ヘマトクリット値が高いサンプルや溶血のあるサンプルの場合は、チューブ内のさまざまな相間で得られる正確なコントラストに応じて、手動で調整するか、別の自動方法(MatlabCodeImageAnalysisSampled.mの129〜131行目で行われているように)を使用することをお勧めします。
- 水平方向に沿ったGrのピクセル(または要素)値の平均を取得します。このステップにより、ノイズが最小限に抑えられ、起こりうるインターフェースの不規則性を効率的に平均化できます( 図1E およびMatlabCodeImageAnalysisSampled.m行目137を参照)。
- 変動を計算する前に、特にチューブに水平方向のマーキングが含まれている場合は、移動平均で曲線を滑らかにします( 図1Fを参照)。提供された例では、このプロセスには~2.5 mm (50 ピクセル) の移動ウィンドウが使用されました (MatlabCodeImageAnalysisSampled.m の 138 行目を参照)。次に、強度変動が最も高い点として界面位置を特定します( 図1Gを参照)。
- 各画像と各サンプルについて繰り返します。各サンプルについて、時間に沿ったインターフェースの位置を適切な形式で保存し、物理モデルに適切に適合するソフトウェアを適合させます。
3. 物理モデルのフィッティング
- 任意の適切に適合するソフトウェアを用いて、血液カラムh0のヘマトクリット値および初期高さを知り、物理モデル17に対する二乗残差の和を最小化する赤血球の遅延時間t0、無次元時間γ、および最終充填体積分率Φmの値を見つける。Matlabコード(ShapeAnalyzerIntegrated.m)は、このようなフィットを実行する方法の例として、補足ファイル2として提供されています。詳細な手順については、補足ファイル 2 を参照してください。他の場所16、17に記載されているように、軟質粒子ゲルとしての生理的ヘマトクリット沈渣における赤血球は、ここで重要な物理的パラメータは、ドナーの血漿と赤血球との間の密度の差Δρ、RBC特性直径rRBC、室温での血漿粘度η、およびドナーのヘマトクリット値Φ.これらのパラメータを使用し、重力応力が、遅延時間t0の後に赤血球によって形成された多孔質ネットワークを通って上向きに流れるプラズマの主な駆動プロセスであると仮定すると、時間的進化が得られます16,17:
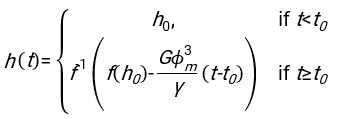
、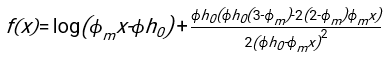
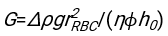 、および
、および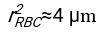 赤血球の平均椎間板半径である。これを実行する Matlab コードの例が添付ファイルとして提供されています (ShapeAnalyzerIntegrated.m は SedimFit.m [補足ファイル 3] で定義されている関数に適合します)。または、G/γ を 1/t 単位のフィットパラメータとして直接使用することもできます。
赤血球の平均椎間板半径である。これを実行する Matlab コードの例が添付ファイルとして提供されています (ShapeAnalyzerIntegrated.m は SedimFit.m [補足ファイル 3] で定義されている関数に適合します)。または、G/γ を 1/t 単位のフィットパラメータとして直接使用することもできます。 - 写真から定量曲線が抽出されたら、サンプルの物理的パラメータを保存します。30分、1時間、または2時間の従来のESR値は、参照用に曲線から抽出できます(ShapeAnalyzerIntegrated.m行123〜132を参照)。
結果
正しく取得された画像シーケンスの例を補足動画1(MovieS1.avi)として提供する。図2に、さまざまな条件に対するモデルの一連の特性適合を示します。フィブリノーゲン濃度は、血漿中フィブ0中のフィブリノーゲン濃度から、血清にフィブリノーゲンが全く存在しないと仮定して決定した。したがって、Fib = C Fib0であり、
ディスカッション
自動化されたプロトコルが効率的に機能するためには、明確な背景と適切な照明を持つことが重要です。背景が暗いと、効率的な二値化しきい値の存在が妨げられる可能性があります。通常、時間の経過とともに発生する(増加する)溶血のあるサンプルの場合、選択した二値化しきい値が初期画像と最終画像の両方に関連していることを最初に確認することが重要です。
...
開示事項
著者は、この記事の内容に関連して宣言する利益相反はありません。
謝辞
この研究は、ドイツ研究財団の研究ユニットFOR 2688-Wa1336/12およびマリー・スクウォドフスカ・キュリー助成契約第860436-EVIDENCEによって支援されました。T. J. と C. W. は、フランス・ドイツ大学(DFH/UFA)からの資金提供を認めています。A.D.は、ザールラント大学の若手研究者助成金による資金提供を認めています。
資料
| Name | Company | Catalog Number | Comments |
| Anticoagulant (EDTA or Heparin) tube (for blood sample) | SARSTEDT | 267001 or 265 | Anticoagulated blood sample to characterize |
| Camera EOS M50 | Canon | Kit EF-M18-150 IS STM | Any camera should work, provided that sector alimentation, connection to computer for automated shooting and adapted objective are available |
| Centrifuge | HERMLE | 302.00 V03 - Z 36 HK | Requirements: at least 3000 x g ofr 7 min. |
| Micro-centrifuge | MLW | TH21 | or any other way to determine the hematocrit |
| Micro-hematocrit capilaries | Fisher scientific | 11884040 | or other capillaries/containers for hematocrit determination |
| Phosphate Buffered Saline (PBS) | ThermoFisher | 10010023 | 1x PBS, pH 7.4, 298 Osm |
| Pipettes (e.g. positive displacement pipette) | Gilson | FD10006 | Pipette required to manipulate blood and/or packed cells.Other models are of course suitable, but be careful to treat blood and pakced cells as highly viscous fluids. |
| Wax sealing plate | Hirschmann | 9120101 | Sealing wax for the micro-hematocrit capillaries |
| Westergren tubes | Praxindo | A9244560 | Any other standard Wetsergren tube should work too |
| White background with illumination | / | / | White sheet(s) of paper behind the samples, with usual room light is perfcetly sufficient. |
参考文献
- Bedell, S. E., Bush, B. T. Erythrocyte sedimentation rate. From folklore to facts. The American Journal of Medicine. 78, 1001-1009 (1985).
- Grzybowski, A., Sak, J. Edmund Biernacki (1866-1911): Discoverer of the erythrocyte sedimentation rate. On the 100th anniversary of his death. Clinics in Dermatology. 29 (6), 697-703 (2011).
- Kushner, I., Mackiewicz, A. . The Acute Phase Response: An Overview. Acute Phase Proteins. , (1993).
- Tishkowski, K., Gupta, V. Erythrocyte Sedimentation Rate. StatPearls Publishing. , (2022).
- Menees, S. B., Powell, C., Kurlander, J., Goel, A., Chey, W. D. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. The Americal Journal of Gastroenterology. 110 (3), 444-454 (2015).
- Brigden, M. L. Clinical utility of the erythrocyte sedimentation rate. Americal Family Physician. 60 (5), 1443-1450 (1999).
- Liu, S., et al. Preliminary case-control study to evaluate diagnostic values of C-reactive protein and erythrocyte sedimentation rate in differentiating active Crohn's disease from intestinal lymphoma, intestinal tuberculosis and Behcet's syndrome. The American Journal of the Medical Sciences. 346 (6), 467-472 (2013).
- Greidanus, N. V., et al. Use of erythrocyte sedimentation rate and C-reactive protein level to diagnose infection before revision total knee arthroplasty: A prospective evaluation. The Journal of Bone and Joint Surgery. 89 (7), 1409-1416 (2007).
- Flormann, D., Kuder, E., Lipp, P., Wagner, C., Kaestner, L. Is there a role of C-reactive protein in red blood cell aggregation. International Journal of Laboratory Hematology. 37 (4), 474-482 (2015).
- Brust, M., et al. The plasma protein fibrinogen stabilizes clusters of red blood cells in microcapillary flows. Scientific Reports. 4, 4348 (2014).
- Gray, S. J., Mitchell, E. B., Dick, G. F. Effect of purified protein fractions on sedimentation rate of erythrocytes. Proceedings of the Society for Experimental Biology and Medicine. 51 (3), 403-404 (1942).
- Kratz, A., et al. ICSH recommendations for modified and alternate methods measuring the erythrocyte sedimentation rate. International Journal of Laboratory Hematology. 39 (5), 448-457 (2017).
- Hung, W. T., Collings, A. F., Low, J. Erythrocyte sedimentation rate studies in whole human blood. Physics in Medicine and Biology. 39 (11), 1855-1873 (1994).
- Woodland, N. B., Cordatos, K., Hung, W. T., Reuben, A., Holley, L. Erythrocyte sedimentation in columns and the significance of ESR. Biorheology. 33 (6), 477-488 (1996).
- Holley, L., Woodland, N., Hung, W. T., Cordatos, K., Reuben, A. Influence of fibrinogen and haematocrit on erythrocyte sedimentation kinetics. Biorheology. 36 (4), 287-297 (1999).
- Dasanna, A. K., et al. Erythrocyte sedimentation: Effect of aggregation energy on gel structure during collapse. Physical Review. E. 105 (2-1), 024610 (2022).
- Darras, A., et al. Erythrocyte sedimentation: collapse of a high-volume-fraction soft-particle gel. Physical Review Letters. 128 (8), 088101 (2022).
- Darras, A., et al. Imaging erythrocyte sedimentation in whole blood. Frontiers in Physiology. 12, 729191 (2022).
- Darras, A., et al. Acanthocyte sedimentation rate as a diagnostic biomarker for neuroacanthocytosis syndromes: Experimental evidence and physical justification. Cells. 10 (4), 788 (2021).
- Rabe, A., et al. The erythrocyte sedimentation rate and its relation to cell shape and rigidity of red blood cells from chorea-acanthocytosis patients in an off-label treatment with dasatinib. Biomolecules. 11 (5), 727 (2021).
- Giavarina, D., Capuzzo, S., Pizzolato, U., Soffiati, G. Length of erythrocyte sedimentation rate (ESR) adjusted for the hematocrit: reference values for the TEST 1 method. Clinical Laboratory. 52 (5-6), 241-245 (2006).
- Bull, B. S. Is a standard ESR possible. Laboratory Medicine. 6 (11), 31-39 (1975).
- Bull, B. S., Brecher, G. An evaluation of the relative merits of the Wintrobe and Westergren sedimentation methods, including hematocrit correction. American Journal of Clinical Pathology. 62 (4), 502-510 (1974).
- Reinhart, W. H., Singh, A., Straub, P. W. Red blood cell aggregation and sedimentation: the role of the cell shape. British Journal of Haematology. 73 (4), 551-556 (1989).
- Jan, K., Usami, S., Smith, J. A. Influence of oxygen tension and hematocrit reading on ESRs of sickle cells: Role of RBC aggregation. Archives of Internal Medicine. 141 (13), 1815-1818 (1981).
- Issaq, H. J., Xiao, Z., Veenstra, T. D. Serum and plasma proteomics. Chemical Reviews. 107 (8), 3601-3620 (2007).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), 21230 (2011).
- . Proper Pipetting Techniques - DE Available from: https://www.thermofisher.com/de/de/home/life-science/lab-plasticware-supplies/lab-plasticware-supplies-learning-center/lab-plasticware-supplies-resource-library/fundamentals-of-pipetting/proper-pipetting-techniques.html (2023)
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Transaction on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Solomon, C., et al. A comparison of fibrinogen measurement methods with fibrin clot elasticity assessed by thromboelastometry, before and after administration of fibrinogen concentrate in cardiac surgery patients. Transfusion. 51 (8), 1695-1706 (2011).
- Norouzi, N., Bhakta, H. C., Grover, W. H. Sorting cells by their density. PLoS One. 12 (7), 0180520 (2017).
- Trudnowski, R. J., Rico, R. C. Specific gravity of blood and plasma at 4 and 37 degrees C. Clinical Chemistry. 20 (5), 615-616 (1974).
- Késmárky, G., Kenyeres, P., Rábai, M., Tóth, K. Plasma viscosity: A forgotten variable. Clinical Hemorheology and Microcirculation. 39 (1-4), 243-246 (2008).
- Teece, L. J., et al. Gels under stress: The origins of delayed collapse. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 458, 126-133 (2014).
- Lindström, S. B., Kodger, T. E., Sprakel, J., Weitz, D. A. Structures, stresses, and fluctuations in the delayed failure of colloidal gels. Soft Matter. 8 (13), 3657-3664 (2012).
- Bartlett, P., Teece, L. J., Faers, M. A. Sudden collapse of a colloidal gel. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 85, 021404 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved