需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
红细胞沉降率:医学环境中的物理驱动表征
摘要
红细胞沉降率(ESR)是一个物理参数,常用于常规健康检查和医学诊断。最近开发了一种理论模型,该模型允许基于现代胶体知识从整个沉降曲线中提取具有物理意义的参数。在这里,我们提出了一种协议,用于随着时间的推移自动收集ESR,并从该自动数据收集中提取该最新模型的参数。这些精炼的参数也可能改善医学证词。
摘要
红细胞(或红细胞)沉降率(ESR)是血液的物理衍生参数,通常用于常规健康检查和医学诊断。例如,在炎症的情况下,由于纤维蛋白原和其他血浆蛋白的相关增加,观察到更高的 ESR。据信,这种增加是由于纤维蛋白原的增加导致红细胞(RBC)形成更大的聚集体。事实上,纤维蛋白原是一种促进红细胞的聚集体,在斯托克斯制度中,假设在血液较大的聚集体中更快地观察到沉淀物。然而,基于这一假设的所有ESR测量模型都需要进一步的具体物理假设,这是任何其他系统都不需要的。此外,胶体悬浮液领域的现代研究已经确定,有吸引力的颗粒形成渗透聚集体(即与容器一样宽的聚集体)。然后,这些胶体的沉降遵循所谓的"胶体凝胶崩溃"。最近,研究表明红细胞实际上遵循相同的行为。该假设还允许对红细胞的沉降曲线进行有效和分析建模,从中提取出稳健且具有物理意义的描述符。本手稿描述了如何进行这种分析,并讨论了这种方法的好处。
引言
红细胞沉降率(ESR)是一种医学体外临床工具,于20世纪正式引入循证医学1,2,3,4。它目前在世界范围内用作非特异性炎症试验,或监测某些特定病症的演变5,6,7,8。这主要是由于纤维蛋白原浓度的增加,但也增加了其他血浆成分,如IgM1,9,10,11。根据当前的Westergren标准协议,ESR值报告为在静止时离开典型尺寸为20cm的垂直管后,在给定时间点(30分钟或1小时)测量无细胞等离子体层12。然而,这种测量方法受到批评,因为已经报道了沉降过程中的定性不同阶段,包括达到最大沉降速度13之前的延迟。这种延迟在大约一半的健康样本中持续超过1小时14。此阶段的速度与沉降的第二个较快阶段的尺度不同15.将读数限制在第一个小时内的平均沉降速度,然后比较不同个体之间各种血液特性的不同组合。
此外,最近已经证明,该协议背后的通常理论考虑是错误的16,17,18。在生理性血细胞比联(约25%以上)时,红细胞(RBC)不会作为单独的聚集体沉降,而是作为连续的,所谓的渗透,红细胞17,18网络,遵循与通常提到的斯托克斯沉降16,17不同的物理方程。已经表明,在某些新的医学环境中,考虑基于沉降(整个曲线)的时间分辨测量的物理描述更为稳健19,20。此外,这些测量可用于阐明改变细胞形状改变的病理学中改变ESR的物理机制19,20。此外,缓慢的 ESR 可以具有有用的医学解释,如神经棘细胞增多症综合征患者队列的测量所示19,20。本文回顾了如何基于整个ESR动力学实际实现物理上有意义的参数的测量。更准确地说,这里介绍的方法提取了最大沉降速度Um,其值可以校正以考虑供体16,17的血细胞比容的影响。该参数比传统的测量值16,17,19,20更准确,因此更可靠。
此外,在一些基础研究中,与其监测给定患者的炎症状态,不如排除血细胞比容对 ESR 21,22,23 的影响,或研究红细胞在修饰的 ESR中的作用 19,20,24,25 在不同的捐赠者之间。比较不是直接来自患者的全血样本的样本可能是有用的。因此,在自体血浆或血浆取代基中重悬具有受控血细胞比容的红细胞可能用作 ESR 测量的第一步。例如,浓度为55 mg/mL的葡聚糖70 kDa在磷酸盐缓冲盐水(PBS)中的溶液在健康细胞的对照范围内产生沉降范围19。这份手稿还展示了应该如何进行这些步骤,并且所提出的分析在这些情况下也相关。
研究方案
血液样本采集和实验得到了"萨尔州人协会"(伦理学第51/18号)的批准,并在根据《赫尔辛基宣言》获得知情同意后进行。标准测量应在韦斯特格伦管中使用乙二胺四乙酸 (EDTA)-抗凝血(标准 EDTA 浓度为 1.6 mg/mL 血液,欧洲标准 NF EN ISO 6710)进行。填充Westergren管所需的体积取决于制造商(因为较低的零件有时包含更宽的储液罐);全血的体积应约为 1 mL, 材料表中所示的试管的体积应为 800 μL。然而,无论具体的悬浮液和容器形状如何,只要探针的血细胞比容高于25%16,下面描述的方法都是有效的。因此,应根据所进行研究的具体目标选择体积、容器、悬浮介质和添加剂。
1. 实验和测量
注意:每分钟记录一次样品的沉降速率。
- 样品制备(如果需要):如果需要对照血细胞比容或悬浮液,首先洗涤细胞并制备样品(例如,我们展示了如何通过混合自体血清和血浆来制备具有不同纤维蛋白原水平的样品)。血清确实可以近似为无纤维蛋白原的血浆26,27,并且在其他生理条件下可用于减少红细胞的聚集。为了制备多个样品,将血液收集在9 mL的标准EDTA管中,在9 mL的标准血清管(用硅胶珠作为凝血激活剂)中收集血清。
- 将血液样品(即所选示例中的9 mL标准EDTA和血清管)以3,000 x g 离心至少7分钟,以最佳压实填充的红细胞。如果有足够的量,用PBS或所需的悬浮液替换上清液。如果只需要控制自体血浆中的血细胞比容,则直接进行步骤1.1.3。否则,在加入上清液后轻轻混合进行洗涤。
- 重复三次。在任何情况下,都要用所需的悬浮液进行最后一次洗涤。
- 在所选的示例中,制备具有确定比例的自体血浆和血清的混合物(例如,血浆-血清体积分数的25%/75%,50%/50%或75%/25%)。例如,在制备 2.5 mL 的 25%/75% 血浆-血清混合物时,将 0.625 mL 血浆加入 1.875 mL 血清中。
- 提取所需体积的填充细胞并将其悬浮在所需液体中。将填充的细胞作为高粘度液体处理(使用标准预移液和/或反向移液或外置活塞式移液器28)。在所选示例中,对于血细胞比容为 45% 的 4 mL 样品,将 1.8 mL 的填充细胞悬浮在血浆-血清混合物的 2.2 mL 内。
- 如果样品的血细胞比容不受控制,则通过高速微量离心测定(其他标准方法也适用)。
- 提取所需量的样品进行血细胞比容测定:通过将微量血细胞比容毛细血管的下尖端浸入液体中来填充毛细血管。当所需量的样品通过毛细管抽吸在管中上升时,通过覆盖顶部开口来停止它。
- 用密封蜡密封毛细管。将它们放入微量血细胞比容离心机中,并以15,000× g(12,000rpm)运行5分钟,或按照制造商的说明运行。
- 读取毛细血管上的血细胞比容水平并写下来以供参考。
- 设置一个摄像头来记录样品的沉降。为避免内存过载或耗尽电池电量,请从电源为设备供电,并将照片直接保存到计算机或外部硬盘驱动器。
- 在支架前面设置一个稳定的摄像头,ESR管将保持静止状态。使用白色的照明背景(背景中的白色纸张效果很好)。
- 使用空的Westergren管,最好没有标记,设置相机的焦点和视野,以获得放置样品的最高分辨率。最好确保图片的边框在垂直和水平方向上对齐。
- 拍摄缩放管的照片以提取像素分辨率。建议使用 RGB 图片。
- 将相机的光线和曝光时间设置为白色背景,但没有饱和度。 图1 中的示例是使用佳能EOS M50获得的,曝光时间为1/15秒,光圈为F8.0,钨丝灯白平衡,单次拍摄模式,手动对焦,ISO感光度为1,000。
- 准备并放置 ESR 管。
- 用与制造商说明相对应的体积填充Westergren管的底部容器。按照制造商的指示将西格伦管插入底部容器中。
- 一旦第一根管准备好,将其放入支架并开始相机录制。每分钟记录一张照片通常可以很好地解决ESR动力学曲线。
- 准备并放置下一个样品。确保拍照时不要站在任何样品前。
- 让测量运行至少 2 小时,以便与 30 分钟、1 小时和 2 小时的标准测量进行比较。但是,最好看到沉积物的饱和和停滞。对于健康样品,或在炎症的情况下,在12小时至24小时之间过夜记录样品绰绰有余,因为最快样品的曲率在3小时内可见13,19。然而,如果条件降低沉降速度,就像纤维蛋白原浓度降低一样(即,在所选的例子中,高血清体积分数),可能需要记录50小时或更长时间才能获得最准确的信息16,19。
2. 图像分析
注意:记录图像后,提取ESR曲线。Matlab代码的示例作为 补充文件1 (MatlabCodeImageAnalysisSampled.m)提供。
- 选择或识别仅可见一根管的感兴趣区域(ROI),下边界位于红细胞无细胞血浆界面的最低位置下,但在样品内(参见图1A,B)。如果需要,请旋转图片,使垂直方向沿图片的第一个组件对齐。
- 将RGB图片的ROI转换为灰度图片或矩阵Gr。通常,将三色通道(红色 [R]、绿色 [G] 和蓝色 [B])组合为 Gr = 2 * R - B - G 非常有效,背景清晰(参见图 1C 和 MatlabCodeImageAnalysisSampled.m 行 121-128)。
- 将图片二值化。对于健康的样本,使用Otsu阈值29 通常给出一致的结果(参见 图1D 和MatlabCodeImageAnalysisSampled.m的第133行)。对于具有高血细胞比容或溶血的样品,最好手动调整或使用其他自动方法(如MatlabCodeImageAnalysisSampled.m的第129-131行所示),具体取决于管内各相之间获得的确切对比度。
- 获取Gr沿水平方向的像素(或元素)值的平均值。此步骤将噪声降至最低,并有效地平均可能的接口不规则性(参见 图1E 和MatlabCodeImageAnalysisSampled.m行137)。
- 在计算变化之前,用移动平均线平滑曲线,特别是如果管子包含一些水平标记(见 图1F)。对于提供的示例,此过程使用了~2.5毫米(50像素)的移动窗口(参见MatlabCodeImageAnalysisSampled.m的第138行)。然后,将界面位置标识为强度变化最大的点(见 图1G)。
- 对每张图片和每个样本重复此操作。对于每个样本,以适当的格式保存界面随时间的位置,以便使用任何合适的软件拟合物理模型。
3. 物理模型的拟合
- 使用任何合适的拟合软件,知道血细胞比容和血柱的初始高度h 0,找到延迟时间t0,无量纲时间γ和红细胞的最终堆积体积分数Φm的值,以最小化物理模型17的残差平方和。Matlab代码(ShapeAnalyzerIntegrated.m)作为补充文件2提供,作为如何执行此类拟合的示例。有关进一步说明,请参阅补充文件 2。如别处16,17所述,红细胞在生理性血细胞比容沉积物处作为软颗粒凝胶,其中重要的物理参数是供体血浆和红细胞之间的密度差Δρ、红细胞特征直径rRBC、血浆在室温η下的粘度、供体的血细胞比容Φ.使用这些参数,并假设引力应力是等离子体在延迟时间t0后通过红细胞形成的多孔网络向上流动的主要驱动过程,可以得到时间演化16,17:
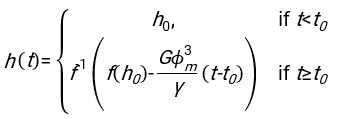
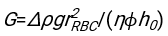 、
、 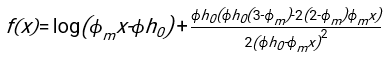 和
和 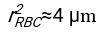 是红细胞的平均椎间盘半径。作为附件提供了执行此操作的 Matlab 代码示例(ShapeAnalyzerIntegrated.m 适合 SedimFit.m [补充文件 3] 中定义的函数)。或者,G/γ也可以直接用作拟合参数,单位为 1/t。
是红细胞的平均椎间盘半径。作为附件提供了执行此操作的 Matlab 代码示例(ShapeAnalyzerIntegrated.m 适合 SedimFit.m [补充文件 3] 中定义的函数)。或者,G/γ也可以直接用作拟合参数,单位为 1/t。 - 从图片中提取定量曲线后,保存样品的物理参数。仍然可以从曲线中提取30分钟,1小时或2小时的传统ESR值以供参考(参见ShapeAnalyzerIntegrated.m行123-132)。
结果
正确采集的图像序列的示例作为补充视频1(MovieS1.avi)提供。图 2 显示了该模型在各种条件下的一系列特征拟合。纤维蛋白原浓度由血浆Fib0中的纤维蛋白原浓度测定,假设血清根本没有任何纤维蛋白原。因此,Fib = C Fib0,其中C是血浆-血清混合物中的血浆体积分数。在先前的研究16中,Fib0
讨论
为了使自动化协议高效工作,具有清晰的背景和适当的照明非常重要。深色背景可能会阻止存在有效的二值化阈值。对于具有一些溶血的样品,通常会随着时间的推移而发生(增加),重要的是首先验证所选的二值化阈值是否与初始和最终图像相关。
当涉及到图片的二值化过程时,ROI和二值化阈值的选择是最敏感的一步。在三个不同的图片上(在沉降过程的开始、中间和结?...
披露声明
作者没有利益冲突来声明与本文内容相关。
致谢
这项工作得到了德国研究基金会FOR 2688 - Wa1336/12研究单位和玛丽·斯克沃多夫斯卡-居里资助协议第860436-EVIDENCE的支持。T. J. 和 C. W. 感谢法国德国大学 (DFH/UFA) 的资助。A. D. 感谢萨尔大学青年研究者资助。
材料
| Name | Company | Catalog Number | Comments |
| Anticoagulant (EDTA or Heparin) tube (for blood sample) | SARSTEDT | 267001 or 265 | Anticoagulated blood sample to characterize |
| Camera EOS M50 | Canon | Kit EF-M18-150 IS STM | Any camera should work, provided that sector alimentation, connection to computer for automated shooting and adapted objective are available |
| Centrifuge | HERMLE | 302.00 V03 - Z 36 HK | Requirements: at least 3000 x g ofr 7 min. |
| Micro-centrifuge | MLW | TH21 | or any other way to determine the hematocrit |
| Micro-hematocrit capilaries | Fisher scientific | 11884040 | or other capillaries/containers for hematocrit determination |
| Phosphate Buffered Saline (PBS) | ThermoFisher | 10010023 | 1x PBS, pH 7.4, 298 Osm |
| Pipettes (e.g. positive displacement pipette) | Gilson | FD10006 | Pipette required to manipulate blood and/or packed cells.Other models are of course suitable, but be careful to treat blood and pakced cells as highly viscous fluids. |
| Wax sealing plate | Hirschmann | 9120101 | Sealing wax for the micro-hematocrit capillaries |
| Westergren tubes | Praxindo | A9244560 | Any other standard Wetsergren tube should work too |
| White background with illumination | / | / | White sheet(s) of paper behind the samples, with usual room light is perfcetly sufficient. |
参考文献
- Bedell, S. E., Bush, B. T. Erythrocyte sedimentation rate. From folklore to facts. The American Journal of Medicine. 78, 1001-1009 (1985).
- Grzybowski, A., Sak, J. Edmund Biernacki (1866-1911): Discoverer of the erythrocyte sedimentation rate. On the 100th anniversary of his death. Clinics in Dermatology. 29 (6), 697-703 (2011).
- Kushner, I., Mackiewicz, A. . The Acute Phase Response: An Overview. Acute Phase Proteins. , (1993).
- Tishkowski, K., Gupta, V. Erythrocyte Sedimentation Rate. StatPearls Publishing. , (2022).
- Menees, S. B., Powell, C., Kurlander, J., Goel, A., Chey, W. D. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. The Americal Journal of Gastroenterology. 110 (3), 444-454 (2015).
- Brigden, M. L. Clinical utility of the erythrocyte sedimentation rate. Americal Family Physician. 60 (5), 1443-1450 (1999).
- Liu, S., et al. Preliminary case-control study to evaluate diagnostic values of C-reactive protein and erythrocyte sedimentation rate in differentiating active Crohn's disease from intestinal lymphoma, intestinal tuberculosis and Behcet's syndrome. The American Journal of the Medical Sciences. 346 (6), 467-472 (2013).
- Greidanus, N. V., et al. Use of erythrocyte sedimentation rate and C-reactive protein level to diagnose infection before revision total knee arthroplasty: A prospective evaluation. The Journal of Bone and Joint Surgery. 89 (7), 1409-1416 (2007).
- Flormann, D., Kuder, E., Lipp, P., Wagner, C., Kaestner, L. Is there a role of C-reactive protein in red blood cell aggregation. International Journal of Laboratory Hematology. 37 (4), 474-482 (2015).
- Brust, M., et al. The plasma protein fibrinogen stabilizes clusters of red blood cells in microcapillary flows. Scientific Reports. 4, 4348 (2014).
- Gray, S. J., Mitchell, E. B., Dick, G. F. Effect of purified protein fractions on sedimentation rate of erythrocytes. Proceedings of the Society for Experimental Biology and Medicine. 51 (3), 403-404 (1942).
- Kratz, A., et al. ICSH recommendations for modified and alternate methods measuring the erythrocyte sedimentation rate. International Journal of Laboratory Hematology. 39 (5), 448-457 (2017).
- Hung, W. T., Collings, A. F., Low, J. Erythrocyte sedimentation rate studies in whole human blood. Physics in Medicine and Biology. 39 (11), 1855-1873 (1994).
- Woodland, N. B., Cordatos, K., Hung, W. T., Reuben, A., Holley, L. Erythrocyte sedimentation in columns and the significance of ESR. Biorheology. 33 (6), 477-488 (1996).
- Holley, L., Woodland, N., Hung, W. T., Cordatos, K., Reuben, A. Influence of fibrinogen and haematocrit on erythrocyte sedimentation kinetics. Biorheology. 36 (4), 287-297 (1999).
- Dasanna, A. K., et al. Erythrocyte sedimentation: Effect of aggregation energy on gel structure during collapse. Physical Review. E. 105 (2-1), 024610 (2022).
- Darras, A., et al. Erythrocyte sedimentation: collapse of a high-volume-fraction soft-particle gel. Physical Review Letters. 128 (8), 088101 (2022).
- Darras, A., et al. Imaging erythrocyte sedimentation in whole blood. Frontiers in Physiology. 12, 729191 (2022).
- Darras, A., et al. Acanthocyte sedimentation rate as a diagnostic biomarker for neuroacanthocytosis syndromes: Experimental evidence and physical justification. Cells. 10 (4), 788 (2021).
- Rabe, A., et al. The erythrocyte sedimentation rate and its relation to cell shape and rigidity of red blood cells from chorea-acanthocytosis patients in an off-label treatment with dasatinib. Biomolecules. 11 (5), 727 (2021).
- Giavarina, D., Capuzzo, S., Pizzolato, U., Soffiati, G. Length of erythrocyte sedimentation rate (ESR) adjusted for the hematocrit: reference values for the TEST 1 method. Clinical Laboratory. 52 (5-6), 241-245 (2006).
- Bull, B. S. Is a standard ESR possible. Laboratory Medicine. 6 (11), 31-39 (1975).
- Bull, B. S., Brecher, G. An evaluation of the relative merits of the Wintrobe and Westergren sedimentation methods, including hematocrit correction. American Journal of Clinical Pathology. 62 (4), 502-510 (1974).
- Reinhart, W. H., Singh, A., Straub, P. W. Red blood cell aggregation and sedimentation: the role of the cell shape. British Journal of Haematology. 73 (4), 551-556 (1989).
- Jan, K., Usami, S., Smith, J. A. Influence of oxygen tension and hematocrit reading on ESRs of sickle cells: Role of RBC aggregation. Archives of Internal Medicine. 141 (13), 1815-1818 (1981).
- Issaq, H. J., Xiao, Z., Veenstra, T. D. Serum and plasma proteomics. Chemical Reviews. 107 (8), 3601-3620 (2007).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), 21230 (2011).
- . Proper Pipetting Techniques - DE Available from: https://www.thermofisher.com/de/de/home/life-science/lab-plasticware-supplies/lab-plasticware-supplies-learning-center/lab-plasticware-supplies-resource-library/fundamentals-of-pipetting/proper-pipetting-techniques.html (2023)
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Transaction on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Solomon, C., et al. A comparison of fibrinogen measurement methods with fibrin clot elasticity assessed by thromboelastometry, before and after administration of fibrinogen concentrate in cardiac surgery patients. Transfusion. 51 (8), 1695-1706 (2011).
- Norouzi, N., Bhakta, H. C., Grover, W. H. Sorting cells by their density. PLoS One. 12 (7), 0180520 (2017).
- Trudnowski, R. J., Rico, R. C. Specific gravity of blood and plasma at 4 and 37 degrees C. Clinical Chemistry. 20 (5), 615-616 (1974).
- Késmárky, G., Kenyeres, P., Rábai, M., Tóth, K. Plasma viscosity: A forgotten variable. Clinical Hemorheology and Microcirculation. 39 (1-4), 243-246 (2008).
- Teece, L. J., et al. Gels under stress: The origins of delayed collapse. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 458, 126-133 (2014).
- Lindström, S. B., Kodger, T. E., Sprakel, J., Weitz, D. A. Structures, stresses, and fluctuations in the delayed failure of colloidal gels. Soft Matter. 8 (13), 3657-3664 (2012).
- Bartlett, P., Teece, L. J., Faers, M. A. Sudden collapse of a colloidal gel. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 85, 021404 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。