A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Erythrocyte Sedimentation Rate: אפיון מונחה פיזיקה בהקשר רפואי
In This Article
Summary
שיעור שקיעת אריתרוציטים (ESR) הוא פרמטר פיזי, המשמש לעתים קרובות בבדיקות בריאות שגרתיות ואבחון רפואי. לאחרונה פותח מודל תיאורטי המאפשר לחלץ פרמטרים בעלי משמעות פיזיקלית מכל עקומת השיקוע, המבוסס על ידע קולואידי מודרני. כאן, אנו מציגים פרוטוקול לאיסוף אוטומטי של ESR לאורך זמן, ומחלצים את הפרמטרים של מודל עדכני זה מאיסוף נתונים אוטומטי זה. פרמטרים מעודנים אלה עשויים לשפר גם את העדות הרפואית.
Abstract
שיעור שקיעת אריתרוציטים (או תאי דם אדומים) (ESR) הוא פרמטר נגזר פיזי של דם המשמש לעתים קרובות בבדיקות בריאות שגרתיות ואבחון רפואי. לדוגמה, במקרה של דלקת, ESR גבוה יותר הוא ציין בשל הגידול הקשורים פיברינוגן וחלבונים פלזמה אחרים. הוא האמין כי עלייה זו נובעת היווצרות של אגרגטים גדולים יותר של תאי דם אדומים (RBCs) שנגרמו על ידי הגידול בפיברינוגן. ואכן, פיברינוגן הוא צבירה המעודדת סוכנים של RBCs ובמשטר סטוקס - מניחים שהוא נצפה במשקעים אגרגטים גדולים יותר בדם. עם זאת, כל המודלים של מדידות ESR המבוססים על השערה זו דורשים הנחות פיזיקליות ספציפיות נוספות, שאינן נדרשות בשום מערכת אחרת. חוץ מזה, מחקרים מודרניים בתחום המתלים הקולואידים הוכיחו כי חלקיקים אטרקטיביים יוצרים אגרגטים מחלחלים (כלומר אגרגטים רחבים כמו המיכל). השקיעה של קולואידים אלה באה לאחר מה שמכונה "קריסת ג'ל קולואידית". לאחרונה, הוכח כי RBCs למעשה בצע את אותה התנהגות. השערה זו מאפשרת גם למדל באופן יעיל ואנליטי את עקומת השקיעה של RBCs, שממנה ניתן לחלץ תיאורים חזקים ובעלי משמעות פיזית. כתב יד זה מתאר כיצד לבצע ניתוח כזה, ודן ביתרונות של גישה זו.
Introduction
שיעור שקיעת כדורית הדם (ESR) הוא כלי קליני רפואי במבחנה, שהוצג רשמית ברפואה מבוססת ראיות במהלך המאה העשרים 1,2,3,4. כיום משתמשים בו ברחבי העולם כבדיקה דלקתית לא ספציפית, או כדי לעקוב אחר האבולוציה של כמה תנאים ספציפיים 5,6,7,8. זאת בעיקר בשל עלייה בריכוז הפיברינוגן, אך גם ברכיבי פלזמה אחרים כגון IgM 1,9,10,11. על פי הפרוטוקול הסטנדרטי הנוכחי של Westergren, ערכי ESR מדווחים כמדידה של שכבת פלזמה נטולת תאים בנקודת זמן נתונה (30 דקות או 1 שעות) לאחר השארת צינור אנכי בגודל טיפוסי של 20 ס"מ אנכית במנוחה12. עם זאת, שיטת מדידה זו זכתה לביקורת מכיוון שדווחו שלבים שונים מבחינה איכותית בתהליך השיקוע, כולל עיכוב לפני הגעה למהירות השיקוע המרבית13. עיכוב זה נמשך יותר משעה בכמחצית מהדגימות הבריאות14. המהירות בשלב זה מצייתת לקנה מידה שונה מאשר בשלב השני, המהיר יותר, של שיקוע15. הגבלת הקריאה למהירות השקיעה הממוצעת במהלך השעה הראשונה ואז משווה תערובת שונה של תכונות דם שונות בין אנשים שונים.
יתר על כן, לאחרונה הוכח כי השיקולים התיאורטיים הרגילים מאחורי פרוטוקול זה היו שגויים16,17,18. בהמטוקריט פיזיולוגי (מעל כ-25%), תאי דם אדומים (RBCs) אינם משקעים כאגרגטים נפרדים, אלא כרשת רציפה, מה שנקרא חלחול, של RBCs 17,18, המצייתת למערכת שונה של משוואות פיזיקליות מאשר שקיעת סטוקס 16,17 המוזכרת בדרך כלל. הוכח כי התחשבות בתיאור פיזי המבוסס על מדידות שנפתרו בזמן של השקיעה (העקומה כולה) הייתה חזקה יותר בכמה הקשרים רפואיים חדשים19,20. יתר על כן, מדידות אלה יכולות לשמש כדי לשפוך אור על המנגנונים הפיזיים המשנים את ESR בפתולוגיות שבהן צורות התא משתנות19,20. בנוסף, ESR איטי יכול להיות פרשנות רפואית שימושית, כפי שצוין במדידות של קבוצה של חולי תסמונת neuroacanthocytosis19,20. מאמר זה סוקר כיצד ליישם באופן מעשי את המדידה של פרמטרים בעלי משמעות פיזית, בהתבסס על קינטיקה ESR כולה. ליתר דיוק, השיטה המוצגת כאן מחלצת את מהירות השקיעה המקסימלית Um, שערכה ניתן לתקן כדי לשקול את השפעת ההמטוקריט של התורם16,17. פרמטר זה מדויק יותר ולכן אמין יותר מהמדידה המסורתית16,17,19,20.
בנוסף, בכמה מחקרים בסיסיים, במקום לפקח על מצב דלקת של חולה נתון, מעניין להוציא את ההשפעה של המטוקריט על ESR 21,22,23, או לחקור את התפקיד של RBCs ב ESR שונה 19,20,24,25 בין תורמים שונים. כדאי להשוות דגימות שאינן ישירות דגימות דם מלאות מחולים. לכן, השעיה מחדש של RBCs עם המטוקריט מבוקר בפלזמה האוטולוגית, או בתחליף פלזמה, עשויה לשמש כצעד הראשון של מדידת ESR. לדוגמה, תמיסות של דקסטרן 70 kDa עם ריכוז של 55 מ"ג/מ"ל במי מלח חוצצים פוספט (PBS) מייצרות טווח שיקוע בטווח הבקרה לתאים בריאים19. כתב יד זה מראה גם כיצד יש לבצע צעדים כאלה, וכי הניתוח המוצג רלוונטי גם במקרים אלה.
Protocol
איסוף דגימות דם וניסויים אושרו על ידי "Ärztekammer des Saarlandes", ethics votum 51/18, ובוצעו לאחר שהתקבלה הסכמה מדעת על פי הצהרת הלסינקי. מדידות סטנדרטיות יש לבצע עם חומצה ethylenediaminetetraacetic (EDTA)-דם נוגד קרישה (ריכוז EDTA סטנדרטי של 1.6 מ"ג / מ"ל דם, הנורמה האירופית NF EN ISO 6710), בצינורות Westergren. הנפח הדרוש למילוי צינור ווסטרגרן תלוי ביצרן (מכיוון שחלקים נמוכים יותר מכילים לפעמים מאגר רחב יותר); נפח צריך להיות כ 1 מ"ל של דם מלא, ו 800 μL עבור צינורות המצוין בטבלת החומרים. עם זאת, השיטה המתוארת להלן תקפה ללא קשר לתרחיף הספציפי ולצורת המיכל, כל עוד ההמטוקריט של הדגימות הנבדקות גבוה מ- 25%16. לכן יש לבחור נפחים, מכולות, מדיום תרחיף ותוספים בהתאם למטרות הספציפיות של המחקר שבוצע.
1. ניסויים ומדידות
הערה: רשום את קצב השקיעה של הדגימה בכל דקה.
- הכנת מדגם (במידת הצורך): אם נדרש המטוקריט בקרה או נוזל מרחף, התחל בשטיפת התאים והכנת הדגימות (כדוגמה, אנו מראים כיצד להכין דגימות עם רמות פיברינוגן שונות, על ידי ערבוב סרום אוטולוגי ופלזמה). סרום אכן יכול להיות משוער כמו פלזמה נטולת פיברינוגן26,27, והוא יכול לשמש על מנת להפחית את הצבירה של RBCs, בתנאים פיזיולוגיים אחרים. על מנת להכין מספר דגימות, לאסוף את הדם בצינורות EDTA סטנדרטיים של 9 מ"ל ואת הסרום בצינורות סרום סטנדרטיים (עם חרוזי סיליקה כמפעילי קרישה) של 9 מ"ל.
- צנטריפוגה את דגימות הדם (כלומר, 9 מ"ל של צינורות EDTA סטנדרטיים וסרום בדוגמה שנבחרה) ב 3,000 x גרם במשך 7 דקות לפחות, לדחיסה אופטימלית של אריתרוציטים ארוזים. החליפו את הסופרנאטנט ב-PBS או בנוזל המרחף הרצוי, אם יש כמות מספקת זמינה. אם זה פשוט נדרש כדי לשלוט hematocrit בפלזמה אוטולוגית, להמשיך ישירות לשלב 1.1.3. אחרת, מערבבים בעדינות לאחר הכללת הסופרנאטנט לשטיפה.
- חזור על הפעולה שלוש פעמים. בצע את הכביסה האחרונה עם נוזל ההרחיה הרצוי בכל מקרה.
- בדוגמה שנבחרה, הכינו תערובות של פלזמה וסרום אוטולוגיים עם פרופורציות קבועות (למשל, 25%/75%, 50%/50%, או 75%/25% מחלק נפח הפלסמה-סרום). לדוגמה, בעת הכנת 2.5 מ"ל של תערובת 25%/75% פלזמה בסרום, להוסיף 0.625 מ"ל של פלזמה ל 1.875 מ"ל של סרום.
- חלץ את הנפח הנדרש של תאים ארוזים ולהשעות אותו בנוזל הרצוי. מעבדים את התאים הארוזים כנוזל צמיג מאוד (באמצעות קדם-פיפטינג סטנדרטי ו/או פיפטינג הפוך או פיפטה עם תזוזה חיובית28). בדוגמה שנבחרה, עבור מדגם 4 מ"ל בהמטוקריט של 45%, להשעות 1.8 מ"ל של תאים ארוזים בתוך 2.2 מ"ל של תערובת פלסמה-סרום.
- אם ההמטוקריט של המדגם אינו נשלט, לקבוע אותו על ידי מיקרוצנטריפוגה במהירות גבוהה (שיטות סטנדרטיות אחרות מתאימות גם).
- חלץ את כמות הדגימה הנדרשת לקביעת המטוקריט: מלא את נימי המיקרו-המטוקריט על ידי טבילת קצהו התחתון בנוזל. עצור אותו על ידי כיסוי הפתח העליון כאשר כמות הדגימה הנדרשת עולה בצינור על ידי יניקה נימית.
- אוטמים את הנימים בשעווה אוטמת. הכניסו אותם לצנטריפוגת המיקרו-המטוקריט והפעילו אותה במהירות של 15,000 x גרם (12,000 סל"ד) למשך 5 דקות, או לפי הוראות היצרן.
- קרא את רמת המטוקריט על הנימים ולרשום אותו לעיון.
- הגדירו מצלמה לתיעוד שקיעת הדגימות. כדי למנוע עומס יתר על הזיכרון או ריקון הסוללה, הפעל את ההתקן מרשת החשמל ושמור את התמונות ישירות במחשב או בכונן קשיח חיצוני.
- התקן מצלמה יציבה מול המחזיק שבו צינורות ESR יישארו במנוחה. השתמש ברקע לבן ומואר (גיליונות נייר לבנים ברקע עובדים בצורה מושלמת).
- באמצעות צינורות Westergren ריקים, רצוי ללא סימונים, להגדיר את המיקוד ואת שדה הראייה של המצלמה כדי לקבל את הרזולוציה הגבוהה ביותר שבו הדגימות ימוקמו. רצוי, ודא שגבולות התמונות מיושרים בכיוון האנכי והאופקי.
- צלם תמונה של צינור שקנה המידה שלו השתנה כדי לחלץ את רזולוציית הפיקסל. מומלץ להשתמש בתמונות RGB.
- הגדר את האור ואת זמן החשיפה של המצלמה כך שיהיה רקע לבן, אך ללא רוויה. הדוגמה באיור 1 התקבלה באמצעות Canon EOS M50, עם זמן חשיפה של 1/15 שניות, צמצם של F8.0, איזון לבן של טונגסטן, במצב צילום בודד עם מיקוד ידני, ומהירות ISO של 1,000.
- הכן ומקם את צינורות ה- ESR.
- מלא את המיכל התחתון של צינור Westergren עם נפח המתאים להוראות היצרן. הכנס את צינור Westergren במיכל התחתון כפי שצוין על ידי היצרן.
- ברגע שהצינור הראשון מוכן, הניחו אותו במחזיק והתחילו את הקלטת המצלמה. הקלטת תמונה אחת בכל דקה בדרך כלל נותנת רזולוציה טובה של העקומה הקינטית ESR.
- הכינו והניחו את הדגימות הבאות. הקפד לא לעמוד מול שום דגימה בעת צילום תמונה.
- תן למדידות לרוץ לפחות שעתיים, כדי להשוות למדידות סטנדרטיות של 30 דקות, שעה ושעתיים. עם זאת, עדיף גם לראות את הרוויה ואת המעצר של משקעים. עבור דגימות בריאות, או במקרה של דלקת, רישום הדגימות במשך הלילה, בין 12 שעות ל 24 שעות, הוא יותר ממספיק מאז העקמומיות של הדגימות המהירות ביותר נראה בתוך 3 שעות13,19. עם זאת, אם מצב מסוים מקטין את מהירות השקיעה, כפי שעושה ירידה בריכוז הפיברינוגן (כלומר, בדוגמה שנבחרה, מקטע נפח גבוה בסרום), הקלטות של 50 שעות או יותר עשויות להידרש כדי לקבל את המידע המדויק ביותר16,19.
2. ניתוח תמונות
הערה: לאחר הקלטת התמונות, חלץ את עקומת ה- ESR. דוגמה לקוד Matlab מסופקת כקובץ משלים 1 (MatlabCodeImageAnalysisSampled.m).
- בחר או זהה אזור עניין (ROI) שבו רק צינורית אחת גלויה, כאשר הגבול התחתון ממוקם מתחת למיקום הנמוך ביותר של ממשק פלזמה ללא תאי אריתרוציטים אך בתוך הדגימה (ראה איור 1A, B). במידת הצורך, סובב את התמונה כך שהכיוון האנכי מיושר לאורך הרכיב הראשון של התמונה.
- המר את החזר ההשקעה של תמונת RGB לתמונה בקנה מידה אפור או למטריצה Gr. בדרך כלל, שילוב שלושת הערוצים (אדום [R], ירוק [G] וכחול [B]) כ- Gr = 2 * R - B - G יעיל מאוד עם רקע ברור (ראה איור 1C ו- MatlabCodeImageAnalysisSampled.m שורות 121-128).
- בינאריזציה של התמונה. עבור דגימה בריאה, שימוש בסףOtsu 29 בדרך כלל נותן תוצאה עקבית (ראה איור 1D ושורה 133 של MatlabCodeImageAnalysisSampled.m). עבור דגימות עם המטוקריט גבוה או עם המוליזה מסוימת, ייתכן שעדיף להתאים אותו ידנית או להשתמש בשיטה אוטומטית אחרת (כפי שנעשה בשורות 129-131 של MatlabCodeImageAnalysisSampled.m), בהתאם לניגודיות המדויקת המתקבלת בין השלבים השונים בתוך הצינור.
- קבל את הממוצע של ערכי הפיקסלים (או הרכיבים) של Gr לאורך הכיוון האופקי. שלב זה ממזער את הרעש וממוצע ביעילות את אי הסדירות האפשרית בממשק (ראה איור 1E ו- MatlabCodeImageAnalysisSampled.m שורה 137).
- לפני חישוב הווריאציות, החליקו את העקומה עם ממוצע נע, במיוחד אם הצינורות מכילים כמה סימונים אופקיים (ראו איור 1F). עבור הדוגמאות שסופקו, חלון נע של ~ 2.5 מ"מ (50 פיקסלים) שימש לתהליך זה (ראה שורה 138 של MatlabCodeImageAnalysisSampled.m). לאחר מכן, זהו את מיקום הממשק כנקודה עם שונות העוצמה הגבוהה ביותר (ראו איור 1G).
- חזור על הפעולה עבור כל תמונה וכל דוגמה. עבור כל מדגם, שמור את מיקומי הממשק לאורך זמן בפורמט מתאים כדי להתאים את המודל הפיזי עם כל תוכנה מתאימה.
3. התאמת המודל הפיזי
- באמצעות כל תוכנה מתאימה, לדעת את המטוקריט ואת הגובה ההתחלתי של עמודת הדם h 0, למצוא את הערכים של זמן עיכוב t0, זמן חסר ממד γ, ואת חלק נפח ארוז הסופי Φmשל אריתרוציטים הממזער את סכום סטיות שיורית בריבוע עבור המודל הפיזיקלי17. קוד Matlab (ShapeAnalyzerIntegrated.m) מסופק כקובץ משלים 2 כדוגמה לביצוע התאמה כזו. ראו קובץ משלים 2 להוראות נוספות. כפי שתואר במקום אחר16,17, אריתרוציטים במשקעים המטוקריט פיזיולוגיים כג'ל חלקיקים רכים, כאשר הפרמטרים הפיזיים החשובים הם ההבדל בצפיפות בין הפלזמה לבין RBCs של התורם Δρ, הקוטר האופייני של RBC rRBC, צמיגות הפלזמה בטמפרטורת החדר η, וההמטוקריט של התורם Φ . באמצעות פרמטרים אלה, ובהנחה שהלחץ הכבידתי הוא התהליך המניע העיקרי של הפלזמה לזרום כלפי מעלה דרך הרשת הנקבובית שנוצרה על ידי אריתרוציטים לאחר זמן עיכוב t0, מקבלים את האבולוציה הטמפורלית16,17:
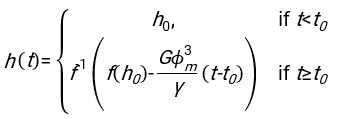
עם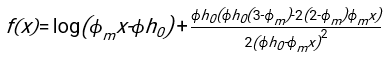 , ,
, , 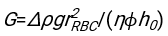 ו
ו 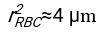 - הוא רדיוס הדיסק הממוצע של אריתרוציטים. דוגמה לקוד Matlab המבצע זאת מסופקת כקובץ מצורף (ShapeAnalyzerIntegrated.m מתאים לפונקציה המוגדרת ב- SedimFit.m [קובץ משלים 3]). לחלופין, G/γ יכול לשמש גם ישירות כפרמטר התאמה עם יחידות של 1/t.
- הוא רדיוס הדיסק הממוצע של אריתרוציטים. דוגמה לקוד Matlab המבצע זאת מסופקת כקובץ מצורף (ShapeAnalyzerIntegrated.m מתאים לפונקציה המוגדרת ב- SedimFit.m [קובץ משלים 3]). לחלופין, G/γ יכול לשמש גם ישירות כפרמטר התאמה עם יחידות של 1/t. - לאחר חילוץ העקומה הכמותית מהתמונה, שמור את הפרמטרים הפיזיים של המדגם. עדיין ניתן לחלץ מהעקומה ערכי ESR מסורתיים של 30 דקות, שעה או שעתיים לצורך הפניה (ראה שורות ShapeAnalyzerIntegrated.m 123-132).
תוצאות
דוגמה לרצף תמונות שנרכש כהלכה מסופקת כסרט משלים 1 (MovieS1.avi). סדרה של התאמות אופייניות של המודל מוצגת עבור תנאים שונים באיור 2. ריכוז הפיברינוגן נקבע מריכוז הפיברינוגן בפלזמה Fib0, בהנחה שבסרום אין פיברינוגן כלל. לפיכך, Fib = C Fib0, כאשר C הוא חלק נפ...
Discussion
כדי שהפרוטוקול האוטומטי יעבוד ביעילות, חשוב שיהיה רקע ברור ותאורה מתאימה. רקע כהה עלול למנוע את קיומו של סף בינאריזציה יעיל. עבור דגימות עם המוליזה מסוימת, אשר מתרחשת בדרך כלל (עולה) לאורך זמן, חשוב לוודא תחילה כי סף בינאריזציה שנבחר רלוונטי הן עבור התמונה הראשונית והן עבור התמונה הסופית.
...Disclosures
למחברים אין ניגודי עניינים להצהיר שהם רלוונטיים לתוכן מאמר זה.
Acknowledgements
עבודה זו נתמכה על ידי יחידת המחקר FOR 2688 - Wa1336/12 של קרן המחקר הגרמנית ועל ידי הסכם המענק של מארי סקלודובסקה-קירי מס '860436-EVIDENCE. T. J. ו- C. W. מכירים במימון מהאוניברסיטה הגרמנית הצרפתית (DFH / UFA). א.ד. מכיר במימון של מענק החוקר הצעיר של אוניברסיטת סארלנד.
Materials
| Name | Company | Catalog Number | Comments |
| Anticoagulant (EDTA or Heparin) tube (for blood sample) | SARSTEDT | 267001 or 265 | Anticoagulated blood sample to characterize |
| Camera EOS M50 | Canon | Kit EF-M18-150 IS STM | Any camera should work, provided that sector alimentation, connection to computer for automated shooting and adapted objective are available |
| Centrifuge | HERMLE | 302.00 V03 - Z 36 HK | Requirements: at least 3000 x g ofr 7 min. |
| Micro-centrifuge | MLW | TH21 | or any other way to determine the hematocrit |
| Micro-hematocrit capilaries | Fisher scientific | 11884040 | or other capillaries/containers for hematocrit determination |
| Phosphate Buffered Saline (PBS) | ThermoFisher | 10010023 | 1x PBS, pH 7.4, 298 Osm |
| Pipettes (e.g. positive displacement pipette) | Gilson | FD10006 | Pipette required to manipulate blood and/or packed cells.Other models are of course suitable, but be careful to treat blood and pakced cells as highly viscous fluids. |
| Wax sealing plate | Hirschmann | 9120101 | Sealing wax for the micro-hematocrit capillaries |
| Westergren tubes | Praxindo | A9244560 | Any other standard Wetsergren tube should work too |
| White background with illumination | / | / | White sheet(s) of paper behind the samples, with usual room light is perfcetly sufficient. |
References
- Bedell, S. E., Bush, B. T. Erythrocyte sedimentation rate. From folklore to facts. The American Journal of Medicine. 78, 1001-1009 (1985).
- Grzybowski, A., Sak, J. Edmund Biernacki (1866-1911): Discoverer of the erythrocyte sedimentation rate. On the 100th anniversary of his death. Clinics in Dermatology. 29 (6), 697-703 (2011).
- Kushner, I., Mackiewicz, A. . The Acute Phase Response: An Overview. Acute Phase Proteins. , (1993).
- Tishkowski, K., Gupta, V. Erythrocyte Sedimentation Rate. StatPearls Publishing. , (2022).
- Menees, S. B., Powell, C., Kurlander, J., Goel, A., Chey, W. D. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. The Americal Journal of Gastroenterology. 110 (3), 444-454 (2015).
- Brigden, M. L. Clinical utility of the erythrocyte sedimentation rate. Americal Family Physician. 60 (5), 1443-1450 (1999).
- Liu, S., et al. Preliminary case-control study to evaluate diagnostic values of C-reactive protein and erythrocyte sedimentation rate in differentiating active Crohn's disease from intestinal lymphoma, intestinal tuberculosis and Behcet's syndrome. The American Journal of the Medical Sciences. 346 (6), 467-472 (2013).
- Greidanus, N. V., et al. Use of erythrocyte sedimentation rate and C-reactive protein level to diagnose infection before revision total knee arthroplasty: A prospective evaluation. The Journal of Bone and Joint Surgery. 89 (7), 1409-1416 (2007).
- Flormann, D., Kuder, E., Lipp, P., Wagner, C., Kaestner, L. Is there a role of C-reactive protein in red blood cell aggregation. International Journal of Laboratory Hematology. 37 (4), 474-482 (2015).
- Brust, M., et al. The plasma protein fibrinogen stabilizes clusters of red blood cells in microcapillary flows. Scientific Reports. 4, 4348 (2014).
- Gray, S. J., Mitchell, E. B., Dick, G. F. Effect of purified protein fractions on sedimentation rate of erythrocytes. Proceedings of the Society for Experimental Biology and Medicine. 51 (3), 403-404 (1942).
- Kratz, A., et al. ICSH recommendations for modified and alternate methods measuring the erythrocyte sedimentation rate. International Journal of Laboratory Hematology. 39 (5), 448-457 (2017).
- Hung, W. T., Collings, A. F., Low, J. Erythrocyte sedimentation rate studies in whole human blood. Physics in Medicine and Biology. 39 (11), 1855-1873 (1994).
- Woodland, N. B., Cordatos, K., Hung, W. T., Reuben, A., Holley, L. Erythrocyte sedimentation in columns and the significance of ESR. Biorheology. 33 (6), 477-488 (1996).
- Holley, L., Woodland, N., Hung, W. T., Cordatos, K., Reuben, A. Influence of fibrinogen and haematocrit on erythrocyte sedimentation kinetics. Biorheology. 36 (4), 287-297 (1999).
- Dasanna, A. K., et al. Erythrocyte sedimentation: Effect of aggregation energy on gel structure during collapse. Physical Review. E. 105 (2-1), 024610 (2022).
- Darras, A., et al. Erythrocyte sedimentation: collapse of a high-volume-fraction soft-particle gel. Physical Review Letters. 128 (8), 088101 (2022).
- Darras, A., et al. Imaging erythrocyte sedimentation in whole blood. Frontiers in Physiology. 12, 729191 (2022).
- Darras, A., et al. Acanthocyte sedimentation rate as a diagnostic biomarker for neuroacanthocytosis syndromes: Experimental evidence and physical justification. Cells. 10 (4), 788 (2021).
- Rabe, A., et al. The erythrocyte sedimentation rate and its relation to cell shape and rigidity of red blood cells from chorea-acanthocytosis patients in an off-label treatment with dasatinib. Biomolecules. 11 (5), 727 (2021).
- Giavarina, D., Capuzzo, S., Pizzolato, U., Soffiati, G. Length of erythrocyte sedimentation rate (ESR) adjusted for the hematocrit: reference values for the TEST 1 method. Clinical Laboratory. 52 (5-6), 241-245 (2006).
- Bull, B. S. Is a standard ESR possible. Laboratory Medicine. 6 (11), 31-39 (1975).
- Bull, B. S., Brecher, G. An evaluation of the relative merits of the Wintrobe and Westergren sedimentation methods, including hematocrit correction. American Journal of Clinical Pathology. 62 (4), 502-510 (1974).
- Reinhart, W. H., Singh, A., Straub, P. W. Red blood cell aggregation and sedimentation: the role of the cell shape. British Journal of Haematology. 73 (4), 551-556 (1989).
- Jan, K., Usami, S., Smith, J. A. Influence of oxygen tension and hematocrit reading on ESRs of sickle cells: Role of RBC aggregation. Archives of Internal Medicine. 141 (13), 1815-1818 (1981).
- Issaq, H. J., Xiao, Z., Veenstra, T. D. Serum and plasma proteomics. Chemical Reviews. 107 (8), 3601-3620 (2007).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), 21230 (2011).
- . Proper Pipetting Techniques - DE Available from: https://www.thermofisher.com/de/de/home/life-science/lab-plasticware-supplies/lab-plasticware-supplies-learning-center/lab-plasticware-supplies-resource-library/fundamentals-of-pipetting/proper-pipetting-techniques.html (2023)
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Transaction on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Solomon, C., et al. A comparison of fibrinogen measurement methods with fibrin clot elasticity assessed by thromboelastometry, before and after administration of fibrinogen concentrate in cardiac surgery patients. Transfusion. 51 (8), 1695-1706 (2011).
- Norouzi, N., Bhakta, H. C., Grover, W. H. Sorting cells by their density. PLoS One. 12 (7), 0180520 (2017).
- Trudnowski, R. J., Rico, R. C. Specific gravity of blood and plasma at 4 and 37 degrees C. Clinical Chemistry. 20 (5), 615-616 (1974).
- Késmárky, G., Kenyeres, P., Rábai, M., Tóth, K. Plasma viscosity: A forgotten variable. Clinical Hemorheology and Microcirculation. 39 (1-4), 243-246 (2008).
- Teece, L. J., et al. Gels under stress: The origins of delayed collapse. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 458, 126-133 (2014).
- Lindström, S. B., Kodger, T. E., Sprakel, J., Weitz, D. A. Structures, stresses, and fluctuations in the delayed failure of colloidal gels. Soft Matter. 8 (13), 3657-3664 (2012).
- Bartlett, P., Teece, L. J., Faers, M. A. Sudden collapse of a colloidal gel. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 85, 021404 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved