A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في الجسم الحي تصوير الكالسيوم للمجموعات العصبية في شبكات الخلايا العصبية الحسية الأولية في العقد الجذرية الظهرية السليمة
In This Article
Summary
يصف هذا البروتوكول التعرض الجراحي لعقدة الجذر الظهري (DRG) متبوعا ب GCaMP3 (مؤشر Ca2+ المشفر وراثيا; بروتين الفلورسنت الأخضر - كالمودولين - M13 بروتين 3) تصوير Ca2+ للمجموعات العصبية باستخدام الفئران Pirt-GCaMP3 أثناء تطبيق مجموعة متنوعة من المحفزات على المخلب الخلفي المماثل.
Abstract
يمكن استخدام تصوير Ca 2+ كوكيل للنشاط الخلوي ، بما في ذلك إمكانات الفعل وآليات الإشارات المختلفة التي تتضمن دخول Ca 2+ إلى السيتوبلازم أو إطلاق مخازن Ca2+ داخل الخلايا. يوفر تصوير Ca2+ القائم على Pirt-GCaMP3 للخلايا العصبية الحسية الأولية لعقدة الجذر الظهرية (DRG) في الفئران ميزة القياس المتزامن لعدد كبير من الخلايا. يمكن مراقبة ما يصل إلى 1800 خلية عصبية ، مما يسمح بدراسة الشبكات العصبية والعمليات الحسية الجسدية كمجموعة في سياقها الفسيولوجي الطبيعي على مستوى السكان في الجسم الحي. يسمح العدد الكبير من الخلايا العصبية التي تتم مراقبتها باكتشاف أنماط النشاط التي يصعب اكتشافها باستخدام طرق أخرى. يمكن تطبيق المحفزات على مؤخرة الفأر ، مما يسمح بدراسة التأثيرات المباشرة للمنبهات على مجموعة الخلايا العصبية DRG. يشير عدد الخلايا العصبية التي تنتج عابرات Ca 2+ بالإضافة إلى سعة العابرين Ca2+ إلى الحساسية لطرائق حسية محددة. يوفر قطر الخلايا العصبية دليلا على أنواع الألياف المنشطة (الميكانيكي غير الضار مقابل ألياف الألم الضارة ، ألياف Aβ و Aδ و C). يمكن تسمية الخلايا العصبية التي تعبر عن مستقبلات محددة وراثيا باستخدام td-Tomato و Cre recombinases المحددة مع Pirt-GCaMP. لذلك ، يوفر تصوير Pirt-GCaMP3 Ca2+ ل DRG أداة ونموذجا قويا لتحليل طرائق حسية محددة وأنواع فرعية من الخلايا العصبية تعمل كمجموعة على المستوى السكاني لدراسة الألم والحكة واللمس والإشارات الحسية الجسدية الأخرى.
Introduction
الخلايا العصبية الحسية الأولية تعصب الجلد مباشرة وتحمل المعلومات الحسية الجسدية مرة أخرى إلى الجهاز العصبي المركزي 1,2. العقد الجذرية الظهرية (DRGs) هي مجموعات جسم الخلية من 10000-15000 خلية عصبية حسية أولية 3,4. تقدم الخلايا العصبية DRG أحجاما متنوعة ومستويات الميالين وأنماط التعبير الجيني والمستقبلات. تشمل الخلايا العصبية ذات القطر الأصغر الخلايا العصبية المستشعرة للألم وتستجيب الخلايا العصبية ذات القطر الأكبر عادة للمنبهات الميكانيكية غير المؤلمة 5,6. يمكن للاضطرابات في الخلايا العصبية الحسية الأولية مثل الإصابة والالتهابات المزمنة واعتلالات الأعصاب الطرفية توعية هذه الخلايا العصبية بمحفزات مختلفة والمساهمة في الألم المزمن والألم الخيفي وفرط الحساسيةللألم 7,8. لذلك ، فإن دراسة الخلايا العصبية DRG مهمة في فهم كل من الإحساس الجسدي بشكل عام والعديد من اضطرابات الألم والحكة.
تعد الخلايا العصبية التي تطلق في الجسم الحي ضرورية للإحساس الجسدي ، ولكن حتى وقت قريب ، كانت أدوات دراسة العقد السليمة في الجسم الحي تقتصر على أعداد صغيرة نسبيا من الخلايا9. نصف هنا طريقة قوية لدراسة جهود الفعالية أو أنشطة الخلايا العصبية على مستوى السكان في الجسم الحي كمجموعة. تستخدم الطريقة التصوير على أساس ديناميكيات السيتوبلازمCa 2+. تعد مؤشرات الفلورسنت الحساسة Ca 2+ وكلاء جيدين لقياس النشاط الخلوي بسبب التركيز المنخفض عادة للسيتوبلازم Ca2+. سمحت هذه المؤشرات بالمراقبة المتزامنة لمئات إلى عدة آلاف من الخلايا العصبية الحسية الأولية في الفئران9،10،11،12،13،14،15،16 والجرذان 17. يمكن استخدام طريقة التصوير في الجسم الحي Ca2+ الموصوفة في هذه الدراسة لمراقبة استجابات مستوى السكان مباشرة للمحفزات الميكانيكية والباردة والحرارية والكيميائية.
يتم التعبير عن بروتين الغشاء المرتبط بالفوسفوينوسيتيد ، Pirt بمستويات عالية في جميع الخلايا العصبية الحسية الأولية تقريبا (>95٪)18,19 ويمكن استخدامه لدفع التعبير عن مستشعر Ca 2+ ، GCaMP3 ، لمراقبة نشاط الخلايا العصبية في الجسم الحي20. في هذا البروتوكول ، يتم وصف التقنيات لإجراء جراحة DRG في الجسم الحي ، وتصوير Ca2+ ، والتحليل في الجانب الأيمن من أسفل الظهر 5 (L5) DRG للفئران Pirt-GCaMP314 باستخدام مجهر المسح بالليزر متحد البؤر (LSM).
Access restricted. Please log in or start a trial to view this content.
Protocol
تم تنفيذ جميع الإجراءات الموضحة هنا وفقا لبروتوكول معتمد من قبل اللجنة المؤسسية لرعاية واستخدام الحيوان التابعة لمركز العلوم الصحية بجامعة تكساس في سان أنطونيو.
ملاحظة: بمجرد البدء ، يجب إكمال جراحة الحيوانات (الخطوة 1) والتصوير (الخطوة 2) بطريقة مستمرة. قد يتم إجراء تحليل البيانات (الخطوة 3) لاحقا.
1. الجراحة وتأمين الحيوان للجانب الأيمن L5 DRG التصوير
ملاحظة: تم استخدام كل من ذكور وإناث الفئران Pirt-GCaMP3 C57BL / 6J التي تبلغ من العمر 8 أسابيع أو أكثر في هذه الدراسة. في حين يمكن تصوير أي من الجنسين بشكل جيد على قدم المساواة ، يجب أن يكون عمر الفئران 8 أسابيع على الأقل بسبب ضعف أو تقطع تعبير Pirt في الفئران الأصغر سنا. تم إنشاء الفئران Pirt-GCaMP3 C57BL / 6J في جامعة جونزهوبكنز 14. يمكن تصوير DRG على كلا الجانبين ، ويمكن تصوير DRGs القطنية الأخرى (على سبيل المثال ، أسفل الظهر 4). الأوقات المعطاة هي تقديرات لجراح متمرس. قد تؤدي المشكلات الفنية العرضية مثل زيادة النزيف إلى زيادة الوقت المطلوب.
- تحضير محلول ملحي معقم يحتوي على 40 ملغ/مل من الكيتامين و6 ملغ/مل من الزيلازين. يجب أن يكون الحجم الكلي 9 ميكرولتر / جم على الأقل من كتلة الجسم لكل من الجراحة والقتل الرحيم بعد التصوير.
تنبيه: الكيتامين ضار إذا تم حقنه أو ابتلاعه أو عند ملامسته للعين. تعامل معها بعناية. - تأكد من أن جميع الأدوات الجراحية نظيفة ومعقمة عن طريق التعقيم أو دليل المعاهد الوطنية للصحة الآخر لرعاية واستخدام طريقة معتمدة من المختبر.
- بين 15 و 25 دقيقة قبل الجراحة ، حقن فأر Pirt-GCaMP3 داخل الصفاق (i.p.) مع ~ 2.25 ميكرولتر من الكيتامين / زيلازين لكل غرام من وزن الجسم (90 ملغم / كغم من الكيتامين ، 13.5 ملغم / كغم من الزيلازين). يجب عدم تجاوز 120 ملغ/كغ من الكيتامين.
- في غضون 15 إلى 25 دقيقة بعد حقن التخدير (الخطوة 1.3) ، تحقق مما إذا كان الفأر قد وصل إلى المستوى الجراحي للتخدير عن طريق الضغط على المخلب الخلفي المقابل (وليس المخلب الخلفي المماثل / الأيمن). يضمن غياب منعكس انسحاب الأطراف الخلفية تحقيق مستوى جراحي للتخدير.
ملاحظة: يستخدم منعكس انسحاب الأطراف الخلفية طوال التجربة لمراقبة التخدير. دائما استخدام مخلب خلفي المقابل. - ضع الماوس على وسادة ساخنة للحفاظ على درجة حرارة الجسم عند 37 درجة مئوية.
ملاحظة: قد يكون من المفيد تثبيت رأس الماوس في مكانه بإطار مجسم (انظر جدول المواد) ، أو إطار آخر بناء على تفضيل الباحث. - حدد موقع تضخم أسفل الظهر عن طريق تحسس عظم حوض الفأر. احلق الجزء الخلفي من الماوس فوق منطقة تكبير أسفل الظهر. يجب أن تستغرق هذه الخطوة ~ 90 ثانية.
ملاحظة: يمكن إزالة الماوس لفترة وجيزة من الوسادة الساخنة للحلاقة. - قم بعمل شق مستطيل ثلاثي الجوانب (8 مم × 20 مم) فوق التوسيع القطني باستخدام المقص وقم بطي الجلد بعيدا بالملقط (الشكل 1 أ). تستغرق هذه الخطوة ~ 2 دقيقة.
ملاحظة: قد يستخدم الباحثون أيضا ملقط مرقئ أو مبعدة لإبقاء الشق مفتوحا. هذه ليست جراحة البقاء على قيد الحياة ، لذلك ليس من الضروري تنظيف إضافي للمنطقة الجراحية. ومع ذلك ، يمكن القيام بذلك باستخدام البوفيدون اليود. يتم إعطاء أكبر حجم شق مقبول هنا. يفضل الشق الأصغر على الشق الأكبر. - استخدم مقص تشريح الزنبرك 13 مم لعمل شقوق 3-4 مم على الجانب الأيمن من العمود الفقري. استخدم المقص لقطع الجلد والعضلات على الجانبين من أجل كشف العمود الفقري (الشكل 1 ب). تستغرق هذه الخطوة ~ 3 دقائق.
- استخدم مقص 8 مم لتنظيف العملية المستعرضة للجانب الأيمن L5 DRG عن طريق قطع العضلات والنسيج الضام أثناء محاولة تقليل النزيف. استخدم القطن و / أو الجلفوم لامتصاص الدم. الفقرة L5 هي أول فقرة منضدة لعظم الحوض.
ملاحظة: تستغرق هذه الخطوة ~ 3 دقائق وقد تستغرق وقتا إضافيا إذا كان الحيوان ينزف أكثر من المعتاد. - قم بقص العملية المستعرضة L5 اليمنى باستخدام Rongeurs Friedman-Pearson أو ملقط ناعم قوي. احرص على عدم لمس DRG (الشكل 1C).
ملاحظة: تستغرق هذه الخطوة ~ 2 دقيقة ولكنها قد تستغرق وقتا إضافيا إذا كان الحيوان ينزف أكثر من المعتاد. - لا تستمر حتى يتوقف النزيف تماما. منع النزيف على سطح DRG باستخدام رغوة الجل أو القطن. تستغرق هذه الخطوة 1-4 دقائق.
- حرك الماوس ووسادة التدفئة إلى المرحلة المخصصة (الشكل 2 أ ، ب). استخدم شريط المسرح لتثبيت الحيوان ووسادة التدفئة في مكانها. ضع أنف الحيوان في مخروط الأنف حتى يتمكن الحيوان من تلقي تخدير إيزوفلوران مستمر. قم بتأمين الجزء الخلفي الأيمن الذي يخرج من المسرح بحيث يمكن تطبيق المنبهات بسهولة على المخلب. تستغرق هذه الخطوة 3 دقائق.
- ثبت العمود الفقري في مكانه مع مشابك المرحلة على الجلد على الفقرات و / أو عظم الحوض فقط المنقار والذيلية إلى L5 DRG. اضبط المشابك والمرحلة لجعل سطح DRG مستويا قدر الإمكان (الشكل 2B ، C).
ملاحظة: قد يكون من الضروري تقليم الأنسجة الموجودة بين DRG والهدف. - ضع المرحلة أسفل المجهر بحيث يكون الهدف 8 مم فوق DRG مباشرة عند خفضه (الشكل 3A ، B). أدخل مقياس حرارة المستقيم.
ملاحظة: قد تختلف المسافة من DRG إلى الهدف بناء على الهدف والمجهر والحيوان. - قم بتوصيل خطوط الكهرباء بوسادة التدفئة ومقياس حرارة المستقيم. قم بتوصيل مخروط الأنف بخطوط غاز الأيزوفلوران.
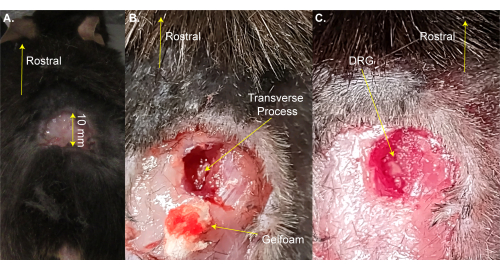
الشكل 1: مثال على جراحة التعرض ل DRG . (أ) حلقت مساحة صغيرة وقطع الجلد وطيه للخلف. الشق هو ~ 10 مم على المحور الذيلي المنقاري. (ب) تم إجراء شق في الجانب الأيمن من العمود الفقري وتم قطع العضلات والنسيج الضام ، مما أدى إلى كشف العملية المستعرضة للجانب الأيمن L5. تم امتصاص الدم مع الجلفوم. (ج) تم تنظيف العملية المستعرضة وإزالة العظم الموجود فوق DRG. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
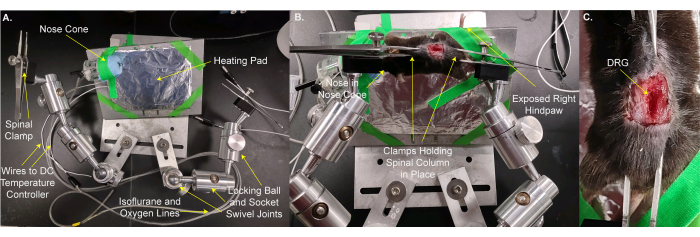
الشكل 2: تركيب الماوس على مرحلة مخصصة لتصوير DRG . (أ) المرحلة المخصصة موضحة. يتكون من لوحة قاعدة ولوحة للحيوان. لوحة تركيب الحيوانات على كرة قفل ومفصل دوار مقبس. يتم لصق مخروط الأنف مع خطوط لتوصيل خليط الأكسجين / الأيزوفلوران وخط غاز النفايات جنبا إلى جنب مع وسادة تسخين ملفوفة بورق الألمنيوم على لوحة تركيب الحيوانات. يتم تثبيت ذراعين ، كل منهما مصنوع من ثلاثة وصلات دوارة كروية ومقبس ، بلوحة القاعدة. يحتوي كل ذراع على مشبك مصنوع من ملقط مع برغي للتشديد والتخفيف. ب: الحيوان مركب على صفيحة تركيب الحيوان. يتم وضع أنفه في مخروط الأنف. يتم وضع المشابك على الجلد الذي يحمل العمود الفقري وعظم الحوض. يتم لصق الجزء الخلفي الأيمن (المماثل) للالتصاق لسهولة الوصول إليه لتطبيق المحفزات. ج: صورة مقربة للعمود الفقري المشدود وعظم الحوض. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: يتم وضع الحيوان على مرحلة مخصصة أسفل هدف المجهر. أ: عرض واسع الزاوية للمرحلة والحيوان والمجهر. تظهر الأسلاك إلى وحدة التحكم في درجة الحرارة DC وخطوط تناول الأكسجين / الأيزوفلوران وخط غاز النفايات على اليسار. (ب) منظر عن قرب للحيوان أسفل هدف المجهر. DRG ~ 8 مم تحت الهدف. يتم إدخال مقياس حرارة المستقيم والأنف داخل مخروط الأنف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تصوير DRG
- استخدم مجهرا متحد البؤر قائما 10x / 0.4 هدف DIC والبرامج المرتبطة به (انظر جدول المواد) للتصوير. استخدم إعدادات المرشح الأخضر (FITC): الإثارة 495 نانومتر ، الانبعاث 519 نانومتر ، الطول الموجي للكشف 500-580 نانومتر ، جهاز التصوير GaAsP-Pmt1 ، كاشف GaAsP-PMT.
ملاحظة: بالنسبة للمجاهر الأخرى ، استخدم الإعدادات الموصى بها من قبل الشركة المصنعة. - العثور على سطح DRG مع المجهر. اضبط المشابك الموجودة على المسرح بحيث يكون سطح DRG مستويا قدر الإمكان ويتم تصور الحد الأقصى لمساحة السطح في المستوى البؤري.
ملاحظة: قد يختلف اختيار الهدف حسب المجهر المستخدم وتفضيلات المستخدم. يعتمد اختيار البرنامج على المجهر. ينتج عن مستوى DRG صور أكثر وضوحا ، ويسمح للبرنامج ببناء أفلام أكثر وضوحا ، ويسمح بتصوير المزيد من الخلايا العصبية ، ويجعل التحليل أسهل وأكثر دقة. - قم بتزويد 1٪ -1.5٪ إيزوفلوران في تدفق الأكسجين إلى مخروط الأنف لضمان بقاء الفأر مخدرا. مراقبة الحيوان بعناية طوال العملية للحفاظ على التخدير isoflurane دون جرعة زائدة.
ملاحظة: قد تختلف كمية الأيزوفلوران اللازمة للحفاظ على التخدير حسب الحيوان الفردي والحافز. عادة ، 1.5 ٪ كافية. إذا تحرك الحيوان أثناء التحفيز ، فيجب زيادة الأيزوفلوران. إذا أصبح التنفس ضحلا ، فيجب تقليل الأيزوفلوران. قبل كل حافز ، اختبر منعكس سحب الطرف الخلفي على مخلب الخلف المقابل.
تنبيه: يمكن أن يكون الإيزوفلوران ضارا أو يسبب الدوخة أو النعاس إذا تم استنشاقه. تجنب الاستنشاق واستخدمه فقط في منطقة جيدة التهوية. - قم بتحميل بروتوكول المسح السريع للمجهر.
- استخدم الإعدادات النموذجية للمسح السريع: حجم فوكسل 2.496 ميكرومتر × 2.496 ميكرومتر × 16 ميكرومتر ، 512 × 512 بكسل ، 10 شرائح بصرية Z-stack ، 1 وحدة تهوية (AU) / 32 ميكرومتر ، 1٪ 488 نانومتر قوة الليزر 5 ميغاواط ، وقت البكسل 1.52 ميكروثانية ، وقت الخط 0.91 مللي ثانية ، وقت الإطار 465 مللي ثانية ، سرعة مسح LSM 8 ، مسح ثنائي الاتجاه ، كاشف GaAsP-PMT كسب 650 فولت ، كسب رقمي 1. قد تختلف الإعدادات المثلى حسب المجهر والحيوان.
- لإعداد بروتوكول المسح السريع ، انقر فوق علامة التبويب اكتساب . ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب الإطارات . انقر فوق الإعدادات المسبقة > 512 × 512 لضبط المجهر لتسجيل صورة 512 بكسل × 512 بكسل. سيؤدي هذا بدوره إلى تعيين قيم X و Y لحجم voxel بناء على حجم الصورة ، والذي يتم تحديده بواسطة برنامج المجهر.
- ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب القنوات . انقر فوق مربع Track2 . استخدم القائمة المنسدلة بجانب مربع Track2 لتحديد Green (FITC). سيتم فتح علامة تبويب جديدة أسفل المسار 2.
- بجانب الليزر ، انقر فوق المربع 488 . سيؤدي ذلك إلى ضبط الأطوال الموجية للإثارة والانبعاث.
- بجانب شريط التمرير 488 نانومتر ، اضبط طاقة الليزر على 1٪. انقر فوق الزر 1 AU لتعيين aperature لوحدة Airy واحدة. ضمن FITC ، اضبط الكسب الرئيسي على 650 فولت ، والإزاحة الرقمية على 0 ، والكسب الرقمي على 1.
- ضمن علامة التبويب الاستحواذ ، حدد مربع Z-Stack . انقر فوق الزر Live لعرض صورة حية للعصابة. أدر مقبض المستوى البؤري لأعلى حتى يظهر قوس صغير فقط من الخلايا العصبية.
- ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب Z-Stack > الزر تعيين الأخير . اقلب مقبض المستوى البؤري لأسفل حتى يظهر قوس صغير فقط من الخلايا العصبية. ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب Z-Stack > الزر تعيين أولا . انقر فوق الزر Live لإيقاف تشغيل الصورة الحية.
- ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب Z-Stack . املأ حقل الشرائح ب 10. سيؤدي هذا إلى تعيين 10 شرائح بصرية وتحديد عمق الفوكسل تلقائيا.
- ضمن علامة التبويب "الاستحواذ" ، انقر فوق مربع السلاسل الزمنية . ستظهر علامة تبويب سلسلة زمنية جديدة ضمن معلمات الاستحواذ. انقر فوق علامة التبويب السلاسل الزمنية > حقل الدورات مع عدد الدورات التي ترغب في أخذها بعد ذلك. في هذه الحالة ، هو 8.
- اضبط سرعة المسح الضوئي واتجاهه. ضمن معلمات الاكتساب، علامة التبويب وضع الاكتساب > > الاتجاه > سهم مزدوج الرأس للمسح الضوئي الاتجاهي. حدد علامة التبويب وضع الاستحواذ > الإطار > شريط تمرير سرعة المسح الضوئي > 8.
ملاحظة: عادة ما يمكن للمرء تحميل إعدادات تجربة سابقة ويتعين عليه فقط ضبط طاقة الليزر إذا كانت الصورة ساطعة جدا أو خافتة وضبط Z-Stack Set Last and Set First.
- قم بإجراء مسح قصير لمدة 8 دورات ل DRG بالنقر فوق بدء التجربة ضمن علامة التبويب الاستحواذ . قم بإنشاء فيلم عن طريق إجراء إسقاط متعامد للمسح الضوئي (مسح ضوئي واحد لكل إطار) بمرور الوقت وتحقق يدويا من وضوح الصورة وعناصر التصوير مثل "موجات" السطوع التي تعبر DRG. اضبط موضع المشبك وسمك المقطع البصري وكرر هذه الخطوة حتى يتم تحقيق فيلم واضح وعالي الجودة.
ملاحظة: يجب تكرار هذه الخطوة إذا تحرك الحيوان أو تم تحريكه من قبل المحقق. تشمل المشاكل التي يجب البحث عنها مناطق من العقدة (وليس فقط الخلايا العصبية المفردة) التي تبدو أفتح وأكثر قتامة على مدار التجربة مما يخلق مظهرا متموجا أو يتسبب في اختفاء المناطق أو تصبح أكثر إشراقا. الحركة أكبر من حوالي نصف قطر الخلية العصبية الصغيرة (<20 ميكرومتر) هي مشكلة رئيسية أخرى. غالبا ما يمكن إصلاح التموج عن طريق تقريب الموضع الأول والأخير من Z-Stack من بعضهما البعض (انظر الخطوة 2.4.4 أعلاه) وتضييق سمك الشريحة البصرية. يقدم الفيلم 1 مثالا على العقد المتموجة قبل التسوية وتحديد سمك الشريحة البصرية الصحيح. الفيلم 2 بعد تصحيح التسوية وسمك الشريحة البصرية. الفرق دقيق ، لكن له تأثير هائل على التحليل. - قم بتحميل بروتوكول المسح الضوئي عالي الدقة للمجهر.
- استخدم الإعدادات النموذجية للمسح الضوئي عالي الدقة: حجم فوكسل 1.248 ميكرومتر × 1.248 ميكرومتر × 14 ميكرومتر ، 1024 × 1024 بكسل ، 6 شرائح بصرية Z-stack ، وحدة تهوية 1.2 (AU) / 39 ميكرومتر ، 5٪ 488 نانومتر طاقة ليزر / 25 ميجاوات ، وقت البكسل 2.06 ميكروثانية ، وقت الخط 4.95 مللي ثانية ، وقت الإطار 5.06 ثانية ، سرعة مسح LSM 6 ، مسح ثنائي الاتجاه ، كاشف GaAsP-PMT كسب 650 فولت ، كسب رقمي 1. قد تختلف الإعدادات المثلى حسب المجهر والحيوان.
- لإعداد بروتوكول مسح عالي الدقة ، انقر فوق علامة التبويب اكتساب . ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب الإطارات . انقر فوق الإعدادات المسبقة > 1024 × 1024 لضبط المجهر لتسجيل صورة 1024 بكسل × 1024 بكسل. سيؤدي هذا بدوره إلى تعيين قيم X و Y لحجم voxel بناء على حجم الصورة ، والذي يتم تحديده بواسطة برنامج المجهر.
- ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب القنوات . انقر فوق مربع Track2 . استخدم القائمة المنسدلة بجانب مربع Track2 لتحديد Green (FITC). سيتم فتح علامة تبويب جديدة أسفل المسار 2.
- بجانب الليزر ، انقر فوق المربع 488 . سيؤدي ذلك إلى ضبط الأطوال الموجية للإثارة والانبعاث. انقر فوق مربع نطاق الليزر عالي الكثافة .
- بجانب شريط التمرير 488 نانومتر ، اضبط طاقة الليزر على 5٪. انقر فوق الزر 1 AU لتعيين aperature لوحدة Airy واحدة. تحت FITC تعيين الكسب الرئيسي إلى 650 فولت ، الإزاحة الرقمية إلى 0 ، والكسب الرقمي إلى 1.
- ضمن علامة التبويب الاستحواذ ، حدد مربع Z-Stack . انقر فوق الزر Live لعرض صورة حية للعصابة. أدر مقبض المستوى البؤري لأعلى حتى يظهر قوس صغير فقط من الخلايا العصبية.
- ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب Z-Stack > الزر تعيين الأخير . اقلب مقبض المستوى البؤري لأسفل حتى يظهر قوس صغير فقط من الخلايا العصبية. ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب Z-Stack > الزر تعيين أولا . انقر فوق الزر Live لإيقاف تشغيل الصورة الحية.
- ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب Z-Stack . املأ حقل الشرائح ب 6. سيؤدي ذلك إلى تعيين 6 شرائح بصرية وتحديد عمق الفوكسل تلقائيا.
- ضمن علامة التبويب الاكتساب ، تأكد من إلغاء تحديد المربع سلسلة زمنية (بدون سلاسل زمنية).
- اضبط سرعة المسح الضوئي واتجاهه. ضمن معلمات الاستحواذ ، انقر فوق علامة التبويب وضع الاستحواذ > إعدادات > المسبقة للإطار > 1024 × 1024. حدد علامة التبويب وضع الاكتساب > اتجاه > الإطار > سهم مزدوج الرأس للمسح الضوئي ثنائي الاتجاه. حدد علامة التبويب وضع الاستحواذ > شريط تمرير سرعة المسح الضوئي > الإطار > 6.
- إذا تم تمييز الخلايا ب td-tomato ، فاضبط المجهر لمسح القناة الحمراء 592 نانومتر / انبعاث 614 نانومتر ، وطول موجة الكشف 600-700 نانومتر بالإضافة إلى القناة الخضراء. اضبط هذا بالانتقال إلى معلمات الاستحواذ وانقر فوق علامة التبويب القنوات > مربع Track1 . استخدم القائمة المنسدلة بجانب مربع Track1 لتحديد الأحمر (أحمر تكساس). اتبع نفس العملية كما في الخطوة 2.6.3 ، باستثناء النقر فوق المربع 561 بدلا من المربع 488 . اضبط طاقة الليزر على 1٪. Td-Tomato أكثر إشراقا من GCaMP3 ويتطلب طاقة ليزر أقل.
- قم بعمل صورة عالية الدقة ل DRG بالنقر فوق الزر "بدء التجربة " ضمن علامة التبويب "الاستحواذ ".
- قم بتحميل بروتوكول المسح السريع للمجهر (انظر الخطوة 2.4). سجل النشاط التلقائي في DRG لمدة 80 دورة (حوالي 10 دقائق). قم بإنشاء فيلم إسقاط متعامد وتحقق من أن الصورة ذات جودة كافية للتحليل.
ملاحظة: اعتبارات الجودة هي نفسها كما في الخطوة 2.5. - لتطبيق المنبهات ، اضبط المجهر لإجراء 15-20 عملية مسح. انتظر حتى تكتمل عمليات الفحص من 1 إلى 5 لإنتاج خط الأساس. تطبيق التحفيز أثناء المسح 6-10. انتظر 5 دقائق على الأقل بعد كل حافز قبل تطبيق التحفيز التالي لمنع إزالة الحساسية.
ملاحظة: يجب تطبيق المحفزات الميكانيكية أولا ، ثم المحفزات الباردة والحرارية والكيميائية. يجب تطبيق المحفزات الأضعف (على سبيل المثال ، القوة الميكانيكية المنخفضة ، ودرجات الحرارة الأقرب إلى درجة حرارة الغرفة) قبل المحفزات الأقوى (على سبيل المثال ، قوة ميكانيكية أعلى ، درجات حرارة أبعد عن درجة حرارة الغرفة). عند تطبيق المنبهات ، تأكد من عدم التسبب في أي حركة ل DRG. بالنسبة للمنبهات الحرارية القوية على وجه الخصوص ، غالبا ما يكون من الضروري تطبيق 2٪ إيزوفلوران لمدة 1-2 دقيقة قبل بدء التحفيز. على المجهر المستخدم في هذه الدراسة ، يمكن سماع كل مسح بوضوح ، بحيث يمكن للباحث بسهولة تحديد نهاية الفحص ، مما يسمح بتطبيق التحفيز مباشرة بعد المسح 5. ومع ذلك ، فإن أي طريقة تسهل تطبيق المنبهات في نقطة زمنية ثابتة ستعمل. - للضغط الميكانيكي ، أمسك قرصة algometer بمخلب بين المجاذيف دون لمس المخلب ، واضغط مباشرة بعد نهاية الفحص 5 وتوقف فورا بعد الفحص 10. راقب القوة الصحفية باستخدام مقياس ألجومتر (انظر جدول المواد). حافظ على قوة الضغط قريبة من القوة المطلوبة (هنا نستخدم محفز ضغط 100 جم) قدر الإمكان وتأكد من أنها لا تتجاوز 10 جم فوق القوة المطلوبة.
ملاحظة: يمكن للمرء اكتشاف المنبهات بأقل من 0.07 جم من خيوط فون فراي وما يصل إلى 600 جم من قوة الضغط. - بالنسبة للمحفزات الباردة والحرارية ، قم بتبريد أو تسخين كوب من الماء إلى أقل بقليل (للبرد) أو أعلى (للحرارة) من درجة الحرارة المطلوبة وابدأ المسح. هنا ، استخدم محفزا 45 درجة مئوية. عندما يكون الماء هو درجة الحرارة الصحيحة ، قم بتطبيق التحفيز مباشرة بعد المسح 5 عن طريق غمر المخلب في الماء. اسحب الدورق بعيدا فورا بعد الفحص 10.
ملاحظة: يجب أن تكون درجة الحرارة في حدود 1 درجة مئوية من درجة الحرارة المطلوبة في المسح الضوئي 5. إذا كانت درجة حرارة الكأس الزجاجية غير صحيحة، فلا تضع المثير لأن ذلك قد يزيل حساسية الخلايا العصبية. بدلا من ذلك ، أعد تبريد الماء أو أعد تسخينه وحاول مرة أخرى. لقد قمنا بقياس درجات حرارة منخفضة تصل إلى 0 درجة مئوية (الماء المثلج) وتصل إلى 95 درجة مئوية. ومع ذلك ، تذكر أن درجات الحرارة فوق 50 درجة مئوية قد تلحق الضرر بالأنسجة وتربك التجارب اللاحقة. وبالمثل ، فإن بعض المواد الكيميائية (مثل السموم الرباعية ، كبخاخات) لا رجعة فيها أو لا يمكن غسلها ويمكن أن تمنع إجراء المزيد من التجارب على الحيوان. - بعد تطبيق جميع المحفزات وتسجيلها ، القتل الرحيم للحيوان عن طريق تناول جرعة زائدة من الكيتامين / الزيلازين (200 مجم / كجم من الكيتامين ، 30 مجم / كجم من الزيلازين ، أو 5 ميكرولتر لكل جرام من كتلة الجسم من المحلول المحضر في الخطوة 1.1) متبوعا بقطع الرأس.
3. تحليل البيانات
- افتح ملفات الصور عن طريق السحب والإفلات في ImageJ. بعد فتح الملف ، حدد نوع الصورة ضمن نوع > الصورة > لون RGB.
ملاحظة: المكون الإضافي StackReg21 ضمن Plugins > StackReg مفيد لتصحيح ومحاذاة عناصر الحركة. يمكن ل ImageJ قراءة معظم تنسيقات ملفات برامج المجهر. يعتمد اختيار نوع الصورة على تفضيل المستخدم. يبسط RGB إنتاج الصور الملونة للنشر. قد تساعد حزم البرامج من الشركة المصنعة للمجهر أو cytoNet22 في التحليل أيضا. ليس من الضروري تنزيل StackReg وتثبيته واستخدامه ، ولكن يوصى به. - استخدم أداة منطقة الاهتمام (ROI) لتحديد الخلايا العصبية النشطة ضمن أداة تحليل > > مدير عائد الاستثمار. ارسم عائد استثمار باستخدام أدوات القطع الناقص أو المستطيل على شريط الأدوات وضعها في ملف عائد الاستثمار بالضغط على الزر " إضافة " ضمن إضافة في نافذة مدير عائد الاستثمار ، أو بالضغط على المفتاح "t".
ملاحظة: تأكد من حفظ ملف ROI بشكل متكرر. يمكن للمستخدمين دائما استعادة عائد الاستثمار عن طريق سحب ملف عائد الاستثمار وإفلاته في ImageJ والنقر فوق مربع إظهار الكل في أسفل نافذة مدير عائد الاستثمار. لا ينصح بالحفظ كتراكب. من التجربة ، يؤدي الحفظ كملف ROI.zip إلى تبسيط التحليل. - ضمن تحليل > تعيين القياسات ، تأكد من تحديد خيار متوسط القيمة الرمادية ؛ قم بإلغاء تحديد جميع المربعات الأخرى ضمن تعيين القياسات. استخدم أداة القياس المتعدد في قائمة مدير عائد الاستثمار لحساب الكثافة داخل عائد الاستثمار. قم بقياس الكثافة باستخدام نافذة عائد الاستثمار ضمن المزيد من > القياس المتعدد.
ملاحظة: في بعض الأحيان تكون الخلايا العصبية المتجاورة قريبة جدا من بعضها البعض لرسم عائد استثمار منفصل. لا يمكن استخدام هذه الخلايا العصبية لقياس شدة عابرة ، ولكن يمكن تضمينها في عدد الخلايا العصبية المنشطة. - احفظ ملف CSV الذي تم إنشاؤه بواسطة Multimeasure وافتح ملف CSV باستخدام أي برنامج جدول بيانات.
ملاحظة: راجع الملف التكميلي 1 للحصول على مثال لنموذج جدول البيانات للمساعدة في التحليل. - احسب كثافة عابرة Ca 2+ ك ΔF / F 0 = (F t- F 0) / F 0 ، حيث Ft هي كثافة البكسل في عائد الاستثمار في نقطة الاهتمام الزمنية ، و F 0 هي شدة خط الأساس المحددة بحساب متوسط شدة أي من الإطارات 2-4 قبل Ca 2+ العابر للنشاط التلقائي أو أول 1-5 إطارات من عائد الاستثمار ل Ca 2+ عابرة تحدث أثناء التحفيز. استبعد أي خلايا عصبية تنتج قمم Ca2+ قبل التحفيز ولا تحلل النشاط بعد انتهاء التحفيز.
- بالنسبة لتحليل الكثافة العابرةCa 2+ ، قم بأخذ عينات عشوائية من أعداد متساوية تقريبا من الخلايا العصبية من كل عقدة لتجنب انحراف البيانات نحو العقد التي أنتجت أكبر عدد من الخلايا العصبية المستجيبة. استبعاد القمم حيث ΔF / F 0 <0.15 .
ملاحظة: هناك طرق بديلة منشورة لتحليل وإدراج / استبعاد الخلايا العصبية11،12،23،24،25،26،27،28. - قياس أقطار الخلايا العصبية باستخدام أداة الخط على شريط الأدوات في ImageJ. احسب متوسط القطر من الخطوط المرسومة على طول أطول وأقصر.
Access restricted. Please log in or start a trial to view this content.
النتائج
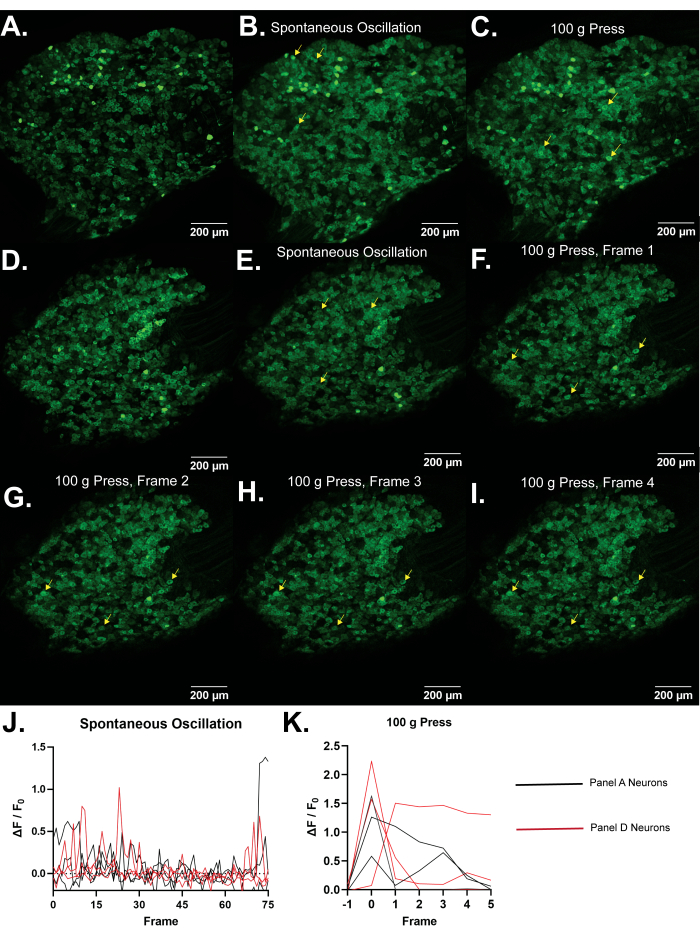
الشكل 4: صور تمثيلية للعقد الجذرية الظهرية L5 لفئران Pirt-GCaMP3. (أ ، د) يتم عرض عمليات مسح عالية الدقة أحادية الإطار لعقد الجذر الظهرية L5 لفئران Pirt-GCaMP3. (ب، ه) . متوسط إسقاطات...
Access restricted. Please log in or start a trial to view this content.
Discussion
الألم المستمر موجود في مجموعة واسعة من الاضطرابات ، مما يضعف و / أو يقلل من نوعية الحياة لحوالي 8٪ من الناس29. تكتشف الخلايا العصبية الحسية الأولية المنبهات الضارة على الجلد ، وتساهم اللدونة في الألم المستمر8. في حين يمكن دراسة الخلايا العصبية في زراعة الخلايا والن?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن أصحاب البلاغ عدم وجود مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة المنح R01DE026677 و R01DE031477 (إلى Y.S.K.) ، وصندوق بدء التشغيل UTHSCSA (Y.S.K.) ، وجائزة Rising STAR من نظام جامعة تكساس (Y.S.K.).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
References
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233(2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083(2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651(2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990(2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846(2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450(2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225(2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810(2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351(2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved