このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
インビボ 無傷の背根神経節における一次感覚ニューロンのネットワークにおけるニューロンアンサンブルのカルシウムイメージング
要約
このプロトコルは、後根神経節(DRG)の外科的曝露とそれに続くGCaMP3(遺伝的にコードされたCa2+ インジケーター;緑色蛍光タンパク質-カルモジュリン-M13タンパク質 3)Pirt-GCaMP3マウスを用いて、同側後肢に様々な刺激を加えながら神経細胞集合体をCa2+ イメージングした。
要約
Ca2+イメージングは、活動電位および細胞質へのCa2+侵入または細胞内Ca2+貯蔵の放出を含む様々なシグナル伝達機構を含む細胞活動の代理として使用することができる。マウスの背根神経節(DRG)の一次感覚ニューロンのPirt-GCaMP3ベースのCa2+イメージングは、多数の細胞を同時に測定できるという利点を提供します。最大1,800個のニューロンをモニターできるため、ニューロンネットワークと体性感覚プロセスを、in vivoの集団レベルで通常の生理学的状況でアンサンブルとして研究できます。監視されるニューロンの数が多いため、他の方法では検出が困難な活動パターンを検出できます。刺激をマウスの後足に適用することができ、DRGニューロンアンサンブルに対する刺激の直接的な影響を研究することができます。Ca2+トランジェントを生成するニューロンの数とCa2+トランジェントの振幅は、特定の感覚様式に対する感受性を示しています。ニューロンの直径は、活性線維の種類(非侵害性メカノ線維と有害な疼痛線維、Aβ、Aδ、およびC線維)の証拠を提供します。特定の受容体を発現するニューロンは、Pirt-GCaMPと一緒にtd-Tomatoおよび特定のCreリコンビナーゼで遺伝的に標識することができます。したがって、DRGのPirt-GCaMP3 Ca2+イメージングは、痛み、かゆみ、触覚、およびその他の体性感覚信号を研究するための集団レベルでアンサンブルとして機能する特定の感覚モダリティおよびニューロンサブタイプの分析のための強力なツールとモデルを提供します。
概要
一次感覚ニューロンは皮膚を直接神経支配し、体性感覚情報を中枢神経系に運び戻します1,2。背根神経節(DRG)は、10,000〜15,000個の一次感覚ニューロンの細胞体クラスターです3,4。DRGニューロンは、多様なサイズ、髄鞘形成レベル、および遺伝子および受容体発現パターンを提示します。より小さい直径のニューロンは、疼痛感知ニューロンを含み、より大きな直径のニューロンは、典型的には、非疼痛の機械的刺激に応答する5、6。傷害、慢性炎症、末梢神経障害などの一次感覚ニューロンの障害は、これらのニューロンをさまざまな刺激に感作し、慢性疼痛、異痛症、および疼痛過敏症に寄与する可能性があります7,8。したがって、DRGニューロンの研究は、一般的な体性感覚と多くの痛みやかゆみの障害の両方を理解する上で重要です。
生体内で発火するニューロンは体性感覚に不可欠であるが、最近まで、生体内で無傷の神経節を研究するためのツールは比較的少数の細胞に限られていた9。ここでは、生体内の集団レベルでニューロンの活動電位または活動をアンサンブルとして研究するための強力な方法について説明します。この方法は、細胞質Ca2+ダイナミクスに基づくイメージングを採用しています。Ca2+高感度蛍光指示薬は、通常は低濃度の細胞質Ca2+のため、細胞活性を測定するための優れたプロキシです。これらの指標は、マウス9、10、11、12、13、14、15、16およびラット17における数百〜数千の一次感覚ニューロンの同時モニタリングを可能にした。この研究に記載されているin vivo Ca2+イメージングの方法は、機械的、低温、熱的、および化学的刺激に対する集団レベルの応答を直接観察するために使用できます。
ホスホイノシチド結合膜タンパク質であるPirtは、ほぼすべての(>95%)一次感覚ニューロン18,19で高レベルで発現しており、Ca2+センサーGCaMP3の発現を駆動して、in vivoでニューロンの活動をモニターするために使用できます20。このプロトコールでは、共焦点レーザー走査顕微鏡(LSM)を用いて、インビボDRG手術、Ca2+画像化、およびPirt−GCaMP3マウス14の右側腰椎5(L5)DRGにおける分析を行うための技術が記載されている。
プロトコル
ここに記載されているすべての手順は、サンアントニオのテキサス大学健康科学センターの施設動物管理および使用委員会によって承認されたプロトコルに従って実行されました。
注意: 開始したら、動物の手術(ステップ1)とイメージング(ステップ2)を継続的に完了する必要があります。データ解析(ステップ3)は、後で行ってもよい。
1.手術と右側のL5 DRGイメージングのための動物の固定
注:この研究では、8週齢以上の男性と女性の両方のPirt-GCaMP3 C57BL / 6Jマウスが使用されました。どちらの性別も同じようにうまく画像化できますが、若いマウスではピルト発現が弱いか断続的であるため、マウスは少なくとも8週齢である必要があります。Pirt-GCaMP3 C57BL/6Jマウスは、ジョンズ・ホプキンス大学で作製された14。両側のDRGを画像化してもよく、他の腰椎DRG(例えば、腰椎4)を画像化してもよい。与えられた時間は経験豊富な外科医の推定値です。出血の増加などの時折の技術的な問題により、必要な時間が長くなる可能性があります。
- 40 mg / mLのケタミンと6 mg / mLのキシラジンを含む滅菌生理食塩水を調製します。総量は、画像撮影後の手術と安楽死の両方で少なくとも9μL / gの体重である必要があります。
注意: ケタミンは、注射、飲み込んだり、目に入ったりすると有害です。取り扱いには注意してください。 - すべての手術器具が清潔で、オートクレーブまたはその他の実験動物の世話と使用のためのNIHガイドによって滅菌されていることを確認してください承認された方法。
- 手術の15〜25分前に、Pirt-GCaMP3マウスを腹腔内(i.p.)に体重1グラムあたり~2.25 μLのケタミン/キシラジン(90 mg / kgケタミン、13.5 mg / kgキシラジン)を注射します。120 mg / kgケタミンを超えないようにしてください。.
- 麻酔注射後15〜25分以内に(ステップ1.3)、マウスが反対側の後足(同側/右後足ではない)をつまんで麻酔の手術面に到達したかどうかを確認します。後肢離脱反射がないことは、麻酔の外科的平面が達成されることを確実にする。
注:後肢離脱反射は、麻酔を監視するために実験全体を通して使用されます。常に反対側の後足を使用してください。 - 加熱パッドの上にマウスを置き、体温を37°Cに維持します。
注意: 脳定位固定装置フレーム( 材料の表を参照)、または研究者の好みに基づく別のフレームを使用してマウスの頭を所定の位置に保持すると便利な場合があります。 - マウスの骨盤の骨を感じることによって腰椎の肥大を見つけます。腰椎拡大領域の上でマウスの背面を剃ります。この手順には ~90 秒かかります。
注意: マウスは、シェービングのために加熱パッドから簡単に取り外すことができます。 - はさみを使用して腰椎拡大の上に3面の長方形の切開(8 mm x 20 mm)を行い、鉗子で皮膚を折り返します(図1A)。このステップには~2分かかります。
注:研究者は、止血鉗子または開創器を使用して切開部を開いたままにすることもできます。これは生存手術ではないので、手術領域の追加洗浄は必要ありません。ただし、ポビドンヨードを使用して行ってもよい。最大許容切開サイズはここに示されています。大きい切開よりも小さい切開が好ましい。 - 13mmのスプリング解剖ハサミを使用して、脊椎の右側に3〜4mmの切開を行います。はさみを使用して、背骨を露出させるために皮膚と筋肉を側面に切り戻します(図1B)。このステップには~3分かかります。
- 出血を最小限に抑えながら、筋肉と結合組織を切り取って、8mmのはさみを使用して右側のL5DRGの横突起をきれいにします。綿および/またはゲルフォームを使用して血液を吸収します。L5椎骨は、骨盤骨への最初の椎骨吻側です。
注:この手順には~3分かかり、動物が通常よりも出血した場合は余分な時間がかかる場合があります。 - フリードマン・ピアソンのロンジャーまたは強力な細かい鉗子を使用して、右側のL5横突起を切り開きます。DRGに触れないように注意してください(図1C)。
注:このステップには~2分かかりますが、動物が通常よりも出血した場合は余分な時間がかかる場合があります。 - 出血が完全に止まるまで先に進まないでください。ゲルフォームまたは綿を使用してDRG表面への出血を防ぎます。このステップステップには1〜4分かかります。
- マウスと加熱パッドをカスタムステージに移動します(図2A、B)。ステージテープを使用して、動物と加熱パッドを所定の位置に固定します。動物が継続的なイソフルラン麻酔を受けることができるように、動物の鼻をノーズコーンに入れます。ステージから突き出た右後足を固定し、足に刺激を与えやすいようにします。この手順には 3 分かかります。
- 椎骨および/またはL5 DRGの吻側および尾側の骨盤骨の皮膚にステージクランプで脊椎を所定の位置に固定します。クランプとステージを調整して、DRGの表面をできるだけ水平にします(図2B、C)。
注意: DRGと対物レンズの間にある組織をトリミングする必要がある場合があります。 - ステージを顕微鏡の下に置き、対物レンズを下げたときにDRGの真上に8 mmになるようにします(図3A、B)。直腸体温計を挿入します。
注意: DRGから対物レンズまでの距離は、対物レンズ、顕微鏡、および動物によって異なる場合があります。 - 電力線を加熱パッドと直腸温度計に接続します。ノーズコーンをイソフルランガスラインに接続します。
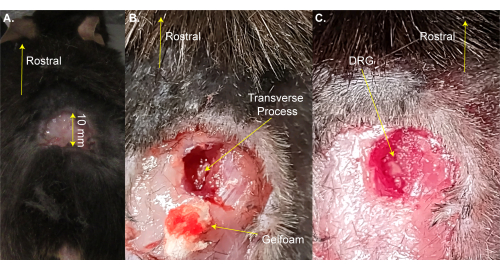
図1:DRG曝露手術の例 。 (A)小さな領域を剃り、皮膚を切り取って折り返しました。切開部は吻側尾軸上で~10mmである。(B)脊柱の右側を切開し、筋肉と結合組織を切り取り、L5右側の横突起を露出させた。血液はゲルフォームで吸収された。(C)横断突起を洗浄し、DRG上の骨を除去した。 この図の拡大版を表示するには、ここをクリックしてください。
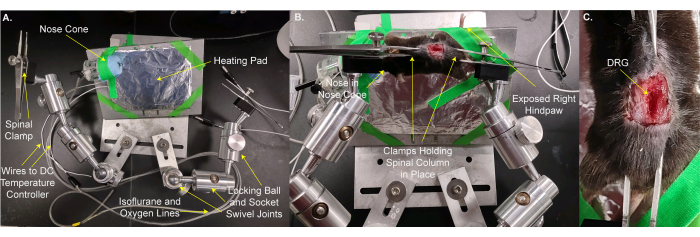
図2:DRGイメージング用のカスタムステージへのマウスのマウント 。 (A) カスタムステージが表示されます。それはベースプレートと動物用のプレートで構成されています。動物取り付けプレートは、ロッキングボールとソケットのスイベルジョイントにあります。酸素/イソフルラン混合物を送達するためのラインを有するノーズコーンおよび廃ガスラインを、アルミニウム箔で包まれた加熱パッドと共に、動物取り付けプレートにテープで留める。それぞれ3つのロッキングボールとソケットスイベルジョイントで作られた2つのアームがベースプレートにボルトで固定されています。各アームには、締め付けたり緩めたりするためのネジ付きの鉗子で作られたクランプがあります。(B)動物を動物取り付けプレートに取り付ける。その鼻はノーズコーンに配置されます。クランプは、脊柱と骨盤骨を保持している皮膚の上に配置されます。右(同側)の後足は、刺激を加えるために簡単にアクセスできるように突き出るようにテープで留められています。(C)固定された脊柱と骨盤骨のクローズアップ画像。 この図の拡大版を表示するには、ここをクリックしてください。

図3:カスタムステージ上の動物は、顕微鏡対物レンズの下に配置されます 。 (A)ステージ、動物、顕微鏡の広角図。DC温度コントローラーへのワイヤーと、酸素/イソフルラン吸気および廃ガスラインへのラインが左側に表示されます。(B)顕微鏡対物レンズの下の動物のクローズアップビュー。DRGは対物レンズより~8mm下にあります。直腸体温計が挿入され、鼻はノーズコーンの内側にあります。 この図の拡大版を表示するには、ここをクリックしてください。
2. DRGイメージング
- 正立共焦点顕微鏡10x/0.4 DIC対物レンズと関連ソフトウェア( 材料表を参照)を使用してイメージングします。グリーンフィルター(FITC)設定を使用します:励起495 nm、発光519 nm、検出波長500-580 nm、GaAsP-Pmt1イメージングデバイス、GaAsP-PMT検出器。
注意: その他の顕微鏡の場合は、メーカー推奨設定を使用してください。 - 顕微鏡でDRGの表面を見つけます。ステージ上のクランプを調整して、DRGサーフェスが可能な限り水平になり、焦点面で最大表面積が視覚化されるようにします。
注:対物レンズの選択は、使用する顕微鏡とユーザーの好みによって異なる場合があります。ソフトウェアの選択は顕微鏡によって異なります。レベルDRGは、より鮮明な画像をもたらし、ソフトウェアがより鮮明なムービーを構築できるようにし、より多くのニューロンのイメージングを可能にし、分析をより簡単かつ正確にします。 - 酸素流中の1%〜1.5%イソフルランをノーズコーンに供給して、マウスが麻酔されたままになるようにします。過剰摂取することなくイソフルラン麻酔を維持するために、手順全体を通して動物を注意深く監視します。.
注:麻酔を維持するために必要なイソフルランの量は、個々の動物や刺激によって異なる場合があります。.通常は1.5%で十分です。動物が刺激中に動く場合は、イソフルランを増やす必要があります。呼吸が浅くなった場合は、イソフルランを減らす必要があります。各刺激の前に、反対側の後肢で後肢の撤退反射をテストします。
注意:イソフルランは、吸入すると有害であるか、めまいや眠気を引き起こす可能性があります。.吸入を避け、換気の良い場所でのみ使用してください。 - 顕微鏡ラピッドスキャンプロトコルをロードします。
- 高速スキャンには、ボクセルサイズ 2.496 μm x 2.496 μm x 16 μm、512 x 512 ピクセル、光学スライス Z スタック 10 個、エアリーユニット (AU) 1 個/32 μm、1% 488 nm レーザー出力 5 mW、ピクセル時間 1.52 μs、ライン時間 0.91 ms、フレーム時間 465 ms、LSM スキャン速度 8、双方向スキャン、 GaAsP-PMT検出器のゲインは650 V、デジタルゲインは1です。最適な設定は、顕微鏡や動物によって異なる場合があります。
- 高速スキャンプロトコルを設定するには、[ 取得 ]タブをクリックします。 [集録パラメータ]で、[ フレーム ]タブをクリックします。 512 x 512>プリセットをクリックして、512ピクセルx512ピクセルの画像を記録するように設定します。これにより、顕微鏡ソフトウェアによって決定される画像サイズに基づいて、ボクセルサイズのX値とY値が設定されます。
- [集録パラメータ]で、[チャンネル]タブをクリックします。[トラック2]ボックスをクリックします。[トラック 2] ボックスの横にあるドロップダウン メニューを使用して、[緑 (FITC)] を選択します。トラック2の下に新しいタブが開きます。
- [ レーザー]の横にある [488 ]ボックスをクリックします。これにより、励起波長と発光波長が設定されます。
- 488 nmスライダーの横にある[レーザー出力]を1%に設定します。1AUボタンをクリックして、1エアリーユニットの絞りを設定します。FITCで、マスター・ゲインを650V、デジタル・オフセットを0、デジタル・ゲインを1に設定します。
- [取得] タブで、[Z スタック] チェックボックスをオンにします。ライブボタンをクリックして、神経節のライブ画像を表示します。ニューロンの小さな弧だけが見えるまで、焦点面ノブを上に回します。
- [集録パラメータ]で、[Zスタック]タブをクリックし、[最後に設定]ボタンをクリックして>をクリックします。ニューロンの小さな弧だけが見えるまで、焦点面ノブを下に回します。[集録パラメータ]で、[Zスタック]タブをクリックし、[最初に設定]ボタンをクリックして>をクリックします。ライブボタンをクリックして、ライブ画像をオフにします。
- [集録パラメータ]で、[Zスタック]タブをクリックします。[スライス] フィールドに 10 を入力します。これにより、10個の光学スライスが設定され、ボクセルの深さが自動的に決定されます。
- [集録]タブで、[ 時系列 ]ボックスをクリックします。新しい時系列タブが[集録パラメータ]の下に表示されます。[ 時系列 ]タブ> [サイクル ]フィールドをクリックして、次に実行するサイクル数を表示します。この場合は 8 です。
- スキャンの速度と方向を設定します。[取得パラメータ]の [取得モード] タブで> > 方向 > 方向矢印 で双方向スキャンを行います。[ 取得モード]タブ>[フレーム>スキャン速度スライダー]>8を選択します。
注:通常、以前の実験の設定をロードでき、画像が明るすぎたり暗すぎたりした場合にのみレーザー出力を調整し、Zスタックを最後に設定し、最初に設定する必要があります。
- 「取得」タブの「実験の開始」をクリックして、DRGの短い8サイクル・スキャンを実行します。時間の経過に伴うスキャンの直交投影(フレームごとに1スキャン)を作成してムービーを作成し、画像の鮮明さと、DRGを横切る明るさの「波」などのイメージングアーティファクトを手動で確認します。クランプ位置と光学セクションの厚さを調整し、クリアで高品質のムービーが得られるまでこの手順を繰り返します。
注:動物が動いたり、研究者によって動かされたりした場合は、この手順を繰り返す必要があります。探すべき問題には、実験の過程で神経節の領域(単一のニューロンだけでなく)が明るくなったり暗くなったりして波状の外観を作成したり、領域が消えたり明るくなったりすることが含まれます。小さなニューロンの直径の約半分(<20μm)を超える動きも大きな問題です。波打線は、Zスタックの最初と最後の位置を近づけ(上記のステップ2.4.4を参照)、光学スライスの厚さを狭くすることで修正できることがよくあります。 動画1 は、レベリングして正しい光学スライスの厚さを設定する前の波状の神経節の例を示しています。 動画2 はレベリングと光学スライス厚みを補正した後です。違いは微妙ですが、分析に多大な影響を及ぼします。 - 顕微鏡の高解像度スキャンプロトコルをロードします。
- 高解像度スキャンには、ボクセルサイズ 1.248 μm x 1.248 μm x 14 μm、1024 x 1024 ピクセル、6 光学スライス Z スタック、1.2 エアリーユニット (AU)/39 μm、5% 488 nm レーザー出力/25 mW、ピクセル時間 2.06 μs、ラインタイム 4.95 ms、フレーム時間 5.06 秒、LSM スキャン速度 6、双方向スキャン、 GaAsP-PMT検出器のゲインは650 V、デジタルゲインは1です。最適な設定は、顕微鏡や動物によって異なる場合があります。
- 高解像度スキャンプロトコルを設定するには、[ 取得 ]タブをクリックします。 [集録パラメータ]で、[ フレーム ]タブをクリックします。 1024 x 1024>プリセットをクリックして、1024ピクセルx1024ピクセルの画像を記録するように設定します。これにより、顕微鏡ソフトウェアによって決定される画像サイズに基づいて、ボクセルサイズのX値とY値が設定されます。
- [集録パラメータ]で、[チャンネル]タブをクリックします。[トラック2]ボックスをクリックします。[トラック 2] ボックスの横にあるドロップダウン メニューを使用して、[緑 (FITC)] を選択します。トラック2の下に新しいタブが開きます。
- [レーザー]の横にある [488 ]ボックスをクリックします。これにより、励起波長と発光波長が設定されます。[ 高強度レーザー範囲 ]ボックスをクリックします。
- 488 nmスライダーの横にある[レーザー出力]を5%に設定します。1AUボタンをクリックして、1エアリーユニットの絞りを設定します。FITCでは、マスター・ゲインを650V、デジタル・オフセットを0、デジタル・ゲインを1に設定します。
- [取得] タブで、[Z スタック] チェックボックスをオンにします。ライブボタンをクリックして、神経節のライブ画像を表示します。ニューロンの小さな弧だけが見えるまで、焦点面ノブを上に回します。
- [集録パラメータ]で、[Zスタック]タブをクリックし、[最後に設定]ボタンをクリックして>をクリックします。ニューロンの小さな弧だけが見えるまで、焦点面ノブを下に回します。[集録パラメータ]で、[Zスタック]タブをクリックし、[最初に設定]ボタンをクリックして>をクリックします。ライブボタンをクリックして、ライブ画像をオフにします。
- [集録パラメータ]で、[Zスタック]タブをクリックします。[スライス] フィールドに 6 を入力します。これにより、6つの光学スライスが設定され、ボクセルの深さが自動的に決定されます。
- [集録] タブで、[時系列] ボックスがオフになっている (時系列がない) ことを確認します。
- スキャンの速度と方向を設定します。[取得パラメータ]で、[取得モード]タブをクリックし>フレーム>プリセット>1024 x 1024をクリックします。双方向スキャンの[フレーム>方向>両方向矢印]>[取得モード]タブを選択します。[取得モード]タブ>[フレーム>スキャン速度スライダー]>6を選択します。
- 細胞がtd-Tomatoで標識されている場合は、緑チャンネルに加えて、赤色チャネル592 nm励起/ 614 nm発光、検出波長600〜700 nmをスキャンするように顕微鏡を設定します。これを設定するには、[集録パラメータ]に移動し、[チャンネル]タブ>[トラック1]ボックスをクリックします。[Track1]ボックスの横にあるドロップダウンメニューを使用して、[赤(テキサス赤)]を選択します。488ボックスの代わりに561ボックスをクリックすることを除いて、手順2.6.3と同じプロセスに従います。[レーザー出力] を 1% に設定します。Td-トマトはGCaMP3よりもはるかに明るく、必要なレーザー出力は低くなります。
- 「取得」タブの「実験の開始」ボタンをクリックして、DRGの高解像度イメージを作成します。
- 顕微鏡ラピッドスキャンプロトコルをロードします(ステップ2.4を参照)。DRG内の自発的なアクティビティを80サイクル(約10分)記録します。直交投影ムービーを生成し、画像が解析に十分な品質であることを確認します。
メモ: 品質に関する考慮事項は、手順 2.5 と同じです。 - 刺激を加えるには、顕微鏡を15〜20スキャンするように設定します。スキャン 1 から 5 が完了してベースラインが生成されるまで待ちます。スキャン6-10の間に刺激を適用します。脱感作を防ぐために次の刺激を適用する前に、各刺激の後に少なくとも5分待ちます。
注意: 最初に機械的刺激を適用し、次に冷、熱、および化学的刺激を適用する必要があります。より弱い刺激(例えば、低い機械的力、室温に近い温度)は、より強い刺激(例えば、より高い機械的力、室温から遠い温度)の前に適用されるべきである。刺激を加えるときは、DRGの動きを引き起こさないように注意してください。特に強い熱刺激の場合、刺激を開始する前に2%イソフルランを1〜2分間適用する必要があることがよくあります。この研究で使用された顕微鏡では、各スキャンがはっきりと聞こえるため、研究者はスキャンの終わりを簡単に識別でき、スキャン5の直後に刺激を加えることができます。ただし、一貫した時点での刺激の適用を容易にする任意の方法が機能します。 - 機械プレスの場合は、足に触れずにパドルの間に足を置いてアルゴメーターのピンチャーを持ち、スキャン5の終了直後にピンチを開始し、スキャン10の直後に停止します。アルゴメーターでプレス力を監視します( 材料表を参照)。プレス力を可能な限り目的の力に近づけ(ここでは100 gのプレス刺激を使用します)、目的の力を超えて10 gを超えないようにします。
注:わずか0.07 gのフォンフレイフィラメントと600 gのプレス力で刺激を検出できます。 - 寒さと熱の刺激の場合は、水のビーカーを目的の温度のすぐ下(冷たい場合)または上(熱の場合)に冷却または加熱し、スキャンを開始します。ここでは、45°Cの刺激を用いる。水が正しい温度になったら、スキャン5の直後に足を水に浸して刺激を加えます。スキャン10の直後にビーカーを引き離します。
注意: 温度は、スキャン1で希望する温度の5°C以内である必要があります。ビーカーの温度が正しくない場合は、ニューロンの感作性を低下させる可能性があるため、刺激を適用しないでください。代わりに、水を再冷却または再加熱して、再試行してください。最低0°C(氷水)から最高95°Cまでの温度を測定しました。 ただし、50°Cを超える温度は組織に損傷を与え、後の実験を混乱させる可能性があることに注意してください。同様に、一部の化学物質(テトロドトキシン、カプサイシンなど)は不可逆的であるか、洗い流すことができず、動物でのさらなる実験を妨げる可能性があります。 - すべての刺激を適用して記録した後、ケタミン/キシラジン(200 mg / kgケタミン、30 mg / kgキシラジン、またはステップ1.1で調製した溶液のグラム体重あたり5 μL)を過剰摂取して動物を安楽死させ、続いて断頭します。.
3.データ分析
- ImageJにドラッグアンドドロップして画像ファイルを開きます。ファイルを開いた後、[画像>の種類] で [画像の種類] で 画像の種類> RGB 色を選択します。
注: StackReg >プラグインの下にある StackReg21 プラグインは、移動アーティファクトの修正と位置合わせに役立ちます。ImageJは、ほとんどの顕微鏡ソフトウェアファイル形式を読み取ることができます。画像の種類の選択は、ユーザーの好みによって異なります。RGBは、公開用のカラー画像の生成を簡素化します。顕微鏡メーカーまたはサイトネット22のソフトウェアパッケージも分析に役立つ場合があります。StackReg をダウンロード、インストール、および使用する必要はありませんが、使用することをお勧めします。 - 関心領域 (ROI) ツールを使用して、 ROI マネージャーの [分析>ツール] でアクティブなニューロン>選択します。ツールバーの 楕円 ツールまたは 長方形 ツールを使用してROIを描画し、ROIマネージャーウィンドウの[追加]の下にある[ 追加 ]ボタンを押すか、「t」キーを押してROIファイルに配置します。
注: ROI ファイルは頻繁に保存してください。ユーザーは、ROIファイルをImageJにドラッグアンドドロップし、ROIマネージャーウィンドウの下部にある[ すべて表示 ]ボックスをクリックすることで、いつでもROIを復元できます。オーバーレイとして保存することはお勧めしません。経験から、ROI.zipファイルとして保存すると、分析が簡単になります。 - [測定値の分析>設定]で、[平均グレー値]オプションがオンになっていることを確認します。[測定値の設定] の下にある他のすべてのチェックボックスをオフにします。ROIマネージャーメニューのマルチメジャーツールを使用して、ROI内の強度を計算します。[より>マルチメジャー]の下のROIウィンドウを使用して強度を測定します。
注:隣接するニューロンが互いに近すぎて、別々のROIを描くことができない場合があります。これらのニューロンは、過渡強度の測定には使用できませんが、活性化ニューロンの数に含めることができます。 - マルチメジャーで生成されたCSVファイルを保存し、任意のスプレッドシートソフトウェアでCSVファイルを開きます。
注: 分析に役立つスプレッドシート テンプレートの例については、 補足ファイル 1 を参照してください。 - Ca2+過渡強度をΔF / F0 =(Ft-F0)/ F 0として計算し、ここで、Ftは対象時点におけるROIのピクセル強度であり、F0は、自発的活動のCa2+過渡現象の前の2〜4フレームまたはCa2+のROIの最初の1〜5フレームのいずれかの強度を平均することによって決定されるベースライン強度である。 刺激中に発生する過渡現象。刺激前にCa2+ピークを生成するニューロンを除外し、刺激終了後の活動を分析しません。
- Ca2+過渡強度解析では、各神経節からほぼ同数のニューロンをランダムにサンプリングして、応答ニューロンの数が最も多い神経節にデータが偏らないようにします。ΔF/F0が0.15<ピークを除外する。
注:ニューロン11、12、23、24、25、26、27、28の分析および包含/除外の代替公開方法があります。 - ImageJのツールバーにある 線 ツールを使用してニューロンの直径を測定します。最長直径と最短直径に沿って描かれた線から平均直径を計算します。
結果
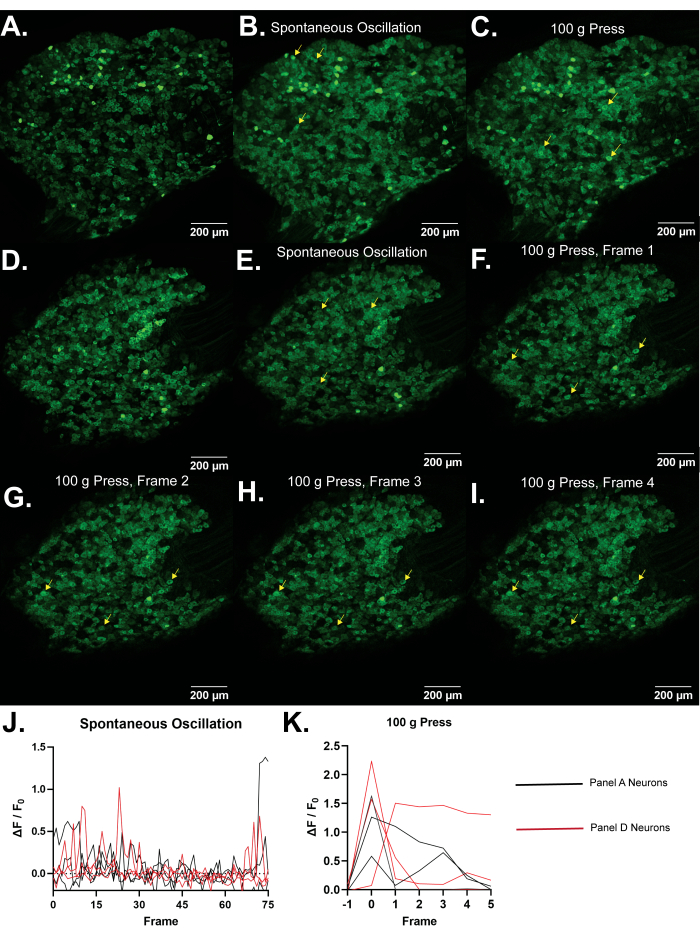
図4:Pirt-GCaMP3マウスのL5後根神経節の代表的な画像。 (A,D)Pirt-GCaMP3マウスのL5後根神経節の単一フレーム高解像度スキャンが示されている。(B,E).刺激がない場合の、パネルAおよびパネルDからのそれぞれ15フレームのPirt-GCaMP3 L5 D...
ディスカッション
持続的な痛みはさまざまな障害に存在し、約8%の人々の生活の質を衰弱および/または低下させます29。一次感覚ニューロンは皮膚の有害な刺激を検出し、その可塑性は持続的な痛みに寄与します8。ニューロンは細胞培養や外植片で研究することができますが、そうすることで通常の生理学的状況からニューロンが取り除かれます。DRGの外科的曝露とそれに?...
開示事項
著者は、競合する金銭的利益を宣言していません。
謝辞
この研究は、国立衛生研究所の助成金R01DE026677およびR01DE031477(Y.S.K.)、UTHSCSA startup fund(Y.S.K.)、およびテキサス大学システム(Y.S.K.)からのライジングスター賞によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
参考文献
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233 (2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083 (2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651 (2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990 (2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846 (2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450 (2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171 (2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225 (2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810 (2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved