A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طريقة ثقافة 3D من كرويات من خطوط خلايا الزرد الجنينية والكبد
In This Article
Summary
هنا ، نقدم بروتوكول ثقافة 3D فعال وسهل وسريع لتشكيل كرويات من خطين خلويين من الزرد (Danio rerio): ZEM2S (الجنين) و ZFL (خلايا الكبد الطبيعية).
Abstract
تعتبر خطوط الخلايا السمكية نماذج مخبرية واعدة لتقييم السمية الإيكولوجية. ومع ذلك ، فإن أنظمة الاستزراع أحادية الطبقة التقليدية (ثقافة 2D) لها قيود معروفة (على سبيل المثال ، طول عمر الثقافة والحفاظ على بعضها في الوظائف الخلوية في الجسم الحي ). وهكذا ، تم اقتراح ثقافات 3D ، مثل الكروية ، لأن هذه النماذج يمكنها إعادة إنتاج الهياكل الشبيهة بالأنسجة ، واستعادة الظروف في الجسم الحي بشكل أفضل. توضح هذه المقالة بروتوكول ثقافة 3D فعال وسهل وسريع لتشكيل كرويات مع اثنين من خطوط خلايا الزرد (Danio rerio): ZEM2S (الجنين) و ZFL (خلايا الكبد الطبيعية). يتكون البروتوكول من طلاء الخلايا في لوحة مستديرة القاع ، منخفضة للغاية ، 96 بئرا. بعد 5 أيام تحت الاهتزاز المداري (70 دورة في الدقيقة) ، يتم تشكيل كروي واحد لكل بئر. تقدم الأجسام الكروية المشكلة حجما وشكلا ثابتين ، وتتجنب هذه الطريقة تكوين كرويات متعددة في البئر ؛ وبالتالي ، ليس من الضروري اختيار كرويات ذات أحجام مماثلة. إن سهولة وسرعة وقابلية استنساخ هذه الطريقة الكروية تجعلها مفيدة للاختبارات عالية الإنتاجية في المختبر .
Introduction
الكرويات هي كرات صغيرة من الخلايا تتشكل عندما يتم استزراع الخلايا في اتصال وثيق من خلية إلى خلية في ثقافة 3D. تمت بالفعل دراسة قدرة الكائنات الكروية على تقليد بيئة الأنسجة في الجسم الحي في مجموعة متنوعة من خطوط الخلايا والخلايا الأولية 1,2. ومع ذلك ، على الرغم من أن الكرويات متطورة بشكل جيد لدراسات سمية الثدييات ، إلا أن تطوير الكرويات لدراسات السمية مع الفقاريات غير الثديية (مثل الأسماك) لا يزال جاريا3. بالنسبة لخطوط خلايا الأسماك ، تم تطوير كرويات من خلال مجموعة متنوعة من الطرق المختلفة ، مثل الاهتزاز المداري (OS) باستخدام أنواع مختلفة من ألواح الآبار3،4،5،6،7 ، وطريقة الرفع المغناطيسي باستخدام الجسيمات النانوية المغناطيسية8. ومع ذلك ، قد يكون لبعض طرق الاستزراع هذه للكرويات عيوب أكثر من غيرها.
على سبيل المثال ، قد تولد الطرق الدورانية في الألواح الدقيقة الكبيرة (24 صفيحة بئر) عددا كبيرا من الأجسام الكروية التي تختلف في الحجم والشكل ؛ في الواقع ، تم إثبات تكوين هيكل متعدد كروي7. وهذا يتطلب جهودا مكثفة لاختيار كرويات ذات حجم وشكل مماثلين للتجربة. تستخدم طريقة ثقافة 3D المعلقة بشكل شائع لتوليد كرويات من خطوط خلايا الثدييات1،2،9،10،11 ، حيث يمكن إنشاء كرويات مفردة لكل قطرة ، وتجنب المشاكل الموضحة أعلاه. ومع ذلك ، على الرغم من أن طريقة الإسقاط المعلقة المعدلة (قطرة معلقة + اهتزاز مداري) قادرة على توليد كرويات ZFL باستخدام طريقة غير مكلفة ، إلا أن لها عيوبها12. لا يمكن الحفاظ على المجاميع الخلوية المتكونة لفترات طويلة في القطرات. وبالتالي ، يجب نقلها إلى لوحات الآبار. تتطلب هذه العملية معالجة مكثفة وفترات طويلة من العمل في غطاء التدفق الصفحي ، حيث يتم تنفيذها بالتنقيط باستخدام micropipette12. بالإضافة إلى ذلك ، تتطلب هذه الطريقة 10 أيام لتشكيل كرويات ZFL بالكامل (5 أيام في قطرة معلقة + 5 أيام في نظام التشغيل)12. هذه العيوب يمكن أن تحد من تطبيق كرويات الأسماك 3D لاختبار السمية ، لا سيما بالنظر إلى التطبيقات المحتملة لتحديد الأولويات الكيميائية واستدامة المنتج.
وبالتالي ، تصف هذه المقالة بروتوكول ثقافة 3D قادر على توليد كرويات مفردة من خطوط خلايا ZFL (D. rerio normal hepatocyte) و ZEM2S (جنين مرحلة D. rerio blastula) بناء على الاستخدام المشترك ل 96 بئرا ، لوحات ربط منخفضة للغاية (لوحات ULA) وشاكر مداري (قطر دوران 22 مم). الطريقة المطبقة بسيطة وقابلة للتكرار ، ويمكن أن تولد أعدادا كبيرة من الأجسام الكروية ذات الحجم والشكل المماثل في فترة قصيرة (5 أيام). يمكن أن تدعم مزايا هذه الطريقة تطبيق نماذج الأسماك 3D لدراسات السمية المائية في كل من الصناعة والأوساط الأكاديمية ، وكذلك التقدم المحرز في تنفيذ طرق بديلة لاختبار السمية البيئية.
Protocol
يتم عرض الخطوات الرئيسية لتوليد كرويات ثلاثية الأبعاد لخطوط خلايا ZFL و ZEM2S في لوحة مستديرة القاع ذات 96 بئرا في الشكل 1.
ملاحظة: انظر جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد المستخدمة في هذا البروتوكول والجدول 1 للحلول ووسائط الثقافة المستخدمة في هذا البروتوكول.
1. ثقافة الخلية الثقافات المتوسطة وأحادية الطبقة
- قم بزراعة كلا خطي الخلايا (ZFL ، ZEM2S) كطبقة أحادية في حاضنة عند 28 درجة مئوية بدون CO2 ، واستزراعهما بنسبة زراعة فرعية تبلغ 1: 3 عندما يصلان إلى التقاء ~ 80٪.
- ابدأ بقارورة T75 من خلايا الزرد عند التقاء ~ 80٪ ، مستزرعة كما هو موضح أعلاه.
- قم بإزالة الوسط الكامل واغسل الخلايا بإضافة 1x محلول ملحي مخزن بالفوسفات (PBS) (0.01 م) إلى دورق الاستزراع بمساعدة ماصة.
- بمساعدة ماصة ، أضف 3 مل من 1x trypsin-0.5 mM EDTA (0.05٪ [v / v]) إلى قوارير الاستزراع ، واحتضانها عند 28 درجة مئوية لمدة 3 دقائق لفصل الخلايا عن القارورة.
- اضغط برفق على القارورة لتحرير الخلايا ، ثم أوقف هضم التربسين بإضافة 3 مل من وسط الاستزراع الكامل إلى القارورة.
- باستخدام ماصة ، انقل تعليق الخلية إلى أنبوب طرد مركزي مخروطي سعة 15 مل ، وأجهزة طرد مركزي عند 100 × جم لمدة 5 دقائق.
- بعد تكوين الحبيبات ، قم بإزالة المادة الطافية بعناية ، وأضف 1 مل من الوسط الكامل لخط الخلية المعني المستخدم (ZFL أو ZEM2S) ، وأعد التعليق باستخدام ماصة ميكروية. خذ قسمة لحساب الخلايا.
2. عد الخلايا مع اختبار استبعاد صبغة التريبان الزرقاء
- أضف 10 ميكرولتر من معلق الخلية و 10 ميكرولتر من صبغة التريبان الزرقاء إلى أنبوب دقيق لحساب الخلايا وتقييم صلاحيتها. امزج تعليق الخلية وصبغها باستخدام ماصة.
- بعد ذلك ، انقل 10 ميكرولتر من هذا الخليط (تعليق الخلية + تريبان الأزرق) إلى غرفة نيوباور وعد الخلايا في المربعات الأربعة الكبيرة (الأرباع: Q) الموضوعة في زوايا الغرفة ، مع الأخذ في الاعتبار الخلايا التي لا تمتص التريبان الأزرق قابلة للحياة. احسب عدد الخلايا القابلة للحياة باستخدام المعادلة (1):
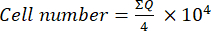 (1)
(1) - لحساب رقم الخلية النهائي في تعليق الخلية ، اضرب رقم الخلية المحدد باستخدام المعادلة (1) في 2 (عامل التخفيف بسبب استخدام تريبان الأزرق).
ملاحظة: بدلا من ذلك ، يمكن استخدام نظام عد الخلايا الآلي.
3. طلاء الخلية في لوحات ULA
- بعد حساب رقم الخلية ، اضبط تعليق الخلية على لوحة 200 ميكرولتر من هذا التعليق لكل بئر من لوحة ULA ذات القاع المستدير ذات 96 بئرا مع عدد الخلايا المطلوبة لكل خط خلية ، كما هو موضح أدناه:
- لوحة 7000 خلية ZFL قابلة للحياة / بئر ؛ وبالتالي ، بالنسبة للوحة ULA بأكملها ، استخدم 700000 خلية في 20 مل من الوسط الكامل.
- لوحة 3500 خلية ZEM2S قابلة للحياة / بئر ؛ وبالتالي ، بالنسبة للوحة ULA بأكملها ، استخدم 350000 خلية في 20 مل من الوسط الكامل.
- قم بإعداد تعليق الخلية بالتركيز المعدل للخلايا في خزان متوسط واخلطه باستخدام ماصة دقيقة متعددة القنوات ، مع الحرص على عدم تكوين رغوة أو فقاعات. باستخدام الماصة الدقيقة متعددة القنوات ، أضف 200 ميكرولتر من تعليق الخلية المعدل إلى كل بئر من لوحة ULA.
ملاحظة: يجب أن تكون اللوحة مختومة ببارافيلم أو رقائق لاصقة مانعة للتسرب لتجنب تبخر وسط الاستزراع من لوحة 96 بئرا.
4. تشكيل كروي
- احتضان لوحة ULA على شاكر مداري عند 70 دورة في الدقيقة لمدة 5 أيام في حاضنة 28 درجة مئوية. اسمح للكرويات بالتشكل على مدار 5 أيام من الاهتزاز المداري (الشكل 2) ، ليصل متوسط حجمها ~ 225 ميكرومتر في القطر (كرويات ZFL) وقطر ~ 226 ميكرومتر (كرويات ZEM2S)12.
ملاحظة: بعد 5 أيام من الحضانة (أقصى دائرية) ، تكون الأجسام الكروية جاهزة للاستخدام. - للحفاظ على الكرويات في الاستزراع لأكثر من 5 أيام ، قم بإزالة 100 ميكرولتر من الوسط المستهلك كل 5 أيام ، وأضف 100 ميكرولتر من وسط الاستزراع الكامل الطازج باستخدام ماصة دقيقة متعددة القنوات.
ملاحظة: احرص على عدم استنشاق الأجسام الكروية أثناء هذه العملية.
5. قياس الحجم (القطر) والشكل (مؤشر دائري) من كرويات
- الحصول على الصور.
- تحت مجهر ضوئي مقلوب مع نظام التقاط التصوير ، احصل على صورة بمقياس محدد.
ملاحظة: استخدم شريحة معايرة مرحلة المجهر أو شريحة Neubauer (التي تعرف فيها أحجام الربع) للحصول على المقياس. - تحت المجهر وباستخدام نفس العدسة الموضوعية المستخدمة للحصول على صورة المقياس ، احصل على صور للكرويات المشكلة بالكامل (أي كرويات عمرها 5 أيام).
ملاحظة: يجب التقاط جميع الصور باستخدام نفس نظام التقاط التصوير، حيث أن دقة الصورة مهمة لتحديد حجم وشكل الأجسام الكروية، وقد تختلف بين أنواع الأنظمة.
- تحت مجهر ضوئي مقلوب مع نظام التقاط التصوير ، احصل على صورة بمقياس محدد.
- اضبط المقياس.
- باستخدام برنامج ImageJ ، افتح صورة المقياس المحدد (انقر فوق ملف | فتح).
- حدد محدد الخط المستقيم من شريط الأدوات، وباستخدام الماوس، اسحب خطا للخارج عبر امتداد المقياس المحدد في الصورة.
- اضبط المقياس عن طريق تحديد تحليل | اضبط المقياس، وانتظر حتى تفتح نافذة تعيين المقياس .
- في نافذة Set Scale ، املأ فراغ المسافة المعروفة بالمسافة المعروفة (μm) المقابلة للخط المستقيم ؛ املأ وحدة الطول ب um ل μm. انقر فوق موافق.
ملاحظة: يتم عرض المقياس بالبكسل/ميكرومتر في أسفل النافذة.
- اضبط معلمات القياس.
- في برنامج ImageJ، حدد تحليل | تعيين القياسات لفتح نافذة تعيين القياسات .
- في نافذة تعيين القياسات، حدد مربعات القياسات المطلوبة (على سبيل المثال، واصفات المساحة والشكل). انقر فوق موافق.
- الحصول على قطر الكرويات ودائريتها.
- افتح صورة كروية (ملف | فتح).
- حدد أداة التحديد اليدوي في شريط الأدوات ، وباستخدام الماوس ، حدد الجانب الخارجي للكروية ، كما هو موضح في الشكل 3 أ.
ملاحظة: لتكبير الصورة أو تصغيرها، اضغط على المفتاح Ctrl واستخدم الماوس للتمرير لأسفل أو لأعلى، أو اضغط على المفتاح Ctrl واستخدم مفتاحي الأسهم لأعلى أو لأسفل على لوحة المفاتيح. - حدد تحليل | قياس لفتح نافذة النتائج ، حيث يتم عرض القيم المقاسة.
- باستخدام قيمة المساحة ، احسب حجم (قطر) الأجسام الكروية باستخدام المعادلة (2):
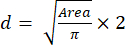 (2)
(2) - يتم إعطاء مؤشر التدوير في نافذة النتائج ك "Circ." ، ويتم حسابه تلقائيا بواسطة البرنامج باستخدام المعادلة (3):
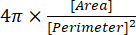 (3)
(3)
ملاحظة: يمثل مؤشر الدوران 1.0 شكلا كرويا مثاليا ، بينما تشير القيمة القريبة من 0.0 إلى شكل ممدود13.
النتائج
يتم تشكيل كرويات واحدة لكل بئر مع حجم وشكل ثابت بهذه الطريقة. يوضح الشكل 2 عملية تكوين كرويات مفردة لخلايا ZFL و ZEM2S في بئر صفيحة ULA تحت الاهتزاز المداري (70 دورة في الدقيقة). خطوط الخلايا ZFL و ZEM2S لها سلوكيات مختلفة في ثقافة 3D. يقدم خط خلية ZEM2S ميزات تمنح القدرة على تكوين شكل كروي ب...
Discussion
هذه طريقة بسيطة وسهلة وسريعة لتوليد كرويات من كبد الزرد وخطوط خلايا الجنين. تم تطوير هذه الطريقة من قبل هذه المجموعة بناء على تعديلات الطرق الكروية ثلاثية الأبعاد الحالية للتغلب على المشكلات المبلغ عنها في الدراسات العلمية المتعلقة بتكوين كروي ، بالإضافة إلى عدم اليقين في دقة البيانات م?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
في ذكرى الدكتور مارسيو لورينسيني ، مؤلف مشارك في هذا العمل ، باحث ممتاز في مجال مستحضرات التجميل ومكرس لتعزيز أبحاث التجميل في البرازيل. يعرب المؤلفون عن امتنانهم للمختبر متعدد المستخدمين في قسم علم وظائف الأعضاء (UFPR) لتوافر المعدات وللدعم المالي المقدم من التنسيق من أجل تحسين موظفي التعليم العالي (CAPES ، البرازيل) (قانون المالية 001) و Grupo Boticário.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate, Individually Wrapped, with Lid, Sterile | Corning | 7007 | |
| DMEM, powder, high glucose, pyruvate | Gibco | 12800-017 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | |
| HEPES (1M) | Gibco | 15630080 | |
| Image Processing and analysis in Java (ImageJ) 1.52p software | National Institutes of Health, USA | Available at: https://imagej.nih.gov/ij/index.html | |
| Leibovitz's L-15 Medium, powder | Gibco | 41300021 | |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10x) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| RPMI 1640 Medium | Gibco | 31800-014 | |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Sodium bicarbonate, powder, bioreagent for molecular biology | Sigma-Aldrich | S5761 | |
| Trypan blue stain (0,4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
References
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research. Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, N. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnology and Bioengineering. 83 (2), 173-180 (2003).
- Baron, M. G., Purcell, W. M., Jackson, S. K., Owen, S. F., Jha, A. N. Towards a more representative in vitro method for fish ecotoxicology: morphological and biochemical characterisation of three-dimensional spheroidal hepatocytes. Ecotoxicology. 21 (8), 2419-2429 (2012).
- Alves, R. F., Rocha, E., Madureira, T. V. Fish hepatocyte spheroids - A powerful (though underexplored) alternative in vitro model to study hepatotoxicity. Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 262, 109470 (2022).
- Baron, M. G., et al. Pharmaceutical metabolism in fish: using a 3-D hepatic in vitro model to assess clearance. PloS One. 12 (1), 0168837 (2017).
- Langan, L. M., et al. Spheroid size does not impact metabolism of the β-blocker propranolol in 3D intestinal fish model. Frontiers in Pharmacology. 9, 947 (2018).
- Lammel, T., Tsoukatou, G., Jellinek, J., Sturve, J. Development of three-dimensional (3D) spheroid cultures of the continuous rainbow trout liver cell line RTL-W1. Ecotoxicology and Environmental Safety. 167, 250-258 (2019).
- Jeong, Y., et al. Differential effects of CBZ-induced catalysis and cytochrome gene expression in three dimensional zebrafish liver cellculture. Journal of Environmental and Analytical Toxicology. 6, 2161 (2016).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), e2720 (2011).
- Lee, W. G., Ortmann, D., Hancock, M. J., Bae, H., Khademhosseini, A. A hollow sphere soft lithography approach for long-term hanging drop methods. Tissue Engineering. Part C, Methods. 16 (2), 249-259 (2010).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods in Molecular Medicine. 140, 141-151 (2007).
- de Souza, I. R., et al. Development of 3D cultures of zebrafish liver and embryo cell lines: a comparison of different spheroid formation methods. Ecotoxicology. 30 (9), 1893-1909 (2021).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 151-161 (2012).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2022)
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Gajski, G., et al. Genotoxic potential of selected cytostatic drugs in human and zebrafish cells. Environmental Science and Pollution Research International. 23 (15), 14739-14750 (2016).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Mueller-Klieser, W. Method for the determination of oxygen consumption rates and diffusion coefficients in multicellular spheroids. Biophysical Journal. 46 (3), 343-348 (1984).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Ho, R. K., Kimmel, C. B. Commitment of cell fate in the early zebrafish embryo. Science. 261 (5117), 109-111 (1993).
- Biswas, S., Emond, M. R., Jontes, J. D. Protocadherin-19 and N-cadherin interact to control cell movements during anterior neurulation. The Journal of Cell Biology. 191 (5), 1029-1041 (2010).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved