A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטת תרבית תלת ממדית של ספרואידים של קווי תאים עובריים ודגי זברה בכבד
In This Article
Summary
כאן, אנו מציגים פרוטוקול תרבית תלת-ממדית יעיל, קל ומהיר ליצירת ספרואידים של שני קווי תאים של דגי זברה (Danio rerio): ZEM2S (עובר) ו-ZFL (הפטוציטים רגילים).
Abstract
קווי תאי דגים מבטיחים מודלים במבחנה להערכת רעילות אקולוגית; עם זאת, למערכות תרבית חד-שכבתיות קונבנציונליות (תרבית דו-ממדית) יש מגבלות ידועות (למשל, אריכות ימים בתרבית ותחזוקה של חלק מהתפקודים התאיים in vivo ). לפיכך, הוצעו תרביות תלת-ממדיות, כגון ספרואידים, שכן מודלים אלה יכולים לשחזר מבנים דמויי רקמות, וללכוד טוב יותר את תנאי in vivo . מאמר זה מתאר פרוטוקול תרבית תלת-ממדית יעיל, קל ומהיר ליצירת ספרואידים עם שני קווי תאים של דגי זברה (Danio rerio): ZEM2S (עובר) ו-ZFL (הפטוציטים רגילים). הפרוטוקול מורכב מציפוי התאים בצלחת בעלת תחתית עגולה, נמוכה במיוחד, בעלת 96 בארות. לאחר 5 ימים תחת רעידות מסלוליות (70 סל"ד), נוצר ספרואיד יחיד לכל באר. הספרואידים שנוצרו מציגים גודל וצורה יציבים, ושיטה זו מונעת היווצרות של ספרואידים מרובים בבאר; לכן, אין צורך לבחור ידנית ספרואידים בגדלים דומים. הקלות, המהירות ויכולת השחזור של שיטה ספרואידית זו הופכים אותה לשימושית עבור בדיקות מבחנה בעלות תפוקה גבוהה.
Introduction
ספרואידים הם כדורים קטנים של תאים הנוצרים כאשר תאים מתורבתים במגע קרוב בין תאים בתרבית תלת-ממדית. היכולת של ספרואידים לחקות את סביבת הרקמה in vivo כבר נחקרה במגוון קווי תאים ותאים ראשוניים 1,2. עם זאת, למרות שספרואידים מפותחים היטב עבור מחקרי רעילות יונקים, הפיתוח של ספרואידים למחקרי רעילות עם בעלי חוליות שאינם יונקים (למשל, דגים) עדיין בעיצומו3. עבור קווי תאי דגים, ספרואידים פותחו במגוון שיטות שונות, כגון טלטול אורביטלי (OS) באמצעות סוגים שונים של לוחות באר 3,4,5,6,7, ושיטת הריחוף המגנטי באמצעות ננו-חלקיקים מגנטיים 8. עם זאת, חלק משיטות התרבית הללו עבור ספרואידים עשויים להיות בעלי חסרונות רבים יותר מאחרים.
לדוגמה, שיטות גירטוריות במיקרו-צלחות גדולות (צלחות של 24 בארות) עשויות ליצור מספר גבוה של ספרואידים השונים זה מזה בגודל ובצורה; ואכן, הודגמה היווצרות מבנה רב-ספרואידי7. זה דורש מאמצים אינטנסיביים לבחור ספרואידים עם גודל וצורה דומים לניסוי. שיטת תרבית תלת ממדית של טיפה תלויה משמשת בדרך כלל ליצירת ספרואידים של קווי תאים של יונקים 1,2,9,10,11, לפיה ניתן ליצור ספרואידים בודדים בכל טיפה, תוך הימנעות מהבעיות שתוארו לעיל. עם זאת, למרות ששיטת נפילה תלויה שונה (טיפה תלויה + טלטול מסלולי) מסוגלת לייצר ספרואידים ZFL בשיטה זולה, יש לה חסרונות12. הצברים התאיים שנוצרו אינם יכולים להישמר לפרקי זמן ארוכים בטיפות; לכן, הם צריכים להיות מועברים צלחות היטב. תהליך זה דורש טיפול אינטנסיבי ופרקי זמן ארוכים של עבודה במכסה מנוע זרימה למינרית, שכן הוא מבוצע באמצעות מיקרופיפטה12. בנוסף, שיטה זו דורשת 10 ימים כדי ליצור באופן מלא את הספרואידים ZFL (5 ימים טיפה תלויה + 5 ימים במערכת ההפעלה)12. חסרונות אלה יכולים להגביל את היישום של כדורי דגים תלת-ממדיים לבדיקת רעילות, במיוחד בהתחשב ביישומים פוטנציאליים לתעדוף כימי וקיימות המוצר.
לפיכך, מאמר זה מתאר פרוטוקול תרבית תלת-ממדי המסוגל ליצור ספרואידים בודדים של קווי תאים ZFL (D. rerio normal hepatocyte) ו-ZEM2S (D. rerio blastula phase fetryo) בהתבסס על שימוש משולב של לוחות חיבור 96 באר ואולטרה-נמוכים (לוחות ULA) ושייקר אורביטלי (קוטר סיבוב של 22 מ"מ). השיטה המיושמת היא פשוטה וניתנת לשחזור, ויכולה ליצור מספר גבוה של ספרואידים בגודל וצורה דומים בתקופה קצרה (5 ימים). היתרונות של שיטה זו יכולים לתמוך ביישום מודלים תלת ממדיים של דגים למחקרי רעילות ימית הן בתעשייה והן באקדמיה, כמו גם בהתקדמות יישום שיטות חלופיות לבדיקת רעילות אקולוגית.
Protocol
שלבי המפתח ליצירת ספרואידים תלת-ממדיים של קווי תאים ZFL ו-ZEM2S בלוח עגול בעל תחתית עגולה של 96 בארות מוצגים באיור 1.
הערה: עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים המשמשים בפרוטוקול זה ובטבלה 1 עבור פתרונות ומדיית תרבות המשמשים בפרוטוקול זה.
1. תרביות מדיום וחד-שכבתיות של תרביות תאים
- לגדל את שני קווי התאים (ZFL, ZEM2S) כחד-שכבות באינקובטור ב-28°C ללאCO2, ולגדל אותם בתת-גידול ביחס של 1:3 כאשר הם מגיעים למפגש ~80%.
- התחל עם בקבוק T75 של תאי דג זברה במפגש ~80%, בתרבית כמתואר לעיל.
- הסר את המדיום המלא ושטוף את התאים על ידי הוספת 1x פוספט buffered מלוחים (PBS) (0.01 M) לבקבוק תרבית בעזרת פיפטה.
- בעזרת פיפטה, להוסיף 3 מ"ל של 1x טריפסין-0.5 mM EDTA (0.05% [v/v]) לצלוחיות התרבית, ולדגור ב 28 ° C במשך 3 דקות לניתוק תאים מן הצלוחית.
- טפחו בעדינות על הבקבוק כדי לשחרר את התאים, ולאחר מכן עצרו את עיכול הטריפסין על ידי הוספת 3 מ"ל של מדיום תרבית שלם לצלוחית.
- באמצעות פיפטה, להעביר את תרחיף התא לצינור צנטריפוגה חרוטי 15 מ"ל, וצנטריפוגה ב 100 × גרם במשך 5 דקות.
- לאחר היווצרות הכדור, בזהירות להסיר את supernatant, להוסיף 1 מ"ל של המדיום המלא עבור קו התא המתאים בשימוש (ZFL או ZEM2S), ו resuspend באמצעות micropipette. קח aliquot עבור ספירת תאים.
2. ספירת תאים עם בדיקת אי הכללת צבע כחול טריפאן
- הוסף 10 μL של תרחיף התא ו 10 μL של צבע כחול טריפאן למיקרו-צינורית כדי לספור את התאים ולהעריך את הכדאיות שלהם. מערבבים את תרחיף התא וצובעים בעזרת פיפטה.
- לאחר מכן, העבירו 10 μL של תערובת זו (תרחיף תאים + טריפאן כחול) לתא נויבאואר וספרו את התאים בארבעת הריבועים הגדולים (רבעים: Q) הממוקמים בפינות התא, בהתחשב בתאים שאינם תופסים כחול טריפאן כבני קיימא. חשב את מספר התאים בני קיימא באמצעות משוואה (1):
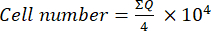 (1)
(1) - כדי לחשב את מספר התא הסופי בתרחיף התא, הכפל את מספר התא שנקבע באמצעות משוואה (1) ב- 2 (גורם הדילול עקב השימוש בכחול טריפאן).
הערה: לחלופין, ניתן להשתמש במערכת ספירת תאים אוטומטית.
3. ציפוי תאים בצלחות ULA
- לאחר חישוב מספר התא, התאם את מתלה התא ללוח 200 μL של תרחיף זה לכל באר של לוחית ULA בעלת תחתית עגולה של 96 בארות עם מספר התאים הדרוש לכל קו תא, כמפורט להלן:
- צלחת 7,000 תאי ZFL קיימא / באר; לכן, עבור צלחת ULA כולה, להשתמש 700,000 תאים ב 20 מ"ל של תווך שלם.
- צלחת 3,500 תאי ZEM2S קיימא / באר; לכן, עבור צלחת ULA כולה, להשתמש 350,000 תאים ב 20 מ"ל של מדיום שלם.
- מכינים את תרחיף התא עם ריכוז התאים המותאם במאגר בינוני ומערבבים אותו באמצעות מיקרופיפטה רב ערוצית, תוך הקפדה שלא ליצור קצף או בועות. באמצעות מיקרופיפטה רב ערוצית, להוסיף 200 μL של תרחיף התא מותאם לכל באר של צלחת ULA.
הערה: הצלחת חייבת להיות אטומה עם ציפוי פרפילם או נייר איטום דבק כדי למנוע אידוי בינוני של תרבית מהצלחת בעלת 96 הקידוחים.
4. היווצרות ספרואידים
- לדגור את צלחת ULA על שייקר מסלול ב 70 סל"ד במשך 5 ימים באינקובטור 28 מעלות צלזיוס. אפשרו לכדוריות להיווצר במשך 5 ימים של רעידות מסלוליות (איור 2), ולהגיע לגודל ממוצע של ~225 מיקרומטר בקוטר (ספרואידים ZFL) וקוטר ~226 מיקרומטר (ספרואידים ZEM2S)12.
הערה: לאחר 5 ימי דגירה (מעגליות מרבית), הספרואידים מוכנים לשימוש. - כדי לשמור על הספרואידים בתרבית במשך יותר מ -5 ימים, להסיר 100 μL של המדיום בילה כל 5 ימים, ולהוסיף 100 μL של מדיום תרבית שלמה טרי באמצעות micropipette רב ערוצי.
הערה: יש להיזהר שלא לשאוף את הספרואידים במהלך תהליך זה.
5. מדידת גודל (קוטר) וצורה (אינדקס מעגליות) של ספרואידים
- רכוש את התמונות.
- תחת מיקרוסקופ אור הפוך עם מערכת לכידת הדמיה, קבל תמונה בקנה מידה מוגדר.
הערה: השתמש בשקופית כיול שלב במיקרוסקופ או בשקופית נויבאואר (שבה ידועים גדלי הרביע) כדי לקבל את קנה המידה. - תחת המיקרוסקופ ובאמצעות אותה עדשה אובייקטיבית המשמשת לקבלת תמונת הסולם, קבל תמונות של הספרואידים שנוצרו במלואם (כלומר, ספרואידים בני 5 ימים).
הערה: יש לצלם את כל התמונות באמצעות אותה מערכת לכידת הדמיה, מכיוון שרזולוציית התמונה חשובה לקביעת הגודל והצורה של הספרואידים, והיא עשויה להשתנות בין סוגי המערכות.
- תחת מיקרוסקופ אור הפוך עם מערכת לכידת הדמיה, קבל תמונה בקנה מידה מוגדר.
- הגדר את קנה המידה.
- באמצעות תוכנת ImageJ, פתח את התמונה של קנה המידה המוגדר (לחץ על קובץ | פתוח).
- בחרו בבורר הקו הישר מסרגל הכלים וגררו קו החוצה באמצעות העכבר לאורך ההרחבה של קנה המידה שהוגדר בתמונה.
- הגדר את קנה המידה על-ידי בחירה באפשרות נתח | הגדר קנה מידה והמתן לפתיחת החלון הגדר קנה מידה .
- בחלון הגדרת קנה מידה , מלא את הריק של המרחק הידוע במרחק הידוע (μm) המתאים לקו הישר; מלא את יחידת האורך ב - um עבור μm. לחץ על אישור.
הערה: קנה המידה בפיקסלים/מיקרומטר מוצג בתחתית החלון.
- הגדר את פרמטרי המדידה.
- בתוכנת ImageJ, בחר נתח | הגדר מידות כדי לפתוח את החלון הגדרת מדידות .
- בחלון Set Measurements, בחרו בתיבות למדידות הרצויות (כלומר, מתארי שטח וצורה). לחץ על אישור.
- קבל את הקוטר והמעגליות של הספרואידים.
- פתח את התמונה של ספרואיד (קובץ | פתוח).
- בחרו בכלי הבחירה החופשית בסרגל הכלים ובעזרת העכבר בחרו את הצד החיצוני של הספרואיד, כפי שמודגם באיור 3A.
הערה: כדי להגדיל או להקטין את התצוגה של התמונה, הקש על מקש Ctrl והשתמש בעכבר כדי לגלול למטה או למעלה, או הקש על מקש Ctrl והשתמש במקשי החצים למעלה או למטה בלוח המקשים. - בחר נתח | מדידה כדי לפתוח את החלון 'תוצאות ', שבו מוצגים הערכים הנמדדים.
- באמצעות ערך השטח , חשב את הגודל (קוטר) של הספרואידים באמצעות משוואה (2):
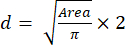 (2)
(2) - מדד המעגליות ניתן בחלון התוצאות כ- "Circ.", ומחושב אוטומטית על ידי התוכנה באמצעות משוואה (3):
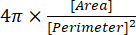 (3)
(3)
הערה: אינדקס המעגליות של 1.0 מייצג צורה כדורית מושלמת, בעוד שערך קרוב ל- 0.0 מציין צורה מוארכת13.
תוצאות
ספרואידים בודדים לכל באר עם גודל וצורה יציבים נוצרים בשיטה זו. איור 2 מדגים את תהליך ההיווצרות של ספרואידים בודדים של תאי ZFL ו-ZEM2S בבאר של צלחת ULA תחת טלטול אורביטלי (70 סל"ד). לקווי התאים ZFL ו-ZEM2S יש התנהגויות שונות בתרבית תלת-ממדית. קו התאים ZEM2S מציג תכונות שמעניקות את היכולת ליצ...
Discussion
זוהי שיטה פשוטה, קלה ומהירה ליצירת ספרואידים של קווי תאי כבד ועובר של דגי זברה. שיטה זו פותחה על ידי קבוצה זו בהתבסס על שינויים של שיטות ספרואידים תלת ממדיות קיימות כדי להתגבר על בעיות שדווחו במחקרים מדעיים הקשורים להיווצרות ספרואידים, כמו גם אי ודאויות בדיוק הנתונים מבדיקות ספרואידים תלת...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
לזכרו של ד"ר מרסיו לורנצ'יני, מחבר שותף של עבודה זו, חוקר מעולה בתחום הקוסמטיקה ומוקדש לקידום המחקר הקוסמטי בברזיל. המחברים אסירי תודה למעבדה מרובת המשתמשים במחלקה לפיזיולוגיה (UFPR) על זמינות הציוד ועל התמיכה הכספית של התיאום לשיפור כוח האדם להשכלה גבוהה (CAPES, ברזיל) (קוד האוצר 001) וה- Grupo Boticário.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate, Individually Wrapped, with Lid, Sterile | Corning | 7007 | |
| DMEM, powder, high glucose, pyruvate | Gibco | 12800-017 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | |
| HEPES (1M) | Gibco | 15630080 | |
| Image Processing and analysis in Java (ImageJ) 1.52p software | National Institutes of Health, USA | Available at: https://imagej.nih.gov/ij/index.html | |
| Leibovitz's L-15 Medium, powder | Gibco | 41300021 | |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10x) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| RPMI 1640 Medium | Gibco | 31800-014 | |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Sodium bicarbonate, powder, bioreagent for molecular biology | Sigma-Aldrich | S5761 | |
| Trypan blue stain (0,4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
References
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research. Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, N. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnology and Bioengineering. 83 (2), 173-180 (2003).
- Baron, M. G., Purcell, W. M., Jackson, S. K., Owen, S. F., Jha, A. N. Towards a more representative in vitro method for fish ecotoxicology: morphological and biochemical characterisation of three-dimensional spheroidal hepatocytes. Ecotoxicology. 21 (8), 2419-2429 (2012).
- Alves, R. F., Rocha, E., Madureira, T. V. Fish hepatocyte spheroids - A powerful (though underexplored) alternative in vitro model to study hepatotoxicity. Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 262, 109470 (2022).
- Baron, M. G., et al. Pharmaceutical metabolism in fish: using a 3-D hepatic in vitro model to assess clearance. PloS One. 12 (1), 0168837 (2017).
- Langan, L. M., et al. Spheroid size does not impact metabolism of the β-blocker propranolol in 3D intestinal fish model. Frontiers in Pharmacology. 9, 947 (2018).
- Lammel, T., Tsoukatou, G., Jellinek, J., Sturve, J. Development of three-dimensional (3D) spheroid cultures of the continuous rainbow trout liver cell line RTL-W1. Ecotoxicology and Environmental Safety. 167, 250-258 (2019).
- Jeong, Y., et al. Differential effects of CBZ-induced catalysis and cytochrome gene expression in three dimensional zebrafish liver cellculture. Journal of Environmental and Analytical Toxicology. 6, 2161 (2016).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), e2720 (2011).
- Lee, W. G., Ortmann, D., Hancock, M. J., Bae, H., Khademhosseini, A. A hollow sphere soft lithography approach for long-term hanging drop methods. Tissue Engineering. Part C, Methods. 16 (2), 249-259 (2010).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods in Molecular Medicine. 140, 141-151 (2007).
- de Souza, I. R., et al. Development of 3D cultures of zebrafish liver and embryo cell lines: a comparison of different spheroid formation methods. Ecotoxicology. 30 (9), 1893-1909 (2021).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 151-161 (2012).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2022)
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Gajski, G., et al. Genotoxic potential of selected cytostatic drugs in human and zebrafish cells. Environmental Science and Pollution Research International. 23 (15), 14739-14750 (2016).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Mueller-Klieser, W. Method for the determination of oxygen consumption rates and diffusion coefficients in multicellular spheroids. Biophysical Journal. 46 (3), 343-348 (1984).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Ho, R. K., Kimmel, C. B. Commitment of cell fate in the early zebrafish embryo. Science. 261 (5117), 109-111 (1993).
- Biswas, S., Emond, M. R., Jontes, J. D. Protocadherin-19 and N-cadherin interact to control cell movements during anterior neurulation. The Journal of Cell Biology. 191 (5), 1029-1041 (2010).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved