JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
배아 및 간 제브라피쉬 세포주의 스페로이드에 대한 3D 배양 방법
요약
여기에서 우리는 두 개의 제브라피쉬(Danio rerio) 세포주인 ZEM2S(배아) 및 ZFL(정상 간세포)의 스페로이드 형성을 위한 효과적이고 쉽고 빠른 3D 배양 프로토콜을 제시합니다.
초록
어류 세포주는 생태 독성 평가를 위한 시험관 내 모델이 유망합니다. 그러나, 종래의 단층 배양 시스템(2D 배양)은 잘 알려진 한계(예를 들어, 배양 수명 및 일부 생체내 세포 기능의 유지)를 갖는다. 따라서, 스페로이드와 같은 3D 배양이 제안되었는데, 그 이유는 이러한 모델이 조직과 같은 구조를 재현할 수 있고, 생체 내 조건을 더 잘 재포착할 수 있기 때문이다. 이 기사에서는 두 개의 제브라피쉬(Danio rerio) 세포주인 ZEM2S(배아) 및 ZFL(정상 간세포)을 사용하여 스페로이드를 형성하기 위한 효과적이고 쉽고 빠른 3D 배양 프로토콜에 대해 설명합니다. 이 프로토콜은 둥근 바닥, 초저 부착, 96웰 플레이트에 세포를 도금하는 것으로 구성됩니다. 오비탈 쉐이킹(70 rpm) 하에서 5일 후, 웰 당 단일 스페로이드가 형성된다. 형성된 스페로이드는 안정적인 크기와 모양을 나타내며, 이 방법은 웰에서 여러 스페로이드가 형성되는 것을 방지합니다. 따라서 비슷한 크기의 스페로이드를 직접 고를 필요가 없습니다. 이 스페로이드 분석법의 용이성, 속도 및 재현성은 고처리량 in vitro 테스트에 유용합니다.
서문
스페로이드는 3D 배양에서 세포가 세포 간 밀접하게 접촉하여 배양될 때 형성되는 작은 세포 구체입니다. 생체 내 조직 환경을 모방하는 스페로이드의 능력은 이미 다양한 세포주와 일차 세포에서 연구되었습니다 1,2. 그러나, 스페로이드가 포유류 독성 연구를 위해 잘 개발되어 있지만, 비포유류 척추동물(예: 어류)을 이용한 독성 연구를 위한 스페로이드의 개발은 아직 진행 중이다3. 어류 세포주의 경우, 스페로이드는 다양한 유형의 웰 플레이트 (3,4,5,6,7)를 사용하는 궤도 쉐이킹 (orbital shaking, OS) 및 자성 나노 입자8를 이용한 자기 부상 방법(2)과 같은 다양한 방법으로 개발되었다. 그러나 스페로이드에 대한 이러한 배양 방법 중 일부는 다른 방법보다 더 많은 단점을 가질 수 있습니다.
예를 들어, 대형 마이크로플레이트(24웰 플레이트)의 선회 방법은 크기와 모양이 다른 많은 수의 스페로이드를 생성할 수 있습니다. 실제로, 다중 스페로이드 구조 형성이 입증되었습니다7. 이를 위해서는 실험을 위해 비슷한 크기와 모양의 스페로이드를 직접 선택하려는 많은 노력이 필요합니다. 행드롭 3D 배양 방법은 포유 동물 세포주 1,2,9,10,11의 스페로이드를 생성하는데 통상적으로 사용되며, 이에 의해 한 방울 당 단일 스페로이드가 생성될 수 있어, 상술한 문제를 피할 수 있다. 그러나, 변형된 행잉 드롭 방법(행잉 드롭 + 오비탈 쉐이킹)은 저렴한 방법을 사용하여 ZFL 스페로이드를 생성할 수 있지만, 그 단점이 있다12. 형성된 세포 응집체는 방울에서 장기간 유지 될 수 없습니다. 따라서 우물 판으로 옮겨야합니다. 이 공정은 층류 후드에서 강렬한 취급과 장기간의 작업을 필요로 하는데, 이는 마이크로피펫(micropipette)(12)을 사용하여 적가(dropwise)하기 때문이다. 또한, 이 방법은 ZFL 스페로이드를 완전히 형성하는 데 10일이 걸립니다(행잉 드롭에서 5일 + OS에서 5일)12. 이러한 단점은 특히 화학적 우선 순위 지정 및 제품 지속 가능성에 대한 잠재적 응용 분야를 고려할 때 독성 테스트를 위한 3D 어류 스페로이드의 적용을 제한할 수 있습니다.
따라서 이 기사에서는 96웰, 초저부착 플레이트(ULA-plates) 및 궤도 쉐이커(회전 직경 22mm)의 조합을 기반으로 ZFL(D. rerio normal hepatocyte) 및 ZEM2S(D. rerio blastula phase embryo) 세포주의 단일 스페로이드를 생성할 수 있는 3D 배양 프로토콜에 대해 설명합니다. 적용된 방법은 간단하고 재현 가능하며 단기간(5일)에 유사한 크기와 모양의 스페로이드를 대량으로 생성할 수 있습니다. 이 방법의 장점은 산업계와 학계 모두에서 수생 독성 연구를 위한 어류 3D 모델의 적용과 생태 독성 테스트를 위한 대체 방법의 구현 진행을 지원할 수 있습니다.
프로토콜
둥근 바닥 96웰 플레이트에서 ZFL 및 ZEM2S 세포주의 3D 스페로이드를 생성하는 주요 단계는 그림 1에 나와 있습니다.
참고: 이 프로토콜에 사용된 모든 재료와 관련된 자세한 내용은 재료 표를 참조하고 이 프로토콜에 사용된 용액 및 배양 배지에 대해서는 표 1 을 참조하십시오.
1. 세포 배양 배지 및 단층 배양
- 두 세포주(ZFL, ZEM2S)를CO2 없이 28°C의 인큐베이터에서 단층으로 성장시키고 ~80% 합류에 도달하면 1:3의 계대배양 비율로 계대배양합니다.
- 위에서 설명한 대로 배양된 ~80% 합류점에서 제브라피쉬 세포의 T75 플라스크로 시작합니다.
- 완전한 배지를 제거하고, 피펫의 도움으로 배양 플라스크에 1x 인산염 완충 식염수(PBS)(0.01 M)를 첨가하여 세포를 세척한다.
- 피펫을 사용하여 3mL의 1x 트립신-0.5mM EDTA(0.05%[v/v])를 배양 플라스크에 넣고 플라스크에서 세포를 분리하기 위해 28°C에서 3분 동안 배양합니다.
- 플라스크를 가볍게 두드려 세포를 방출한 다음 플라스크에 완전한 배양 배지 3mL를 추가하여 트립신 소화를 중지합니다.
- 피펫을 사용하여 세포 현탁액을 15mL 원추형 원심분리 튜브로 옮기고 100× g 에서 5분 동안 원심분리합니다.
- 펠렛 형성 후, 상층액을 조심스럽게 제거하고, 사용중인 각 세포주 (ZFL 또는 ZEM2S)에 대한 완전한 배지 1mL를 첨가하고, 마이크로 피펫을 사용하여 재현탁한다. 세포 계수를 위해 부분 표본을 가져 가십시오.
2. 트리판 블루 염료 배제 테스트를 통한 세포 계수
- 세포 현탁액 10μL와 트리판 블루 염료 10μL를 마이크로튜브에 추가하여 세포 수를 세고 생존력을 평가합니다. 세포 현탁액을 혼합하고 피펫을 사용하여 염색합니다.
- 그런 다음 이 혼합물(세포 현탁액 + 트리판 블루) 10μL를 노이바우어 챔버로 옮기고 트리판 블루를 흡수하지 않는 세포를 생존 가능한 것으로 간주하여 챔버 모서리에 배치된 4개의 큰 사각형(사분면: Q)의 세포를 계수합니다. 방정식 (1)을 사용하여 생존 가능한 세포의 수를 계산합니다.
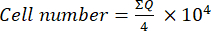 (1개)
(1개) - 세포 현탁액의 최종 세포 수를 계산하려면 식 (1)을 사용하여 결정된 세포 번호에 2(트리판 블루 사용으로 인한 희석 계수)를 곱합니다.
알림: 또는 자동 세포 계수 시스템을 사용할 수 있습니다.
3. ULA 플레이트의 셀 도금
- 세포 수를 계산한 후, 세포 현탁액을 각 세포주에 필요한 세포 수로 96-웰 둥근 바닥 ULA 플레이트의 웰당 200 μL의 플레이트로 조정하고, 아래와 같이 한다.
- 플레이트 7,000 생존 가능한 ZFL 세포/웰; 따라서 전체 ULA 플레이트에 대해 20mL의 완전 배지에 700,000개의 세포를 사용합니다.
- 플레이트 3,500 생존 가능한 ZEM2S 세포/웰; 따라서 전체 ULA 플레이트에 대해 20mL의 완전 배지에 350,000개의 세포를 사용합니다.
- 배지 저장소에서 조정된 농도의 세포로 세포 현탁액을 준비하고 거품이나 기포가 형성되지 않도록 주의하면서 다채널 마이크로피펫을 사용하여 혼합합니다. 멀티채널 마이크로피펫을 사용하여 조정된 세포 현탁액 200μL를 ULA 플레이트의 각 웰에 추가합니다.
알림: 플레이트는 96웰 플레이트에서 배양 배지가 증발하는 것을 방지하기 위해 파라필름 또는 접착 밀봉 호일로 밀봉해야 합니다.
4. 스페로이드 형성
- ULA 플레이트를 28°C 인큐베이터에서 5일 동안 70 rpm의 오비탈 쉐이커 상에서 인큐베이션한다. 스페로이드가 5일 동안 궤도 흔들림을 통해 형성되도록 하여 평균 직경 ~225μm(ZFL 스페로이드) 및 직경 ~226μm(ZEM2S 스페로이드)에 도달합니다12.
참고: 5일간의 배양(최대 원형도) 후 스페로이드를 사용할 준비가 된 것입니다. - 스페로이드를 5일 이상 배양 상태로 유지하려면 5일마다 사용한 배지 100μL를 제거하고 멀티채널 마이크로피펫을 사용하여 신선하고 완전한 배양 배지 100μL를 추가합니다.
알림: 이 과정에서 스페로이드를 흡인하지 않도록 주의하십시오.
5. 스페로이드의 크기(직경)와 형상(원형지수) 측정
- 이미지를 획득합니다.
- 이미징 캡처 시스템이 있는 도립 광학 현미경에서 정의된 스케일의 이미지를 얻습니다.
참고: 현미경 사용 stage, 보정 슬라이드 또는 Neubauer 슬라이드(사분면 크기를 알고 있음)를 사용하여 스케일을 얻습니다. - 현미경으로 스케일 사진을 얻는 데 사용된 것과 동일한 대물 렌즈를 사용하여 완전히 형성된 스페로이드(즉, 5일 된 스페로이드)의 이미지를 얻습니다.
참고: 이미지 해상도는 스페로이드의 크기와 모양을 결정하는 데 중요하며 시스템 유형에 따라 다를 수 있으므로 모든 이미지는 동일한 이미징 캡처 시스템을 사용하여 촬영해야 합니다.
- 이미징 캡처 시스템이 있는 도립 광학 현미경에서 정의된 스케일의 이미지를 얻습니다.
- 스케일을 설정합니다.
- ImageJ 소프트웨어를 사용하여 정의된 스케일의 이미지를 엽니다( 파일 | 열기 클릭).
- 도구 모음에서 직선 선택기 를 선택하고 마우스를 사용하여 이미지에서 정의된 비율의 확장을 가로질러 선을 끕니다.
- Analyze(분석) | 배율을 설정하고 배율 설정 창이 열릴 때까지 기다립니다.
- 배율 설정 창에서 알려진 거리의 공백을 직선에 해당하는 알려진 거리(μm)로 채웁니다. 길이 단위를 μm의 UM으로 채웁니다. 확인을 클릭합니다.
참고: 픽셀/μm 단위의 배율은 창 하단에 표시됩니다.
- 측정 매개변수를 설정합니다.
- ImageJ 소프트웨어에서 분석 | 측정값 설정 - 측정값 설정 창을 엽니다.
- Set measurements(측정 설정) 창에서 원하는 측정에 대한 상자(예: Area 및 Shape 설명자)를 선택합니다. 확인을 클릭합니다.
- 스페로이드의 지름과 원형도를 구합니다.
- 스페로이드 그림 열기(파일 | 열기).
- 도구 모음에서 자유형 선택 도구를 선택하고 그림 3A와 같이 마우스를 사용하여 스페로이드의 바깥쪽을 선택합니다.
참고: 이미지를 확대 또는 축소하려면 Ctrl 키를 누르고 마우스를 사용하여 아래 또는 위로 스크롤하거나 Ctrl 키를 누르고 키보드의 위쪽 또는 아래쪽 화살표 키를 사용합니다. - 분석 | 측정을 클릭하여 측정값이 표시되는 결과 창을 엽니다.
- 면적 값을 사용하여 방정식 (2)를 사용하여 스페로이드의 크기(직경)를 계산합니다.
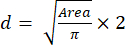 (2개)
(2개) - 순환성 지수는 결과 창에 "Circ."로 표시되며 방정식 (3)을 사용하여 소프트웨어에 의해 자동으로 계산됩니다.
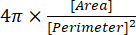 (3)
(3)
참고: 원형도 지수 1.0은 완벽한 구상 형상을 나타내고, 값이 0.0에 가까울수록 길쭉한 형상을 나타낸다13.
결과
안정된 크기 및 형상을 갖는 웰 당 단일 스페로이드가 이 방법에 의해 형성된다. 그림 2는 궤도 진탕(70rpm) 하에서 ULA 플레이트의 웰에서 ZFL 및 ZEM2S 세포의 단일 스페로이드 형성 과정을 보여줍니다. ZFL 및 ZEM2S 세포주는 3D 배양에서 서로 다른 거동을 보입니다. ZEM2S 세포주는 궤도 진탕 첫날부터 구상 모양을 쉽게 형성할 수 있는 능력을 부여하는 특징을 나타내는 반면(그림
토론
이것은 제브라피쉬 간 및 배아 세포주의 스페로이드를 생성하기 위한 간단하고 쉽고 빠른 방법입니다. 이 방법은 스페로이드 형성과 관련된 과학적 연구에서 보고된 문제와 3D 스페로이드 분석의 데이터 정확도 불확실성을 극복하기 위해 기존 3D 스페로이드 방법을 수정하여 개발했습니다. 예를 들어, 보고된 문제는 취급의 어려움, 스페로이드 생성의 시간 소모적인 특성, 분석을 수행하기 위해 ?...
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 연구의 공동 저자 인 Márcio Lorencini 박사를 기리기 위해 화장품 분야의 우수한 연구원이자 브라질에서 화장품 연구를 촉진하는 데 전념했습니다. 저자는 장비 가용성과 고등 교육 인력 개선 조정 (CAPES, 브라질) (재정 코드 001) 및 Grupo Boticário의 재정 지원에 대해 생리학 부서 (UFPR)의 다중 사용자 실험실에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate, Individually Wrapped, with Lid, Sterile | Corning | 7007 | |
| DMEM, powder, high glucose, pyruvate | Gibco | 12800-017 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | |
| HEPES (1M) | Gibco | 15630080 | |
| Image Processing and analysis in Java (ImageJ) 1.52p software | National Institutes of Health, USA | Available at: https://imagej.nih.gov/ij/index.html | |
| Leibovitz's L-15 Medium, powder | Gibco | 41300021 | |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10x) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| RPMI 1640 Medium | Gibco | 31800-014 | |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Sodium bicarbonate, powder, bioreagent for molecular biology | Sigma-Aldrich | S5761 | |
| Trypan blue stain (0,4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
참고문헌
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research. Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, N. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnology and Bioengineering. 83 (2), 173-180 (2003).
- Baron, M. G., Purcell, W. M., Jackson, S. K., Owen, S. F., Jha, A. N. Towards a more representative in vitro method for fish ecotoxicology: morphological and biochemical characterisation of three-dimensional spheroidal hepatocytes. Ecotoxicology. 21 (8), 2419-2429 (2012).
- Alves, R. F., Rocha, E., Madureira, T. V. Fish hepatocyte spheroids - A powerful (though underexplored) alternative in vitro model to study hepatotoxicity. Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 262, 109470 (2022).
- Baron, M. G., et al. Pharmaceutical metabolism in fish: using a 3-D hepatic in vitro model to assess clearance. PloS One. 12 (1), 0168837 (2017).
- Langan, L. M., et al. Spheroid size does not impact metabolism of the β-blocker propranolol in 3D intestinal fish model. Frontiers in Pharmacology. 9, 947 (2018).
- Lammel, T., Tsoukatou, G., Jellinek, J., Sturve, J. Development of three-dimensional (3D) spheroid cultures of the continuous rainbow trout liver cell line RTL-W1. Ecotoxicology and Environmental Safety. 167, 250-258 (2019).
- Jeong, Y., et al. Differential effects of CBZ-induced catalysis and cytochrome gene expression in three dimensional zebrafish liver cellculture. Journal of Environmental and Analytical Toxicology. 6, 2161 (2016).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), e2720 (2011).
- Lee, W. G., Ortmann, D., Hancock, M. J., Bae, H., Khademhosseini, A. A hollow sphere soft lithography approach for long-term hanging drop methods. Tissue Engineering. Part C, Methods. 16 (2), 249-259 (2010).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods in Molecular Medicine. 140, 141-151 (2007).
- de Souza, I. R., et al. Development of 3D cultures of zebrafish liver and embryo cell lines: a comparison of different spheroid formation methods. Ecotoxicology. 30 (9), 1893-1909 (2021).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 151-161 (2012).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2022)
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Gajski, G., et al. Genotoxic potential of selected cytostatic drugs in human and zebrafish cells. Environmental Science and Pollution Research International. 23 (15), 14739-14750 (2016).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Mueller-Klieser, W. Method for the determination of oxygen consumption rates and diffusion coefficients in multicellular spheroids. Biophysical Journal. 46 (3), 343-348 (1984).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Ho, R. K., Kimmel, C. B. Commitment of cell fate in the early zebrafish embryo. Science. 261 (5117), 109-111 (1993).
- Biswas, S., Emond, M. R., Jontes, J. D. Protocadherin-19 and N-cadherin interact to control cell movements during anterior neurulation. The Journal of Cell Biology. 191 (5), 1029-1041 (2010).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유