Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode de culture 3D de sphéroïdes de lignées cellulaires de poissons-zèbres embryonnaires et hépatiques
Dans cet article
Résumé
Ici, nous présentons un protocole de culture 3D efficace, facile et rapide pour la formation de sphéroïdes de deux lignées cellulaires de poisson zèbre (Danio rerio): ZEM2S (embryon) et ZFL (hépatocytes normaux).
Résumé
Les lignées cellulaires de poissons sont des modèles in vitro prometteurs pour l’évaluation de l’écotoxicité; cependant, les systèmes de culture monocouche conventionnels (culture 2D) ont des limites bien connues (p. ex. longévité de la culture et maintien de certaines fonctions cellulaires in vivo ). Ainsi, des cultures 3D, telles que des sphéroïdes, ont été proposées, car ces modèles peuvent reproduire des structures tissulaires, mieux recapturer les conditions in vivo . Cet article décrit un protocole de culture 3D efficace, facile et rapide pour la formation de sphéroïdes avec deux lignées cellulaires de poisson zèbre (Danio rerio) : ZEM2S (embryon) et ZFL (hépatocytes normaux). Le protocole consiste à plaquer les cellules dans une plaque à fond rond, à fixation ultra-basse, à 96 puits. Après 5 jours sous agitation orbitale (70 rpm), un seul sphéroïde par puits est formé. Les sphéroïdes formés présentent une taille et une forme stables, et cette méthode évite la formation de plusieurs sphéroïdes dans un puits; Ainsi, il n’est pas nécessaire de choisir à la main des sphéroïdes de tailles similaires. La facilité, la rapidité et la reproductibilité de cette méthode sphéroïde la rendent utile pour les tests in vitro à haut débit.
Introduction
Les sphéroïdes sont de petites sphères de cellules formées lorsque les cellules sont cultivées en contact étroit de cellule à cellule en culture 3D. La capacité des sphéroïdes à imiter l’environnement tissulaire in vivo a déjà été étudiée dans une variété de lignées cellulaires et de cellules primaires 1,2. Cependant, bien que les sphéroïdes soient bien développés pour les études de toxicité chez les mammifères, le développement de sphéroïdes pour les études de toxicité avec des vertébrés non mammifères (p. ex. poissons) est toujours en cours3. Pour les lignées cellulaires de poissons, les sphéroïdes ont été développés par une variété de méthodes différentes, telles que l’agitation orbitale (OS) en utilisant différents types de plaques de puits 3,4,5,6,7, et la méthode de lévitation magnétique utilisant des nanoparticules magnétiques8. Cependant, certaines de ces méthodes de culture pour les sphéroïdes peuvent avoir plus d’inconvénients que d’autres.
Par exemple, les méthodes giratoires dans de grandes microplaques (plaques à 24 puits) peuvent générer un nombre élevé de sphéroïdes de taille et de forme différentes; En effet, la formation de structures multi-sphéroïdes a été démontrée7. Cela nécessite des efforts intenses pour sélectionner des sphéroïdes de taille et de forme similaires pour une expérience. La méthode de culture 3D à gouttes suspendues est couramment utilisée pour générer des sphéroïdes de lignées cellulaires de mammifères 1,2,9,10,11, ce qui permet de générer des sphéroïdes uniques par goutte, évitant ainsi les problèmes décrits ci-dessus. Cependant, bien qu’une méthode de goutte suspendue modifiée (goutte suspendue + secousse orbitale) soit capable de générer des sphéroïdes ZFL en utilisant une méthode peu coûteuse, elle présente ses inconvénients12. Les agrégats cellulaires formés ne peuvent pas être maintenus pendant de longues périodes dans les gouttes; Ainsi, ils doivent être transférés sur des plaques de puits. Ce processus nécessite une manipulation intense et de longues périodes de travail dans une hotte à flux laminaire, car il est effectué goutte à goutte à l’aide d’une micropipette12. De plus, cette méthode nécessite 10 jours pour former complètement les sphéroïdes ZFL (5 jours en goutte suspendue + 5 jours en SG)12. Ces inconvénients peuvent limiter l’application de sphéroïdes de poissons 3D pour les tests de toxicité, en particulier compte tenu des applications potentielles pour la priorisation des produits chimiques et la durabilité des produits.
Ainsi, cet article décrit un protocole de culture 3D capable de générer des sphéroïdes uniques de lignées cellulaires ZFL (hépatocytes normaux de D. rerio) et ZEM2S (embryon en phase blastula de D. rerio) basés sur l’utilisation combinée de plaques de fixation ultra-basses à 96 puits (plaques ULA) et d’un agitateur orbital (diamètre de rotation de 22 mm). La méthode appliquée est simple et reproductible, et peut générer un grand nombre de sphéroïdes de taille et de forme similaires en peu de temps (5 jours). Les avantages de cette méthode peuvent soutenir l’application de modèles 3D de poissons pour les études de toxicité aquatique dans l’industrie et le milieu universitaire, ainsi que les progrès de la mise en œuvre de méthodes alternatives pour les essais d’écotoxicité.
Protocole
Les étapes clés pour générer des sphéroïdes 3D de lignées cellulaires ZFL et ZEM2S dans une plaque à fond rond de 96 puits sont présentées à la figure 1.
REMARQUE : Voir le tableau des matériaux pour plus de détails sur tous les matériaux utilisés dans ce protocole et le tableau 1 pour les solutions et les milieux de culture utilisés dans ce protocole.
1. Milieu de culture cellulaire et cultures monocouches
- Cultiver les deux lignées cellulaires (ZFL, ZEM2S) en monocouches dans un incubateur à 28 °C sans CO2, et les sous-cultiver à un rapport de sous-culture de 1:3 lorsqu’elles atteignent ~80% de confluence.
- Commencez avec une fiole T75 de cellules de poisson zèbre à ~80% de confluence, cultivées comme décrit ci-dessus.
- Retirer le milieu complet et laver les cellules en ajoutant 1x solution saline tamponnée au phosphate (PBS) (0,01 M) dans la fiole de culture à l’aide d’une pipette.
- À l’aide d’une pipette, ajouter 3 mL de 1x trypsine-0,5 mM EDTA (0,05 % [v/v]) dans les fioles de culture et incuber à 28 °C pendant 3 min pour détacher les cellules de la fiole.
- Tapoter doucement la fiole pour libérer les cellules, puis arrêter la digestion de la trypsine en ajoutant 3 mL de milieu de culture complet dans la fiole.
- À l’aide d’une pipette, transférer la suspension cellulaire dans un tube à centrifuger conique de 15 mL et centrifuger à 100 × g pendant 5 min.
- Après la formation de la pastille, retirez soigneusement le surnageant, ajoutez 1 mL du milieu complet pour la lignée cellulaire respective utilisée (ZFL ou ZEM2S) et remettez en suspension à l’aide d’une micropipette. Prenez une partie aliquote pour le comptage cellulaire.
2. Comptage des cellules avec test d’exclusion du colorant bleu trypan
- Ajouter 10 μL de suspension cellulaire et 10 μL de colorant bleu de trypan à un microtube pour compter les cellules et évaluer leur viabilité. Mélanger la suspension cellulaire et le colorant à l’aide d’une pipette.
- Ensuite, transférez 10 μL de ce mélange (suspension cellulaire + bleu de trypan) dans une chambre de Neubauer et comptez les cellules dans les quatre grands carrés (quadrants: Q) placés aux coins de la chambre, en considérant les cellules qui n’absorbent pas le bleu de trypan comme viables. Calculer le nombre de cellules viables à l’aide de l’équation (1) :
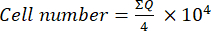 (1)
(1) - Pour calculer le nombre final de cellules dans la suspension cellulaire, multipliez le nombre de cellules déterminé à l’aide de l’équation (1) par 2 (le facteur de dilution dû à l’utilisation du bleu de trypan).
REMARQUE: Alternativement, un système automatisé de comptage de cellules peut être utilisé.
3. Placage cellulaire dans les plaques ULA
- Après avoir calculé le nombre de cellules, ajuster la suspension de la cellule à la plaque de 200 μL de cette suspension par puits d’une plaque ULA à fond rond de 96 puits avec le nombre de cellules requis pour chaque lignée cellulaire, comme indiqué ci-dessous:
- Plaque 7 000 cellules ZFL viables/puits; ainsi, pour l’ensemble de la plaque ULA, utiliser 700 000 cellules dans 20 mL de milieu complet.
- Plaque 3 500 cellules ZEM2S viables/puits; ainsi, pour l’ensemble de la plaque ULA, utiliser 350 000 cellules dans 20 mL de milieu complet.
- Préparez la suspension cellulaire avec la concentration ajustée de cellules dans un réservoir de milieu et mélangez-la à l’aide d’une micropipette multicanal, en prenant soin de ne pas former de mousse ou de bulles. À l’aide de la micropipette multicanaux, ajouter 200 μL de la suspension cellulaire ajustée à chaque puits de la plaque ULA.
REMARQUE : La plaque doit être scellée avec un parafilm ou une feuille d’étanchéité adhésive pour éviter l’évaporation du milieu de culture de la plaque de 96 puits.
4. Formation sphéroïde
- Incuber la plaque ULA sur un agitateur orbital à 70 tr/min pendant 5 jours dans un incubateur à 28 °C. Laisser les sphéroïdes se former au cours de 5 jours d’agitation orbitale (Figure 2), atteignant une taille moyenne de ~225 μm de diamètre (sphéroïdes ZFL) et ~226 μm de diamètre (sphéroïdes ZEM2S)12.
NOTE: Après 5 jours d’incubation (circularité maximale), les sphéroïdes sont prêts à être utilisés. - Pour maintenir les sphéroïdes en culture pendant plus de 5 jours, retirer 100 μL du milieu épuisé tous les 5 jours et ajouter 100 μL de milieu de culture complet frais à l’aide d’une micropipette multicanal.
REMARQUE: Veillez à ne pas aspirer les sphéroïdes pendant ce processus.
5. Mesure de la taille (diamètre) et de la forme (indice de circularité) des sphéroïdes
- Acquérir les images.
- Sous un microscope à lumière inversée avec un système de capture d’imagerie, obtenir une image d’une échelle définie.
REMARQUE : Utilisez une lame d’étalonnage de l’étage du microscope ou une lame de Neubauer (dans laquelle les tailles des quadrants sont connues) pour obtenir l’échelle. - Au microscope et en utilisant la même lentille d’objectif que celle utilisée pour obtenir l’image de l’échelle, obtenir des images des sphéroïdes entièrement formés (c.-à-d. des sphéroïdes âgés de 5 jours).
REMARQUE: Toutes les images doivent être prises à l’aide du même système de capture d’imagerie, car la résolution de l’image est importante pour déterminer la taille et la forme des sphéroïdes, et elle peut différer selon les types de systèmes.
- Sous un microscope à lumière inversée avec un système de capture d’imagerie, obtenir une image d’une échelle définie.
- Définissez l’échelle.
- À l’aide du logiciel ImageJ, ouvrez l’image de l’échelle définie (cliquez sur Fichier | ouvrir).
- Sélectionnez le sélecteur de ligne droite dans la barre d’outils et, à l’aide de la souris, faites glisser une ligne sur l’extension de l’échelle définie dans l’image.
- Définissez l’échelle en sélectionnant Analyser | Définissez l’échelle et attendez que la fenêtre Définir l’échelle s’ouvre.
- Dans la fenêtre Set Scale (Définir l’échelle), remplissez le blanc de Distance connue par la distance connue (μm) correspondant à la ligne droite ; Remplissez l’unité de longueur avec um pour μm. Cliquez sur OK.
REMARQUE : L’échelle en pixels/μm est affichée en bas de la fenêtre.
- Réglez les paramètres de mesure.
- Dans le logiciel ImageJ, sélectionnez Analyser | Définir les mesures pour ouvrir la fenêtre Définir les mesures .
- Dans la fenêtre Définir les mesures, cochez les cases correspondant aux mesures souhaitées (c’est-à-dire les descripteurs de zone et de forme). Cliquez sur OK.
- Obtenir le diamètre et la circularité des sphéroïdes.
- Ouvrez l’image d’un sphéroïde (Fichier | Ouvert).
- Sélectionnez l’outil de sélection à main levée dans la barre d’outils et, à l’aide de la souris, sélectionnez le côté extérieur du sphéroïde, comme illustré à la figure 3A.
REMARQUE: Pour effectuer un zoom avant ou arrière sur l’image, appuyez sur la touche Ctrl et utilisez la souris pour faire défiler vers le bas ou vers le haut, ou appuyez sur la touche Ctrl et utilisez les touches fléchées haut ou bas du clavier. - Sélectionnez Analyser | Mesure pour ouvrir la fenêtre Résultats dans laquelle les valeurs mesurées sont affichées.
- À l’aide de la valeur Surface , calculez la taille (diamètre) des sphéroïdes à l’aide de l’équation (2) :
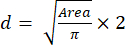 (2)
(2) - L’indice de circularité est indiqué dans la fenêtre Résultats sous la forme « Circ. », et est calculé automatiquement par le logiciel à l’aide de l’équation (3):
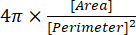 (3)
(3)
REMARQUE: L’indice de circularité de 1,0 représente une forme sphéroïdale parfaite, tandis qu’une valeur proche de 0,0 indique une forme allongée13.
Résultats
Des sphéroïdes simples par puits avec une taille et une forme stables sont formés par cette méthode. La figure 2 illustre le processus de formation de sphéroïdes simples de cellules ZFL et ZEM2S dans un puits d’une plaque ULA sous agitation orbitale (70 tr/min). Les lignées cellulaires ZFL et ZEM2S ont des comportements différents en culture 3D. La lignée cellulaire ZEM2S présente des caractéristiques qui confèrent la capacité de former facilement une forme sphéroïdale dès ...
Discussion
Il s’agit d’une méthode simple, facile et rapide pour générer des sphéroïdes de lignées cellulaires de foie et d’embryons de poisson zèbre. Cette méthode a été développée par ce groupe sur la base des modifications apportées aux méthodes sphéroïdes 3D existantes pour surmonter les problèmes signalés dans les études scientifiques liées à la formation de sphéroïdes, ainsi que les incertitudes dans la précision des données des tests 3D sphéroïdes. Par exemple, les problèmes signalés résid...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
En mémoire du Dr Márcio Lorencini, coauteur de cet ouvrage, excellent chercheur dans le domaine des cosmétiques et dévoué à la promotion de la recherche cosmétique au Brésil. Les auteurs remercient le Laboratoire multi-utilisateurs du Département de physiologie (UFPR) pour la disponibilité des équipements et pour le soutien financier de la Coordination pour l’amélioration du personnel de l’enseignement supérieur (CAPES, Brésil) (Code financier 001) et du Grupo Boticário.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate, Individually Wrapped, with Lid, Sterile | Corning | 7007 | |
| DMEM, powder, high glucose, pyruvate | Gibco | 12800-017 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | |
| HEPES (1M) | Gibco | 15630080 | |
| Image Processing and analysis in Java (ImageJ) 1.52p software | National Institutes of Health, USA | Available at: https://imagej.nih.gov/ij/index.html | |
| Leibovitz's L-15 Medium, powder | Gibco | 41300021 | |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10x) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| RPMI 1640 Medium | Gibco | 31800-014 | |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Sodium bicarbonate, powder, bioreagent for molecular biology | Sigma-Aldrich | S5761 | |
| Trypan blue stain (0,4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
Références
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research. Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, N. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnology and Bioengineering. 83 (2), 173-180 (2003).
- Baron, M. G., Purcell, W. M., Jackson, S. K., Owen, S. F., Jha, A. N. Towards a more representative in vitro method for fish ecotoxicology: morphological and biochemical characterisation of three-dimensional spheroidal hepatocytes. Ecotoxicology. 21 (8), 2419-2429 (2012).
- Alves, R. F., Rocha, E., Madureira, T. V. Fish hepatocyte spheroids - A powerful (though underexplored) alternative in vitro model to study hepatotoxicity. Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 262, 109470 (2022).
- Baron, M. G., et al. Pharmaceutical metabolism in fish: using a 3-D hepatic in vitro model to assess clearance. PloS One. 12 (1), 0168837 (2017).
- Langan, L. M., et al. Spheroid size does not impact metabolism of the β-blocker propranolol in 3D intestinal fish model. Frontiers in Pharmacology. 9, 947 (2018).
- Lammel, T., Tsoukatou, G., Jellinek, J., Sturve, J. Development of three-dimensional (3D) spheroid cultures of the continuous rainbow trout liver cell line RTL-W1. Ecotoxicology and Environmental Safety. 167, 250-258 (2019).
- Jeong, Y., et al. Differential effects of CBZ-induced catalysis and cytochrome gene expression in three dimensional zebrafish liver cellculture. Journal of Environmental and Analytical Toxicology. 6, 2161 (2016).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), e2720 (2011).
- Lee, W. G., Ortmann, D., Hancock, M. J., Bae, H., Khademhosseini, A. A hollow sphere soft lithography approach for long-term hanging drop methods. Tissue Engineering. Part C, Methods. 16 (2), 249-259 (2010).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods in Molecular Medicine. 140, 141-151 (2007).
- de Souza, I. R., et al. Development of 3D cultures of zebrafish liver and embryo cell lines: a comparison of different spheroid formation methods. Ecotoxicology. 30 (9), 1893-1909 (2021).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 151-161 (2012).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2022)
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Gajski, G., et al. Genotoxic potential of selected cytostatic drugs in human and zebrafish cells. Environmental Science and Pollution Research International. 23 (15), 14739-14750 (2016).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Mueller-Klieser, W. Method for the determination of oxygen consumption rates and diffusion coefficients in multicellular spheroids. Biophysical Journal. 46 (3), 343-348 (1984).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Ho, R. K., Kimmel, C. B. Commitment of cell fate in the early zebrafish embryo. Science. 261 (5117), 109-111 (1993).
- Biswas, S., Emond, M. R., Jontes, J. D. Protocadherin-19 and N-cadherin interact to control cell movements during anterior neurulation. The Journal of Cell Biology. 191 (5), 1029-1041 (2010).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon